La proteinosis alveolar pulmonar (PAP) es una enfermedad rara que se caracteriza por la acumulación de material lipoproteináceo del surfactante en los espacios alveolares y bronquiolos terminales debido a una disminución en su aclaramiento por parte de los macrófagos alveolares. Su forma primaria se relaciona con una disfunción en los macrófagos por una alteración en la vía de señalización del factor estimulante de las colonias de los granulocito-macrófagos (granulocyte–macrophage colony-stimulating factor [GM-CSF]), bien por la presencia de anticuerpos frente GM-CSF (PAP autoinmune) que supone en torno al 90% de los casos o bien por mutaciones en los genes del receptor de GM-SCF (PAP hereditaria)1. Presentamos un caso donde se consiguió la resolución radiológica completa tras tratamiento con GM-CSF por vía inhalada.
Se trata de un varón de 55 años, fumador activo -20 paquetes/año-, sin antecedentes médicos de interés ni tratamiento habitual. Tras una neumonía de lenta resolución es diagnosticado de PAP mediante biopsia pulmonar transbronquial. La determinación de anticuerpos anti-GM-CSF fue positiva. Dado que en ese momento se encontraba asintomático, con estudio funcional normal (FVC 5,08 L, 130,1%; FEV1 3,89L, 124,0%, FEV1/FVC 76,62%, difusión pulmonar de monóxido de carbono [DLCOc] 7,41, 82,3%) se optó por observación y seguimiento.
A los dos años del diagnóstico experimentó empeoramiento clínico y funcional (DLCOc 63%), por lo que se planteó el tratamiento con GM-CSF inhalado.
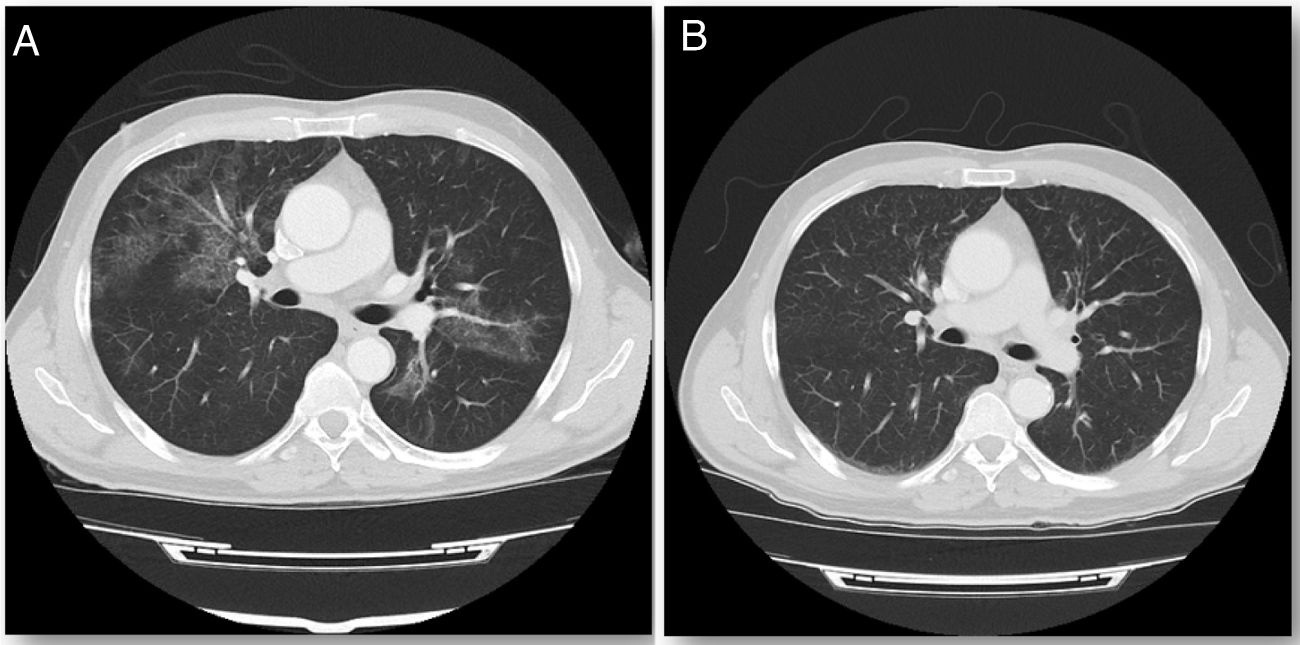
Comenzó terapia con GM-CSF inhalado siguiendo la pauta de administración empleada en el estudio de Tazawa et al.2, inicialmente a alta dosis (125 μg dos veces al día del primer al octavo día y descanso de noveno al décimo cuarto) durante seis ciclos de dos semanas, seguido de administración a baja dosis (125 μg una vez al día del primer al cuarto día con descanso del quinto al décimo cuarto) durante seis ciclos de dos semanas. Al finalizar el tratamiento mejoró la disnea y la tos, con mínima expectoración. A los dos meses la tomografía computarizada de tórax evidenció la desaparición completa de los infiltrados (imagen 1), junto con normalización de la DLCOc (82%) que se mantiene hasta la actualidad.
No hay una estrategia común para el manejo médico. En pacientes asintomáticos y/o con mínimas alteraciones en el intercambio gaseoso puede optarse por observación. Para aquellos con síntomas leves-moderados o hipoxemia con el ejercicio, se suele administrar oxigenoterapia durante el esfuerzo. Los pacientes con síntomas moderados-graves con alteraciones en el intercambio gaseoso en reposo deben recibir un tratamiento específico y más agresivo. En dicho caso, el tratamiento considerado de elección es el lavado pulmonar total3. Desde que se descubrió la implicación de los anticuerpos anti-GM-CSF en el mantenimiento de la homeostasis del surfactante alveolar, se ha planteado la administración de esta citoquina por vía exógena como posible terapia en formas graves de PAP en su forma primaria autoinmune. Cuenta con una base fisiopatológica sólida y aunque se puede administrar de forma subcutánea o inhalada, esta última es la que cuenta con mayor nivel de evidencia2,4,5.
El estudio de Tazawa et al.2 incluía pacientes con PAP primaria autoinmune que presentaban presión parcial oxígeno inferior a 75 mmHg. Tras seis meses de tratamiento, tuvieron una tasa de respuesta global del 62% mantenida en el 83% de los pacientes durante un año sin necesidad de terapia adicional.
Recientemente se han publicado nuevos ensayos clínicos con terapias inhaladas cuyos resultados igualan o incluso mejoran los publicados en la literatura previamente (4 y 5). Si bien excluían pacientes con afectación grave por el riesgo de que estos pudiesen desarrollar exacerbaciones en caso de recibir placebo, en ambos estudios se demuestra una mejoría significativa del gradiente alveolo-arterial y de la DLCOc. Además, se pone de manifiesto una mejoría tanto radiológica como en las escalas de calidad de vida de pacientes con síntomas respiratorios, todo ello con una baja tasa de eventos adversos sin diferencias significativas entre los dos grupos analizados.
No están bien establecidas ni la dosis ni la duración más adecuadas, en los estudios reseñados se emplean terapias de 24 semanas, pero es posible que en periodos más largos consigan mejores resultados. Su principal limitación es el precio, aunque dada la baja incidencia de la enfermedad no es previsible que se emplee en un alto número de pacientes.
El caso que presentamos confirma que el tratamiento con GM-CSF por vía inhalada es eficaz y seguro en la forma primaria autoinmune de proteinosis alveolar, y debería valorarse su uso en formas moderadas o leves muy sintomáticas de la enfermedad.
Conflicto de interesesTodos los autores declaramos no tener ningún conflicto de interés relacionado directa o indirectamente con los contenidos del manuscrito.
Consentimiento informadoEl paciente ha dado y firmado el consentimiento informado para la publicación de sus datos e imágenes clínicas.
FinanciaciónSe declara no haber recibido ninguna financiación.