Describir los resultados perinatales en pacientes con colestasis intrahepática del embarazo (CIE) en el Instituto Nacional de Perinatología.
Material y métodosSe realizó un estudio de serie de casos, retrolectivo y observacional durante el periodo 2012-2015, en el Instituto Nacional de Perinatología. Se incluyeron expedientes de pacientes con embarazo único o gemelar con diagnóstico de CIE.
ResultadosSe estudiaron 25 expedientes de pacientes; el 32% de las pacientes eran primigestas. El diagnóstico se realizó de manera clínica en el 100% de las pacientes. Se corroboró mediante elevación de enzimas hepáticas en 21 pacientes. Se solicitaron ácidos biliares en el 48% de las pacientes, de los cuales 67% se reportaron> 10 mmol/l. Una paciente se clasificó como CIE severa (ácidos biliares> 100 mmol/l). El 68% de las pacientes recibieron tratamiento con ácido ursodesoxicólico. El parto pretérmino se presentó en el 40% de los casos, el 24% de ellos espontáneos y el 16% iatrogénicos. Dos pacientes (8%) desarrollaron preeclampsia leve. Se obtuvo un total de 26 recién nacidos, ya que uno de los embarazo fue un embarazo gemelar. Un recién nacido presentó peso bajo para edad gestacional. El 12% de los recién nacidos requirieron de cuidados intensivos. Se reportó meconio en 3 ocasiones. El Apgar promedio fue de 8/9.
ConclusiónExisten varias diferencias en el manejo de las pacientes con CIE en el Instituto Nacional de Perinatología. Es indispensable que existan lineamientos internos para homogeneizar su diagnóstico, seguimiento y tratamiento.
To describe the perinatal and maternal outcomes of patients with intrahepatic cholestasis of pregnancy (ICP) in the National Institute of Perinatology.
Material and methodA retrospective, observational study was conducted that included clinical files of women with single or multiple pregnancy with ICP between January 2012 and December 2015.
ResultsA total of 25 patient files were included, 32% of whom were primiparous. On the multiparous, 2 stillbirths were recorded in their previous pregnancy (these patients had a history of ICP). The diagnosis was carried out clinically in 100% of the cases. It was then confirmed by hepatic enzyme elevation in 21 patients. Bile acids were requested for 48% of the patients, of which 67% were reported as> 10 mmol/L. One patient was classified as severe ICP (bile acids> 100 mmol/L. Around two-thirds (68%) of patients received ursodeoxycholic acid. The birth was preterm in 40% of the patients 24% were spontaneous and 16% iatrogenic, and 2 patients (8%) developed mild pre-eclampsia. There were a total of 26 newborns, as one of the patients was carrying twins. One newborn was small for gestational age. Admission to neonatal intensive care unit was required for 12% of the newborns, and 3 cases of meconium were reported. The mean Apgar score was 8/9.
ConclusionThe treatment for patients with ICP in the present hospital varies significantly. Therefore, it is essential to develop internal guidelines to homogenise the diagnosis, follow-up, and treatment of the patients.
La colestasis intrahepática del embarazo (CIE) es una enfermedad hepática asociada al embarazo1. La prevalencia de esta enfermedad es variable2,3. En el Instituto Nacional de Perinatología la incidencia de CIE es del 0.1%2. Las mutaciones de los genes que codifican para el transportador de ácidos biliares pueden conducir a problemas en la secreción de estos y producir colestasis4-6. Otras teorías proponen regulación a la alza de genes placentarios involucrados en la apoptosis7, CIE secundaria a alteración de hormonas esteroideas8,9.
El diagnóstico de CIE se basa en la combinación de prurito característico y alteración de las pruebas de función hepática2,9,10. Se cree que la TGP es un indicador más sensible6. En el INPER, TGO 31 U/l: S 84.1%/E 90%, TGP 34 U/l: S 86.4%/, E 80%11. La elevación de ácidos biliares (> 10μmol/l) es la alteración de laboratorio más sensible y más frecuentemente encontrada12. Los niveles normales de ácidos biliares no excluyen el diagnóstico de CIE2,13. En el INPER, el diagnóstico de CIE se realiza con los datos clínicos característicos del prurito y con elevación de enzimas hepáticas, principalmente TGP.
Se ha detectado un riesgo de óbito de 2.58 (IC del 95%, 1.03-6.49). Se ha implementado ácidos biliares> 40 mmol/l como punto de cohorte para riesgo de óbito; sin embargo, se han reportado óbitos con cifras menores9. Las pacientes con CIE severa tuvieron un parto 2.12 semanas antes (IC del 95%, 1.98-2.27). La mayoría de los partos pretérmino fueron iatrogénicos (OR 7.39; IC del 95%, 5.33-10.25)14. Se ha observado una correlación negativa entre la elevación de ácidos biliares y las semanas de gestación (SDG) (r=–0.409, p=0.038)3. Los niveles de ácidos biliares y el inicio temprano del prurito en la gestación son predictores independientes de parto pretérmino. (OR 2.13; IC del 95%, 1.13-3.25, y OR 1.7; IC del 95%, 1.23-2.95, respectivamente)15. En el INPER, el meconio fue el único desenlace en el que se demostró significación estadística (p = 0.002)11. Se ha observado una asociación entre CIE y fetos grandes para edad gestacional (aOR 2.27; IC del 95%, 2.02-2.55)16. También se ha visto asociado a CIE moderada (ácidos biliares 40-99 mmol/l) la hemorragia posparto9.
Se ha demostrado17,18 que la arteria umbilical (IP e índice S/D) puede ser útil en predecir el desenlace perinatal. Suri et al. valoraron la monitorización fetal anteparto. Los métodos estándar de vigilancia fetal anteparto no son útiles en CIE18,19. El desenlace perinatal adverso aumenta 1-2% por cada mmol/l en la concentración de ácidos biliares2.
Pathak y Lee recomiendan la interrupción temprana del embarazo (< 37 SDG) bajo 2 circunstancias: 1) prurito materno intenso que no remite a tratamiento farmacológico, y 2) antecedente de óbito secundario a CIE con recurrencia de CIE en el embarazo actual9. Varios autores2,19,20 consideran que si existiera una relación entre la CIE y el óbito fetal, no es estadísticamente significativa, por lo que no recomiendan la interrupción temprana del embarazo.
El objetivo del tratamiento es alterar la circulación enterohepática de ácidos biliares para reducir su concentración en sangre materna21. Ningún fármaco disminuye el riesgo de óbito secundario a CIE. Según la biblioteca de Cochrane22, hubo menor cantidad de partos pretérmino con AUCD (RR 0.46; IC del 95%, 0.28-0.73). La combinación de los fármacos no fue más efectiva que la monoterapia con AUCD para el tratamiento del prurito.
Con este trabajo buscamos conocer los desenlaces perinatales asociados a CIE, así como el manejo realizado en un grupo de pacientes con este diagnóstico. Se realizó una revisión de la literatura para proponer algoritmos de diagnóstico y tratamiento para la patología.
Material y métodosSe realizó un estudio de serie de casos, retrolectivo y observacional, durante el periodo 2012-2015, en el Instituto Nacional de Perinatología. Se incluyeron expedientes de pacientes con embarazo único o gemelar que hayan sido atendidas en el Instituto Nacional de Perinatología con diagnóstico de CIE. Se solicitó apoyo del servicio de la Consulta Externa y de Archivo clínico para la revisión de expedientes de pacientes con diagnóstico de CIE. Con la revisión inicial se seleccionó el grupo de expedientes de pacientes que cumplían los criterios de inclusión (pacientes con diagnóstico prenatal de colestasis descartadas otras enfermedades hepáticas). Se analizaron las características sociodemográficas, los hallazgos maternos (prurito y enzimas hepáticas), los resultados maternos (hemorragia obstétrica> 1,000ml en cesárea y> 500 cc en parto, parto pretérmino espontáneo, parto pretérmino iatrógenico), los resultados perinatales (asfixia perinatal según parámetros de gasometría de cordón, pequeño para edad gestacional <p10, Apgar bajo <5, ingreso a UCIN, óbito) y el tratamiento materno. Los datos obtenidos se recolectaron en Excel 2016 y se analizaron mediante estadística descriptiva utilizando medidas de tendencia central.
ResultadosSe obtuvieron un total de 32 expedientes de pacientes con CIE según el Departamento de Estadística y las hojas de consulta diaria del Departamento de Dermatología. Sin embargo, en 2 pacientes el expediente materno se encontraba incompleto y 5 pacientes tenían otra enfermedad vesicular asociada, por lo que se excluyeron dichas pacientes, quedando un total de 25 pacientes.
Respecto a los antecedentes heredofamiliares, no se encontró ninguna pacientes cuya madre hubiese tenido colestasis intrahepática.
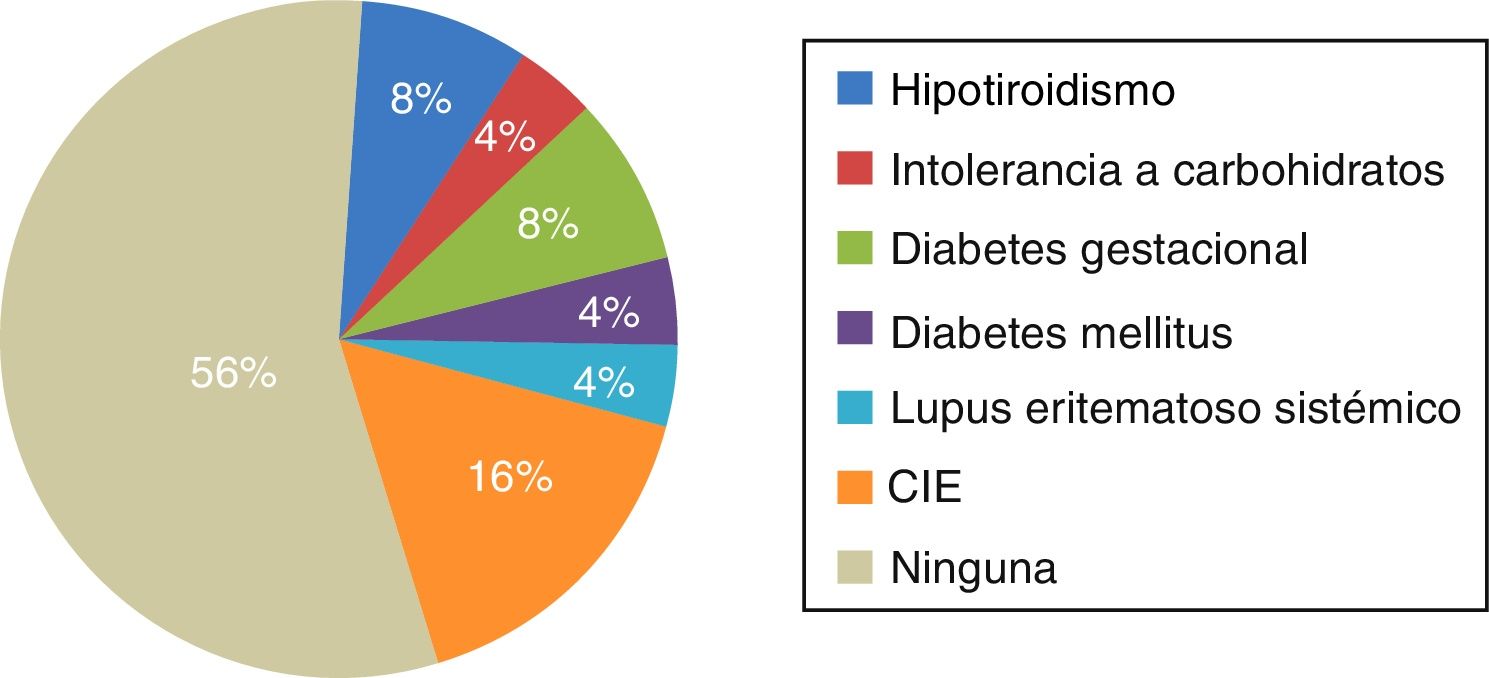
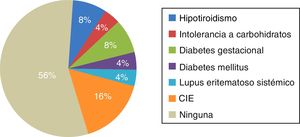
En 11 pacientes (44%) se encontró alguna comorbilidad, de las cuales la principal fue CIE en gestaciones previas, en un 16% de las pacientes, y en segundo lugar hipotiroidismo y diabetes gestacional, en un 8% ambas (fig. 1).
Dentro de los antecedentes obstétricos, el 32% de las pacientes (8) eran primigestas. De las pacientes multíparas, 2tenían antecedente de colestasis en el embarazo previo y presencia de óbito en el mismo.
En cuanto al embarazo actual, describiremos los resultados en 4 etapas: 1) diagnóstico; 2) tratamiento; 3) desenlaces maternos, y 4) desenlaces perinatales
El diagnóstico se realizó de manera clínica en el 100% de las pacientes, con las características previamente mencionadas del prurito. Este diagnóstico se corroboró mediante elevación de enzimas hepáticas en el 84% de las pacientes (21), de las cuales 8 pacientes cursaron con elevación de ácidos biliares.
Respecto al prurito, inició en promedio a las 31.3 SDG, aunque se detectó desde las 23.1 SDG. En 4 pacientes (16%), el prurito se acompañó de lesiones dérmicas secundarias a rascado. En relación con el inicio de los síntomas en comparación con las alteraciones bioquímicas, el 48% de las pacientes (12) presentaron sintomatología antes de la elevación de enzimas hepáticas. Como ya se mencionó, el 84% de las pacientes presentaron elevación de enzimas hepáticas, de las cuales predominó la elevación de TGP en 22 pacientes (88%), a diferencia de la elevación de TGO en 21 pacientes (84%), con un valor máximo de 276 UI/l y 327 UI/l, respectivamente. Las enzimas hepáticas se elevaron a partir de las 29 SDG en promedio. Se calculó la frecuencia con la que se solicitaron las enzimas hepáticas y se clasificó a las pacientes en 3 grupos: 1-7 días, 7-15 días y más de 15 días, encontrado 11, 6 y 4 pacientes en cada grupo, respectivamente.
En el 20% de los casos (5 pacientes) se continuó el seguimiento mediante medición de enzimas hepáticas durante el puerperio. Se solicitaron ácidos biliares en 12 pacientes (48%), de los cuales 67% (8 pacientes) se reportaron por arriba de lo normal (10 mmol). Una de las pacientes se clasificó como CIE severa (ácidos biliares> 100) con ácidos biliares de 128 mmol.
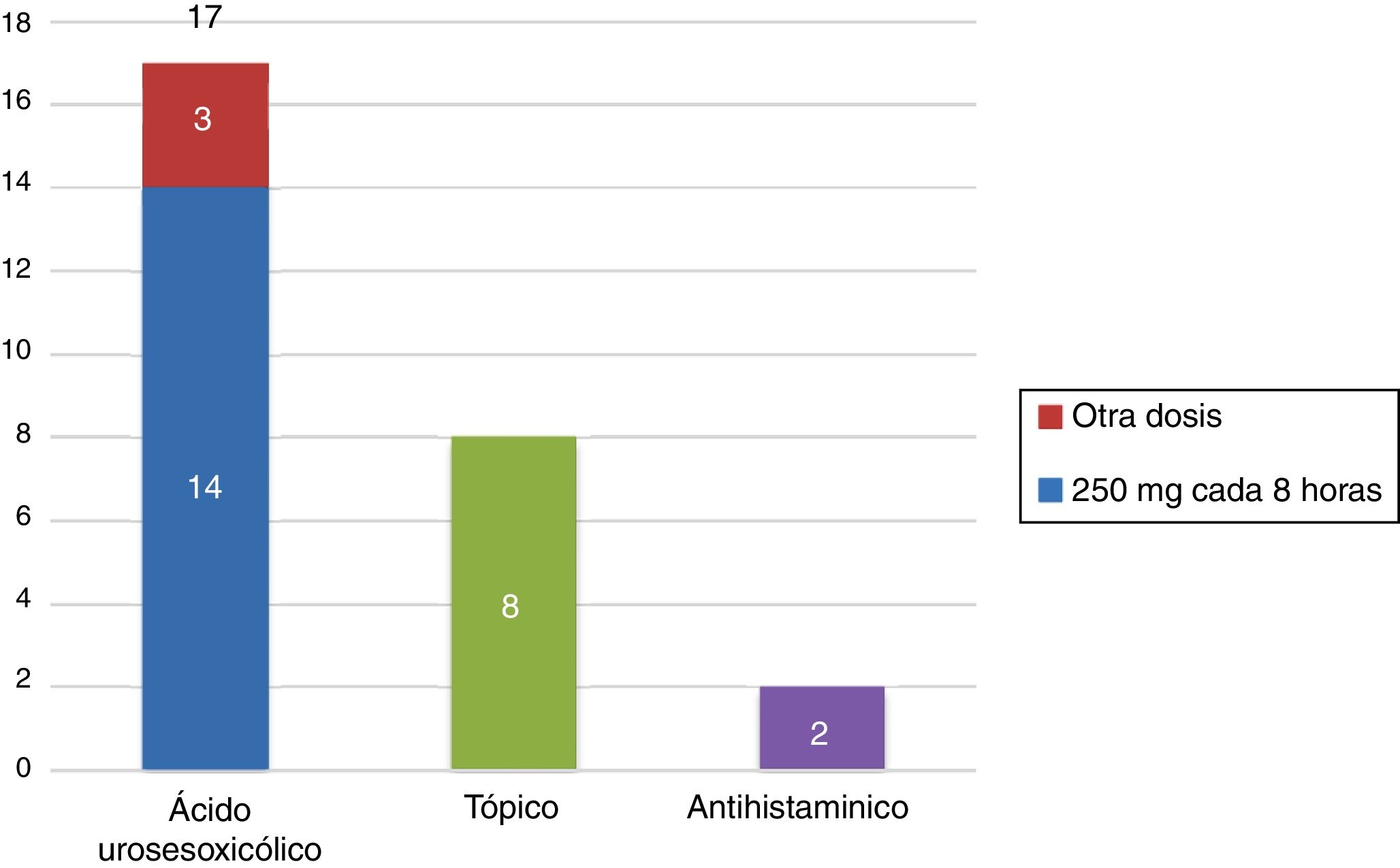
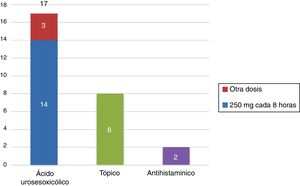
Respecto al tratamiento, el 68% (17 pacientes) de las pacientes recibieron tratamiento con ácido ursodesoxicólico, de las cuales el 82% (14 pacientes) recibió la dosis de 250mg cada 8h. El 8% (2 pacientes) de las pacientes recibieron antihistamínicos para el prurito y el 32% (8 pacientes) de las pacientes recibieron algún tratamiento tópico (fig. 2).
Se valoró la frecuencia de parto pretérmino, el cual se presentó en el 40% de los casos (10 pacientes). El 24% de ellos fueron partos pretérmino espontáneos (6 pacientes) y el 16% fueron partos pretérmino iatrogénicos.
Dos pacientes (8%) desarrollaron preeclampsia leve. No se reportó ningún caso de hemorragia obstétrica. La vía de interrupción del embarazo más frecuente fue la cesárea, con un 92%. El embarazo se interrumpió alrededor de las 36.6 SDG (34.1-38.1 SDG). En el 32% de las pacientes la indicación de la interrupción por vía abdominal fue la cesárea electiva por mayor beneficio fetal y en el 24% la indicación fue por la presencia de CIE. Únicamente en una paciente la indicación de la cesárea fue por hipomotilidad fetal.
Se obtuvo un total de 26 recién nacidos, ya que uno de los embarazos fue un embarazo gemelar. En uno de los casos se detectó de manera prenatal un feto con bloqueo auriculoventricular de tercer grado. Este embarazo se resolvió a las 38.1 semanas, se obtuvo un recién nacido con peso normal para edad gestacional, Apgar 7/9 y no requirió ingreso en la UCIN. Se observó un (4%) recién nacido con peso bajo para edad gestacional y no se reportó ningún caso de asfixia neonatal. Tres (12%) de los recién nacidos requirieron de cuidados intensivos. Se reportó meconio en 3 ocasiones (12%). El Apgar promedio fue de 8/9, el Apgar más bajo reportado al primer minuto fue de 6 y a los 5 min fue de 8, por lo que no hubo ningún caso Apgar bajo. En el caso que se comentó de colestasis severa (ácidos biliares 128 mmol), los desenlaces perinatales reportados fueron: peso normal para edad gestacional, meconio y Apgar 6/9.
Al describir los resultados perinatales y maternos en relación con las características maternas (tabla 1), observamos que de las 5 pacientes que presentaron CIE en el embarazo anterior, únicamente una desarrollo algún desenlace adverso (parto pretérmino). Una de las pacientes que cursó con preeclampsia leve tuvo un embarazo gemelar. Algunas pacientes presentaron más de un desenlace perinatal. Como era de esperarse, las pacientes con diagnóstico corroborado de CIE mediante ácidos biliares presentaron más desenlaces adversos.
Desenlaces y características maternas
| Ant. CIE (n=5) | Ácidos biliares (n=10) | Tratamiento (n=11) | ||||
|---|---|---|---|---|---|---|
| Normales (n=2) | > 10 mmol/l (n=8) | AUD 250mg cada 8h (n=14) | AUD otra dosis (n=3) | Sin tratamiento (n=8) | ||
| UCIN (n=3) | – | – | 1 | 3 | – | – |
| Meconio (n=3) | – | – | 2 | 3 | – | – |
| PEG (n=1) | – | – | – | 1 | – | – |
| PP espont. (n=6) | 1 | 1 | 2 | 3 | 1 | 2 |
| PP iatrogénico (n=4) | – | – | 2 | 3 | 1 | – |
| PE leve (n=2) | – | – | – | 2 | – | – |
En nuestros resultados no se encontró ninguna paciente cuya madre hubiese tenido CIE; sin embargo, en la literatura se ha reportado que tanto el antecedente familiar de colestasis como de hipertensión son factores de riesgo para presentar esta patología, por lo que es necesario llevar un interrogatorio dirigido hacia la CIE en los antecedentes heredofamiliares de la paciente. La historia clínica continúa siendo un método muy útil para la detección de factores de riesgo y para el diagnóstico de algunas enfermedades, por lo que es indispensable realizar una historia clínica detallada y dirigida en busca de factores de riesgo para CIE.
Dentro de las características sociodemográficas, podemos ver que el rango de edad es muy amplio; sin embargo, el 75% de la población se encuentra por debajo de los 33 años, es decir, que la mayoría de nuestra población de estudio se encuentra por debajo de la edad materna considerada como factor de riesgo para desarrollar colestasis (35 años). El IMC pregestacional también se considera como un factor de riesgo para desarrollar CIE. En nuestro estudio el IMC promedio fue de 25.9; sin embargo, este resultado no es valorable, ya que las pacientes acuden de manera tardía al Instituto por lo que no contamos con el IMC pregestacional. Idealmente, la paciente debería de acudir a una asesoría prenatal donde se registrarán las medidas antropométricas o por lo menos se interrogará a la paciente acerca del peso preconcepcional y registrar ese dato en la historia clínica de primera vez.
En cuanto a las comorbilidades maternas, únicamente se ha encontrado un mayor riesgo para desarrollar colestasis el antecedente de haber cursado otro embarazo con colestasis. Brouwers et al.1 reportan una incidencia del 14.9% de pacientes con antecedente de CIE, por lo que podemos decir que nuestro resultado coincide con los datos reportados en la literatura.
La CIE es una enfermedad que se suele detectar durante el tercer trimestre, tal y como lo encontramos en nuestros resultados, donde el momento de diagnóstico fue en promedio a las 31.3 SDG. La presencia de prurito nos obliga a pensar en el diagnóstico de CIE, cuya sospecha clínica es muy importante; en nuestras pacientes la presencia de prurito se encontró en el 100% de las pacientes estudiadas. Es indispensable que estas pacientes sean valoradas por el Servicio de Dermatología, ya que al observar otro tipo de lesiones que no sean secundarias a rascado se puede descartar la CIE.
Una proporción de pacientes no tuvo acceso a la realización de niveles de ácidos biliares. No existe en la literatura un punto de cohorte establecido de enzimas hepáticas para diagnosticar colestasis, por lo que decidimos utilizar los valores previamente publicados en un estudio realizado en el Instituto en 2009. Únicamente 4 pacientes no cursaron con elevación de enzimas hepáticas, por lo que podemos decir que el diagnóstico clínico es un instrumento confiable en los lugares donde no se cuente con otro recurso. La enzima TGP es un indicador más sensible de la enfermedad que la TGO, porque su incremento suele ser más marcado6. En nuestro estudio, la diferencia que hubo entre las pacientes que elevaron TGP y las que elevaron TGO fue de una paciente, perteneciente al grupo de TGP. La elevación de ácidos biliares es el hallazgo de laboratorios más frecuentemente encontrado y más sensible. Este recurso fue utilizado en 12 pacientes (48%) y el diagnóstico se confirmó mediante elevación de ácidos biliares en 8 pacientes, es decir que el 66% de las pacientes a las que se les solicitó ácidos biliares cursaron con elevación del mismo. Estos hallazgos no concuerdan con la literatura, ya que el hallazgo de laboratorios más frecuentemente encontrado fue la elevación de TGP y no la elevación de ácidos biliares; sin embargo, esto podría deberse a que los ácidos biliares no pudieron realizarse en el 100% de la población. A pesar de la utilidad del diagnóstico clínico, en especial en instituciones donde no estén disponibles todos los recursos, hay que recordar que no se ha logrado identificar si la elevación de ácidos biliares precede al inicio de los síntomas o viceversa, por lo que es necesario que todas las pacientes con prurito característico entren al protocolo de estudio para CIE.
Las guías internacionales2 recomiendan el seguimiento mediante enzimas hepáticas en caso de que las pacientes persistan con prurito de etiología desconocida. Recomiendan que este seguimiento se realice cada 1-2 semanas; en el Instituto la mayoría de las pacientes tienen estudios de laboratorio en un lapso menor a 7 días. Este seguimiento intensivo no ha demostrado ningún beneficio ni materno ni fetal y representa únicamente un gasto en los recursos. También es necesario monitorizar la rapidez con la que ocurre la elevación de las enzimas hepáticas, si este aumento es muy rápido, probablemente no se trate de una CIE. En nuestro estudio, únicamente 5 pacientes continuaron con el seguimiento de las enzimas hepáticas en el puerperio. Parte de la confirmación del diagnóstico es la resolución posnatal tanto de la sintomatología, como de las alteraciones bioquímicas. En los embarazos normales puede haber una elevación fisiológica de las enzimas hepáticas en los primeros 10 días de puerperio, por lo que se recomienda que los estudios de control sean después de este periodo. Es importante recordar que, a pesar de que la principal importancia de la CIE son los desenlaces perinatales, es indispensable que las pacientes tengan un seguimiento integral de la patología.
Aunque la asociación con óbito aún es polémica, el último estudio publicado por Geenes et al. en 201414 reporta una clara asociación con OR 2.58 e IC del 95%, 1.03-6.49; sin embargo, en nuestros resultados no encontramos ningún óbito, probablemente por la baja incidencia de este desenlace. De igual manera, se observaron 3 ingresos en la UCIN, así como meconio, que podría ser un indicador indirecto de la severidad de la enfermedad. Se han reportado otros desenlaces, como asfixia neonatal o hemorragia obstétrica; en nuestro estudio no observamos ninguna de las anteriores. Al realizar el análisis de los resultados en relación con los antecedentes maternos, observamos que las pacientes con tratamiento presentaron más desenlaces adversos que las pacientes sin tratamiento. Sin embargo, esto puede ser secundario a que el grupo de pacientes que recibió tratamiento es mayor que el grupo de pacientes que no recibieron tratamiento. En la literatura se describe que el tratamiento con AUD 250mg cada 8h disminuye el parto pretérmino (RR 0.46; IC del 95%, 0.28-0.73)9.
En el 88% de los casos la vía de interrupción fue abdominal de las cuales más del 50% fue por cesárea electiva y CIE; sin embargo, hay que recordar que la CIE por sí sola no es una indicación para la vía de interrupción abdominal. Detectamos una mayor incidencia de partos pretérmino espontáneos (24%), en comparación con los partos pretérmino iatrogénicos (16%); en la literatura se ha reportado una OR de 5.39 para parto pretérmino espontáneo en pacientes con CIE. El seguimiento clínico y bioquímico de las pacientes podría ayudar a predecir el parto pretérmino, ya que se ha observado asociación entre el inicio temprano del prurito y la elevación de ácidos biliares con el desarrollo del parto pretérmino15. No existe un consenso en la literatura respecto al mejor momento para decidir la interrupción del embarazo; esto se debe a que no existe un método para llevar a cabo la vigilancia fetal en pacientes con CIE, por lo que no se puede predecir el óbito. Sin embargo, al realizar una revisión de la literatura9,14,19, consideramos que la decisión de interrupción tiene que ser mediante una valoración integral de la paciente, en donde se incluya: sintomatología materna, antecedente materno de CIE en embarazos anteriores, ácidos biliares entre las 35-37 SDG para determinar la severidad de la enfermedad y, con base a estos criterios, tomar la decisión de interrupción del embarazo.
Respecto al seguimiento fetal, aún no existe un método útil para detectar de manera oportuna a los fetos en riesgo. Algunos autores recomiendan el seguimiento mediante monitorización fetal 2 veces por semana a partir del diagnóstico9; sin embargo, como ya hemos comentado, en la CIE la vigilancia fetal antenatal no tiene utilidad por lo que no consideramos que sea una recomendación útil. Además, esto resultaría en una disminución de los recursos económicos del Instituto que podrían utilizarse de otra manera como, por ejemplo, contar con ácidos biliares dentro de los laboratorios de rutina.
El ácido ursodesoxicólico se considera como la terapia de elección para estas pacientes, recordando que su principal beneficio es la disminución del prurito y de las enzimas hepáticas22 pero aún no se comprueba su utilidad en los desenlaces perinatales. A pesar de que el 68% de las pacientes obtuvieron el fármaco adecuado, únicamente el 56% lo recibieron a la dosis correcta. Se estipula que la dosis para que haya un efecto en las sales biliares es de 10-15mg/kg/día, por lo que es necesario iniciar mínimo con dosis de 750mg diarios e ir escalando la dosis según se considere necesario.
ConclusionesEl realizar un diagnóstico clínico de CIE nos permite captar a la mayoría de las pacientes con esta patología; sin embargo, es necesario corroborar el diagnóstico, lo cual se realiza únicamente en algunas pacientes, ya sea por la falta de recursos (ácidos biliares) o por fallo en el algoritmo diagnóstico.
El seguimiento prenatal de las pacientes con CIE es ineficiente ya que no existe evidencia que demuestre el beneficio de solicitar pruebas de función hepática de manera intensiva.
Solo algunas pacientes cuentan con todos los estudios necesarios para poder integrar el diagnóstico de CIE como diagnóstico de exclusión.
Es necesario hacer hincapié en la necesidad de realizar una valoración integral de la paciente con diagnóstico de CIE durante el embarazo, para esto es preciso el seguimiento clínico y bioquímico de las pacientes durante el puerperio.
La elevación de enzimas hepáticas ocurre en el 20-60% de las pacientes con CIE, a diferencia de la elevación de ácidos biliares, que es la alteración de laboratorio más sensible y más frecuentemente encontrada, por lo que es indispensable contar con ácidos biliares. Además, no solo son útiles para el diagnóstico, sino también para el seguimiento de las pacientes.
Hay que acabar con el paradigma de que es necesario interrumpir la gestación antes de las 37 SDG. Es necesario establecer normas internas de conducta en estas pacientes ya que el criterio y el momento de interrupción no se ajustan a las recomendaciones mundiales.
La causa de óbito en estas pacientes continúa siendo poco clara, de tal forma que no existe una prueba 100% confiable para detectar el feto que está en riesgo mayor de óbito. La vigilancia del bienestar fetal de forma intensiva no ha mejorado los resultados pero sí ha incrementado los costos.
El diagnóstico oportuno de la enfermedad y el manejo activo de la paciente con colestasis, que incluye esquema de madurez pulmonar fetal entre la semana 28 y 34, y el nacimiento una vez confirmada la madurez a la semana 37, parece disminuir la mortalidad perinatal.
El tratamiento indicado debe ser administrado cumpliendo los estándares descritos en la literatura en cuanto a dosis y frecuencia.
La falta de normativa para el diagnóstico, seguimiento y tratamiento de estas pacientes se traduce en un desperdicio de recursos para cualquier institución.
A pesar de que la CIE es una enfermedad poco frecuente, es indispensable que existan lineamientos internos para homogeneizar su diagnóstico, seguimiento y tratamiento. No debemos dejar de recordar la complejidad en el diagnóstico de esta enfermedad, por lo que es necesario realizar una valoración integral y multidisciplinaria de las pacientes.
Se anexan 2algoritmos dentro de este artículo, con la finalidad de ayudar al médico a seguir una ruta diagnóstica y de toma de decisiones ante una paciente con sospecha de colestasis intrahepática (material suplementario, anexos 1 y 2).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses