Radiología mamaria: Nuevos horizontes en tiempos de pandemia
More infoSiempre ha existido preocupación por los efectos secundarios de métodos diagnósticos que utilizan radiaciones ionizantes. Durante una mamografía preocupa la dosis glandular promedio y la dosis de radiación dispersa. Evaluamos la dosis de radiación a la mama, glándula tiroides y cristalino con mamografía digital sin y con implante, tomosíntesis sin y con implante y mamografía con contraste.
Materiales y métodosEl estudio incluyó 212 mujeres sanas y con patología que fueron divididas en 5 grupos dependiendo de la modalidad mamográfica y de la presencia o no de implantes. Acudieron al Centro Clínico de Estereotaxia, CECLINES, en Caracas, Venezuela, entre junio y agosto de 2017. El análisis estadístico contempla una descripción de la población en estudio. Se comparó la dosis glandular promedio y la dosis en glándula tiroides y cristalino entre los grupos, utilizando el estadístico U de Mann Whitney.
ResultadosLa dosis glandular promedio y la dosis de radiación recibida en la glándula tiroides y el cristalino están dentro de los valores aceptables. En pocas excepciones, la dosis glandular promedio por proyección estaba discretamente por encima de los 3 mGy. La radiación dispersa a glándula tiroides y cristalino durante una mamografía tiene una contribución muy pequeña a la dosis anual equivalente.
ConclusiónLas pacientes con implante (tomosíntesis y mamografía 2D) tuvieron la mayor mediana de dosis glandular promedio y dosis a glándula tiroides y cristalino mayor que las modalidades mamográficas sin implantes.
There have always been concerns about the secondary effects of diagnostic methods that use ionizing radiation. During mammography, the parameters to be concerned about are the mean glandular dose and the scatter dose. We evaluated the dose of radiation to the breast, thyroid gland, and lens in digital mammography in women with and without implants, in tomosynthesis in women with and without implants, and in contrast-enhanced mammography.
Materials and methodsThe study included 212 women with and without disease who were attended at the Centro Clínico de Estereotaxia, CECLINES, in Caracas, Venezuela, between June 2017 and August 2017; the women were classified into five groups according to the mammographic modality used to evaluate them and whether or not they had implants. The statistical analysis included descriptive statistics for the study population. We used the Mann-Whitney U to compare the mean glandular dose and dose in the thyroid gland and lens between groups.
ResultsThe mean glandular dose and the dose of radiation received in the thyroid and lens were within the acceptable range. In a few exceptions, the mean glandular dose per view was slightly higher than 3mGy. The scatter dose to the thyroid gland and the lens during mammography has a very small contribution to the annual dose equivalent.
ConclusionThe mean glandular dose and the scatter dose to the thyroid gland and lens delivered during tomosynthesis and 2D mammography in women with implants were higher than those delivered during other mammographic techniques in women without implants.
La mamografía es útil en el cribado, diagnóstico, tratamiento y seguimiento de las pacientes con cáncer de mama, pero el hecho de que es un estudio que utiliza rayos X ha alertado sobre su uso1,2..
Demostrar efectos nocivos, estocásticos, producto del uso de los rayos X en radiodiagnóstico, en los órganos involucrados o por la radiación dispersa, en las diferentes técnicas de estudios de diagnóstico médico no es fácil1,2. Esto se debe a que los niveles de dosis utilizados son cada vez menores y sin efectos inmediatos.
Se ha cuestionado la mamografía como método de pesquisa por la posible inducción de cáncer de mama o alteraciones en órganos cercanos3, como sería el cáncer de tiroides y la opacidad del cristalino (cataratas), reflejándolo en documentos científicos, diarios, revistas y hasta en las redes sociales4,5.
Los responsables de los equipos de radiodiagnóstico deben garantizar que la dosis de radiación se encuentre en los niveles permitidos, por lo difícil que es evaluar los efectos estocásticos2,6.
Con los años ha habido mejoras notables en los equipos de mamografía, la técnica usada, el conocimiento de las ventajas de la compresión, y el desarrollo y mejoras de los diferentes componentes de los equipos para el aprovechamiento de la dosis de radiación suministrada, que se refleja en una mejor calidad de imagen con una menor dosis de radiación7,8.
Hay que tomar en cuenta que entre las pacientes existen diferencias, como el grosor de la mama y la densidad, lo que condiciona una radiación con mayor o menor potencia y variaciones en el tiempo de exposición. A estas se puede agregar la presencia de implantes mamarios que adicionarían una mayor cantidad de proyecciones y mayor grosor mamario, justificando un ajuste de la técnica para tener un estudio completo e interpretable4.
En los últimos años se ha observado un auge en la aparición de nuevas modalidades mamográficas como la tomosíntesis o mamografía 3D y la mamografía con contraste endovenoso o Contrast Enhanced Mamography9, con una modificación importante de la dosis de radiación y de la cantidad de proyecciones por estudio.
Las proyecciones a realizar en una mamografía 2D son cuatro, pero en las portadoras de implantes mamarios se realizan más proyecciones por mama, pudiendo variar la cantidad dependiendo del protocolo del centro; aumentaría hasta 8 proyecciones según Eklund y colaboradores10. En las mamografías con contraste son cuatro las proyecciones, pero existe variación en el tubo, filtros y en la potencia del rayo9.
Una mención especial merece la tomosíntesis. En principio se consideró la necesidad de realizar “combos”, 4 proyecciones 3D sumado a cuatro 2D11. Posteriormente, ha variado la cantidad de proyecciones hasta que desarrollaron la imagen reconstruida8, y se sugieren 4 proyecciones 3D más 4 2D reconstruidas12. En las pacientes con implantes retropectorales se agregan 4 proyecciones 2D con la inclusión de los implantes, lo que aumentaría la radiación total.
Existen organismos nacionales e internacionales encargados de establecer límites de dosis y la vigilar el cumplimiento13–15.
Es por ello por lo que nos hemos propuesto estimar, en pacientes referidas a nuestro centro, la dosis glandular promedio (DGP) en la glándula mamaria y la dosis de radiación al cristalino y la glándula tiroides durante la realización de las diferentes modalidades de mamografías: mamografía digital (2D) y tomosíntesis (3D) sin y con implantes y mamografía con contraste.
Materiales y métodosEl estudio se realizó con 218 mujeres sanas y con patología que acudieron al Centro Clínico de Estereotaxia, CECLINES, en Caracas, Venezuela, a realizarse una mamografía, durante los meses de junio a agosto de 2017.
Las pacientes firmaron el consentimiento informado. No se modificó la indicación del médico de referencia por lo que no fue necesaria la evaluación por parte del comité de ética. Se analizaron 5 grupos de estudio.
Criterios de inclusión: pacientes femeninos, sanas y con patología, sin y con implantes mamarios de localización retropectoral. Solo pacientes con proyecciones habituales.
Criterios de exclusión: pacientes masculinos, embarazadas, pacientes con implantes de localización prepectoral, pacientes con proyecciones adicionales.
EquiposUsamos dos equipos Senographe Essential GE Healthcare® Buc, France, con unidades añadidas SenoClaire® para las tomosíntesis y SenoBright® para las mamografías con contraste. Se corroboró el funcionamiento adecuado de los equipos 3 meses antes por un físico médico del Laboratorio Secundario de Calibración Dosimétrica (LSCD), Unidad de Tecnología Nuclear del Instituto Venezolano de Investigaciones Científicas (IVIC) en Venezuela basado en protocolos nacionales e internacionales16.
MedidasSe transcribieron a una página Excel de la pantalla de visualización del médico, por proyección, los valores de la DGP, kilovoltaje, miliamperaje por tiempo de exposición en segundos, grosor de la mama, fuerza de compresión, parámetros técnicos (automático o manual) y los datos del ánodo, molibdeno-rodio y filtro de molibdeno-rodio y cobre. Adicionalmente, edad, presencia o no de implante, cantidad de proyecciones y densidad mamaria según el BI-RADS®17. Se usó técnica en automática en mamas sin implantes y técnica manual en pacientes con implantes (tabla 1).
Análisis de la variación de los valores de dosis glandular promedio en relación con los parámetros técnicos utilizados en cada una de las proyecciones mamográficas por grupo de estudio (grupo 1 al 4)
| Grupo | Proyección | Parámetros técnicos | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Kvp | mAs | Grosor (cm) | Compr. (N) | Dosis glandular promedio (mGy) | |||||||
| Prom. (máx.-min.) | CV% | Prom. (máx.-min.) | CV% | Prom. (máx.-min.) | CV% | Prom. (máx-min.) | CV% | Prom. (máx.-min.) | CV% | ||
| 1 | CCD | 29,0 (30,0-27,0) | 2,99 | 60,6 (79,0-44,4) | 21,04 | 5,9 (7,5-2,9) | 26,41 | 108,9 (130-80) | 14,11 | 1,45 (1,8-1,0) | 18,11 |
| CCI | 28,9 (31,0-26,0) | 4,39 | 67,6 (99,0-44,0) | 24,68 | 6,1 (7,6-2,9) | 24,58 | 94,4 (110-70) | 17,65 | 1,60 (2,1-1,1) | 23,80 | |
| MLOD | 29,0 (31,0-26,0) | 4,56 | 67,6 (91,0 -43,0) | 25,36 | 6,4 (10,0-3,1) | 29,70 | 115,6 (140-80) | 20,12 | 1,63 (2,2-1,2) | 20,12 | |
| MLOI | 29,0 (31,0-26,0) | 4,56 | 68,6 (89,0 -44,0) | 19,71 | 6,4 (8,7-2,9) | 25,60 | 93,3 (110-70) | 16,94 | 1,60 (2,1-1,3) | 15,80 | |
| 2 | CCD | 28,1 (30,0-27,0) | 2,20 | 78,2 (80,0-56,0) | 6,52 | 7,8 (9,8-6,2) | 11,81 | 69,4 (90-30) | 24,79 | 1,3 (1,6-0,9) | 15,8 |
| CCI | 28,2 (30,0-27,0) | 2,57 | 78,6 (80,0-56,0) | 6,26 | 7,8 (9,7-6,0) | 12,56 | 71,5 (100-40) | 23,91 | 1,3 (2,1-0,9) | 20,14 | |
| MLOD | 28,2 (30,0-27,0) | 2,52 | 78,6 (80,0-56,0) | 6,26 | 7,4 (9,6-1,0) | 12,99 | 72,3 (110-30) | 26,53 | 1,3 (1,9-0,9) | 18,01 | |
| MLOI | 28,2 (30,0-27,0) | 2,52 | 78,6 (80,0-56,0) | 6,26 | 7,4 (9,4-6,2) | 12,98 | 72,2 (100-30) | 25,02 | 1,3 (2,2-0,1) | 25,31 | |
| CCD DI | 27,9 (29,0-26,0) | 2,67 | 65,1 (80,0-38,0) | 22,41 | 3,8 (5,8-1,7) | 27,40 | 55,9 (90-30) | 30,83 | 1,7 (2,7-0,9) | 27,44 | |
| CCI DI | 27,7 (29,0-26,0) | 2,61 | 67,4 (84,0-40,0) | 19,92 | 3,8 (8,0-2,0) | 32,93 | 58,7 (100-23) | 33,01 | 1,7 (2,5-1,0) | 26,21 | |
| MLOD DI | 27,4 (29,0-26,0) | 2,85 | 66,3 (80,0-45,0) | 20,25 | 3,7 (5,2-1,3) | 25,47 | 61,7 (110-30) | 34,66 | 1,7 (2,9-1,0) | 29,02 | |
| MLOI DI | 27,6 (29,0-26,0) | 2,99 | 65,5 (80,0-33,0) | 21,55 | 3,6 (5,8-1,7) | 27,75 | 61,3 (110-30) | 28,51 | 1,7 (2,6-0,8) | 29,85 | |
| 3 | CCD | 29,1 (31,0-26,0) | 2,50 | 66,2 (117,0-36,0) | 27,00 | 5,3 (7,5-2,4) | 21,9 | 93,1 (130-50) | 20,1 | 1,9 (3,4-0,8) | 25,5 |
| CCI | 29,2 (31,0-26,0) | 2,40 | 68,2 (189,0-27,0) | 32,50 | 5,4 (8,5-2,6) | 21,5 | 94,9 (140-40) | 20,1 | 1,9 (5,3-0,9) | 31,5 | |
| MLOD | 29,3 (31,0-26,0) | 3,10 | 70,3 (144,0-27,0) | 28,10 | 5,4 (7,9-2,5) | 22,6 | 96,5 (150-50) | 20,9 | 2,0 (4,0-1,0) | 28,5 | |
| MLOI | 29,3 (26,0-26,0) | 2,90 | 72,3 (225,0-36,0) | 33,40 | 5,5 (8,7-2,6) | 22,3 | 96,3 (150-50) | 18,3 | 2,0 (6,1-1,1) | 32,5 | |
| 4 | CCD | 28 | 0 | 80 | 0 | 7,3 (9,0-3,7) | 17,7 | 61,5 (90-30) | 29,5 | 1,4 (1,7 -1,1) | 12,4 |
| CCI | 28,1 (29,0 -28,0) | 0,8 | 80 | 0 | 7,5 (9,2-3,7) | 16,7 | 62,0 (90-40) | 27,5 | 1,4 (1,6-1,1) | 12,1 | |
| MLOD | 28 | 0 | 80 | 0 | 7,0 (9,1-3,4) | 18,3 | 66,5 (100-40) | 25,5 | 1,4 (1,6-1,1) | 12,2 | |
| MLOI | 28 | 0 | 80 | 0 | 7,2 (9,6-3,1) | 20 | 65,0 (100-40) | 26,2 | 1,3 (1,9-0,91) | 16,5 | |
| CCD DI | 28,9 (29,0-26,0) | 2,3 | 47,0 (63,0-27,0) | 24,6 | 4,3 (8,0-1,5) | 33,7 | 55,0 (80-40) | 20,9 | 1,4 (1,9-0,85) | 19,7 | |
| CCI DI | 28,7 (29,0-26,0) | 3,2 | 50,4 (72,0-27,0) | 24,9 | 4,2 (7,2-1,7) | 30 | 56,5 (80-40) | 19,3 | 1,5 (2,1-0,97) | 19,3 | |
| MLODID | 29 | 0 | 50,0 (81,0-27,0) | 25,8 | 4,2 (6,4-1,9) | 27,6 | 54,2 (80-30) | 26,3 | 1,5 (2,3-0,88) | 22,3 | |
| MLOI ID | 28,7 (29,0-26,0) | 3,2 | 46,1 (72,0-27,0) | 26,7 | 4,0 (6,3-1,5) | 29,2 | 58,0 (80-30) | 22,8 | 1,4 (1,9-0,89) | 21,8 | |
CCD: craneocaudal derecha; CCD DI: Craneocaudal derecha con desplazamiento del implante;CCI: craneocaudal izquierda; CCI DI: craneocaudal izquierda con desplazamiento del implante; cm: centímetro; comp: compresión; CV%: coeficiente de variación; kVp: kilovoltios; mAs: miliamperios segundos; máx.: máximo; mGy: miligrays; min.: mínimo; MLOD: mediolateral oblicua derecha; MLOD ID: mediolateral oblicua derecha con desplazamiento del implante; MLOI: mediolateral oblicua izquierda; MLOI DI: mediolateral oblicua izquierda con desplazamiento del implante; prom: promedio; proy: proyecciones.
Para la medida de la radiación en glándula tiroides y en cristalino se usaron dosímetros termoluminiscentes (TLD por sus siglas en inglés). La dosis a la glándula tiroides y el cristalino es el resultado de la suma de todas las proyecciones. Se colocó un TLD entre las dos cejas y otro sobre el istmo de la glándula tiroides. Los estudios fueron realizados por técnicos radiólogos y fueron evaluados por médicos radiólogos con 5 años y 22 años de experiencia, respectivamente.
Después de su exposición, los TLD se enviaron para su lectura en menos de 5 horas. La radiación de fondo se obtuvo con tres TLD colocados fuera del cuarto de mamografía, cuyo valor promedio se restó al valor que registró cada dosímetro, representando la dosis de radiación a la piel de la glándula tiroides y al cristalino.
Se emplearon 50 TLD-100H tipo MCP de la marca Radcard® (Poland), de fluoruro de litio dopados con magnesio, cobre y fósforo, tipo CHIP con dimensiones 3,2 mm× 3,2 mm× 0,9 mm. Umbral de detección: 50 nGy. La caracterización de los TLD se hizo según el método usado por el LSCD y descrito por Leal y colaboradores18.
El análisis estadístico se llevó a cabo en dos fases. La primera contempla una estadística descriptiva que caracteriza la población en estudio. En la segunda fase se realizó la evaluación comparativa de la mediana de DGP y dosis medidas en glándula tiroides y cristalino entre los grupos, usando el estadístico de comparación de U de Mann Whitney por el número de pacientes en cada grupo de estudio. La significación estadística se estableció con un valor p<0,05. Los cálculos estadísticos fueron realizados usando Microsoft Excel® 2013 (Microsoft, Redmont, EE. UU.) y con el programa estadístico Real Statistics Using Excel (www.real-statistic.com).
Se compararon grupos con la misma cantidad de proyecciones con diferentes modalidades mamográficas. Para la comparación de los grupos con implantes, se considera la dosis total de cada proyección como la adición de la dosis con implante más la del desplazamiento del implante.
ResultadosDel total de 218 pacientes fueron excluidas 6 por presentar implantes de localización prepectoral; se incluyó un total de 212 pacientes. Todos los implantes eran de silicona.
Grupos de pacientes:
Grupo 1: 9 (4,2%) pacientes con mamografías digitales 2D sin implantes, 4 proyecciones.
Grupo 2: 29 (13,7%) pacientes con mamografías digitales 2D con implantes: cuatro con la inclusión y cuatro con el desplazamiento de los implantes.
Grupo 3: 139 (65,6%) pacientes con mamografía 3D. Se hicieron 4 proyecciones 3D y 4 imágenes 2D sintéticas.
Grupo 4: 20 (9,4%) pacientes con implante y mamografía 3D: 4 proyecciones 2D con la inclusión y 4 proyecciones 3D con rechazamiento del implante y las 4 imágenes 2D sintéticas.
Grupo 5: 15 (7,1%) pacientes con mamografías con contraste (CESM).
En la tabla 2 se observa la caracterización de la población, con una mediana de edad de 52 años (79 a 31), la distribución por grupo y la densidad de la mama según ACR-BIRADS®. El análisis de los resultados se realizó de la siguiente manera:
Caracterización de la población
| Clasificación de la población por grupos de estudio y densidad de la mama | |
|---|---|
| Población total | 212 |
| Edad (años) | Med. (máx.-min.) |
| 52 (79-31) | |
| Clasificación | n (%) |
| Grupo 1 | 9 (4,2) |
| DA | 4 (44,4) |
| DB | 3 (33,3) |
| DC | 2 (22,2) |
| Grupo 2 | 29 (13,7) |
| DB | 12 (41,4) |
| DC | 14 (48,3) |
| DD | 3 (10,3) |
| Grupo 3 | 139 (65,6) |
| DA | 16 (11,5) |
| DB | 46 (33,1) |
| DC | 51 (36,7) |
| DD | 26(18,7) |
| Grupo 4 | 20 (9,4) |
| DA | 1 (5,0) |
| DB | 9 (45,0) |
| DC | 9 (45,0) |
| DD | 1 (5,0) |
| Grupo 5 | 15 (7,1) |
| DB | 5 (33,3) |
| DC | 8 (53,3) |
| DD | 2 (13,3) |
DA, DB, DC, DD: densidad A, B, C, D, respectivamente, por ACR; máx: máximo; med.: mediana; min: mínimo.
Dosis glandular promedio: el grupo 5 fue excluido por no haber podido recuperar todos los datos necesarios.
Se obtuvieron el valor promedio, rango y coeficiente de variación (CV%) para observar el comportamiento de los valores de cada uno de los parámetros que pudieran afectar a la dosis glandular promedio (tabla 1).
La mediana de la DGP (tabla 3) en el grupo 3, para las proyecciones craneocaudal derecha (CCD), craneocaudal izquierda (CCI), mediolateral oblicua derecha (MLOD) y mediolateral oblicua izquierda (MLOI) fueron 1,29, 1,02, 1,12 y 1,15 veces mayor, respectivamente, que las del grupo 1. Al comparar los grupos 2 y 4, no se observan diferencias estadísticamente significativas (p>0,05); la mayoría de los valores en el grupo 2 son mayores que en el grupo 4.
Comparación de dosis glandular promedio (DGP) entre grupos con igual número de proyecciones, pero con diferente modalidad de mamografía y comparación de DGP entre grupos con diferente número de proyecciones, pero con la misma modalidad de mamografía
| U Man-Whitney. (α=0,05) | ||||||
|---|---|---|---|---|---|---|
| Proyección | DGP. G1 (mGy) | DGP. G3 (mGy) | Valor p | Sig. | ||
| Mediana | Promedio (máx.-min.) | Mediana | Promedio (máx.-min.) | |||
| CCD | 1,36 | 1,45 (1,79-1,03) | 1,76 | 1,85 (3,43-0,84) | 0,005 | Sí |
| CCI | 1,75 | 1,60 (2,10-1,10) | 1,78 | 1,91 (5,25-0,93) | 0,137 | No |
| MLOD | 1,65 | 1,62 (2,15-1,20) | 1,85 | 1,98 (4,00-0,96) | 0,049 | Sí |
| MOLI | 1,62 | 1,60 (2,06-1,26) | 1,86 | 2,03 (6,07-1,12) | 0,013 | Sí |
| Proyección | DGP. G2 (mGy) | DGP. G4 (mGy) | Valor p | Sig. | ||
| Mediana | Promedio (máx.-min.) | Mediana | Promedio (máx.-min.) | |||
| CCD+CCD DI | 2,95 | 2,97 (4,00-2,01) | 2,94 | 2,89 (3,33-3,21) | 0,369 | No |
| CCI+CCI DI | 2,91 | 3,08 (4,09-2,38) | 2,80 | 2,85 (3,38-2,40) | 0,206 | No |
| MLOD+MLOD DI | 2,87 | 2,98 (4,18-2,21) | 2,88 | 2,88 (3,37-2,27) | 0,880 | No |
| MOLI+MLOD DI | 2,93 | 3,00 (2,93-4,05) | 2,72 | 2,77 (2,80-2,35) | 0,072 | No |
| Proyección | DGP. G1 (mGy) | DGP. G2 (mGy) | Valor p | Sig. | ||
| Mediana | Promedio (Max-min) | Mediana | Promedio (Max-min) | |||
| CCD | 1,36 | 1,45 (1,79-1,03) | 2,95 | 2,97 (4,00-2,01) | 0,00001 | Sí |
| CCI | 1,75 | 1,60 (2,10-1,10) | 2,91 | 3,08 (4,09-2,38) | 0,00001 | Sí |
| MLOD | 1,65 | 1,62 (2,15-1,20) | 2,87 | 2,98 (4,18-2,21) | 0,00001 | Sí |
| MOLI | 1,62 | 1,60 (2,06-1,26) | 2,93 | 3,00 (2,93-4,05) | 0,00003 | Sí |
| Proyección | DGP. G3 (mGy) | DGP. G4 (mGy) | Valor p | Sig. | ||
| Mediana | Promedio (Max-min) | Mediana | Promedio (Max-min) | |||
| CCD+CCD DI | 1,76 | 1,85 (3,43-0,84) | 2,94 | 2,89 (3,33-3,21) | 0,0000000002 | Sí |
| CCI+CCI DI | 1,78 | 1,91 (5,25-0,93) | 2,80 | 2,85 (3,38-2,40) | 0,0000000004 | Sí |
| MLOD+MLOD DI | 1,85 | 1,98 (4,00-0,96) | 2,88 | 2,88 (3,37-2,27) | 0,000000003 | Sí |
| MOLI+MLOD DI | 1,86 | 2,03 (6,07-1,12) | 2,72 | 2,77 (2,80-2,35) | 0,00000002 | Sí |
CCD: craneocaudal derecha; CCD DI: Craneocaudal derecha con desplazamiento del implante; CCI: craneocaudal izquierda; CCI DI: craneocaudal izquierda con desplazamiento del implante; G1, G2, G3, G4: Grupos 1,2,3,4 respectivamente; máx.: máximo; min.: mínimo; MLOD: mediolateral oblicua derecha; MLOD ID: mediolateral oblicua derecha con desplazamiento del implante; MLOI: mediolateral oblicua izquierda; MLOI DI: mediolateral oblicua izquierda con desplazamiento del implante; sig: significancia.
Se observa un aumento significativo (p<0,05) de la mediana de dosis del grupo 2 con respecto al grupo 1, con 2,17, 1,66, 1,74 y 1,81 veces más para CCD, CCI, MLOD y MLOI, respectivamente. Lo mismo ocurre para el grupo 4 con respecto al grupo 3, donde el aumento es de 1,67, 1,57, 1,56 y 1,46 veces más para CCD, CCI, MLOD y MLOI, respectivamente, con significación estadística (p<0,05).
Dosis a glándula tiroides y a cristalino: con los 5 grupos de estudiosLa dosis medida a nivel del cristalino para el grupo 3 es ligeramente mayor con respecto al grupo 1; lo mismo ocurre entre el grupo 4 y el grupo 2, sin diferencia estadísticamente significativa (p>0,05). Sí existe un aumento estadísticamente significativo en la dosis medida en cristalino (p<0,05) del grupo 5 con respecto a los grupos 1 y 3. La mediana de dosis en cristalino de los grupos 2 y 4 está por encima del valor que registra el grupo 5 con significación estadística (p<0,05). La mediana de dosis al cristalino de los grupos 4 y 2 son mayores que en los grupos 3 y 1, respectivamente, con significación estadística (p<0,05).
En cuanto a las medianas de dosis de radiación a la glándula tiroides, se observó que los grupos 3 y 4 resultaron ligeramente menores en relación con los grupos 1 y 2, respectivamente, sin diferencias estadísticamente significativas (p>0,05). La mediana de dosis para el grupo 5 es ligeramente mayor que en los grupos 1 y 3, sin significación estadística (p>0,05). La mediana de dosis a nivel de la glándula tiroides del grupo 2 es mayor que la del grupo 5 y esta a su vez es mayor que la del grupo 4, no presentando significación estadística (p>0,05). La mediana de dosis a glándula tiroides es mayor en el grupo 2 y con respecto al grupo 1 sin significación estadística (p>0,05), y mayor en el grupo 4 con respecto al grupo 3 con significación estadística (p<0,05).
DiscusiónLa exposición a la radiación con fines médicos es la mayor fuente de radiación para la población general19. Existen muchos estudios publicados en la literatura científica en los que se presentan datos estimados con maniquíes y adquiridos durante procedimientos mamográficos en pacientes4,20–22. En nuestro estudio evaluamos la dosis de radiación a la mama, la glándula tiroides y el cristalino con el uso de diversas modalidades mamográficas, agregando una variable bastante común como son los implantes, además de situaciones que se presentan en la práctica diaria que no son fáciles de simular, como el grosor, la densidad y el número de proyecciones.
Es conocido que la dosis de radiación y la radiación dispersa durante una mamografía aumenta con el grosor de la mama (tabla 1). A pesar de existir mamas con grosor de hasta 10 cm, el promedio de dosis de radiación de la mayoría se mantuvo por debajo de los límites permitidos por proyección (3 mGy). En las proyecciones que incluían los implantes, los parámetros controlados con técnica manual de kVp y mAs mantuvieron la DGP por debajo del valor permitido por proyección. La excepción se presentó en el grupo 3, en el que a pesar de que el promedio de la DGP está por debajo de 3 mG, encontramos algunos valores máximos por encima, debido a la combinación de mama gruesa y densa. Podemos mencionar el caso particular de una paciente en la que coincidieron una densidad mamaria tipo ACR D con un grosor de mama de 8,7 cm, en el que se obtuvieron valores altos de DGP de hasta 6,07 mGy en una de las proyecciones, siendo este el valor máximo de su grupo presentando un grosor de más de 7 cm con densidad mamaria ACR D. Experiencia similar presentan Baek y colaboradores en una serie de pacientes con un grosor de mama de 8,2 cm y DGP de 1,49 mGy y 1,96 mGy en mama con densidad moderada y mamas densas, respectivamente, y con valores máximos superiores23.
El grosor promedio de las mamas en los grupos 1 y 3 es de 5,6 cm (máx. 10 cm y min. 2,4 cm). Resultados similares muestran Houben y colaboradores, con un promedio de 5,88 cm24. Para Badr y colaboradores, en un grupo de 104 pacientes el grosor promedio de las mamas fue de 5,6 cm25 y para Chetlen y colaboradores, el grosor promedio reportado en su trabajo es de 6,2 cm.
En los grupos 2 y 4, el espesor de las mamas en las proyecciones sin implantes es de 3,95 cm, y en las proyecciones con implantes, de 7,4 cm, lo que representa en promedio 1,9 veces más y agrega un promedio de 3,7 cm más de grosor. En el trabajo de Smathers y colaboradores, el promedio de las proyecciones con inclusión de implantes es de 7,7 cm, y en las imágenes sin implantes de 3,5 cm, agregando los implantes más de 4 cm de espesor26. En las pacientes con implantes se presenta mayor grosor y mayor cantidad de proyecciones.
Las pacientes del grupo 3 registraron una DGP significativamente mayor (p<0,05) que las pacientes del grupo 1; solo en la proyección CCI; la diferencia no era significativa (p>0,05). En el grupo 3, la DGP fue de 1,81 mGy y un grosor de mama promedio de 5,4 cm.
En un trabajo realizado por Svahn y colaboradores, en el que hicieron una revisión de la dosis media absorbida reportada en varios estudios clínicos usando mamografía 3D y 2D, cuando se realiza la tomosíntesis en “combo” hay un aumento de la dosis de radiación a la mama significativamente mayor en 2 1/4 veces más que con la mamografía bilateral digital. Si la tomosíntesis se acompaña con la imagen 2D sintética, la dosis de radiación es casi igual a la mamografía 2D27. James y colaboradores reportan una dosis glandular promedio para la mamografía 2D de 1,3 mGy y para la 3D de 1,6 mGy, para un grosor de mama de 4,7 mm y 5,7 cm, respectivamente22.
Al comparar los grupos 2 y 4 observamos que la dosis de radiación no presentaba entre ellos diferencia con significación estadística (p>0,05), por lo que, en pacientes con implantes, el uso de la mamografía 3D no generó un aumento significativo de la dosis con respecto a la mamografía 2D.
Luego comparamos la DGP entre grupos con diferente número de proyecciones y la misma modalidad de mamografía grupo 1 vs. grupo 2 y grupo 3 vs. grupo 4 (tabla 3). Se observó un aumento estadísticamente significativo (p<0,05) de la DGP del grupo 2 con respecto al grupo 1 y del grupo 4 respecto al grupo 3.
Es importante destacar que en los cuatro grupos la mediana y el promedio de la DGP se mantiene por debajo de los valores permitidos por proyección (3mGy), de acuerdo con la Food and Drug Administration. No obstante, en la tabla 1 se observan casos con un aumento de la DGP en el grupo 3 con mama densa y gruesa, y en los grupos 2 y 4 en los que se sumó el valor de DGP de las proyecciones sin y con implante.
En el trabajo de Smathers y colaboradores se evaluó la DGP en pacientes con implantes, en mamografías analógicas, en imágenes con la inclusión y con el rechazamiento de los implantes, así como el efecto del número de proyecciones. En su casuística muestra que una mamografía de 4 proyecciones tiene una DGP de 3,4 mGy y una mamografía de 8 proyecciones, una DGP de 9,4 mGy, dato mayor que el nuestro.
Es importante saber que el valor reflejado en cada imagen de mamografía se puede tomar en cuenta para monitorear la dosis recibida por el paciente. Esto está siendo adoptado por algunos países para controlar la dosis recibida durante estudios radiológicos.
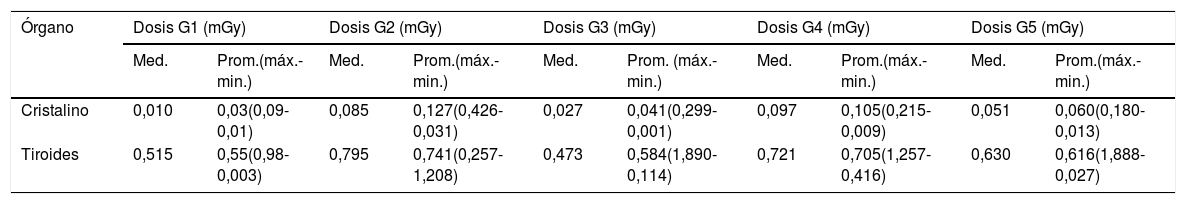
En la tabla 4, la dosis de radiación a la glándula tiroidea muestra valores que van entre los 0,55 mGy para el grupo 1, 0,584 mGy para el grupo 3 y de 0,616 mGy para el grupo 5. Los que presentaron los valores más elevados de dosis de radiación a la glándula tiroides son el grupo 4 con 0,705 mGy y el grupo 2 con 0,741 mGy.
Valores de dosis registrados en cristalino y glándula tiroides en cada grupo estudiado
| Órgano | Dosis G1 (mGy) | Dosis G2 (mGy) | Dosis G3 (mGy) | Dosis G4 (mGy) | Dosis G5 (mGy) | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Med. | Prom.(máx.-min.) | Med. | Prom.(máx.-min.) | Med. | Prom. (máx.-min.) | Med. | Prom.(máx.-min.) | Med. | Prom.(máx.-min.) | |
| Cristalino | 0,010 | 0,03(0,09-0,01) | 0,085 | 0,127(0,426-0,031) | 0,027 | 0,041(0,299-0,001) | 0,097 | 0,105(0,215-0,009) | 0,051 | 0,060(0,180-0,013) |
| Tiroides | 0,515 | 0,55(0,98-0,003) | 0,795 | 0,741(0,257-1,208) | 0,473 | 0,584(1,890-0,114) | 0,721 | 0,705(1,257-0,416) | 0,630 | 0,616(1,888-0,027) |
Prom.: promedio; máx: máximo; med.: mediana; mGy: miligrays; min.: mínimo; G1, G2, G3, G4: grupos 1,2,3,4.
En una publicación de 2016, Chetlen y colaboradores reportaron dosis en piel del lóbulo derecho del tiroides de 0,24 mGy (0,05-0,82 mGy) y del lóbulo izquierdo de 0,25 mGy (0,06-0,73 mGy), en pacientes con mamografía bilaterales de 4 proyecciones, lo que representa valores promedios por debajo de los nuestros.
Sechopoulos y Hendrick, en un artículo relacionado con la alerta de cáncer de tiroides inducido por radiación en pacientes que se realizan mamografía afirman que, para una mamografía digital de 4 proyecciones con una DGP de 3,7 mGy y asumiendo la dosis máxima relativa a la glándula tiroides de 0,045% estiman una máxima dosis a la glándula de 0,0033 mGy durante una mamografía digital, siendo estos valores muy bajos al comparar con los nuestros5. Valores similares a los nuestros son los publicados por Whelan y colaboradores en un estudio realizado en 91 pacientes con mamografía analógica, en el que reportan una dosis a la tiroides de 0,39+0,22 mGy, y encuentran que la dosis es mayor en las proyecciones MLO que en la CC y que la dosis en la glándula tiroides se estima que sea un 10% de la dosis en la piel21.
En nuestra casuística, como mencionamos, los grupos 2 y 4 registran aumentos de la mediana de dosis a nivel de tiroides por encima del 10% con respecto a los grupos sin implantes. En un estudio previo realizado por Carrizales Silva y colaboradores28, en el que evaluaron la dosis de radiación de entrada en el cristalino y glándula tiroides en mujeres a las que se les había realizado una mamografía digital 2D en 4 proyecciones, encontraron que el KERMA estimado para cristalino y glándula tiroides es de un 33,33% y un 50% menor, respectivamente, que el valor de referencia en mama de DGP de 3 mGy15,29.
En el presente trabajo, los promedios de dosis de radiación a la glándula tiroides están por debajo de los valores permitidos por los organismos nacionales e internacionales. Adicionalmente, la glándula tiroides es un órgano susceptible de desarrollar cáncer posterior a la exposición a los rayos X en individuos jóvenes, no siendo la edad en la que a las mujeres le indican la mamografía30.
Con respecto a la dosis al cristalino, evidenciamos que los valores se encuentran en niveles menores que para la glándula tiroides. Los niveles de dosis de radiación en el grupo 1 son de 0,03 mGy y en el grupo 2, de 0,127 mGy, siendo este último valor aún menor que en el grupo 5 (0,06 mGy). La dosis en el “puente nasal” reportada por Chetlen y colaboradores, de un total de 207 pacientes solo obtuvo una dosis de radiación medible en 51 con un promedio de 0,025m Gy (<0,0335 mGy -0,121 mGy) con valores similares a nuestro grupo 1.
No son muchos los trabajos que estudian la dosis de radiación dispersa en el cristalino con una mamografía. Mayor dosis de radiación al cristalino se observa si el ojo está en el campo de estudio durante una tomografía axial de cabeza o en el personal ocupacionalmente expuesto durante un procedimiento intervencionista18.
El límite de dosis a las lentes del ojo ha ido disminuyendo en los últimos años31. Para el 2011, “La comisión hace una revisión y emite nuevas recomendaciones y estima que el límite de dosis absorbida es de 0,5 Gy; y recomienda para el personal ocupacional, en situaciones de exposición planificada que, el límite de dosis equivalente a las lentes del ojo debe ser de 20 mSv en un año promediado en períodos definidos de 5 años con exposiciones que no excedan los 50 mSv en ninguno de los años”32.
La contribución de la mamografía a la dosis de radiación dispersa al cristalino durante la realización de las diferentes modalidades en nuestro trabajo está muy por debajo de la dosis de referencia anual recomendada por la Comisión Internacional de Protección Radiológica (32).
Las pacientes del grupo 5 recibieron una dosis mayor en cristalino que las pacientes del grupo 3 y estas a su vez mayor que las pacientes del grupo 1; el aumento en la dosis está relacionada con la modalidad de mamografía utilizada. Además, observamos que la mediana de dosis en los grupos 2 y 4 se mantiene por encima de la registrada para el grupo 5, por lo que la mayor cantidad de proyecciones tienen un efecto de radiación importante.
En la tabla 4 se observa que en todos los grupos la mediana de dosis a nivel de la glándula tiroides es mayor que la mediana de dosis a nivel del cristalino, 51,5, 9,35, 17,52, 7,43 y 12,35 veces para los grupos 1, 2, 3, 4 y 5, respectivamente. Estos valores están relacionados con la situación anatómica de la glándula tiroides y con la radiación dispersa de la mamografía y no por escape de radiación del sistema de blindaje del tubo de rayos X, ni por estar estos órganos involucrados en el campo de radiación.
Si evaluamos la diferencia de las medianas de dosis en cristalino, se observa un aumento de 8,5 veces para el grupo 2 con respecto al grupo 1, y de 3,59 veces para el grupo 4 con respecto al grupo 3. En el caso de la dosis medida en la glándula tiroides se observó un aumento de 1,54 veces en el grupo 2 con respecto al grupo 1 y 1,52 veces en el grupo 4 con respecto al grupo 3. De igual manera, las medianas de dosis de radiación al cristalino y a la glándula tiroides del grupo 5 fueron mayores en 5,1 y 1,52 veces, respectivamente, al comparar con las del grupo 1. La dosis de radiación del grupo 2 se mantiene por encima de las registradas para el grupo 5 de 1,67 veces para cristalino y 2,26 veces para la glándula tiroides, resaltando la importancia que tiene una mayor cantidad de proyecciones.
Dentro de las limitaciones del estudio tenemos que fue realizado con equipos de una sola marca. No hicimos mediciones con cámaras de ionización para corroborar la DGP señalada por el mamógrafo, tuvimos como referencia la comprobación del funcionamiento de los equipos por el mantenimiento regular y la evaluación por un físico médico. Para la comparación de los grupos utilizamos la mediana por el número tan heterogéneo de pacientes en cada grupo. Otra limitación fue el no poder recuperar los valores de DGP en las pacientes del grupo 5.
Debemos resaltar que la experiencia del técnico radiólogo y el control de calidad frecuente en los equipos son fundamentales para que se cumpla con los parámetros de garantía de calidad establecidos en las diferentes normas internacionales16 y lograr dosis de radiación lo razonablemente menor posible para el diagnóstico médico.
Se requiere de nuevos estudios en los que se evalúe la reducción de la dosis de radiación en las pacientes con implantes y con la garantía de que no se reduciría la tasa de diagnóstico de cáncer de mama como lo plantearon Smathers y colaboradores en el 200726.
ConclusiónLa mediana de DGP y de dosis de radiación recibida en la glándula tiroides y el cristalino está dentro de los valores esperados. En pocas excepciones, la DGP estaba por encima de los 3 mGy. En los grupos sin implantes, la DGP en las pacientes con tomosíntesis era significativamente mayor que en las pacientes con mamografía 2D, pero la más alta DGP la presentaron los grupos con implante. La radiación a la glándula tiroides y el cristalino de una mamografía tiene una contribución muy pequeña a la dosis anual equivalente. La tomosíntesis y la mamografía 2D con implantes tienen una dosis al cristalino mayor que la mamografía con contraste y esta mayor que la mamografía 3D y 2D. La radiación a la glándula tiroides en los grupos con implantes mamografía 2D y 3D fue mayor que la mamografía con contraste, la mamografía 2D y la tomosíntesis.
Autoría- 1.
Responsable de la integridad del estudio: JPF
- 2.
Concepción del estudio: JPF.
- 3.
Diseño del estudio: JPF.
- 4.
Obtención de datos: JPF, AFM, SB, VR.
- 5.
Análisis e interpretación de los datos: JPF, VR, CS.
- 6.
Tratamiento estadístico: Lic. Laura Aguirre.
- 7.
Búsqueda bibliográfica: JPF
- 8.
Redacción de trabajo: JPF, AG.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: JPF, AG.
- 10.
Aprobación de la versión final JPF, AG, CS.
Los autores declaran no tener ningún conflicto de intereses.