Hasta hace algunas décadas los tumores cardiacos tenían solo un interés académico dada su baja tasa de presentación; sin embargo, con el advenimiento del baipás cardiopulmonar, el manejo quirúrgico comienza a ser posible y, más recientemente, junto con la investigación farmacológica, contribuyen al desarrollo de nuevas estrategias de tratamiento para estos pacientes.
La incidencia estimada de los tumores cardiacos es baja y tiene un comportamiento generalmente benigno y manifestaciones clínicas inespecíficas. Estos tumores en la edad pediátrica se asocian a esclerosis tuberosa, una enfermedad de patrón de herencia autosómica dominante que se caracteriza por una alteración en la diferenciación y multiplicación celular (hamartomas) en diferentes sistemas. Desde el punto de vista cardiaco, el grado de morbilidad está condicionado por el tamaño y la localización tumoral dentro de la cavidad, y tiene riesgo de obstruir los tractos de salida ventriculares, alterar la función valvular o producir trastornos de conducción. Algunos pacientes solo requieren seguimiento clínico durante el transcurso de su vida, pero existe la posibilidad de regresión tumoral; otros se benefician de una resección quirúrgica por su impacto hemodinámico o alteraciones del ritmo cardiaco. Sin embargo, no todos son candidatos quirúrgicos, en cuyo caso el manejo con inhibidores m-TOR ha surgido como una alternativa terapéutica.
Se presenta el caso de tres neonatos con esclerosis tuberosa y rabdomioma cardiaco, diagnosticados en etapa prenatal, a quienes se les realizó un abordaje terapéutico individualizado, basado en las opciones actuales disponibles para este grupo de pacientes.
Up to a few decades ago, cardiac tumours were only of academic interest given their low presentation rate. However, with the advances in cardiopulmonary, surgical management began to be possible, and more recently, they contribute to the development of new treatment strategies for these patients.
The estimated incidence of cardiac tumours is low and are generally benign with non-specific clinical signs and symptoms. In paediatrics, these tumours are associated with tuberous sclerosis, a disease with a dominant autosomal inheritance pattern, which is characterised by an alteration in cell differentiation and multiplication (hamartomas) in different systems. From a cardiac point of view, the morbidity level is determined by the size and location of the tumour within the cavity, the risk of obstructing ventricular outflow tracts, alterations in valvular function, and conduction disorders. Some patients only require clinical follow-up all their lives, as there is the risk of tumour regression. Others may benefit from surgical resection due to its haemodynamic impact or changes in cardiac rhythm. However, not everyone is a candidate for surgery, in which case, management with m-TOR inhibitors has emerged as a therapeutic alternative.
The case is presented on three neonates with tuberous sclerosis and a cardiac rhabdomyoma, diagnosed in the prenatal stage. An individualised therapeutic approach was made based on the current options available for this group of patients.
La esclerosis tuberosa es una enfermedad multisistémica, con patrón de herencia autosómico dominante, secundario a una mutación en los genes TSC1 y TSC2, que altera una vía de señalización que controla el crecimiento celular y el metabolismo1. Se caracteriza por la presencia de múltiples hamartomas benignos en diferentes órganos, como el cerebro, los ojos, el corazón, el hígado, los riñones y la piel. La mayoría de estos pacientes presentan déficit cognitivo, autismo, problemas de conducta y dificultades psicosociales, los cuales han sido relacionados con la presencia de hamartomas glioneurales2. Las lesiones cutáneas descritas en más del 90% de los pacientes corresponden a máculas hipopigmentadas, angiofibromas, placas fibrosas en la frente y fibromas periungueales. Por su parte, la prevalencia de lesiones renales incrementa con la edad, con frecuencia se encuentran angiomiolipomas, y en menor frecuencia se hallan quistes benignos y carcinoma de células renales. Desde el punto de vista oftalmológico, los hamartomas pueden comprometer la retina, los párpados y el iris3. El compromiso cardiovascular está determinado principalmente por la presencia de rabdomiomas, que son el tumor primario más común en lactantes menores de un año y tienen un curso benigno en el 75% de los casos4. Infortunadamente, la regresión de los tumores no se presenta en todos los casos, por lo cual es necesario realizar un seguimiento clínico estrecho y establecer un plan de manejo interdisciplinario para aquellos con impacto clínico significativo.
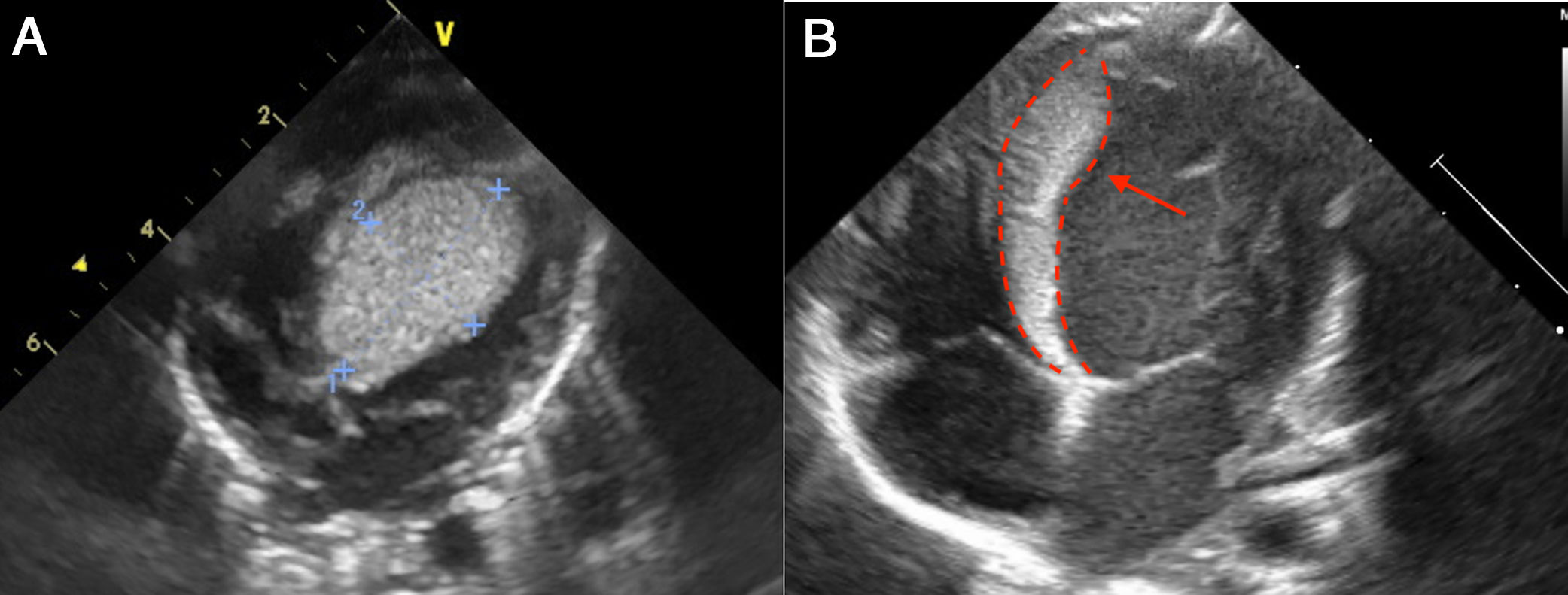
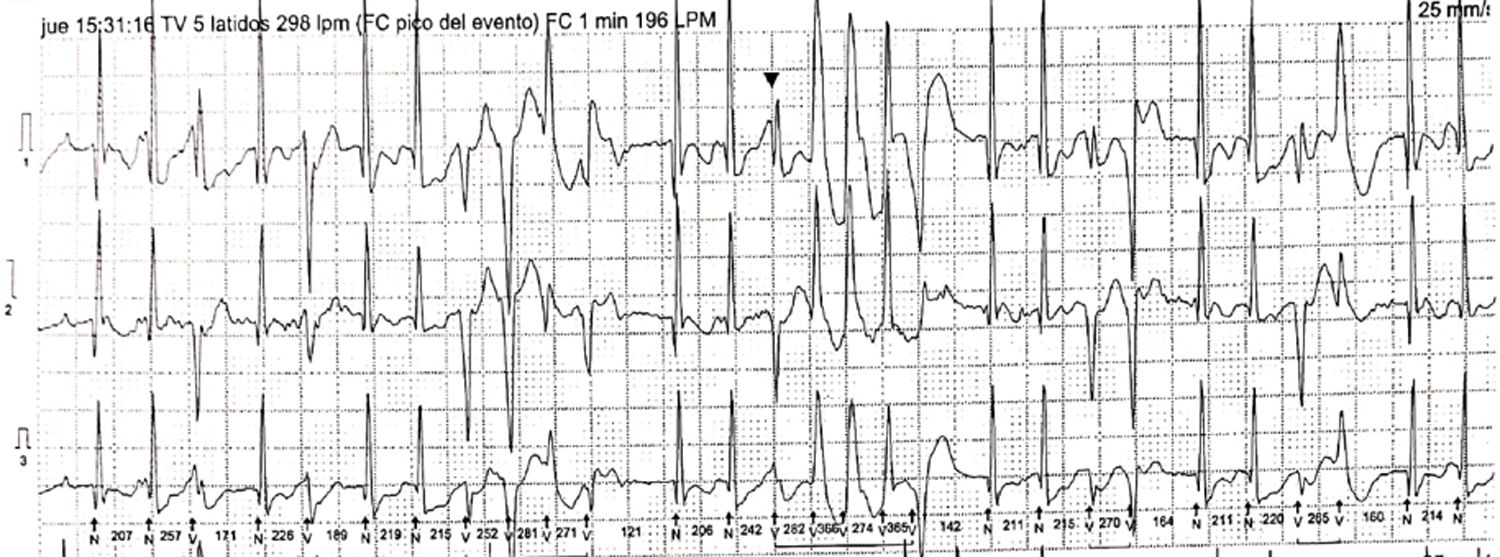
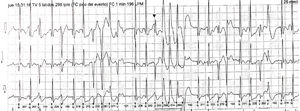
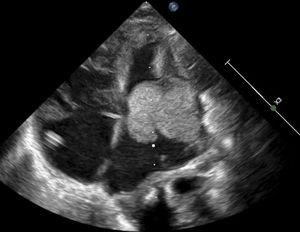
Caso 1Paciente de 2 días de vida, con peso de 2.900g, producto de un segundo embarazo. Las ecografías prenatales reportan múltiples rabdomiomas cardiacos y tuberomas cerebrales, y tiene diagnóstico genético de la mutación por amniocentesis de esclerosis tuberosa. Ingresó estable y asintomático. Se realizó ecocardiograma que confirmó múltiples rabdomiomas, especialmente uno de gran tamaño en el tracto de salida del ventrículo izquierdo, sin obstrucciones (fig. 1A). Durante los primeros días de estancia hospitalaria continuó con frecuencias cardíacas normales para la edad, sin trastornos del ritmo y buena estabilidad hemodinámica. Se consideró que en ese momento no era candidato a manejo quirúrgico dado que no presentaba obstrucción importante de los tractos de salida cardíacos ni arritmias de alto grado. Adicionalmente, se tuvo en cuenta el riesgo de la resección profunda septal que probablemente perforaría el septum nativo. Por consiguiente, se eligió la opción farmacológica. Se inició tratamiento con everolimus 0,1mg/día. Se realizó resonancia magnética nuclear (RMN) cerebral que reportó numerosas lesiones nodulares, compatibles con esclerosis tuberosa. Al quinto día del inicio de la terapia se tomaron niveles en sangre de 12,31 ng/ml (valor de referencia 3-8 ng/ml), por lo que se disminuyó la dosis a 0,05mg/día. Al décimo día de vida se detectaron ruidos cardiacos arrítmicos, evidencia de latidos prematuros de origen ventricular y trastornos en la repolarización en el electrocardiograma (EKG). Mediante Holter de 24 horas se confirmó una alta carga arrítmica, 18%, por presencia de latidos ventriculares prematuros polimórficos (fig. 2). Se inició betabloqueador y tuvo adecuada tolerancia hemodinámica, sin evidencia de otro tipo de arritmias en Holter de control. A los 19 días de vida los niveles de everolimus estaban en rango terapéutico, sin evidencia de alteración hematológica, trastorno del metabolismo de los lípidos o alteración renal, por lo cual se dio egreso. Acudió a control ambulatorio a las 5 semanas de iniciado el everolimus y no se documentaron efectos colaterales de la terapia, como infección; había control de la alteración del ritmo y evidencia ecocardiográfica de reducción del tamaño del tumor (fig. 1B).
A. Imagen de rabdomioma cardiaco, caso 1; vista apical cuatro cámaras. Ecocardiograma 2 D. Se observa una gran masa de 30mm x 30mm homogénea, de bordes limitados, que compromete todo el septum interventricular, la cual se extiende hacia la cavidad ventricular izquierda con disminución del calibre del tracto de salida sin generar gradiente. B. Ecocardiograma 2D: imagen de rabdomioma cardiaco, caso 1. Posterior a manejo con everolimus; vista apical cuatro cámaras. La flecha señala una masa homogénea, de bordes limitados, móvil, de 7 x 23 mm, que compromete todo el septum interventricular, y la cual, previo a manejo con everolimus, tenía unas dimensiones de 30 x 30 mm, con extensión a la cavidad ventricular y disminución de aproximadamente 40% del tamaño.
Trazado electrocardiográfico de Holter 24 horas. Se evidencian extrasístoles ventriculares de diferente morfología, en bigeminismo, trigeminismo, dupletas, tripletas y episodios de taquicardia ventricular polimórfica, así como extrasístoles supraventriculares ocasionales, algunas con conducción aberrante.
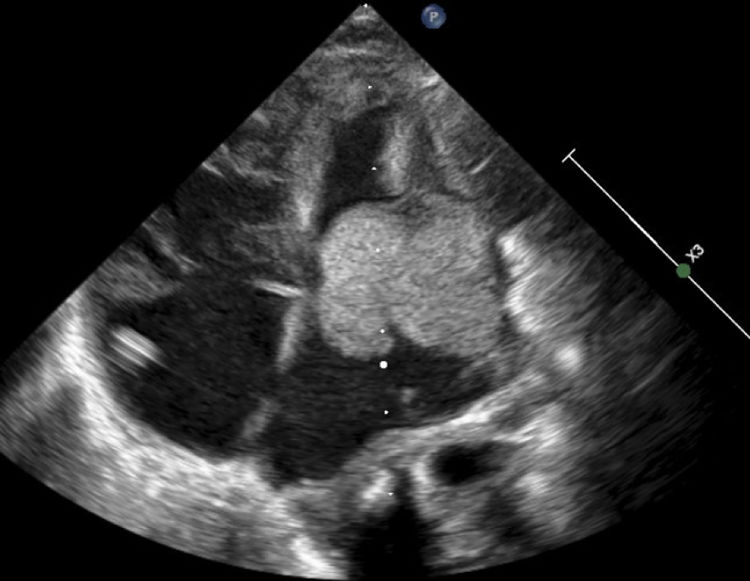
Paciente masculino, producto del segundo embarazo, en cuya ecografía fetal del tercer trimestre se reportó ventrículo izquierdo ocupado por imagen ecogénica. Nació sin complicaciones. Al tercer día de vida presentó signos de inestabilidad hemodinámica con hipoperfusión distal. Fue admitido a la unidad de cuidado neonatal donde se documentó evento de taquicardia supraventricular que revirtió con medidas vagales. Se realizó ecocardiograma que reportó gran masa homogénea, móvil, que comprometía la cruz del corazón y múltiples lesiones de iguales características a nivel biventricular, de tamaños variables, con función sistólica y diastólica normal (fig. 3). Se inició manejo con inodilatador y prostaglandina para favorecer el flujo sistémico. La tomografía axial computarizada (TAC) cerebral reportó imágenes sugestivas de tuberosidades, en tanto que la ecocardiografía abdominal no mostró alteraciones. Con base en estos resultados se realizó resección parcial de masa auricular y estudio histológico, el cual confirmó rabdomioma cardiaco. En el primer día posoperatorio presentó nuevo evento de taquicardia supraventricular (sospecha flutter atrial) inestable, con frecuencia cardíaca hasta de 230 lpm e hipotensión. Se administró adenosina y amiodarona, y se realizó cardioversión eléctrica, pero no se logró controlar el ritmo, por lo que requirió estimulación de la aurícula con marcapasos, con lo cual recuperó el ritmo sinusal. Al día 13 de vida se inició everolimus como coadyuvante en la disminución del tamaño de la lesión; sin embargo, presentó deterioro infeccioso con compromiso gastrointestinal, que obligó a suspender la terapia. Permaneció en la unidad de cuidados intensivos pediátricos para manejo de su proceso infeccioso, al que se asoció compromiso sistémico e inestabilidad hemodinámica. Tuvo un nuevo episodio de taquicardia supraventricular para el cual se realizó Holter y nuevo EKG, en el que se documentó acortamiento del intervalo PR, ensanchamiento del QRS en presencia de onda delta, alteraciones en la repolarización y eje de la onda T opuesto al eje QRS, con lo cual se estableció el diagnóstico de síndrome de Wolff-Parkinson-White (WPW) asociado. Se inició manejo betabloqueador con el cual se obtuvo buena respuesta y se pudo dar de alta hospitalaria a los 52 días de vida, para seguimiento ambulatorio.
Ecocardiograma 2D vista apical (cuatro cámaras). Se observa una gran masa homogénea, móvil, de bordes limitados, de 28 x 25 mm, que compromete la cruz del corazón y se extiende hacia su interior. Hay obstrucción severa en el tracto de entrada del ventrículo izquierdo. Se observan múltiples masas de iguales características y diferentes tamaños en ambos ventrículos.
Paciente femenino, de un día de vida, producto del primer embarazo. Parto por cesárea, embarazo sin complicaciones, con diagnóstico prenatal a las 30 semanas de gestación por ecocardiografía fetal de múltiples masas cardiacas y esclerosis tuberosa confirmada en líquido amniótico por estudio genético de la mutación. Peso al nacer de 2.920g, con adaptación neonatal espontánea. Al examen físico se documentó un soplo mesosistólico en mesocardia, grado III/IV, sin frémito, componente pulmonar del segundo ruido cardiaco normal, sin otros hallazgos patológicos al examen físico. El EKG mostró ritmo sinusal con frecuencia cardiaca entre 80-110 por minuto, con latidos auriculares prematuros. Se realizó monitorización Holter en la que no se evidenciaron arritmias de alto grado o trastornos en la conducción cardiaca. La radiografía de tórax mostró cardiomegalia y flujo pulmonar normal. Se realizó ecocardiograma en el que se observaron múltiples imágenes refringentes, ovaladas, adheridas a la pared de ambos ventrículos, atrios sin masas, sin obstrucción de los tractos de salida, y función sistólica y diastólica normal. Se realizó ecografía abdominal sin hallazgos patológicos. La RMN cerebral mostró calcificaciones subependimarias a nivel periventricular sin datos de edema u obstrucciones. Mediante estudio histopatológico se diagnosticó rabdomioma cardiaco. Se decidió conducta conservadora y seguimiento ambulatorio. Durante el seguimiento se evidenció regresión de la masa tumoral total a los dos años siguientes.
DiscusiónEstos casos muestran la presentación, los posibles abordajes y las complicaciones asociadas al estudio de rabdomiomas cardiacos neonatales con buenos resultados iniciales.
Los rabdomiomas representan el tumor primario más común en lactantes menores de un año5. La mayoría de los pacientes pediátricos en quienes se encuentran rabdomiomas cardiacos tienen esclerosis tuberosa subyacente; sin embargo, no es un hallazgo universal en todos los pacientes que padecen dicha enfermedad6. Generalmente los rabdomiomas son multifocales, circunscritos y sin cápsula. Inician su desarrollo in útero y, con frecuencia, son diagnosticados en etapas prenatales, como ocurrió con estos tres pacientes. La edad gestacional de diagnóstico oscila entre las 16 y 39 semanas, con una etapa de rápido crecimiento hasta la semana 327. Las hormonas maternas se postulan como un factor favorecedor durante esta etapa, presentando una regresión paulatina luego del nacimiento debido a la pérdida de estimulación hormonal8.
La localización más frecuente es ventricular, de predominio izquierdo, pero también se pueden hallar en las aurículas o la unión cavo-atrial9. La presentación clínica es amplia e inespecífica, desde hallazgo incidental en un estudio de imagen por otras causas aparentemente no relacionadas, hasta trastornos severos en el ritmo cardiaco y falla cardiaca. En general, los síntomas se presentan entre la etapa perinatal y el primer año de vida.
Los casos descritos, además de las implicaciones mecánicas derivadas del tamaño y la localización de los rabdomiomas, presentan trastornos en el ritmo, las cuales han sido relacionados previamente como debut clínico temprano en neonatos10. Los rabdomiomas cardiacos puede ser un sustrato para la generación de arritmias de tipo taquicardia supraventricular, disfunción del nodo sinusal, bloqueo cardiaco y taquicardia ventricular. Se ha descrito preexcitación ventricular hasta en el 10% de los pacientes afectados por estos tumores11.
La evaluación inicial de los pacientes con diagnóstico prenatal de rabdomioma cardiaco incluye no solo la evaluación cardiovascular mediante EKG y ecocardiograma, sino también la búsqueda activa del compromiso de los diferentes sistemas, principalmente el nervioso central12. Las imágenes diagnósticas no invasivas, como ecocardiografía, TAC y RMN, desempeñan un papel fundamental para la identificación y estadificación de las diferentes tumoraciones cardiacas, así como para establecer un diagnóstico diferencial basado en las características morfológicas y la planificación de su abordaje terapéutico13.
El manejo de las lesiones cardiacas es variado. La regresión espontánea de los rabdomiomas es una de las características que ocurre en más de la mitad de los pacientes13–15. En uno de los casos que se exponen se documentó la regresión completa a los dos años de seguimiento. Los pacientes asintomáticos generalmente solo requieren vigilancia estrecha, dada su baja probabilidad de transformación maligna. Los pacientes sintomáticos con signos de falla cardiaca o con arritmias e inestabilidad hemodinámica, que no respondan al tratamiento médico, requieren intervención; sin embargo, la resección quirúrgica no siempre es técnicamente posible, ya sea por su localización (masas intramurales) o por ser múltiples y tener extensiones intracavitarias16,17. A ello se suman los riesgos inherentes de una intervención quirúrgica cardiaca en este grupo poblacional.
En vista de que la esclerosis tuberosa se da por mutaciones que resultan en activación de m-TOR, una proteína relacionada con el incremento en la proliferación celular responsable de las lesiones hamartomatosas18, se ha postulado el uso de inhibidores m-TOR (everolimus) como alternativa farmacológica para los pacientes con rabdomiomas hemodinámicamente significativos o no candidatos para manejo quirúrgico, por su actividad en la disminución de la proliferación anormal19,20. Uno de los pacientes con un rabdomioma de gran tamaño, pero sin obstrucción del tracto de salida ventricular, se consideró candidato e inició terapia con everolimus. Tuvo adecuada tolerancia al fármaco, no se documentaron reacciones adversas durante el periodo inicial y se redujo de manera significativa la masa tumoral a las 5 semanas de seguimiento ambulatorio.
La literatura disponible hasta el momento proviene de reporte de casos y un limitado número de pacientes; sin embargo, se describen resultados favorables a corto y mediano plazo, con los que se demuestra la eficacia de everolimus en la reducción del volumen tumoral19,21,22. Los principales efectos adversos descritos son manifestaciones dermatológicas, alteraciones en el perfil lipídico, anemia, neutropenia, así como procesos infecciosos, especialmente del tracto gastrointestinal y respiratorio23. En otro de los casos expuesto se intentó esta terapia pero tuvo que ser suspendida a causa de un proceso infeccioso con compromiso sistémico. Existe un vacío en la literatura sobre el seguimiento a largo plazo y en cuanto a la evidencia de resolución del tumor tras suspender el tratamiento con everolimus.
ConclusiónA pesar de su baja incidencia los rabdomiomas cardíacos representan una causa importante de morbilidad y mortalidad en la población pediátrica. Las técnicas de imágenes hacen posible su diagnóstico en etapas tempranas del desarrollo y se dispone de varias alternativas de manejo según su impacto y presentación clínica, que incluyen desde el seguimiento expectante, hasta la resección quirúrgica y el manejo farmacológico dirigido al tumor o a sus complicaciones. En la actualidad existe la necesidad de realizar registros poblacionales que incluyan un número suficiente de pacientes para evaluar la historia natural de los rabdomiomas cardiacos tratados con everolimus.
FinanciaciónNinguno.
Conflicto de interesesNinguno.