Las fracturas por fragilidad (FF) son frecuentes en pacientes osteoporóticos. Existen una serie de factores de riesgo y variables clínicas, que podrían predecir su aparición.
Material y métodoSe realizó un estudio observacional retrospectivo de casos y controles. Los casos estuvieron definidos por la presencia de una FF (326 participantes) y los controles por pacientes de similares características sin FF (629 participantes).
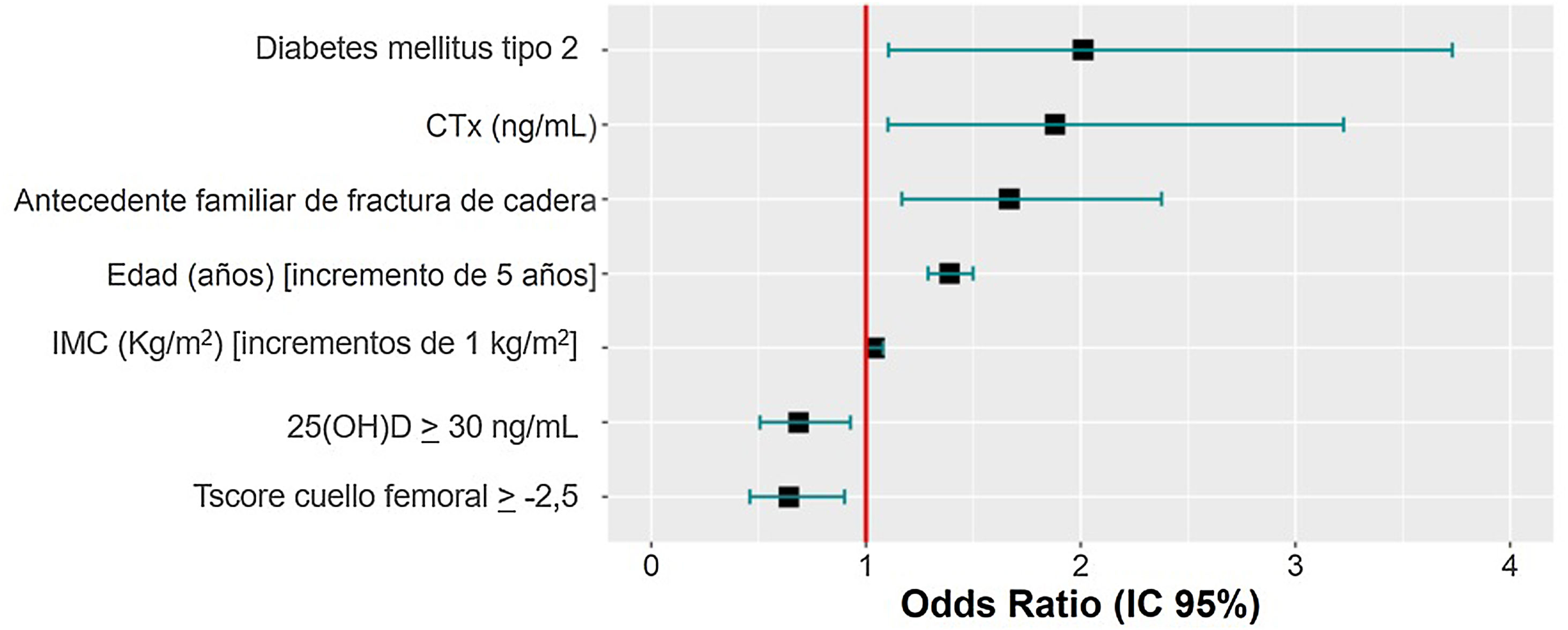
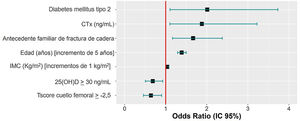
ResultadosCiertos factores aumentan el riesgo de FF, como un diagnóstico previo de DM tipo 2 (OR: 2,001), las elevaciones de 1ng/mL del CTX (OR: 1,88), tener antecedentes parentales de fractura de cadera (OR: 1,667), el aumento en 5 años en la edad (OR: 1,39) y los incrementos de 1kg/m2 del IMC (OR: 1,041). Por el contrario, otros factores evaluados disminuyen ese riesgo, como mantener unos niveles de 25(OH)D≥30ng/mL (OR: 0,686) y una T-score≥−2,5 (OR: 0,642).
ConclusionesNiveles de 25(OH)D≥30ng/mL y una T-score en el cuello femoral≥−2,5 son factores protectores de las FF, mientras que el diagnóstico previo de DM tipo 2, un CTX elevado, el antecedente parental de fractura de cadera, un incremento de 1kg/m2 del IMC y el aumento de la edad en 5 años serían predisponentes a padecer FF.
Fragility fractures (FF) are frequent in osteoporotic patients. There are a series of risk factors and clinical variables that could predict their appearance.
Material and methodA retrospective observational study of cases and controls was carried out. Cases were defined by the presence of FF (326 participants) and controls by patients with similar characteristics without FF (629 participants).
ResultsCertain factors increase the risk of FF, such as a previous diagnosis of type 2 DM (OR: 2.001), 1ng/mL elevations of CTX (OR: 1.88), having a parental history of hip fracture (OR: 1.667), 5-year increase in age (OR: 1.39), and 1kg/m2 increases in BMI (OR: 1.041). In contrast, other factors evaluated decreased this risk, such as maintaining 25(OH)D levels≥30ng/mL (OR: 0.686) and a T-score≥−2.5 (OR: 0.642).
ConclusionsLevels of 25(OH)D≥30ng/mL and a T-score at the femoral neck≥−2.5 are protective factors for FF, while a previous diagnosis of type 2 DM, an elevated CTX, a parental history of hip fracture, an increase of 1kg/m2 in BMI and an increase in age by 5 years would be predisposing to FF.
La osteoporosis (OP) es una enfermedad caracterizada por una pérdida gradual e indolora de hueso, aumentando el riesgo de fracturas por fragilidad (FF), ante traumatismos de baja energía1. Su diagnóstico se realiza fundamentalmente por medición de la densidad mineral ósea (DMO) por medio de una densitometría ósea (DO). La utilización de las puntuaciones T de la DO se considera el patrón oro para distinguir entre valores normales (−1 y superiores), osteopenia (entre −1 y −2,5), osteoporosis (−2,5 o menos) y osteoporosis grave (−2,5 asociado a una FF)2. La presencia de algunas FF puede establecer el diagnóstico de OP, como ocurre con la fractura vertebral y de cadera3.
Sabemos que una de cada 3 mujeres y uno de cada 5 hombres mayores de 50 años sufrirán una FF a lo largo de su vida4. Las FF más características son aquellas localizadas en la cadera, los cuerpos vertebrales, el húmero, la muñeca, las costillas, la tibia (excluyendo el tobillo), la pelvis y otras fracturas femorales3,5,6. Hay que destacar que aquellas personas que sufren una primera FF tienen a su vez un incremento del riesgo de nuevas FF, que se eleva exponencialmente con la edad4,7,8. A pesar del importante impacto que las FF provocan en la salud y en la calidad de vida del paciente8, existe una infravaloración de sus consecuencias y de su tratamiento.
Conocemos una serie de factores de riesgo (FR) y de situaciones clínicas, analíticas y densitométricas, que influyen en la predisposición individual a desarrollar la enfermedad y sus FF. Los FR se dividen en dos grupos: no modificables, como la edad y el sexo, y modificables relacionados con el estilo de vida, como el tabaquismo o el consumo de alcohol, entre otros. La mayoría de los FR actúan provocando un descenso de la DMO y solo algunos se identifican como FR independientes (DMO, AR, tratamiento GC, antecedente parental de fractura de cadera y probablemente la diabetes mellitus [DM])1,9,10.
La vitamina D ayuda a la absorción intestinal de calcio de los alimentos, tiene un efecto regulador disminuyendo el nivel de la hormona paratiroidea (PTH), asegurando una correcta renovación y mineralización del hueso, aumentando la DMO1. Existe un consenso general de que las personas mayores tienen unos niveles séricos de vitamina D por debajo de lo normal. Restaurar estos niveles es importante para la homeostasis del calcio y del hueso y, por tanto, para la salud en general11 y es necesario para optimizar una respuesta adecuada a los tratamientos antirresortivos12. Se considera que la 25(OH)D es un marcador del estatus corporal de vitamina D11, siendo recomendable mantener unos niveles séricos superiores a 30ng/ml (75nmol/L)12.
Según varios estudios, parece existir una relación inversa entre los niveles séricos de 25(OH)D y la PTHi13,14. El aumento de los niveles séricos de PTH estimula el recambio óseo, provocando una pérdida de hueso predominantemente cortical, aumentando el riesgo de fractura15.
Hipótesis del estudio. Nuestra hipótesis del estudio indicaba que existen variables clínicas, analíticas y densitométricas relacionadas con la aparición de la FF. Para determinar su efecto se ha realizado este estudio observacional retrospectivo, cuyos objetivos fueron:
- •
Objetivo primario. Evaluar los FR y determinadas variables clínicas, analíticas y densitométricas.
- •
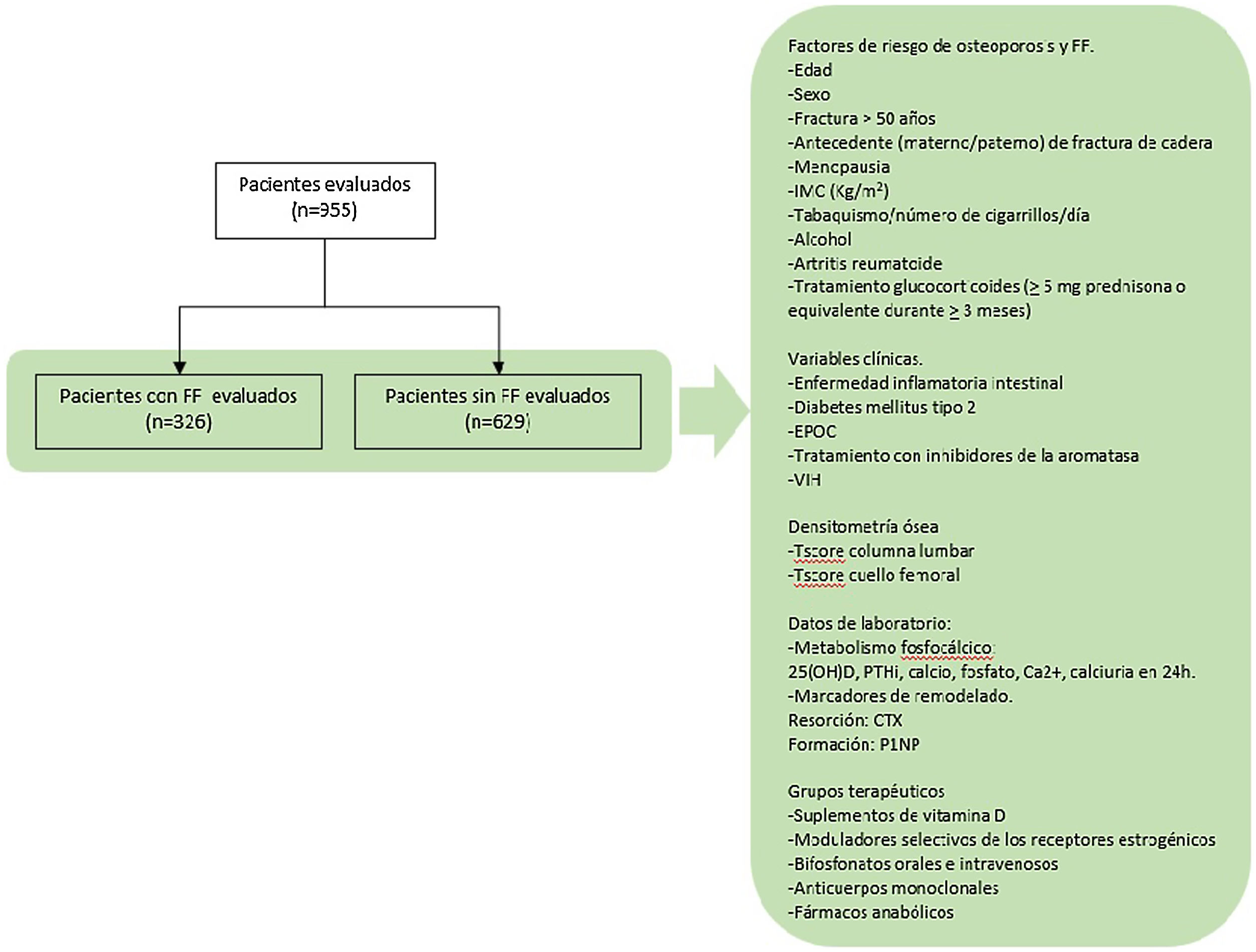
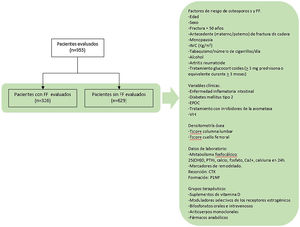
Objetivo secundario. Evaluar los grupos terapéuticos con los que estaban siendo tratados los participantes (fig. 1).
Se realizó un estudio retrospectivo de casos y controles, utilizando los datos recogidos en la primera visita de las historias clínicas de los pacientes atendidos en una unidad de metabolismo óseo hospitalaria, desde enero de 2019 hasta diciembre de 2020. Todos ellos habían sido previamente evaluados por médicos de distintas especialidades y remitidos a esta unidad al ser candidatos de evaluación para descartar enfermedades metabólicas óseas.
Se incluyeron todos aquellos sujetos atendidos durante este periodo de tiempo, siendo reclutados un total de 955 pacientes. Se establecieron dos grupos definidos por la presencia o no de una FF (grupo de casos y de controles, respectivamente).
Las variables recogidas fueron las siguientes:
- •
FR de OP. Edad, sexo, antecedente de fractura con más de 50 años, antecedente parental (materno o paterno) de fractura de cadera, menopausia, IMC (kg/m2), tabaquismo y número de cigarrillos por día, consumo de alcohol, diagnóstico de AR, tratamiento glucocorticoides (>5mg prednisona o equivalente durante>3meses).
- •
Variables clínicas. Diagnóstico previo de enfermedad inflamatoria intestinal, diabetes mellitus tipo 2, EPOC, tratamiento con inhibidores de la aromatasa y presencia de VIH.
- •
Datos de laboratorio relacionados con el metabolismo fosfocálcico: 25(OH)D, PTHi, calcio, fosfato, Ca2+, calciuria en 24h y los marcadores de remodelado, «C-terminal cross-linking telopeptide of type 1 collagen» (CTX) y «procollagen type 1 N-telopeptide» (P1NP). Para la recogida de los marcadores de remodelado se siguieron las recomendaciones de la National Bone Health Alliance16, realizando la extracción de sangre después del ayuno nocturno y en las primeras horas de la mañana. La determinación se realizó por electroluminiscencia (Cobas®8000: modules e602 and e801, Roche Diagnostics).
- •
Resultados de las DMO (T-score columna lumbar y cuello femoral). Para su evaluación se siguieron las recomendaciones de la International Society for Clinical Densitometry Position Development Conference, por las cuales las vértebras con densidad mayor a 1DE respecto a las adyacentes son excluidas del análisis, aceptándose en ese caso el valor obtenido de 2 vértebras contiguas17.
Se recogieron los siguientes grupos terapéuticos con los que estaban siendo tratados los participantes: suplementos de vitamina D, moduladores selectivos de los receptores estrogénicos, bifosfonatos orales e intravenosos, anticuerpos monoclonales y fármacos anabólicos.
Análisis estadísticoTodos los resultados de las variables de análisis se realizaron para el global de la muestra evaluable y en función de la presencia de fractura. Para todas las variables de análisis se presentaron los resultados descriptivos, incluyendo medidas de tendencia central y dispersión para las variables cuantitativas, y frecuencias absolutas y relativas para las variables cualitativas, con intervalo de confianza del 95% en ambos casos. En ningún caso los datos perdidos o valores «missing» se imputaron a partir de datos disponibles. La significación estadística de la comparación entre los 2 grupos (con fractura versus sin fractura) se realizó mediante la prueba U de Mann-Whitney de muestras independientes para las variables cuantitativas, puesto que no se pudo confirmar normalidad en la gran mayoría de variables mediante la prueba Shapiro-Wilk, la prueba exacta de Fisher para las variables binarias, y la prueba exacta de Mantel-Haenszel para las variables ordinales. Las pruebas estadísticas se realizaron con un nivel de significación del 5% y bilaterales en todos los casos. No se realizaron ajustes para controlar el error de tipo I a pesar de presentar multiplicidad.
Se aplicó un modelo de regresión logística multivariante de selección de variables explicativas por pasos («stepwise selection») para analizar los posibles factores pronósticos de la presencia de fractura (sí/no). Se incluyeron variables con significación estadística en el análisis univariante y variables indicadas como factores pronósticos en otros estudios publicados previamente.
Con el modelo final obtenido, se consideraron como factores pronósticos aquellas variables que en el modelo de regresión presentaban significación estadística (p<0,05). Se evaluó también la significación estadística de la interacción entre los factores detectados y la multicolinealidad de las variables explicativas encontradas mediante el estadístico VIF («variance inflation factor»).
Se utilizó el programa estadístico SAS versión 9.4 (TS1M5) para realizar los análisis estadísticos.
Aspectos éticosLos investigadores respetaron los principios fundamentales de la Declaración de Helsinki y el Convenio del Consejo de Europa relativo a los derechos humanos y biomedicina, así como toda la legislación vigente relacionada con el estudio. El estudio fue aprobado por el Comité de Investigación Clínica HM Hospitales con número de registro 20.01.1519-GHM.
ResultadosSe evaluaron un total de 955 individuos. La proporción de mujeres evaluadas fue significativamente más elevada que de hombres. Se establecieron dos grupos. El grupo de casos estaba formado por 321 individuos (33,6%) frente a 634 (66,4%) correspondiente al grupo control.
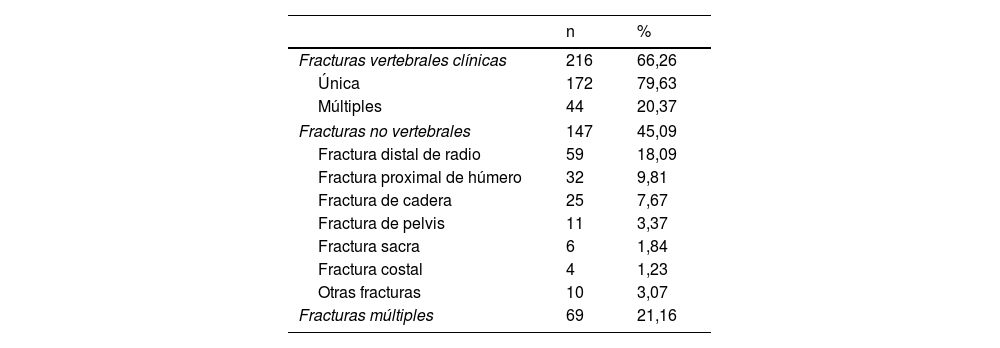
Fracturas por fragilidadSe recogieron los antecedentes de haber padecido una FF después de los 50 años. Las FF más frecuentemente registradas fueron las vertebrales clínicas, seguidas de las fracturas distales de radio, las proximales de húmero y de la cadera (tabla 1).
Localización de las FF. Un paciente puede tener más de una fractura
| n | % | |
|---|---|---|
| Fracturas vertebrales clínicas | 216 | 66,26 |
| Única | 172 | 79,63 |
| Múltiples | 44 | 20,37 |
| Fracturas no vertebrales | 147 | 45,09 |
| Fractura distal de radio | 59 | 18,09 |
| Fractura proximal de húmero | 32 | 9,81 |
| Fractura de cadera | 25 | 7,67 |
| Fractura de pelvis | 11 | 3,37 |
| Fractura sacra | 6 | 1,84 |
| Fractura costal | 4 | 1,23 |
| Otras fracturas | 10 | 3,07 |
| Fracturas múltiples | 69 | 21,16 |
En fracturas múltiples se incluyen fracturas vertebrales y no vertebrales.
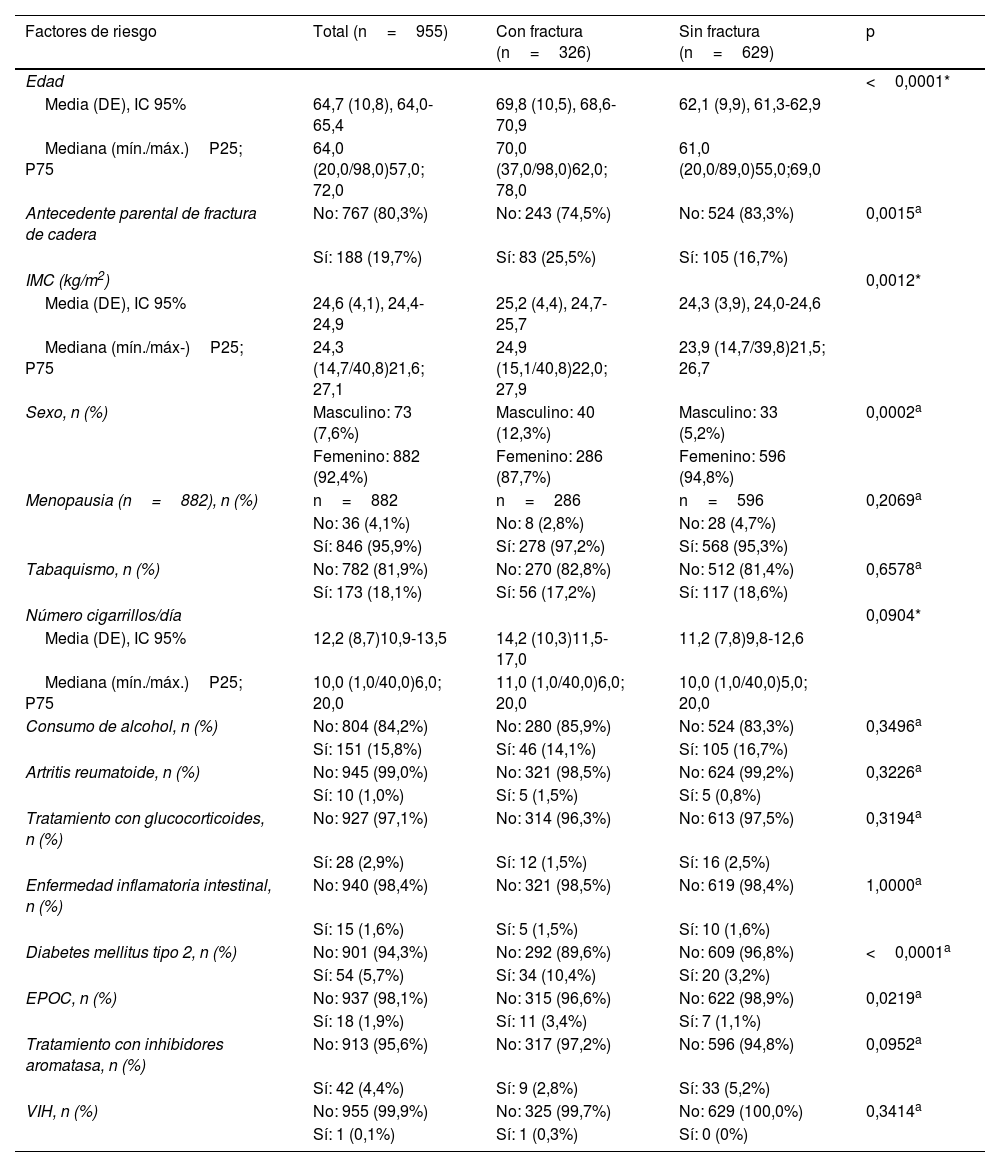
Los pacientes con FF tuvieron de manera significativa una mayor edad, mayor frecuencia de antecedente parental de fractura de cadera y un mayor IMC. De las mujeres de este grupo, las posmenopáusicas fueron más frecuentes y tuvieron un mayor tiempo desde la menopausia. También fue significativo en el grupo con FF, el diagnóstico previo de DM tipo 2 y de EPOC. La presencia de tabaquismo fue similar en ambos grupos, aunque la media del número de cigarrillos por día fue superior en el grupo con FF.
En la tabla 2 se describen los FR y variables clínicas de los participantes.
Características de los pacientes
| Factores de riesgo | Total (n=955) | Con fractura (n=326) | Sin fractura (n=629) | p |
|---|---|---|---|---|
| Edad | <0,0001* | |||
| Media (DE), IC 95% | 64,7 (10,8), 64,0-65,4 | 69,8 (10,5), 68,6-70,9 | 62,1 (9,9), 61,3-62,9 | |
| Mediana (mín./máx.)P25; P75 | 64,0 (20,0/98,0)57,0; 72,0 | 70,0 (37,0/98,0)62,0; 78,0 | 61,0 (20,0/89,0)55,0;69,0 | |
| Antecedente parental de fractura de cadera | No: 767 (80,3%) | No: 243 (74,5%) | No: 524 (83,3%) | 0,0015a |
| Sí: 188 (19,7%) | Sí: 83 (25,5%) | Sí: 105 (16,7%) | ||
| IMC (kg/m2) | 0,0012* | |||
| Media (DE), IC 95% | 24,6 (4,1), 24,4-24,9 | 25,2 (4,4), 24,7-25,7 | 24,3 (3,9), 24,0-24,6 | |
| Mediana (mín./máx-)P25; P75 | 24,3 (14,7/40,8)21,6; 27,1 | 24,9 (15,1/40,8)22,0; 27,9 | 23,9 (14,7/39,8)21,5; 26,7 | |
| Sexo, n (%) | Masculino: 73 (7,6%) | Masculino: 40 (12,3%) | Masculino: 33 (5,2%) | 0,0002a |
| Femenino: 882 (92,4%) | Femenino: 286 (87,7%) | Femenino: 596 (94,8%) | ||
| Menopausia (n=882), n (%) | n=882 | n=286 | n=596 | 0,2069a |
| No: 36 (4,1%) | No: 8 (2,8%) | No: 28 (4,7%) | ||
| Sí: 846 (95,9%) | Sí: 278 (97,2%) | Sí: 568 (95,3%) | ||
| Tabaquismo, n (%) | No: 782 (81,9%) | No: 270 (82,8%) | No: 512 (81,4%) | 0,6578a |
| Sí: 173 (18,1%) | Sí: 56 (17,2%) | Sí: 117 (18,6%) | ||
| Número cigarrillos/día | 0,0904* | |||
| Media (DE), IC 95% | 12,2 (8,7)10,9-13,5 | 14,2 (10,3)11,5-17,0 | 11,2 (7,8)9,8-12,6 | |
| Mediana (mín./máx.)P25; P75 | 10,0 (1,0/40,0)6,0; 20,0 | 11,0 (1,0/40,0)6,0; 20,0 | 10,0 (1,0/40,0)5,0; 20,0 | |
| Consumo de alcohol, n (%) | No: 804 (84,2%) | No: 280 (85,9%) | No: 524 (83,3%) | 0,3496a |
| Sí: 151 (15,8%) | Sí: 46 (14,1%) | Sí: 105 (16,7%) | ||
| Artritis reumatoide, n (%) | No: 945 (99,0%) | No: 321 (98,5%) | No: 624 (99,2%) | 0,3226a |
| Sí: 10 (1,0%) | Sí: 5 (1,5%) | Sí: 5 (0,8%) | ||
| Tratamiento con glucocorticoides, n (%) | No: 927 (97,1%) | No: 314 (96,3%) | No: 613 (97,5%) | 0,3194a |
| Sí: 28 (2,9%) | Sí: 12 (1,5%) | Sí: 16 (2,5%) | ||
| Enfermedad inflamatoria intestinal, n (%) | No: 940 (98,4%) | No: 321 (98,5%) | No: 619 (98,4%) | 1,0000a |
| Sí: 15 (1,6%) | Sí: 5 (1,5%) | Sí: 10 (1,6%) | ||
| Diabetes mellitus tipo 2, n (%) | No: 901 (94,3%) | No: 292 (89,6%) | No: 609 (96,8%) | <0,0001a |
| Sí: 54 (5,7%) | Sí: 34 (10,4%) | Sí: 20 (3,2%) | ||
| EPOC, n (%) | No: 937 (98,1%) | No: 315 (96,6%) | No: 622 (98,9%) | 0,0219a |
| Sí: 18 (1,9%) | Sí: 11 (3,4%) | Sí: 7 (1,1%) | ||
| Tratamiento con inhibidores aromatasa, n (%) | No: 913 (95,6%) | No: 317 (97,2%) | No: 596 (94,8%) | 0,0952a |
| Sí: 42 (4,4%) | Sí: 9 (2,8%) | Sí: 33 (5,2%) | ||
| VIH, n (%) | No: 955 (99,9%) | No: 325 (99,7%) | No: 629 (100,0%) | 0,3414a |
| Sí: 1 (0,1%) | Sí: 1 (0,3%) | Sí: 0 (0%) |
FR y variables clínicas del total de pacientes, grupo con FF y sin FF.
DE: desviaciones estándar; IC: intervalo de confianza.
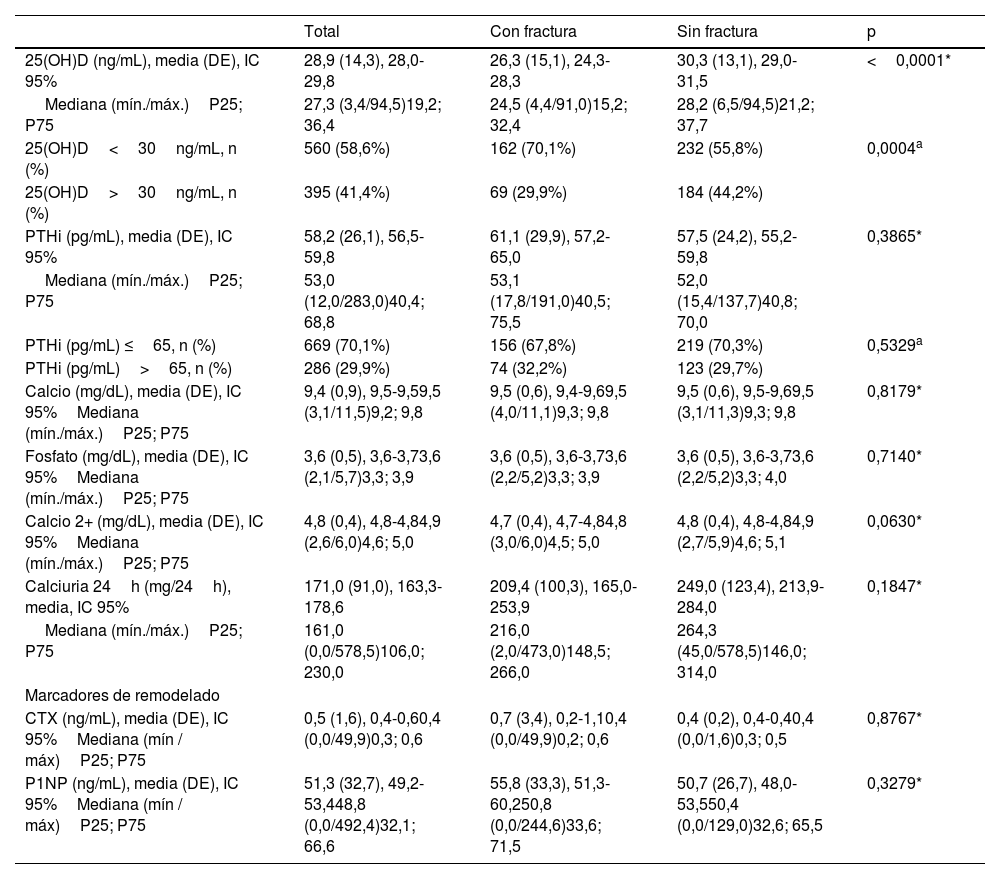
Una significativa proporción de pacientes tuvieron unos niveles medios de 25(OH)D inferiores a 30ng/mL. Los participantes del grupo con FF tuvieron valores significativamente inferiores al grupo sin FF. De los marcadores de remodelado óseo, el marcador de resorción CTX obtuvo un valor medio superior en pacientes con FF (tabla 3).
Datos de laboratorio relacionados con el metabolismo fosfocálcico
| Total | Con fractura | Sin fractura | p | |
|---|---|---|---|---|
| 25(OH)D (ng/mL), media (DE), IC 95% | 28,9 (14,3), 28,0-29,8 | 26,3 (15,1), 24,3-28,3 | 30,3 (13,1), 29,0-31,5 | <0,0001* |
| Mediana (mín./máx.)P25; P75 | 27,3 (3,4/94,5)19,2; 36,4 | 24,5 (4,4/91,0)15,2; 32,4 | 28,2 (6,5/94,5)21,2; 37,7 | |
| 25(OH)D<30ng/mL, n (%) | 560 (58,6%) | 162 (70,1%) | 232 (55,8%) | 0,0004a |
| 25(OH)D>30ng/mL, n (%) | 395 (41,4%) | 69 (29,9%) | 184 (44,2%) | |
| PTHi (pg/mL), media (DE), IC 95% | 58,2 (26,1), 56,5-59,8 | 61,1 (29,9), 57,2-65,0 | 57,5 (24,2), 55,2-59,8 | 0,3865* |
| Mediana (mín./máx.)P25; P75 | 53,0 (12,0/283,0)40,4; 68,8 | 53,1 (17,8/191,0)40,5; 75,5 | 52,0 (15,4/137,7)40,8; 70,0 | |
| PTHi (pg/mL) ≤65, n (%) | 669 (70,1%) | 156 (67,8%) | 219 (70,3%) | 0,5329a |
| PTHi (pg/mL)>65, n (%) | 286 (29,9%) | 74 (32,2%) | 123 (29,7%) | |
| Calcio (mg/dL), media (DE), IC 95%Mediana (mín./máx.)P25; P75 | 9,4 (0,9), 9,5-9,59,5 (3,1/11,5)9,2; 9,8 | 9,5 (0,6), 9,4-9,69,5 (4,0/11,1)9,3; 9,8 | 9,5 (0,6), 9,5-9,69,5 (3,1/11,3)9,3; 9,8 | 0,8179* |
| Fosfato (mg/dL), media (DE), IC 95%Mediana (mín./máx.)P25; P75 | 3,6 (0,5), 3,6-3,73,6 (2,1/5,7)3,3; 3,9 | 3,6 (0,5), 3,6-3,73,6 (2,2/5,2)3,3; 3,9 | 3,6 (0,5), 3,6-3,73,6 (2,2/5,2)3,3; 4,0 | 0,7140* |
| Calcio 2+ (mg/dL), media (DE), IC 95%Mediana (mín./máx.)P25; P75 | 4,8 (0,4), 4,8-4,84,9 (2,6/6,0)4,6; 5,0 | 4,7 (0,4), 4,7-4,84,8 (3,0/6,0)4,5; 5,0 | 4,8 (0,4), 4,8-4,84,9 (2,7/5,9)4,6; 5,1 | 0,0630* |
| Calciuria 24h (mg/24h), media, IC 95% | 171,0 (91,0), 163,3-178,6 | 209,4 (100,3), 165,0-253,9 | 249,0 (123,4), 213,9-284,0 | 0,1847* |
| Mediana (mín./máx.)P25; P75 | 161,0 (0,0/578,5)106,0; 230,0 | 216,0 (2,0/473,0)148,5; 266,0 | 264,3 (45,0/578,5)146,0; 314,0 | |
| Marcadores de remodelado | ||||
| CTX (ng/mL), media (DE), IC 95%Mediana (mín / máx)P25; P75 | 0,5 (1,6), 0,4-0,60,4 (0,0/49,9)0,3; 0,6 | 0,7 (3,4), 0,2-1,10,4 (0,0/49,9)0,2; 0,6 | 0,4 (0,2), 0,4-0,40,4 (0,0/1,6)0,3; 0,5 | 0,8767* |
| P1NP (ng/mL), media (DE), IC 95%Mediana (mín / máx)P25; P75 | 51,3 (32,7), 49,2-53,448,8 (0,0/492,4)32,1; 66,6 | 55,8 (33,3), 51,3-60,250,8 (0,0/244,6)33,6; 71,5 | 50,7 (26,7), 48,0-53,550,4 (0,0/129,0)32,6; 65,5 | 0,3279* |
Datos de laboratorio del total de participantes, grupo sin FF y con FF.
DE, desviaciones estándar. IC, intervalo de confianza.
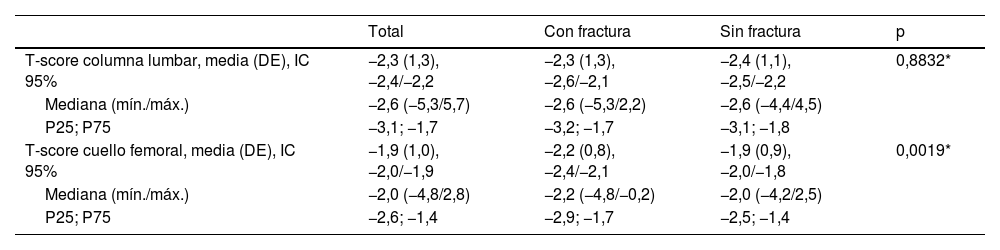
El valor medio de la T-score en la columna lumbar en el grupo con FF fue similar al del grupo sin FF, sin embargo, el valor medio de la T-score en cuello femoral del grupo con FF fue significativamente inferior al del grupo sin FF (tabla 4).
Valores densitométricos
| Total | Con fractura | Sin fractura | p | |
|---|---|---|---|---|
| T-score columna lumbar, media (DE), IC 95% | −2,3 (1,3), −2,4/−2,2 | −2,3 (1,3), −2,6/−2,1 | −2,4 (1,1), −2,5/−2,2 | 0,8832* |
| Mediana (mín./máx.) | −2,6 (−5,3/5,7) | −2,6 (−5,3/2,2) | −2,6 (−4,4/4,5) | |
| P25; P75 | −3,1; −1,7 | −3,2; −1,7 | −3,1; −1,8 | |
| T-score cuello femoral, media (DE), IC 95% | −1,9 (1,0), −2,0/−1,9 | −2,2 (0,8), −2,4/−2,1 | −1,9 (0,9), −2,0/−1,8 | 0,0019* |
| Mediana (mín./máx.) | −2,0 (−4,8/2,8) | −2,2 (−4,8/−0,2) | −2,0 (−4,2/2,5) | |
| P25; P75 | −2,6; −1,4 | −2,9; −1,7 | −2,5; −1,4 |
Resultados de la densitometría ósea del total de participantes, grupo sin FF y con FF.
DE: desviaciones estándar; IC: intervalo de confianza.
Del total de la muestra, se recogieron los siguientes grupos terapéuticos que tomaban los participantes: suplemento de vitamina D (47,5%), moduladores de los receptores estrogénicos (2,1%), bifosfonatos orales (10,5%), bifosfonatos intravenosos (0,9%), anticuerpos monoclonales (8,4%) y fármacos anabólicos (2,7%). Del total de pacientes evaluados, recibieron algún tratamiento para la OP, 652 sujetos (68,2%). De ellos, 232 pertenecieron al grupo con fractura (35,58%) y 420 al grupo sin fractura (64,4%). A pesar de que un 47,5% estaban en tratamiento con suplementos de vitamina D, en un 35,2% los valores de 25(OH)D se mantuvieron por debajo de 30ng/mL.
Factores predictores de la presencia de fracturas por fragilidadSe analizaron 952 participantes del total por falta de datos necesarios en 3 participantes. El diagnóstico previo de DM tipo 2, elevaciones de 1ng/mL del CTX, la presencia de antecedentes parentales de fractura de cadera, aumentos de 5 años de la edad y un aumento de 1kg/m2 del IMC suponen un incremento del riesgo de FF, mientras que mantener valores de 25(OH)D≥30ng/mL y una puntuación de la T-score en el cuello femoral≥−2,5 reducen el riesgo de FF (tabla 5). En la figura 2 se muestran las odds ratio (OR) de prevalencias obtenidas del modelo de regresión logística hacia atrás, para las variables independientes.
Asociación de factores de riesgo, datos de laboratorio, resultados densitométricos y FF. Odds ratio de prevalencia crudas estimadas mediante análisis de regresión logística
| Odds ratio | IC 95% | Coeficiente de regresión | p | VIF | |
|---|---|---|---|---|---|
| Diabetes mellitus tipo 2 | 2,001 | 1,098-3,681 | 0,67 | 0,031 | 1,028 |
| CTX (ng/mL) | 1,88 | 1,102-3,208 | 0,554 | 0,044 | 1,036 |
| Antecedente materno/paterno de fractura de cadera | 1,667 | 1,169-2,378 | 0,497 | 0,006 | 1,008 |
| Edad (años) [unidad=5] | 1,39 | 1,289-1,500 | 0,306 | <0,001 | 1,067 |
| IMC (kg/m2) | 1,041 | 1,003-1,079 | 0,054 | 0,005 | 1,122 |
| 25(OH)D≥30ng/mL | 0,686 | 0,507-0,929 | −0,395 | 0,011 | 1,02 |
| T-score cuello femoral≥−2,5 | 0,642 | 0,458-0,900 | −0,395 | 0,011 | 1,133 |
IC: intervalo de confianza; VIF: variation inflaction factor.
Se ha encontrado una relación significativa entre el diagnóstico previo de DM tipo 2, aumento del CTX, los antecedentes parentales de fractura de cadera, el aumento de la edad y del IMC con la presencia de FF. Por el contrario, se ha observado un efecto protector frente a las FF, si se mantienen unos niveles de 25(OH)D≥30 ng/mL y un valor de la T-score en el cuello femoral≥−2,5.
La proporción entre mujeres y hombres (92,4% y 7,6%, respectivamente) de este estudio es habitual en unidades de metabolismo óseo donde la OP es uno de los principales motivos de consulta.
En nuestra serie un 33,6% de participantes tuvieron antecedentes de una FF después de los 50 años, datos superiores a otros estudios1,8,18,19 probablemente debido a las características poblacionales de nuestros participantes.
Existe controversia sobre el papel que la DM tipo 2 ejerce sobre la salud ósea. Para algunos autores, un diagnóstico previo de DM tipo 2 se considera un FR independiente de la DMO para la aparición de todo tipo de FF9,10,20–22. Nosotros encontramos una proporción significativamente elevada de participantes con diagnóstico previo de DM tipo 2 en aquellos pacientes del grupo con FF frente al grupo sin FF (10,4% vs. 3,2% respectivamente), siendo responsable de un aumento del riesgo de FF. Al tratarse de un FR, desconocemos otros datos clínicos de la enfermedad que pudieran influir en su efecto, por lo que estos resultados tienen un valor limitado.
Niveles elevados del CTX, teniendo en cuenta su amplia variabilidad, se asocian a un mayor riesgo de fractura en las mujeres de edad avanzada3,23,24. En nuestro estudio, se observaron valores mayores del CTX en el grupo con FF, siendo significativo en el modelo multivariante. La presencia de una fractura aguda provoca una elevación transitoria de los marcadores de remodelado óseo25, aunque debido a que en nuestro estudio se recogieron los antecedentes de haber padecido una fractura después de los 50 años y no una fractura aguda consideramos que su influencia, de existir, sería mínima.
Algunos estudios ponen de manifiesto la relación existente entre los antecedentes parentales de fractura de cadera26–28 y la edad5 como FR independiente de la DMO que favorece la aparición de nuevas FF. Nuestros datos son coincidentes al encontrar una asociación significativa entre los antecedentes parentales de fractura de cadera (25,5% frente al 16,7%) y una mayor edad (70 años frente a 62 años) en el grupo con FF.
A pesar de que es conocida la relación entre OP y un bajo IMC29, hemos encontrado una relación significativa entre el incremento del IMC y las FF. Otros recientes estudios también apuntan en esta dirección30,31, si bien podría estar influida por la asociación existente entre obesidad, el ejercicio físico y la DM31, necesitándose estudios específicos en este subgrupo poblacional.
Valores de 25(OH)D superiores a 30ng/mL se asocian significativamente a una reducción del riesgo de sufrir una FF32,33. Nosotros encontramos niveles medios de 25(OH)D de 26,3ng/mL en los pacientes con FF. Es interesante destacar que un 47,5% estaban recibiendo suplementos de vitamina D, a pesar de lo cual en un 35,2% sus niveles de vitamina D fueron <30ng/mL. Estos datos indican la necesidad de evaluar periódicamente los niveles de 25(OH)D para mantenerlos en las recomendaciones actuales de las guías clínicas internacionales34.
Por cada DE que disminuye la DMO en relación con el valor medio de referencia el riesgo relativo para una fractura se duplica comparándolo con un individuo con DMO normal35, aunque debemos tener en cuenta que los resultados de la T-score en la columna lumbar pueden no ser representativos del estado real de la DMO del paciente en ciertas situaciones, tales como las alteraciones del eje (escoliosis), procesos degenerativos (artrosis), elementos quirúrgicos (osteosíntesis), entre otros17. En nuestra serie, solo el valor de la T-score en el cuello femoral≥−2,5 se asoció a una reducción del riesgo de fractura.
La principal limitación de nuestro estudio está en relación con su propio diseño al tratarse de un estudio observacional retrospectivo de casos y controles. Eso hace que tenga una menor validez interna que un ensayo clínico tradicional, sin poder evitar un posible sesgo de reclutamiento, pero debido al número de participantes y a la inclusión de todos y cada uno de los pacientes atendidos durante el periodo de tiempo establecido, consideramos que este posible sesgo queda minimizado. Además, los datos de nuestro estudio en práctica clínica real serán útiles para tomar decisiones y respaldar los datos obtenidos en los ensayos clínicos tradicionales.
ConclusionesEn pacientes con FF la determinación de los FR y de ciertas variables clínicas, analíticas y densitométricas es una necesidad para prevenir la aparición de la segunda fractura. Mantener un nivel de 25(OH)D≥30ng/mL y un valor de la T-score en el cuello femoral≥–2,5 actuarían como factores protectores, mientras que el diagnóstico previo de DM tipo 2, un CTX elevado, el antecedente parental de fractura de cadera, un incremento de 1kg/m2 del IMC y el aumento de la edad en 5 años serían predisponentes a padecer FF.
Nivel de evidenciaNivel de evidencia II.
FinanciaciónEsta investigación ha sido financiada por Laboratorios Gebro Pharma S.A. Laboratorios Gebro Pharma S.A. no ha tenido ningún papel corporativo en el diseño, análisis e interpretación de los resultados y la preparación del manuscrito.
AutoríaAOA participó en la concepción y el diseño del estudio, en la recopilación e interpretación de los datos y en la redacción del manuscrito. MTMB, TFF y GAB participaron en la recopilación y en la interpretación de los datos y revisión crítica del contenido intelectual.
Conflicto de interesesAOA, MTMB, TFF y GAB declaran no tener conflicto de intereses respecto a este manuscrito. AOA ha recibido honorarios como ponente de Theramex, Grunenthal Pharma y Pfizer. MTMB ha recibido honorarios como ponente de Lilly, GSK, Boehringer Ingelheim, Sanofi y AstraZeneca. TFF y GAB declaran no tener conflicto de intereses.
Los autores agradecen a la Fundación para la Investigación HM Hospitales y especialmente a Dra. Nerea Ruiz del Árbol Lasagabaster su ayuda en la obtención de los datos. Agradecemos a los pacientes que contribuyeron voluntariamente con sus datos para esta investigación.