Para la reconstrucción exitosa del ligamento cruzado anterior (LCA) son necesarias la revascularización y la maduración histológica del injerto. Fallos en este proceso pueden causar la rotura del neoligamento.
ObjetivoDescribir las diferencias en la maduración histológica de plastias fallidas precoces (menos de 12 meses poscirugía) y tardías (más de 12 meses poscirugía) en pacientes con rerrotura de reconstrucción de LCA con tendones flexores.
Materiales y métodosEstudio observacional descriptivo. Serie consecutiva de 20 pacientes con fallo en la reconstrucción de LCA con tendones flexores. Muestras obtenidas mediante biopsia de los remanentes del injerto (porción proximal, corporal y distal) durante la cirugía de revisión. Las muestras fueron evaluadas por microscopia de luz y la vascularización y la maduración fueron establecidas mediante un puntaje histológico descrito en la literatura.
ResultadosLa causa más común de fallo de reconstrucción (86,6%) fue un evento identificable sin mediar traumatismo directo. Los pacientes con rotura precoz de la plastia del LCA presentaron vasos sanguíneos más superficiales en comparación con los con rotura tardía. El segmento distal del injerto en los pacientes con roturas precoces mostró una menor maduración histológica con menor número de fibras de colágeno.
ConclusiónEn los pacientes que presentaron fallos en las reconstrucciones de LCA precoces (dentro de los 12 meses poscirugía) encontramos una distribución menor de vasos sanguíneos y fibras de colágeno en la región distal del injerto. Estos resultados indican un retraso en la maduración, pudiendo generar mayor riesgo de fallo del injerto.
For successful anterior cruciate ligament (ACL) reconstruction, revascularisation and histological maturation are necessary, as their failure can cause graft rupture.
PurposeThe purpose of this study was to describe differences in the histological maturation of early failed plasty (less than 12 months after surgery) and late failed plasty (more than 12 months after surgery) in patients with re-rupture after ACL reconstruction with hamstring tendons.
Material and methodsA descriptive observational study was conducted on a consecutive series of 20 patients whose ACL reconstruction had failed. Graft biopsy samples were obtained during the revision surgery from the proximal, medial, and distal graft remnants. The samples were evaluated by light microscopy, and the vascularity and maturation of the samples were established by histological scoring.
ResultsThe most common aetiology of reconstruction failure (86.6%) was a specific event with non-contact mechanism. The patients with re-rupture of their ACL plasty less than 12 months after surgery had substance vessels that were less deep. The distal segment of the graft in those patients showed a delay in histological maturation with fewer collagen fibres.
ConclusionIn patients whose ACL grafts failed less than 12 months after surgery, a lower distribution of blood vessels and collagen fibres was found that were less ordered in the distal graft. These results indicate a delay in maturation, which leads to a higher risk of graft failure.
La reconstrucción del ligamento cruzado anterior (LCA) puede ser realizada con distintos tipos de injerto, siendo 2 los principalmente utilizados: los de tendones flexores (isquiotibiales) o injerto de hueso-tendón patelar-hueso (HTH)1. Si bien los resultados obtenidos con estas técnicas alcanzan altas tasas de éxito, siguen existiendo interrogantes en relación con el tiempo requerido para la maduración del injerto, lo cual es fundamental para el retorno a las actividades habituales de los pacientes, y con qué retardos en este proceso podrían generar altos riesgos de fallo de la cirugía y rerrotura del LCA2.
Independientemente del tipo de injerto utilizado, estos deben adquirir en el transcurso del tiempo las características similares a las del LCA nativo, proceso denominado ligamentización3. Las descripciones originales de este proceso se realizaron en modelos animales de reconstrucción con HTH3, no estando del todo caracterizadas las etapas para los otros tipos de injertos, describiéndose resultados disímiles con tiempos de maduración variables entre 6 a 18 meses poscirugía. Dentro de las etapas que se han descrito en el proceso de ligamentización destacan la necrosis isquémica, la revascularización, la remodelación y la maduración, culminando de esta forma con un injerto histológicamente similar al LCA4,5. Probablemente es la revascularización del injerto la fase más crítica, ya que de esta depende la maduración histológica y biomecánica; los estudios originales describieron en modelos caninos que la vascularidad del injerto provenía desde la grasa infrapatelar y desde las estructuras posteriores articulares, mientras que estudios actuales con técnica de resonancia magnética (RM) en pacientes reconstruidos demuestran que la vascularidad del injerto de flexores proviene de ramas de las arterias geniculadas medias e inferiores siendo la primera porción del injerto en revascularizarse la porción intraarticular y las porciones intraóseas lo hacen de manera más tardía6-8; esto es concordante con los estudios histológicos en que se han evaluado plastias de LCA, determinándose que a nivel intraarticular la revascularización se produce desde la semana 249. Hasta el conocimiento de los autores, no existen estudios que hayan evaluado la vascularidad presente en el injerto de las plastias fallidas de LCA, cuestión que nos parece fundamental para poder determinar la causa de la rerrotura, que hasta el momento no está clara, postulándose que puede deberse a combinaciones de factores biológicos, técnicos y traumáticos.
El objetivo del presente estudio fue determinar el patrón histológico de maduración y revascularización del injerto en 3 diferentes segmentos de la plastia rota (proximal, medio y distal) en pacientes con fallos de reconstrucción primaria del LCA precoces (durante los 12 primeros meses poscirugía) y tardías (posterior a los 12 primeros meses poscirugía), hipotetizando que en los pacientes con roturas precoces existe un retardo en el proceso de ligamentización.
Materiales y métodosEstudio prospectivo, observacional, comparativo, ciego (en relación con evaluación histológica) en una serie consecutiva de 20 pacientes con rotura de la plastia de LCA. Previa aprobación del Comité de Bioética de nuestra institución, identificamos a los pacientes con rotura de la plastia del LCA con mínimo de 6 meses desde la cirugía primaria realizada en un único centro por el mismo equipo quirúrgico con autoinjerto de tendones flexores con técnica transtibial y fijación femoral con Transfix (Transfix, Arthrex®, Naples, FL) y tibial con tornillo interferencial bioabsorbible (Tornillo Biodelta, Arthrex®, Naples, FL). Todos los pacientes fueron evaluados con una RM a los 6 meses postoperados, en la que se comprobó la adecuada incorporación ósea del injerto y la posición de los túneles. En el momento de producirse la rotura de la plastia, los pacientes fueron separados en 2 grupos: roturas precoces (durante los primeros 12 meses desde la cirugía) y tardías (posterior a los 12 meses desde la cirugía) y se registraron la edad, el sexo, el mecanismo de la lesión y el tiempo exacto entre la cirugía y la rotura de la plastia.
Toma de muestras y evaluación histológicaPrevio consentimiento informado, durante la cirugía de revisión, una vez comprobada la rotura de la plastia del LCA, se obtuvieron muestras para biopsia desde la porción proximal (cercana al túnel femoral), corporal o media (en el remanente de la plastia) y distal (cercana al túnel tibial) del remanente del injerto mediante una pinza básquet. Las muestras obtenidas fueron fijadas en formalina al 10% y posteriormente analizadas por un patólogo ciego al tiempo entre la cirugía primaria y la rotura, y al segmento del cual procedía la muestra. Mediante microscopia de luz se clasificaron una serie de variables relacionadas con la maduración de la plastia. Se cuantificaron la vascularidad (cantidad de vasos sanguíneos presentes y a la distribución de estos en relación con la profundidad en el injerto), la celularidad (cantidad de células tipo fibroblastos) y la orientación de las fibras de colágeno. Cada uno de estos parámetros se clasificó en una escala de 0 a 4, siendo 4 el puntaje de un tejido de características similares al LCA según lo descrito en la literatura (tabla 1)9,10.
Escalas de puntajes asignadas para cada variable histológica
| Hipercelularidad estromal | Infiltrado inflamatorio | Vascularización | Localización | |
|---|---|---|---|---|
| 0 | No | No | No | No |
| 1 | Discreta o leve | Discreto | Escasos | Periféricos |
| 2 | Leve a moderada | Leve | Algunos | Centrales |
| 3 | Moderada | Moderado | Moderada cantidad | Centrales y periféricos |
| 4 | Moderada a acentuada | Acentuado | Numerosos | |
| 5 | Acentuada |
Se calcularon los promedios con sus desviaciones estándar. Posteriormente, los resultados fueron analizados mediante prueba U de Mann-Whitney para muestras continuas. Las diferencias con un valor p<0,05 fueron consideradas estadísticamente significativas. Para determinar correlaciones entre las variables estudiadas utilizamos la correlación lineal de Pearson considerando un valor r>0,80 como positivo para relaciones.
ResultadosDescripción de los pacientesDe los 20 pacientes, el 80% (16 pacientes) fueron hombres, con un promedio de edad de 30,3 años (19-44 años). La rotura de la plastia fue secundaria a un mecanismo identificable sin mediar traumatismo directo en el 86,6% y el tiempo promedio transcurrido entre la cirugía de reconstrucción y la de revisión del LCA fue de 39,3 meses (7-96 meses). En los pacientes que lograron reconocer un evento que pudiera corresponder al momento de la rotura de la plastia, el tiempo promedio entre este evento y la cirugía de revisión fue de 3,5 semanas (2-6 semanas).
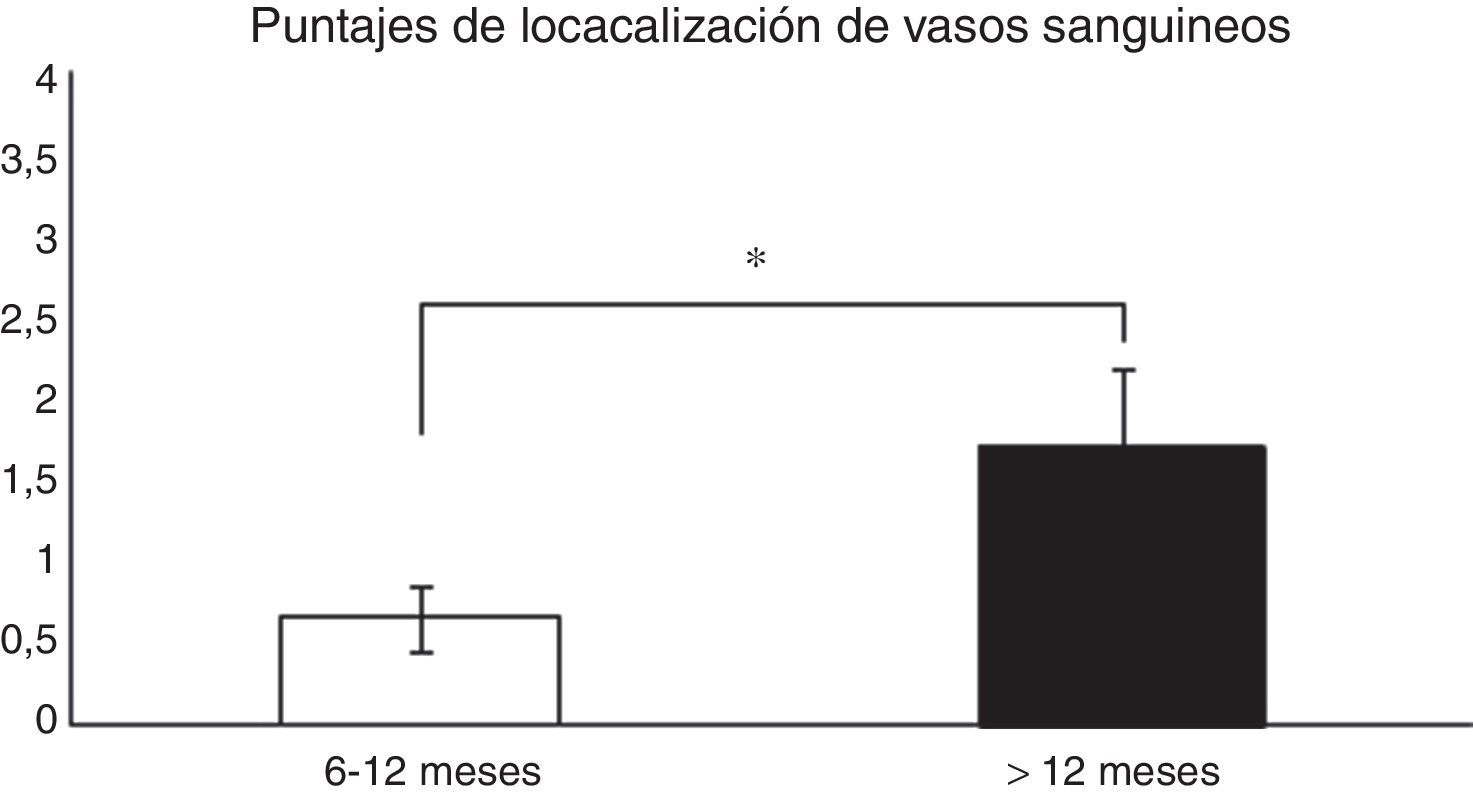
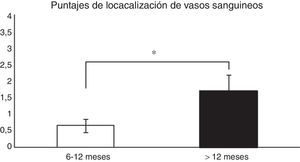
Análisis histológico y relaciones entre las variables analizadasPara analizar si hubo relaciones entre el tiempo desde la cirugía de reconstrucción del LCA y la madurez del injerto, las muestras fueron evaluadas de forma general (promedio de los 3 segmentos) y según el segmento (proximal, medio o distal) del cual fueron obtenidas, para posteriormente correlacionar los resultados con las variables descritas en la tabla 1. Al relacionar el tiempo desde la cirugía con las variables de madurez evaluadas en el promedio de los 3 segmentos, encontramos que existen diferencias significativas (p=0,038) entre los pacientes en quienes el fallo de la reconstrucción se produce antes de los 12 meses y entre los que se produce posterior a este tiempo en relación con la localización de los vasos sanguíneos (fig. 1). Al evaluar por separado cada uno de los segmentos no encontramos diferencias significativas (p=0,071) entre ellos en relación con el tiempo de producido el fallo.
Comparación en la maduración del LCA evaluada por la localización de los vasos sanguíneos (véase score en la tabla 1). En los pacientes en que el fallo del injerto se produjo antes de los 12 meses encontramos un promedio significativamente menor en este puntaje que en los que la rotura se produjo posterior a los 12 meses (0,66±0,2 vs. 1,7±0,4).
*p=0,038.
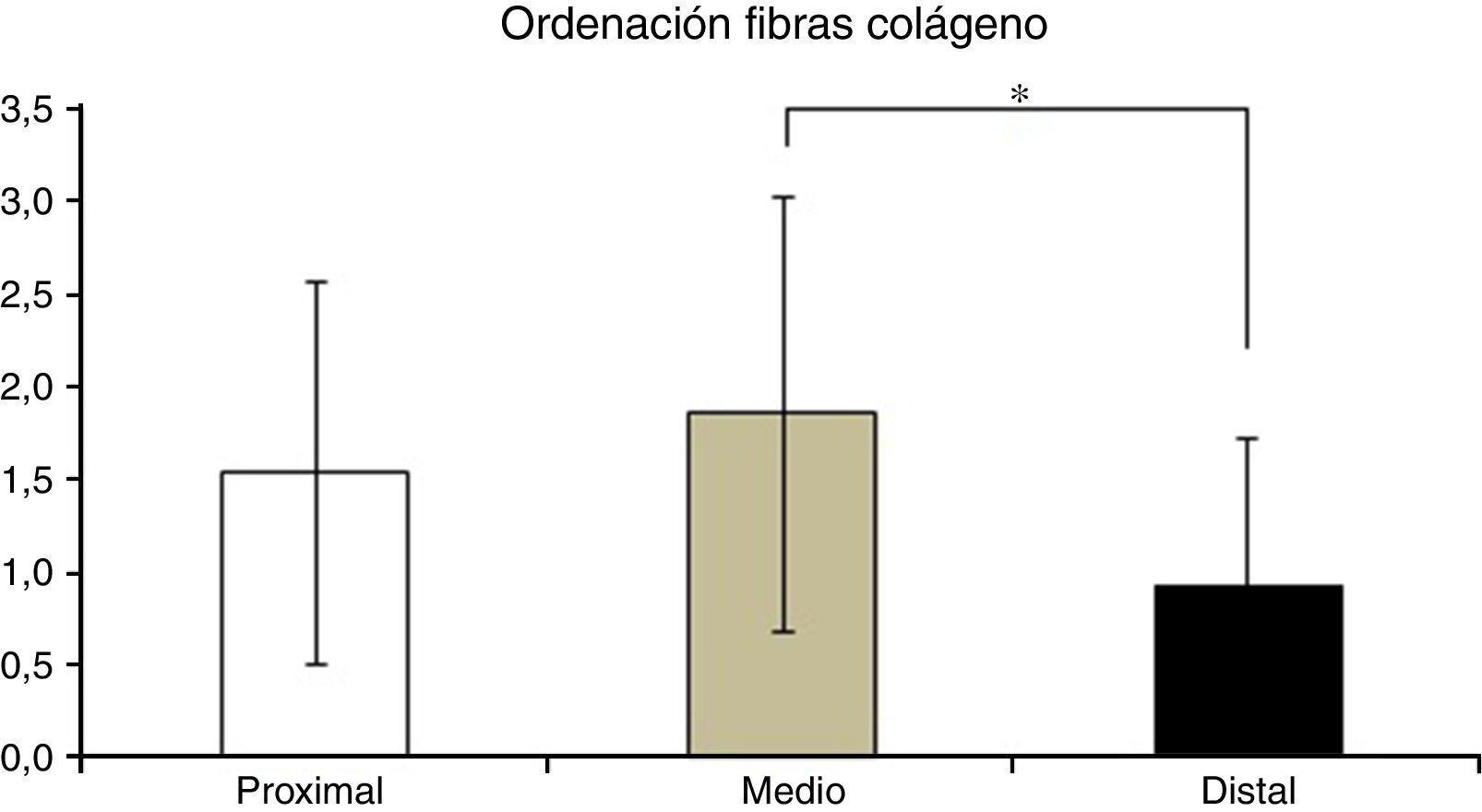
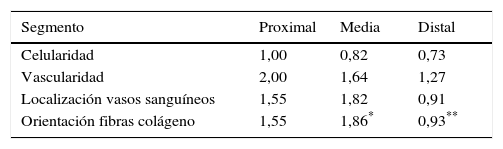
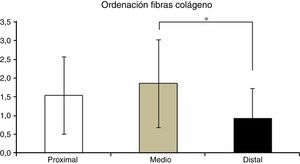
En la tabla 2 se muestran los promedios obtenidos de vascularidad, celularidad y orientación de las fibras de colágeno en cada uno de los 3 segmentos del LCA del cual se obtuvieron las muestras. Al relacionar los resultados histológicos de cada uno de los segmentos con el tiempo desde la cirugía no encontramos diferencias significativas. Al evaluar la relación entre las variables descritas en la tabla 1 y el segmento del cual fueron obtenidas las muestras encontramos que en la orientación de las fibras de colágeno existen diferencias significativas (p=0,042), presentándose una maduración menor en el segmento distal en comparación al segmento medio (fig. 2), sin existir diferencias entre el segmento distal y el proximal o el medio y el distal. No encontramos diferencias en el resto de las variables analizadas.
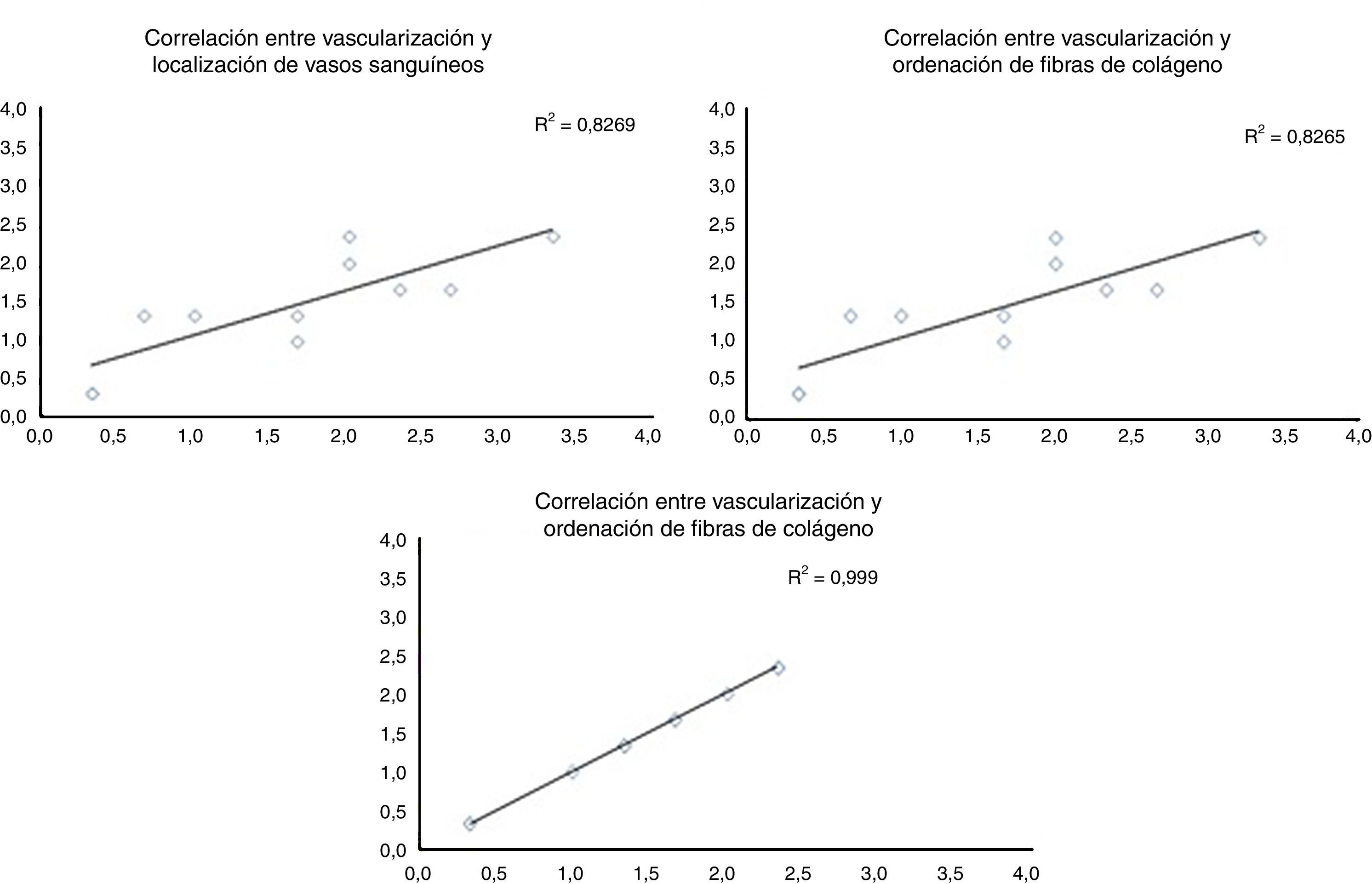
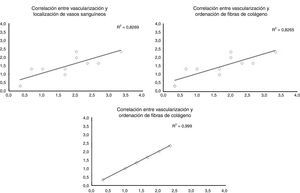
Al evaluar cómo se correlacionan las diferentes variables histológicas entre ellas, encontramos una excelente correlación entre la localización de los vasos sanguíneos y la orientación de las fibras de colágeno (r=0,99), entre la cantidad de vasos sanguíneos y la distribución de fibras colágeno (r=0,82) y entre la cantidad de vasos sanguíneos y la profundidad de estos en el injerto (r=0,82) (fig. 3).
Correlación entre las diferentes variables histológicas analizadas. Al evaluar las diferentes variables histológicas entre ellas, encontramos una excelente correlación entre la localización de los vasos sanguíneos y la orientación de las fibras de colágeno, cantidad de vasos sanguíneos y la distribución de fibras colágeno y la cantidad de vasos sanguíneos y la profundidad de estos en el injerto.
El conocer el tiempo en el cual el injerto utilizado para reconstruir el LCA se encuentra maduro parece ser fundamental para disminuir el riesgo de rotura de la plastia y poder autorizar el retorno a las actividades habituales de forma más segura. Los estudios clásicos realizados en modelos animales han descrito que el injerto hasta el primer mes sufre un proceso de necrosis, manteniéndose la matriz extracelular del tejido, en especial la conformación de las fibras de colágeno. Durante los 2 meses siguientes el injerto es repoblado por una gran cantidad de células, tanto de características inflamatorias como de características fibroblásticas y se inicia el proceso de revascularización. Al sexto mes la cantidad de células encontradas ya es similar a la de un ligamento cruzado nativo pese a que la estructura aún no es similar, proceso que se completa entre los 9 y los 12 meses, siendo el tendón nativo repoblado por células sinoviales11. Sin embargo, hasta el momento no existe suficiente evidencia de cómo se reproduce esta ligamentización en la práctica clínica ni cómo eventuales modificaciones de este proceso pudieran generar fallos en la cirugía de reconstrucción del LCA. Nuestro objetivo con este trabajo fue evaluar las relaciones entre el tiempo desde la cirugía de reconstrucción del LCA y el patrón histológico de maduración del injerto en 3 diferentes segmentos de la plastia (proximal, medio y distal) en pacientes con fallos de la cirugía primaria.
En nuestra muestra de 20 pacientes encontramos que el principal mecanismo involucrado en el fallo fueron aquellos traumáticos sin contacto directo, lo cual está en línea con otras observaciones publicadas en la literatura12. Dado que todos nuestros pacientes habían sido evaluados previo a la rotura con una RM en la que se comprobó la adecuada incorporación ósea del injerto y la posición de los túneles femoral y tibial de acuerdo con las recomendaciones de la literatura, creemos haber descartado adecuadamente estos factores como causas de los fallos encontrados en la reconstrucción del LCA. Debido a que en la rotura de la plastia participan diversos factores, basándonos en nuestros resultados creemos que los fallos en nuestros pacientes se debieron fundamentalmente a una combinación de un componente mecánico y biológico13. Dentro de las variables biológicas que pueden estar involucradas nos parece interesante que al evaluar la maduración, específicamente en relación con la localización de los vasos sanguíneos, encontramos que los pacientes en que el fallo de la reconstrucción se produce antes de 12 meses presentan una menor penetración de vasos sanguíneos hacia el injerto en relación con los pacientes en que el fallo se produce luego de 12 meses, traduciendo una menor maduración del injerto. Nuestros resultados difieren de la información disponible en relación con el proceso de ligamentización normal en que la plastia no presenta fallos; Falconiero et al. analizaron 43 biopsias de injertos de LCA concluyendo que entre los 6 y 12 meses posterior a la realización de la plastia no existían diferencias significativas en la vascularización ni en la orientación de las fibras de colágeno9.
Nos parece que es posible plantear que existe un subgrupo de pacientes en los cuales, por motivos no claros, se produce un retardo en el proceso de maduración del injerto de LCA en relación con la vascularización de la plastia más que en el proceso de incorporación óseo, el que sí fue alcanzado a los 6 meses según la evaluación por RM. Debido a que la evidencia disponible señala que la porción posterior del injerto a nivel femoral y la anterior a nivel tibial son las primeras en revascularizarse6, nos parece planteable que fallos en este proceso puedan aumentar el riesgo de rotura del injerto, lo que pudiera haber ocurrido en nuestra muestra. Esto pudiera tener una repercusión clínica, ya que es posible evaluar mediante técnicas de RM la vascularidad del injerto6-8 y eventuales retrasos de este proceso pudieran cambiar el tiempo en el cual se autoriza el reintegro deportivo de los pacientes.
Otro aspecto biológico que pudiera tener relación con el fallo en la reconstrucción del LCA en estos pacientes es la diferencia que encontramos en la orientación de las fibras de colágeno entre los segmentos distal y medio. Los estudios biomecánicos de tendones flexores utilizados para reconstruir LCA indican que el contenido de colágeno aumenta progresivamente a medida que el injerto madura, llegando a presentar valores mayores a los de LCA nativo entre los 11 y los 13 meses desde la cirugía. Una menor maduración en el segmento distal con menor cantidad de fibras colágenas como lo que determinamos en nuestro estudio pudiera condicionar un mayor riesgo de fallo de la plastia. Esto es sumamente importante a la luz de estudios que señalan que el segmento distal del injerto es el que presenta mayores niveles de estrés biomecánicos5, por lo que pudiera ser posible que el fallo de la reconstrucción observada en nuestros pacientes se deba al retraso en la maduración a nivel distal determinada por esta menor concentración de colágeno en este segmento.
Dentro de las debilidades metodológicas de nuestro estudio están el número limitado de pacientes enrolados y la ausencia de un grupo control, además de no hacer referencia al sitio en que se presentaba la rotura del LCA según la RM, ya que estudios realizados con esta técnica han descrito que el sitio de rotura más frecuente en autoinjertos es la zona proximal, similar a lo que ocurre con el LCA nativo, y en aloinjertos existe similitud en la frecuencia de roturas entre la zona proximal y distal14. Eventualmente, en nuestro grupo de pacientes con autoinjerto el retardo en la maduración a nivel distal podría generar un comportamiento de imagen particular, el cual no fue determinado.
ConclusionesEn nuestra muestra de pacientes con falla de la plastia del LCA encontramos una menor distribución en los vasos sanguíneos en los pacientes en que la rerrotura se produce antes de los 12 meses y una menor ordenación de las fibras de colágeno a nivel distal del injerto. Estos resultados pudieran traducir un retardo en el proceso de maduración, lo que condicionaría mayores riesgos de fallo de la cirugía. Nos parece pertinente la realización de nuevos estudios orientados a determinar la real importancia clínica de estos fenómenos y la posibilidad de diagnosticarlos precozmente.
Nivel de evidenciaNivel de evidencia iii.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesNo existen conflictos de interés en el presente trabajo.