La captación miocárdica en la gammagrafía ósea se ha convertido en un método útil para la detección de la amiloidosis cardiaca secundaria al depósito de transtirretina (ATTR-CA). El objetivo de este estudio fue evaluar la prevalencia de captación miocárdica en pacientes mayores de 18 años sin sospecha clínica de amiloidosis cardiaca (AC) y a los que se realizó una gammagrafía ósea.
Métodos y resultadosSe trata de un estudio observacional, retrospectivo y multicéntrico realizado en 21 hospitales de España (de septiembre a noviembre de 2019). De las 9.864 gammagrafías analizadas (de forma local y central), en 71 pacientes (0,72%), se observó captación cardiaca incidental, con una prevalencia que aumentó con la edad. En el 16,9% de los pacientes con captación positiva se detectó un diagnóstico previo de insuficiencia cardiaca (IC), con >50% de los pacientes en un grado II de la clasificación de la NYHA. En 10 pacientes se realizó el diagnóstico de ATTR-CA, con un retraso medio de 10,4 meses (IC 95%: 5,1-15,7). Todos ellos eran mayores de 70 años, principalmente varones y presentaban una mayor hipertrofia ventricular izquierda (HVI) respecto a los pacientes sin diagnóstico confirmado (p<0,0001). Los pacientes con ATTR-CA presentaron una mayor tasa de hipotensión ortostática (30,0% vs. 3,8% en los pacientes sin ATTR-CA; p=0,025).
ConclusionesSe trata del primer estudio retrospectivo, de ámbito nacional y multicéntrico que evalúa la prevalencia de captación cardiaca incidental en gammagrafías óseas realizadas por motivos extracardiacos, y que muestra una prevalencia del 0,72% en esta población. La derivación de estos pacientes puede facilitar el diagnóstico precoz de la AC con el consiguiente beneficio para los mismos.
Myocardial uptake on bone scintigraphy has become useful for the detection of transthyretin cardiac amyloidosis (ATTR-CA). This study aimed to assess the prevalence of myocardial uptake in patients over 18 years of age with no clinical suspicion of cardiac amyloidosis (CA) who had undergone bone scintigraphy.
Methods and resultsThis was an observational, retrospective, multicenter study across 21 Spanish hospitals (September–November 2019). Of the 9864 scans analyzed (locally and centrally), incidental cardiac uptake was observed in 71 patients (0.72%), a prevalence that increased with age. A previous diagnosis of heart failure was found in 16.9% of patients with positive uptake, with>50% in NYHA II. ATTR-CA was diagnosed in 10 patients, with a mean delay of 10.4 months (95% CI: 5.1-15.7). All were>70 years old, primarily male, and had greater left ventricular hypertrophy than patients without a confirmed diagnosis (p<0.0001). ATTR-CA patients had higher rates of orthostatic hypotension (30.0% vs. 3.8% in non-ATTR-CA; p=0.025).
ConclusionsThis is the first retrospective, national, multicenter study evaluating the prevalence of incidental cardiac uptake in bone scintigraphy performed for non-cardiac reasons, showing a prevalence of 0.72% in this population. Referral of these patients may facilitate early diagnosis of CA with a resulting benefit for patients.
El término amiloidosis engloba a un conjunto heterogéneo de enfermedades causadas por el depósito extracelular de fibras amiloide en los tejidos, como consecuencia de un trastorno por un mal plegamiento de proteínas1. En el caso de la amiloidosis cardiaca (AC), el depósito fibrilar conduce a una miocardiopatía infiltrativa restrictiva1, que causa una pérdida de estructura tisular y una disfunción miocárdica2. Más del 98% de los diagnósticos de AC corresponden a una amiloidosis por depósito de cadenas ligeras de inmunoglobulinas (AL) o de transtirretina (ATTR), ya sea de forma hereditaria (ATTRv) o adquirida (ATTRwt)3. Ambas enfermedades tienen un mal pronóstico en comparación con otras causas de cardiopatía, con las que a menudo se confunden4,5.
La gammagrafía ósea permite realizar el diagnóstico no invasivo de la ATTR-CA3: una puntuación en el índice de captación miocárdica de Perugini de 2 o 36, en ausencia de proteínas monoclonales en las pruebas de cadenas ligeras, tiene una especificidad y un valor predictivo positivo del 100% para la detección de ATTR-CA6,7. La posibilidad de un diagnóstico no invasivo junto con el desarrollo de tratamientos específicos ha impulsado una búsqueda más activa de ATTR-CA8. Los estudios han estimado una prevalencia media de ATTR-CA (principalmente ATTRwt) del ∼ 15% en pacientes con insuficiencia cardiaca (IC) e hipertrofia ventricular izquierda (HVI) ≥ 12mm9, del 5,2% en pacientes con IC sin HVI10, del 7% en pacientes sometidos a cirugía por síndrome del túnel carpiano (STC) y del 8% en pacientes con estenosis aórtica (EA) severa8. Sin embargo, estos estudios se basan en poblaciones concretas de pacientes y no existen datos actuales sobre la prevalencia en una población más general.
Existen varios estudios que han evaluado la captación incidental del radiotrazador en el corazón de pacientes sometidos a gammagrafías óseas por motivos extracardiacos. Estudios realizados en un solo centro han encontrado una prevalencia de captación cardiaca positiva que oscila entre el 0,23% y el 0,78% en gammagrafías realizadas por motivos extracardiacos11,12. En España, dos estudios retrospectivos unicéntricos realizados en población anciana han mostrado una prevalencia de captación cardiaca incidental que oscila entre el 1% y el 2,78%13,14. Sin embargo, no se han realizado estudios multicéntricos a gran escala.
El objetivo de este estudio ha sido evaluar la prevalencia de captación cardiaca incidental en la gammagrafía ósea en una muestra representativa de pacientes sin sospecha clínica previa de AC. Se describe el perfil de los pacientes con ATTR-CA no sospechada.
Materiales y métodosDiseño del estudioSe trata de un estudio multicéntrico, retrospectivo y observacional en el que participaron 21 centros distribuidos por todo el territorio nacional y que representaban a la mayoría de las regiones de España (Figura suplementaria 1). Las Tablas suplementarias 1 y 2 muestran la lista completa de los centros participantes, los investigadores y su distribución geográfica. Los investigadores principales fueron especialistas en Medicina Nuclear que actuaron de acuerdo con la práctica clínica. No se pidió a los pacientes que firmaran un formulario de consentimiento informado.
Este estudio fue aprobado por el Departamento de Medicamentos para Uso Humano de la Agencia Española de Medicamentos y Productos Sanitarios (clasificado como Estudio observacional no pos-autorización) y por el Comité Ético de Investigación de Medicamentos del Hospital Universitario Puerta de Hierro-Majadahonda, Madrid (España) en su reunión del 15/06/2020 (Registro n° 11/2020).
Población del estudio.Se revisaron retrospectivamente todas las gammagrafías óseas consecutivas realizadas en distintos Servicios de Medicina Nuclear durante los meses de septiembre, octubre y noviembre del 2019. Se seleccionó este periodo para evitar el posible impacto de la pandemia por COVID, así como el efecto de unos meses con una menor carga asistencial. Las exploraciones seleccionadas fueron adquiridas por el personal hospitalario según el protocolo habitual de cada centro participante.
Los participantes en el estudio debían cumplir los siguientes criterios para ser incluidos en el estudio: (a) ser mayores de edad (≥18 años); (b) disponer de una gammagrafía ósea realizada por un motivo extracardiaco durante el periodo de estudio indicado; y (c) disponer de una gammagrafía ósea realizada con radiotrazador [99mTc]Tc-DPD ([99mTc]Tc-HDP [99mTc]Tc-HMDP o [99mTc]Tc-PYP. Los criterios de exclusión fueron: (a) pacientes en los que la gammagrafía ósea se realizó por una sospecha de AC; (b) aquellos en los que se utilizó un radiofármaco distinto de los mencionados anteriormente; (c) pacientes embarazadas o en periodo de lactancia; y (d) pacientes previamente diagnosticados de ATTR.
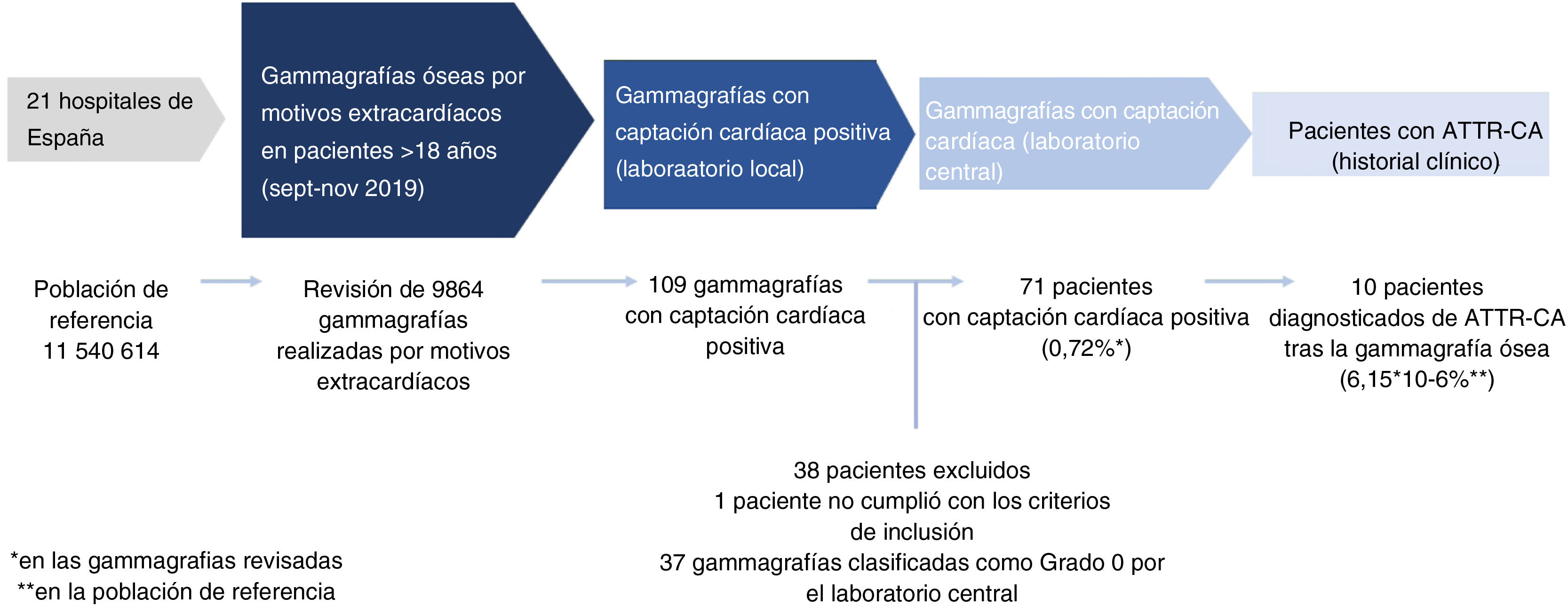
Se revisaron las historias clínicas de los pacientes con gammagrafías óseas positivas para captación cardiaca, y se recogió la información mediante un formulario. La figura 1 muestra el diseño y el flujo de trabajo del estudio.
Análisis de las imágenesSe realizó un análisis visual de las gammagrafías óseas para poder establecer el grado de captación cardiaca según la puntuación de la escala de Perugini6: (a) grado 0, o negativo, en ausencia de depósitos en la zona cardiaca; (b) grado 1, cuando el depósito visualizado en la zona cardiaca es de menor intensidad que en las costillas adyacentes; (c) grado 2, cuando el depósito en la zona cardiaca es similar al de las costillas adyacentes; y (d) grado 3, cuando el depósito es mayor en la zona cardiaca que en las costillas adyacentes. En aquellos pacientes en los que hubo disponibilidad, se calculó la captación semicuantitativa mediante la obtención del índice corazón-contralateral (relación C/CL)15.
Las gammagrafías óseas consideradas positivas (grados 1-3) fueron revisadas posteriormente por un laboratorio central con el fin de homogeneizar las interpretaciones.
Recogida de variablesSe recogieron las variables relativas a cada centro participante: número total de gammagrafías revisadas y exploraciones por grupo de edad. También se recogieron las variables relativas al procedimiento.
Los hallazgos clínicos existentes relativos a posibles signos cardiacos y/o síntomas de amiloidosis, cuando existieron, fueron registrados a partir del historial clínico de aquellos pacientes con gammagrafía positiva.
Análisis estadísticoSe llevó a cabo un análisis descriptivo utilizando el sistema SAS, versión 9.4 (SAS Institute Inc., Cary, NC, EE. UU.), en el que las variables continuas se expresaron según la media con su intervalo. Las variables categóricas se expresaron según su porcentaje. Se utilizó la prueba de la X2, la prueba exacta de Fisher, la prueba t de Student o la U de Mann-Whitney, según procediera. El nivel de significación estadística se fijó en p <0,05.
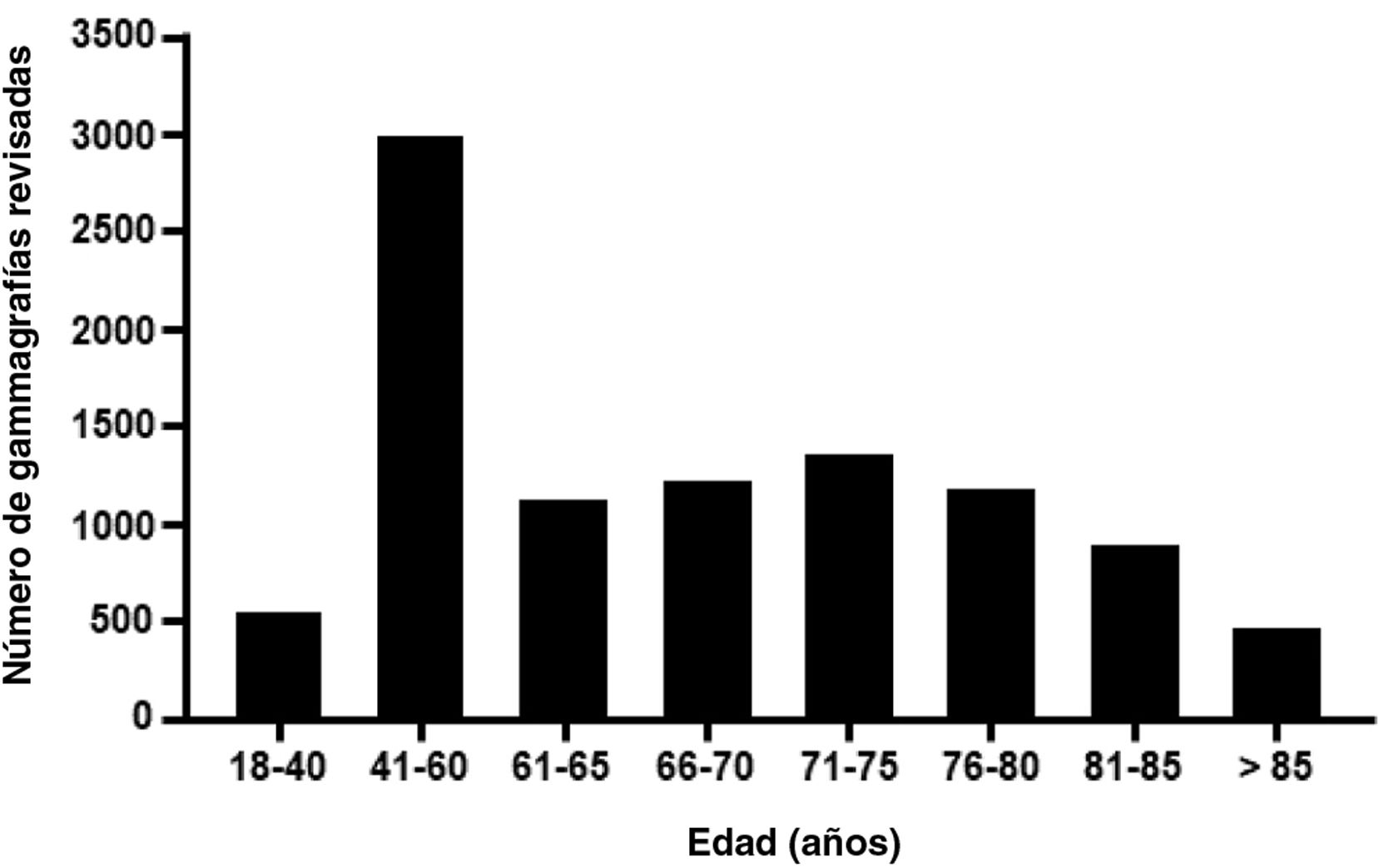
ResultadosSe revisaron un total de 9.864 gammagrafías óseas de todas las pruebas realizadas en los meses de septiembre, octubre y noviembre de 2019. La población de referencia de los 21 centros comprende un total de 11.540.614 habitantes, lo que corresponde al 24,4% de la población nacional de España (Tabla suplementaria 2). La figura 2 muestra el número total de exploraciones revisadas según los grupos de edad.
Prevalencia de la captación cardiaca incidental en la gammagrafía ósea realizada por motivos extracardiacosSe detectó captación cardiaca incidental en 109 de las 9.864 gammagrafías incluidas en el estudio; 38 casos fueron posteriormente excluidos: uno por no cumplir los criterios de inclusión, y los 37 restantes por corresponder con un grado 0 en la evaluación realizada posteriormente en el laboratorio central. Las causas más frecuentes de exclusión fueron la presencia de falsos positivos debidos a lagunas vasculares y calcificación costales. El número final de gammagrafías valoradas con captación cardiaca fue de 71 (0,72%) (fig. 1).
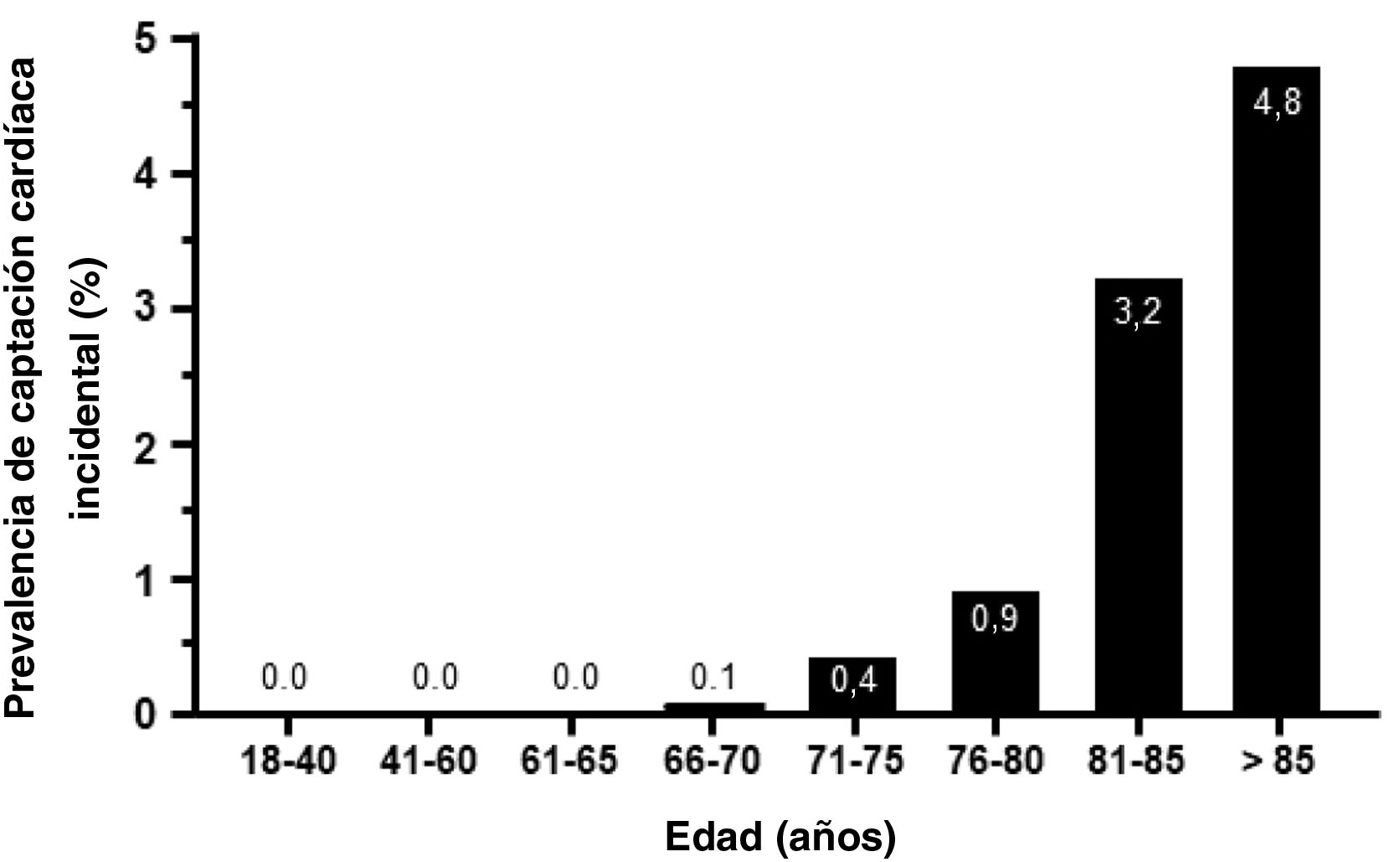
Como era de esperar, la captación fue mínima en los pacientes menores de 70 años y fue aumentando a partir de dicha edad, siendo máxima en aquellos pacientes ˃ 85 años (4,8%) (fig. 3). La distribución geográfica de los casos positivos tampoco fue homogénea (Tabla S2).
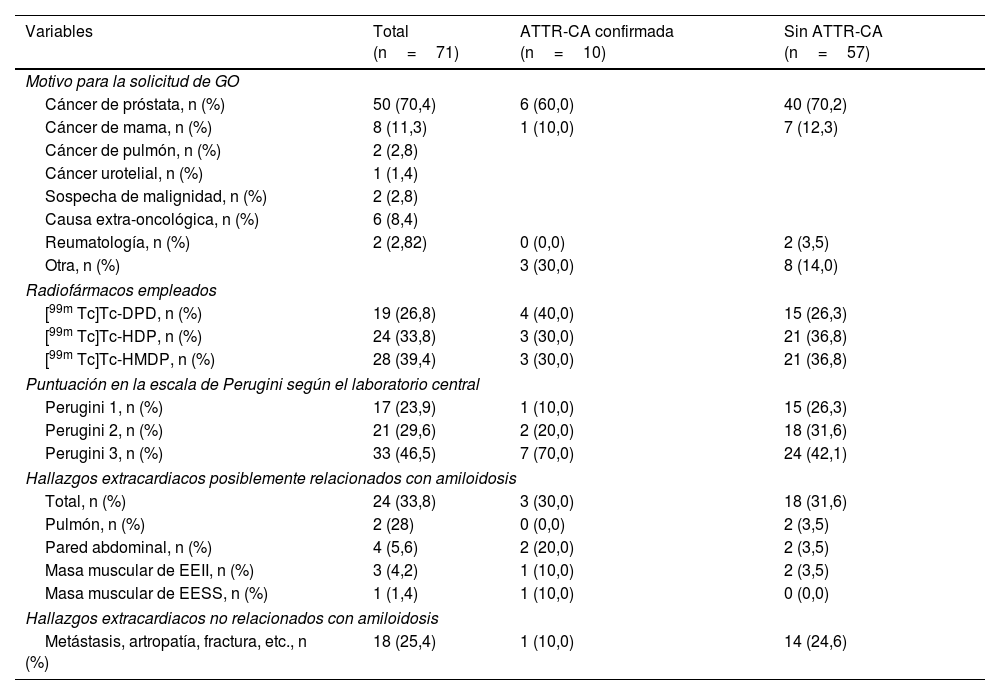
Características de las gammagrafías de los sujetos con captación cardiaca positivaDe las 71 exploraciones positivas válidas, 17 fueron de grado 1 (23,9%), 21 de grado 2 (29,6%) y 33 de grado 3 (46,5%) (tabla 1). En 24 casos se obtuvo el índice de captación C/CL (media± DE) siendo de 1,18±0,07 (rango 1,07 - 1,27), 2,39±1,25 (rango 1,08 - 4,64) y 2,49±1,01 (rango 1,40 - 4,54) para las puntuaciones de Perugini de grado 1 (n=6), 2 (n=7), y 3 (n=11), respectivamente (p=0,04).
Motivo de solicitud de la gammagrafía y características de la exploración en la población de pacientes con captación cardiaca incidental con y sin diagnóstico de ATTR-CA
| Variables | Total (n=71) | ATTR-CA confirmada (n=10) | Sin ATTR-CA (n=57) |
|---|---|---|---|
| Motivo para la solicitud de GO | |||
| Cáncer de próstata, n (%) | 50 (70,4) | 6 (60,0) | 40 (70,2) |
| Cáncer de mama, n (%) | 8 (11,3) | 1 (10,0) | 7 (12,3) |
| Cáncer de pulmón, n (%) | 2 (2,8) | ||
| Cáncer urotelial, n (%) | 1 (1,4) | ||
| Sospecha de malignidad, n (%) | 2 (2,8) | ||
| Causa extra-oncológica, n (%) | 6 (8,4) | ||
| Reumatología, n (%) | 2 (2,82) | 0 (0,0) | 2 (3,5) |
| Otra, n (%) | 3 (30,0) | 8 (14,0) | |
| Radiofármacos empleados | |||
| [99m Tc]Tc-DPD, n (%) | 19 (26,8) | 4 (40,0) | 15 (26,3) |
| [99m Tc]Tc-HDP, n (%) | 24 (33,8) | 3 (30,0) | 21 (36,8) |
| [99m Tc]Tc-HMDP, n (%) | 28 (39,4) | 3 (30,0) | 21 (36,8) |
| Puntuación en la escala de Perugini según el laboratorio central | |||
| Perugini 1, n (%) | 17 (23,9) | 1 (10,0) | 15 (26,3) |
| Perugini 2, n (%) | 21 (29,6) | 2 (20,0) | 18 (31,6) |
| Perugini 3, n (%) | 33 (46,5) | 7 (70,0) | 24 (42,1) |
| Hallazgos extracardiacos posiblemente relacionados con amiloidosis | |||
| Total, n (%) | 24 (33,8) | 3 (30,0) | 18 (31,6) |
| Pulmón, n (%) | 2 (28) | 0 (0,0) | 2 (3,5) |
| Pared abdominal, n (%) | 4 (5,6) | 2 (20,0) | 2 (3,5) |
| Masa muscular de EEII, n (%) | 3 (4,2) | 1 (10,0) | 2 (3,5) |
| Masa muscular de EESS, n (%) | 1 (1,4) | 1 (10,0) | 0 (0,0) |
| Hallazgos extracardiacos no relacionados con amiloidosis | |||
| Metástasis, artropatía, fractura, etc., n (%) | 18 (25,4) | 1 (10,0) | 14 (24,6) |
GO: gammagrafía ósea; ATTR-CA: amiloidosis cardiaca por transtiretina; [99m Tc]Tc-DPD: 99mTc-3,3-difosfono-1,2- ácido propanodicarboxílico; EEII: extremidades inferiores; EESS: extremidades superiores.
El motivo de solicitud de la gammagrafía ósea fue principalmente la valoración de posible afectación ósea metastásica en pacientes con patología oncológica, fundamentalmente cáncer de próstata (70,4%) y de mama (11,3%) (tabla 1). La tabla 1 muestra los radiofármacos empleados y los hallazgos de la gammagrafía.
Se observaron hallazgos extracardiacos en 24 pacientes (33,80%), habiendo 18 casos (25,4%) relacionados con la patología que motivó la solicitud de la exploración (tabla 1).
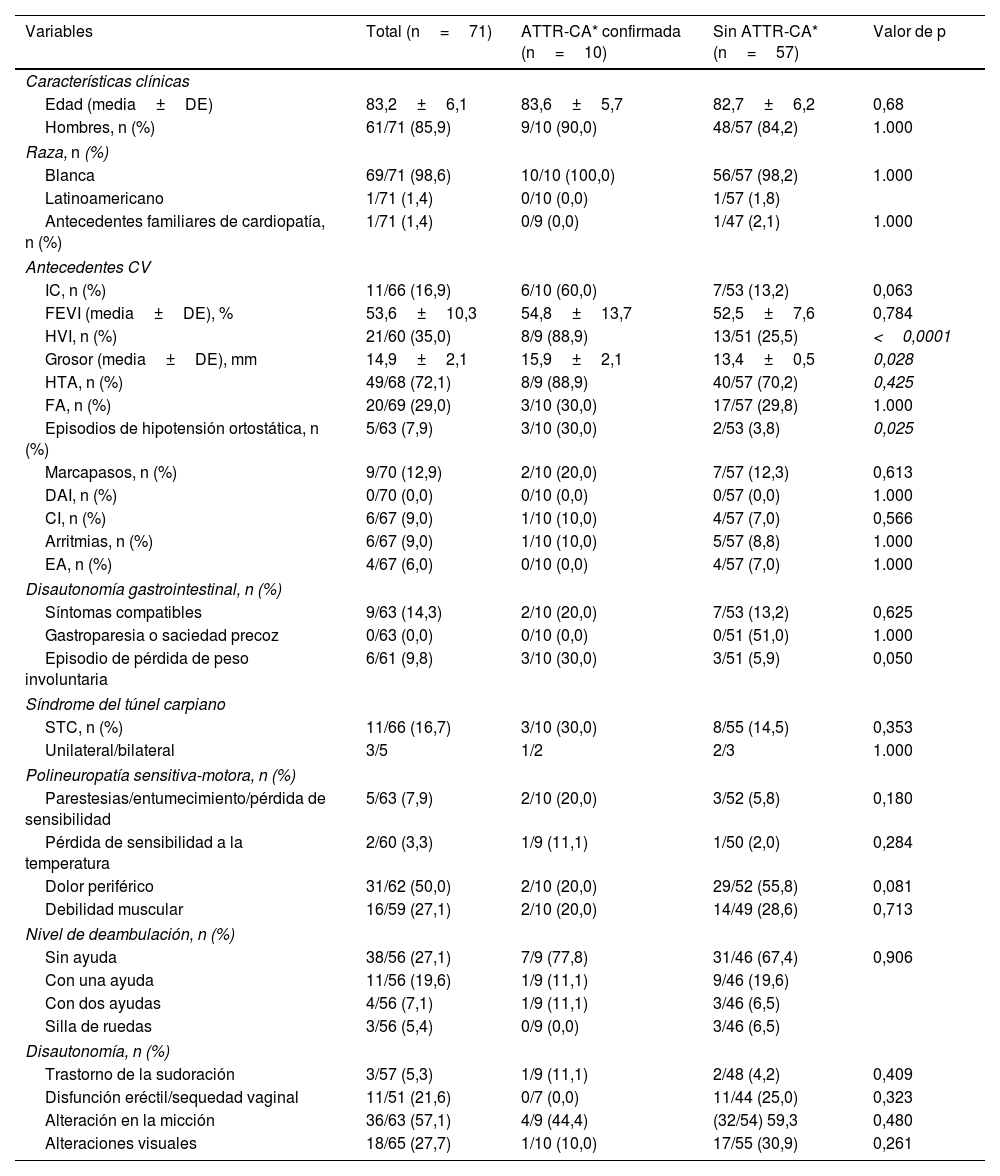
Características demográficas y clínicas de los sujetos con captación cardiaca positivaLa tabla 2 muestra las características demográficas y clínicas principales de los sujetos con captación cardiaca incidental. La edad media (± DE) de la población con captación cardiaca positiva incluida en el estudio fue de 83,2±6,1 años, correspondiendo el 85,9% a varones (61/71).
Características demográficas y clínicas de los pacientes con captación cardiaca positiva según el diagnóstico de ATTR-CA
| Variables | Total (n=71) | ATTR-CA* confirmada (n=10) | Sin ATTR-CA* (n=57) | Valor de p |
|---|---|---|---|---|
| Características clínicas | ||||
| Edad (media±DE) | 83,2±6,1 | 83,6±5,7 | 82,7±6,2 | 0,68 |
| Hombres, n (%) | 61/71 (85,9) | 9/10 (90,0) | 48/57 (84,2) | 1.000 |
| Raza, n (%) | ||||
| Blanca | 69/71 (98,6) | 10/10 (100,0) | 56/57 (98,2) | 1.000 |
| Latinoamericano | 1/71 (1,4) | 0/10 (0,0) | 1/57 (1,8) | |
| Antecedentes familiares de cardiopatía, n (%) | 1/71 (1,4) | 0/9 (0,0) | 1/47 (2,1) | 1.000 |
| Antecedentes CV | ||||
| IC, n (%) | 11/66 (16,9) | 6/10 (60,0) | 7/53 (13,2) | 0,063 |
| FEVI (media±DE), % | 53,6±10,3 | 54,8±13,7 | 52,5±7,6 | 0,784 |
| HVI, n (%) | 21/60 (35,0) | 8/9 (88,9) | 13/51 (25,5) | <0,0001 |
| Grosor (media±DE), mm | 14,9±2,1 | 15,9±2,1 | 13,4±0,5 | 0,028 |
| HTA, n (%) | 49/68 (72,1) | 8/9 (88,9) | 40/57 (70,2) | 0,425 |
| FA, n (%) | 20/69 (29,0) | 3/10 (30,0) | 17/57 (29,8) | 1.000 |
| Episodios de hipotensión ortostática, n (%) | 5/63 (7,9) | 3/10 (30,0) | 2/53 (3,8) | 0,025 |
| Marcapasos, n (%) | 9/70 (12,9) | 2/10 (20,0) | 7/57 (12,3) | 0,613 |
| DAI, n (%) | 0/70 (0,0) | 0/10 (0,0) | 0/57 (0,0) | 1.000 |
| CI, n (%) | 6/67 (9,0) | 1/10 (10,0) | 4/57 (7,0) | 0,566 |
| Arritmias, n (%) | 6/67 (9,0) | 1/10 (10,0) | 5/57 (8,8) | 1.000 |
| EA, n (%) | 4/67 (6,0) | 0/10 (0,0) | 4/57 (7,0) | 1.000 |
| Disautonomía gastrointestinal, n (%) | ||||
| Síntomas compatibles | 9/63 (14,3) | 2/10 (20,0) | 7/53 (13,2) | 0,625 |
| Gastroparesia o saciedad precoz | 0/63 (0,0) | 0/10 (0,0) | 0/51 (51,0) | 1.000 |
| Episodio de pérdida de peso involuntaria | 6/61 (9,8) | 3/10 (30,0) | 3/51 (5,9) | 0,050 |
| Síndrome del túnel carpiano | ||||
| STC, n (%) | 11/66 (16,7) | 3/10 (30,0) | 8/55 (14,5) | 0,353 |
| Unilateral/bilateral | 3/5 | 1/2 | 2/3 | 1.000 |
| Polineuropatía sensitiva-motora, n (%) | ||||
| Parestesias/entumecimiento/pérdida de sensibilidad | 5/63 (7,9) | 2/10 (20,0) | 3/52 (5,8) | 0,180 |
| Pérdida de sensibilidad a la temperatura | 2/60 (3,3) | 1/9 (11,1) | 1/50 (2,0) | 0,284 |
| Dolor periférico | 31/62 (50,0) | 2/10 (20,0) | 29/52 (55,8) | 0,081 |
| Debilidad muscular | 16/59 (27,1) | 2/10 (20,0) | 14/49 (28,6) | 0,713 |
| Nivel de deambulación, n (%) | ||||
| Sin ayuda | 38/56 (27,1) | 7/9 (77,8) | 31/46 (67,4) | 0,906 |
| Con una ayuda | 11/56 (19,6) | 1/9 (11,1) | 9/46 (19,6) | |
| Con dos ayudas | 4/56 (7,1) | 1/9 (11,1) | 3/46 (6,5) | |
| Silla de ruedas | 3/56 (5,4) | 0/9 (0,0) | 3/46 (6,5) | |
| Disautonomía, n (%) | ||||
| Trastorno de la sudoración | 3/57 (5,3) | 1/9 (11,1) | 2/48 (4,2) | 0,409 |
| Disfunción eréctil/sequedad vaginal | 11/51 (21,6) | 0/7 (0,0) | 11/44 (25,0) | 0,323 |
| Alteración en la micción | 36/63 (57,1) | 4/9 (44,4) | (32/54) 59,3 | 0,480 |
| Alteraciones visuales | 18/65 (27,7) | 1/10 (10,0) | 17/55 (30,9) | 0,261 |
DE: desviación estándar; CV: cardiovascular; IC: insuficiencia cardiaca; HVI: hipertrofia ventricular izquierda; FEVI: fracción de eyección del ventrículo izquierdo; HTA: hipertensión arterial; FA: fibrilación auricular; DAI: desfibrilador automático implantable; CI: miocardiopatía isquémica; EA: estenosis aórtica; STC: síndrome del túnel carpiano.
Se recogieron los antecedentes patológicos personales de síntomas y signos cardiacos potencialmente relacionados con la AC en aquellos casos con captación cardiaca positiva. Hubo una HVI en 21/62 pacientes (33,9%), con un grosor máximo de pared de 14,9±2,1mm (rango 13-20mm). Curiosamente, en 16 de los pacientes sin HVI mostraron una captación cardiaca de grado 3. Hubo un total de 11/65 pacientes (16,9%) con IC diagnosticada en una media de 2,9±2,4 años (rango 0,1 - 6,8 años) previamente a la realización de la gammagrafía ósea, con una fracción de eyección ventricular izquierda (FEVI) media de 53,6±10,3% (rango 42 – 74%). De estos 11 pacientes, los de edad ≤ 80 años fueron diagnosticados de IC antes que los pacientes> 80 años (media±DE: 6,1±0,9 años vs. 2,2±1,9 años; p=0,022). Un porcentaje de 72,1% (48/68) pacientes presentaban antecedentes de hipertensión arterial (HTA) con una media de 11,3±7,8 años (rango 0,4 - 40,8) previos a la realización de la gammagrafía. La fibrilación auricular (FA) estuvo presente en el 29,0% (20/69) de los casos, siendo diagnosticada 4,9±3,8 años (0,4 - 12,4) antes de la gammagrafía; en los pacientes de edad ≤ 80 años el diagnóstico fue anterior que en los de edad> 80 (media±DE: 7,5±3,6 vs. 3,8±3,5 años; p=0,048).
También se recogieron los antecedentes personales patológicos de otros síntomas signos potencialmente relacionados con la ATTR (tabla 2).
Características demográficas y clínicas de los pacientes con ATTR-CA confirmadaHubo diez casos con captación cardiaca incidental que fueron posteriormente diagnosticados de una ATTR-CA, con un intervalo medio hasta su diagnóstico de 10,4±7,4 meses (rango 1,1 - 20,0) tras la gammagrafía ósea.
La edad media de los pacientes con ATTR-CA fue de 83,6±5,7 años (rango 73 - 93); el 80% eran mayores de 80 años, situándose la mitad de los pacientes dentro del grupo de edades comprendidas entre los 81 y 85 años. Casi todos los pacientes (90%) eran varones. La gammagrafía ósea mostró un grado 3 en la escala de Perugini en seis casos, un grado 2 en tres casos y un grado 1 en el caso restante.
Los pacientes con ATTR-CA presentaron antecedentes personales de: HTA (8/10), FA (3/10), IC (3/10), STC (2/10), cardiopatía isquémica (CI) (1/10), arritmias (1/10), estenosis del canal lumbar (ECL) (1/10), insuficiencia renal (IR) (1/10) y diabetes mellitus (DM) (1/10); no hubo ningún paciente con EA ni polineuropatía periférica. No se obtuvieron diferencias significativas cuando se compararon las características de los pacientes con y sin ATTR-CA (tabla 2). En comparación con los pacientes clasificados como «sin ATTR-CA» por los investigadores, los pacientes con ATTR-CA presentaron una mayor prevalencia de HVI (88,9% vs. 25,5%; p <0,001), con una mayor HVI (15,9±2,1 vs. 13,4±0,5; p=0,028) así como mayor prevalencia de hipotensión ortostática (30,0 vs. 3,8%; p=0,025). Hubo una mayor proporción de pacientes con pérdida de peso involuntaria, aunque ello no fue estadísticamente significativo (30,0% vs. 5,9%; p=0,05). En ambos grupos los hallazgos extracardiacos se produjeron en una proporción similar (tabla 1).
DiscusiónEste es el primer estudio retrospectivo y multicéntrico que abarca a una gran parte de España (∼ 25% de la población del país) para poder analizar la prevalencia de captación cardiaca incidental en la gammagrafía ósea en una cohorte de pacientes sin sospecha previa de AC. Se incluyó una población general procedente de todo el país, con la participación de centros presentes en casi todas las comunidades autónomas.
Se detectó captación cardiaca en el 0,72% de los pacientes sometidos a gammagrafía por motivos extracardiacos. A la hora de considerar la población global de referencia, la prevalencia fue considerablemente menor. Hemos observado que esta prevalencia aumentó progresivamente con la edad, hasta llegar al 3,8% en los pacientes de 80-84 años y hasta el 4,8% en los pacientes ˃ 85 años. Estos resultados son comparables a los obtenidos en estudios realizados en un único centro. En un metaanálisis reciente realizado sobre 10 estudios16, se describió una prevalencia del 1,1%, indicando que la prevalencia de la captación cardiaca aumentaba con la edad (edad media de 78 a 86 años) y que los varones representaban a la mayoría de estos pacientes (del 62% al 90% en los estudios examinados)11,16, con una mayor prevalencia en aquellos varones ≥ 85 años (6,15%). Otro estudio de carácter unicéntrico y que analizó 4.228 gammagrafías óseas, mostró una prevalencia de captación cardiaca del 0,54% de los casos, con mayor captación observada en las edades más avanzadas y en varones17. En España, dos estudios previos han mostrado una prevalencia de captación miocárdica incidental del 1,2%-2,8%13,14, con un mayor riesgo de hospitalización por IC13. Otro estudio que analizó los datos de 9.619 gammagrafías óseas realizadas por diferentes indicaciones clínicas en un centro de Italia entre el 2009 y el 2020 observó captación cardiaca en el 0,7% de las exploraciones18, con resultados muy similares a los nuestros.
En España hay dos focos endémicos de ATTRv Val30Met (en Mallorca y en la población de Valverde del Camino, Huelva)19. Además, se ha observado una elevada prevalencia de esta mutación en la Safor (Valencia), Barcelona, Cantabria y Vigo (Galicia)20, así como se ha detectado una elevada prevalencia de la variante Glu109Lys en Jaén21. Los dos hospitales ubicados en las áreas endémicas e incluidos en el estudio mostraron una prevalencia de captación cardiaca incidental similar a la media. Una posible causa podría ser la sensibilidad subóptima de algunos radiotrazadores empleados, como el [99mTc]Tc-DPD, para detectar afectación cardiaca en los pacientes con la mutación V30M presente, especialmente en aquellos casos con enfermedad en sus fases iniciales22. Esta es precisamente la mutación y presentación características de los focos de Mallorca en España. Otra posible explicación podría ser la baja prevalencia de ATTRv.
Se ha observado una variabilidad en la interpretación de la gammagrafía ósea por parte de diferentes especialistas en lo que respecta a la evaluación de la puntuación en la escala de captación. Ello indica una cierta discrepancia en la evaluación visual de la extensión de la captación utilizando la escala de Perugini, siendo algunos pacientes potencialmente clasificados como falsos positivos de forma errónea. Esto ya ha sido publicado recientemente por el Centro de Amiloidosis de Boston, que describió a la interpretación errónea de la gammagrafía como la segunda causa más común (29%) de los casos descritos como falsos positivos23. Además, la mayoría de las gammagrafías óseas analizadas no incluyeron la adquisición tomografía computarizada por emisión de fotón único (SPECT), que permite una diferenciación más sensible y especifica del origen de la captación cardiaca3. El uso de esta técnica podría reducir el número de falsos positivos23 y resulta esencial para el diagnóstico de la AC3.
En este estudio se han detectado pacientes con captación cardiaca incidental y, en la mayoría de los casos, no se habían llevado a cabo aquellas pruebas necesarias para establecer o descartar el diagnóstico definitivo de AC (estudio retrospectivo). Hoy en día, dicho diagnóstico puede realizarse de forma no invasiva mediante la realización de gammagrafía ósea, excluyendo la presencia de proteínas monoclonales mediante el ensayo de cadenas ligeras libres en plasma (Freelite), y mediante técnicas de inmunofijación en sangre y orina3. Sin embargo, como se observa en los resultados obtenidos en este estudio, sólo 10 de los 71 pacientes con captación cardiaca obtuvieron una confirmación diagnóstica de ATTR-CA, en un intervalo de tiempo medio superior a los 10 meses. Esto es hallazgo llamativo, ya que en aquellos casos con una captación de grado 2/3 en la escala de Perugini (n=43), la realización de un estudio hematológico hubiera permitido diagnosticar o excluir una AC, sobre todo teniendo en cuenta que en algunos casos se trataba de pacientes que ya presentaban síntomas. Debe tenerse en cuenta que, en el caso de la ATTRwt, su retraso diagnóstico mayor de seis meses se asocia a un aumento de la mortalidad24.
Si bien es cierto que la gammagrafía ha sido una técnica validada para el diagnóstico de AC en pacientes con sospecha de ATTR-AC y no para la población general7, así como tampoco para una población no seleccionada como la que ocupa este estudio, la derivación del paciente tras detectar una captación incidental positiva podría conducir al diagnóstico cuando no se sospecha la ATTR-AC. Teniendo en cuenta el mal pronóstico de la amiloidosis AL, especialmente cuando afecta al corazón25, resulta crucial la exclusión de un proceso monoclonal lo antes posible.
Además, llegar a un diagnóstico adecuado implica que no sólo los pacientes con ATTR-CA pueden acceder a tratamientos que van a contrarrestar la enfermedad, sino que el simple hecho de obtener el diagnóstico va a afectar al manejo sintomático de la enfermedad al ajustar el tratamiento de las comorbilidades concomitantes. Esto se traduce en un aumento de la esperanza de vida de años y en una disminución de las hospitalizaciones de origen cardiovascular, así como en un ahorro para el sistema nacional de salud26. Además, se ha demostrado que en aquellos casos detectados precozmente en los que los pacientes no presentan IC, el tratamiento con estabilizadores proporciona un beneficio pronóstico en cuanto a la aparición de síntomas y de mortalidad asociados a IC27.
En la AC, aparecen con frecuencia depósitos extracardiacos, que se caracterizan por la acumulación de componente amiloide en los tejidos blandos. En este sentido, la inclusión de esta información en este estudio permite evaluar la extensión de los depósitos de amiloide28. En nuestro estudio, más de un tercio (33,8%) de los pacientes con captación cardiaca presentaron además hallazgos extracardiacos, y en casi la mitad de los casos (∼ 42%) no estaban relacionados con el motivo de la exploración. Además, en una proporción variable de pacientes, se identificaron las siguientes «señales de alarma» (∼ 3-30%): FA, diagnóstico previo de IC, STC bilateral y afectación sensitiva y disautonómica. Aunque la mayoría de estos síntomas podrían ser atribuibles a la edad del paciente, algunos de ellos, como la presencia de hipotensión ortostática, se observaron con una mayor proporción en los pacientes diagnosticados de ATTR-CA respecto a los no diagnosticados de esta enfermedad. Esto indica la necesidad de concienciar y aumentar la sospecha clínica respecto a la AC en aquellos escenarios donde la prevalencia sea significativa8.
Limitaciones del estudioEl carácter retrospectivo de nuestro estudio impidió recuperar datos no incluidos en el historial clínico de los pacientes. Además, no se registró el sexo de aquellos pacientes que no presentaron captación incidental, por lo que no pudimos determinar la prevalencia según este factor. Además, únicamente se revisaron de forma centralizada aquellas exploraciones positivas seleccionadas localmente, lo que supone otra posible fuente de sesgo de selección. En el caso de los pacientes clasificados como no ATTR-CA, no podemos asegurar que en todos los casos se hubiera realizado el correspondiente estudio hematológico para descartar una AL. Mientras que la gammagrafía ósea se asocia a la detección de neoplasias formadoras de hueso como el carcinoma de próstata, su uso para otro tipo de tumores como el de mama es menos frecuente29. Esto podría haber introducido un sesgo de género en la población incluida. Aunque la ATTR-CA es una enfermedad que se asocia estrechamente con el sexo masculino, existen varios artículos que muestran que la prevalencia en las mujeres puede estar infravalorada30.
ConclusiónNuestros resultados muestran una prevalencia de captación cardiaca incidental del 0,72% en pacientes sometidos a gammagrafía ósea por motivos extracardiacos, proporción que aumenta exponencialmente con la edad. La identificación de captación cardiaca incidental por parte del especialista en medicina nuclear resulta crucial para la posterior derivación de estos pacientes hacia el diagnóstico de AC. La derivación de dichos pacientes puede facilitar el diagnóstico precoz de la AC, con el consiguiente impacto en el tratamiento, pronóstico y calidad de vida del paciente.
FinanciaciónEstudio financiado por Pfizer SLU. Pfizer contribuyó en el diseño del proyecto y en la redacción del manuscrito bajo la supervisión del resto de autores.
Conflicto de interesesFJdH es coordinador del estudio ECCINGO y ha recibido honorarios por su trabajo. LB, DP y PT son empleados a tiempo completo de Pfizer SLU. PT tiene acciones de Pfizer y opción de compra.
Disponibilidad de los datos y materialesLos resultados manejados y/o analizados durante el presente estudio están disponibles por parte de los autores correspondientes previa su solicitud razonable.