Pneumocystis carinii is an opportunistic fungal pathogen that may cause pneumonia and lead to pulmonary fibrosis.
AimsThis study attempted to investigate the role of P. carinii infection-related genes in regulating lung fibrosis in mice.
MethodsA screening of P. carinii infection-related differential mRNAs was performed using the GEO database, followed by protein–protein interaction (PPI) network construction using the STRING website in order to obtain P. carinii infection-related key genes. The development of a mouse model with gene aberrant expression was achieved by utilizing mice carrying the Cre-LoxP recombinase system. Dexamethasone was employed to induce tracheal infection in order to develop a model of pulmonary fibrosis, and the magnitude of lung injury was assessed by performing hematoxylin–eosin (H&E) staining and Masson staining. Lung coefficient and hydroxyproline level were assessed on sections of lung tissue as well. Finally, the magnitude of lung fibrosis and inflammation in mice was determined based on immunofluorescence and on the expression of genes associated with lung fibrosis and inflammation.
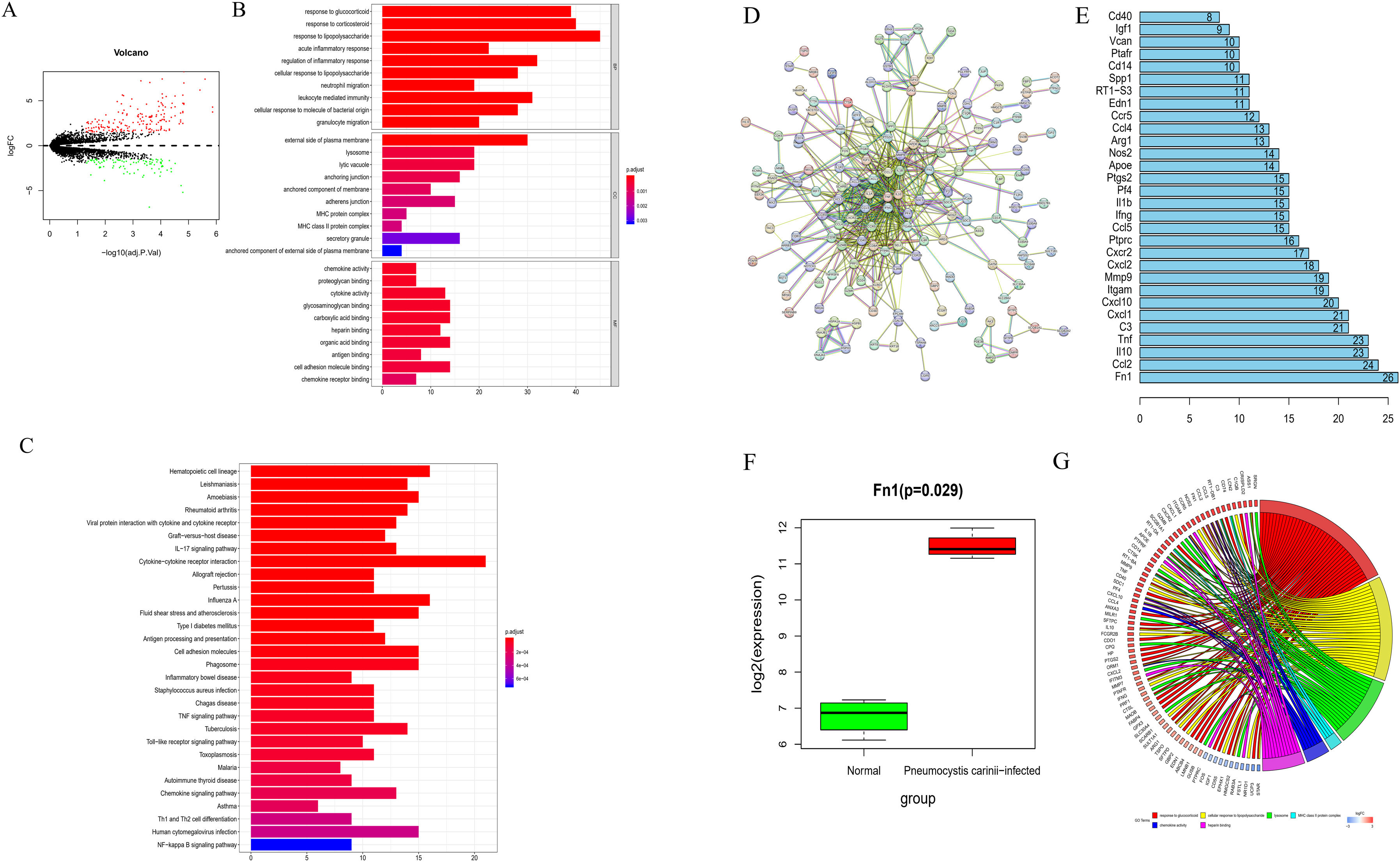
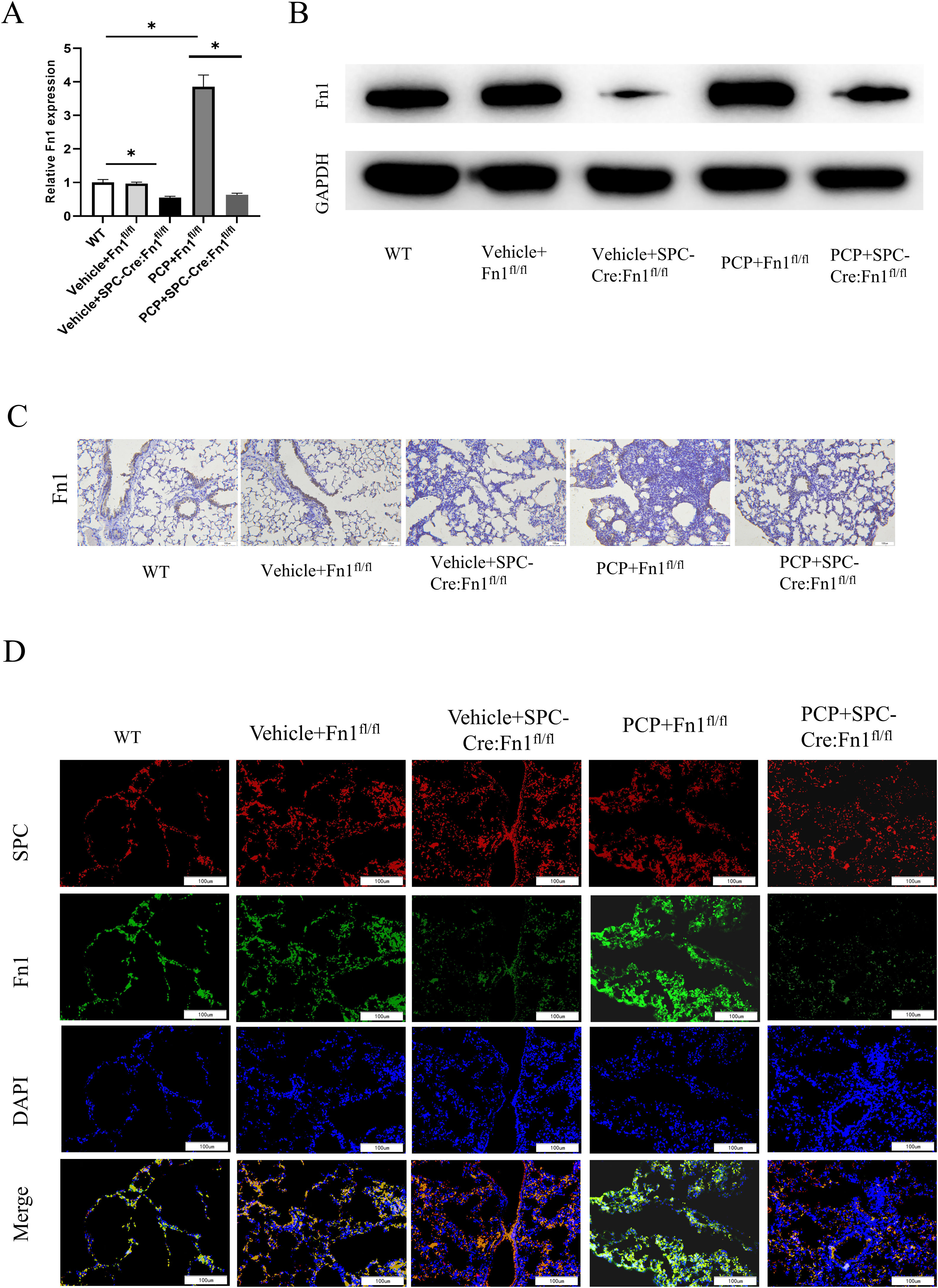
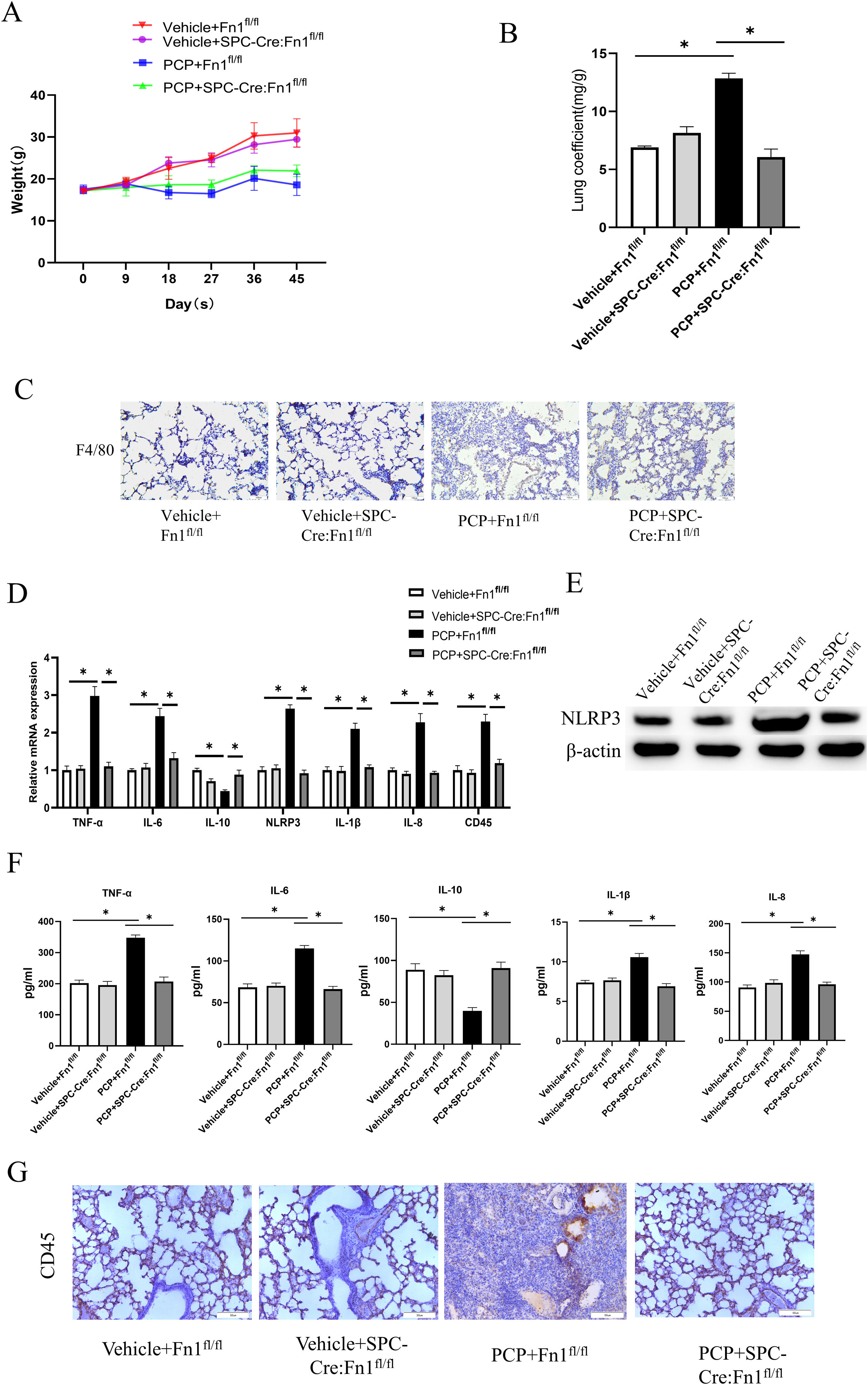
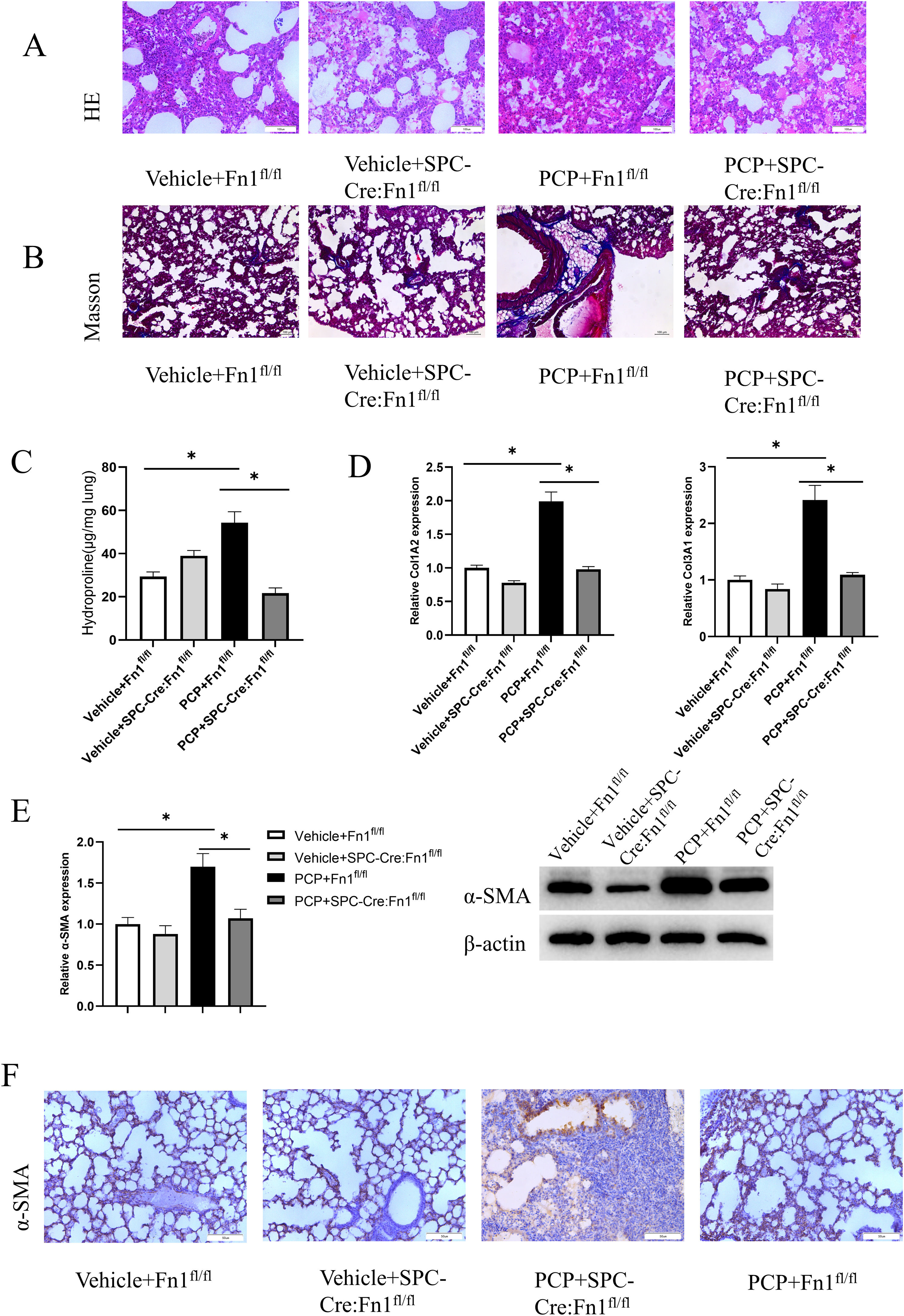
ResultsFn1 was found by PPI with the highest connectivity in the PPI network associated with immunity and inflammation. Besides, Fn1 was significantly highly expressed in P. carinii-infected mice samples. The P carinii pneumonia (PCP)+Fn1fl/fl group had significantly higher lung coefficients, hydroxyproline levels and TNF-α, IL-6, IL-1β, IL-8 and NLRP3 expression levels, and significantly lower IL-10 expression levels. The results found in PCP+SPC-Cre:Fn1fl/fl group were the opposite. The results of the pulmonary fibrosis level study showed that the PCP+Fn1fl/fl group had the most intense H&E and Masson staining, and significantly higher expression levels of Col1A2, Col3A1 and α-SMA, which were lower in the PCP+SPC-Cre:Fn1fl/fl group.
ConclusionsP. carinii infection may promote the upregulation of Fn1, which causes pulmonary fibrosis with an inflammatory response.
Pneumocystis carinii es un patógeno fúngico oportunista que puede causar neumonía y provocar fibrosis pulmonar.
ObjetivosEste estudio trató de investigar el papel de los genes relacionados con la infección por P. carinii en la regulación de la fibrosis pulmonar en ratones.
MétodosSe realizó un cribado de moléculas de ARNm diferenciales relacionadas con la infección por P. carinii por medio de la base de datos GEO, seguido de la construcción de redes de interacción proteína-proteína (PPI) en el sitio web STRING con el fin de obtener genes clave relacionados con la infección por P. carinii. Se desarrolló un modelo de fibrosis pulmonar y se evaluó la magnitud de la lesión pulmonar mediante tinción con hematoxilina-eosina (H&E) y tinción de Masson. También se evaluaron el coeficiente pulmonar y el nivel de hidroxiprolina en secciones de tejido pulmonar. Por último, se determinó la magnitud de la fibrosis y la inflamación pulmonares en ratones mediante inmunofluorescencia y la expresión de genes asociados a la fibrosis y la inflamación pulmonares.
ResultadosFn1 se encontró por PPI con la mayor conectividad en la red PPI asociada con la inmunidad y la inflamación. Además, Fn1 se expresó significativamente en muestras de ratones infectados por P. carinii. El grupo con neumonía por P. carinii (PCP)+Fn1fl/fl presentó coeficientes pulmonares, niveles de hidroxiprolina y niveles de expresión de TNF-α, IL-6, IL-1β, IL-8 y NLRP3 significativamente más altos, y niveles de expresión de IL-10 significativamente más bajos. Los resultados encontrados en el grupo PCP+SPC-Cre:Fn1fl/fl fueron los opuestos. Los resultados del estudio del nivel de fibrosis pulmonar mostraron que el grupo PCP+Fn1fl/fl presentaba las tinciones de H&E y Masson más intensas, y niveles de expresión de Col1A2, Col3A1 y α-SMA significativamente superiores, que eran inferiores en el grupo PCP+SPC-Cre:Fn1fl/fl.
ConclusionesLa infección por P. carinii puede promover la expresión de Fn1, lo que causa fibrosis pulmonar con respuesta inflamatoria.