Algunos tratamientos empleados para tratar el cáncer y enfermedades hematológicas poseen efectos secundarios gonadotóxicos que pueden producir infertilidad. Por lo tanto, la criopreservación de esperma se ofrece rutinariamente a los pacientes como estrategia para preservar su fertilidad. Sin embargo, existen muchos casos en los que el banco de esperma no es una estrategia aplicable, como es el caso de pacientes prepúberes y otros incapaces de producir gametos maduros en el momento del diagnóstico. En relación con ello, recientes avances han llamado la atención de la sociedad sobre las opciones de preservación de la fertilidad que la Medicina Regenerativa puede ofrecer a estos pacientes. En esta revisión, tratamos de compilar y discutir los últimos avances en estas estrategias alternativas desde un punto de vista crítico.
Some treatments for any cancer therapy and hematological diseases may have gonadotoxic side effects that can result in infertility, and thus sperm cryopreservation is routinely offered to patients as the strategy to preserve their fertility. However, there are many cases where sperm banking cannot be applied, as is the case of pre-pubertal cancer patients and others unable to produce mature gametes at the moment of diagnosis. Regarding this, recent breakthroughs have gained public attention to the fertility preservation options that Regenerative Medicine can offer to these patients. In this review, we tried to compile and discuss the latest updates about all these strategies from a critical point of view.
Importantes avances en los últimos años en los tratamientos contra el cáncer han conseguido mejorar las tasas de supervivencia en cáncer infantil por encima del 80%1,2. Sin embargo, la quimioterapia y la radioterapia comúnmente empleadas para combatir las células neoplásicas, o para destruir la médula ósea en pacientes con enfermedades hematológicas de cara a un trasplante de progenitores hematopoyéticos, suelen tener efectos secundarios a largo plazo, entre los cuales destaca su efecto gonadotóxico que puede provocar infertilidad. Siendo la calidad de vida de los pacientes una cuestión importante a tener en cuenta, incluidas sus opciones reproductivas y de planificación familiar, la crioconservación de gametos y embriones son las estrategias de preservación de la fertilidad que generalmente son ofrecidas a los pacientes antes de comenzar un tratamiento potencialmente gonadotóxico.
Sin embargo, estas estrategias no son posibles cuando los pacientes no pueden producir sus propios gametos, como es el caso de los pacientes prepúberes. Para estos pacientes, entre las diferentes estrategias que se están desarrollando actualmente, las aplicaciones derivadas del uso de células madre espermatogoniales (SSC, del inglés Spermatogonial Stem Cell)3 como fuente de gametos maduros funcionales han progresado de manera importante, y su traslación a la clínica puede ocurrir en los próximos años.
En esta revisión, destacaremos y discutiremos los avances más recientes con respecto a la preservación de la fertilidad en niños prepúberes, destacando sus ventajas e inconvenientes, así como algunas cuestiones que deben ser resueltas antes de su implantación clínica.
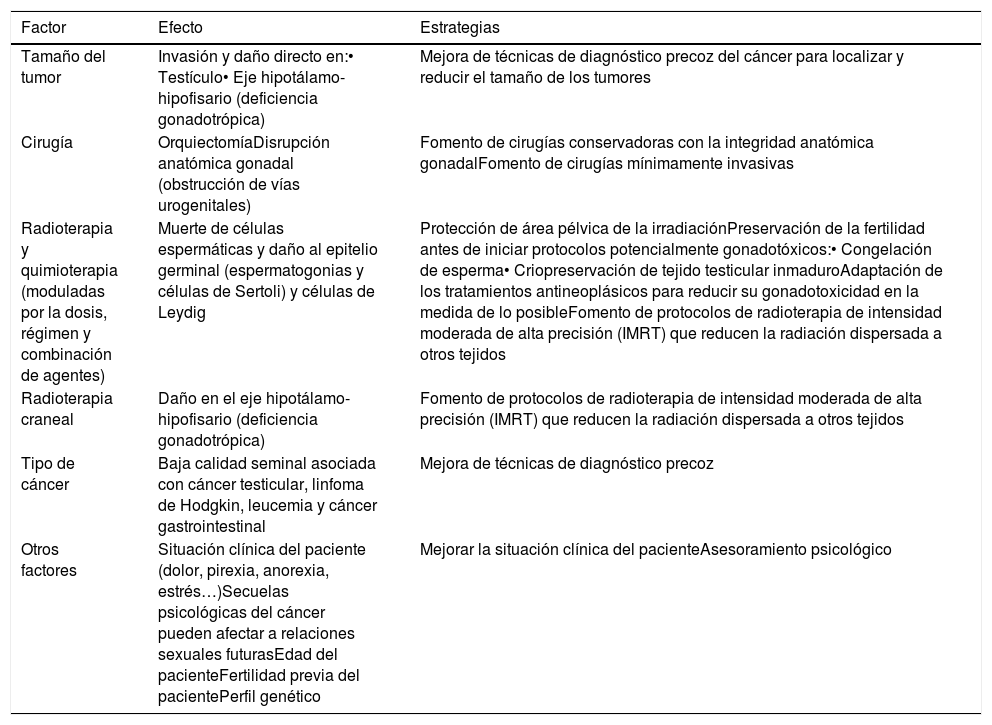
Riesgo gonadotóxico y criterios de selección de pacientes que podrían beneficiarse de la preservación de fertilidadLos efectos adversos de las terapias antineoplásicas en los órganos reproductivos son el resultado del daño de la cirugía o la radioterapia en el eje hipotalámico-pituitario-gonadal, o el daño a las gónadas por parte de la quimioterapia y la radioterapia. Así, aunque la administración exógena de gonadotropinas puede restaurar la deficiencia de gonadotropinas causada por el daño al eje hipotalámico-hipofisario-gonadal, el daño en las gónadas puede perjudicar el desarrollo puberal, produciendo insuficiencia hormonal, disfunción sexual y problemas de fertilidad4. En los hombres, la espermatogénesis es especialmente sensible a los efectos dañinos de los agentes alquilantes, siendo los diagnósticos de oligozoospermia o azoospermia comunes en pacientes con cáncer5. En la tabla 1 se resumen los principales factores que afectan el resultado reproductivo de los pacientes con cáncer y las estrategias biotecnológicas destinadas a mejorarlo.
Factores que afectan al pronóstico reproductivo de los pacientes y estrategias para mejorarlo
| Factor | Efecto | Estrategias |
|---|---|---|
| Tamaño del tumor | Invasión y daño directo en:• Testículo• Eje hipotálamo-hipofisario (deficiencia gonadotrópica) | Mejora de técnicas de diagnóstico precoz del cáncer para localizar y reducir el tamaño de los tumores |
| Cirugía | OrquiectomíaDisrupción anatómica gonadal (obstrucción de vías urogenitales) | Fomento de cirugías conservadoras con la integridad anatómica gonadalFomento de cirugías mínimamente invasivas |
| Radioterapia y quimioterapia (moduladas por la dosis, régimen y combinación de agentes) | Muerte de células espermáticas y daño al epitelio germinal (espermatogonias y células de Sertoli) y células de Leydig | Protección de área pélvica de la irradiaciónPreservación de la fertilidad antes de iniciar protocolos potencialmente gonadotóxicos:• Congelación de esperma• Criopreservación de tejido testicular inmaduroAdaptación de los tratamientos antineoplásicos para reducir su gonadotoxicidad en la medida de lo posibleFomento de protocolos de radioterapia de intensidad moderada de alta precisión (IMRT) que reducen la radiación dispersada a otros tejidos |
| Radioterapia craneal | Daño en el eje hipotálamo-hipofisario (deficiencia gonadotrópica) | Fomento de protocolos de radioterapia de intensidad moderada de alta precisión (IMRT) que reducen la radiación dispersada a otros tejidos |
| Tipo de cáncer | Baja calidad seminal asociada con cáncer testicular, linfoma de Hodgkin, leucemia y cáncer gastrointestinal | Mejora de técnicas de diagnóstico precoz |
| Otros factores | Situación clínica del paciente (dolor, pirexia, anorexia, estrés…)Secuelas psicológicas del cáncer pueden afectar a relaciones sexuales futurasEdad del pacienteFertilidad previa del pacientePerfil genético | Mejorar la situación clínica del pacienteAsesoramiento psicológico |
Es importante destacar que la combinación precisa de fármacos quimioterapéuticos y la frecuencia y duración de su administración son factores clave que pueden determinar sus efectos gonadotóxicos, dificultando en gran medida un pronóstico reproductivo a largo plazo. Teniendo esto en cuenta, como medida de precaución y siempre que no implique un retraso significativo en términos clínicos en el inicio del tratamiento, la congelación de esperma debe ser aconsejada a todos los pacientes que vayan a ser sometidos a tratamientos potencialmente gonadotóxicos. Con respecto a esto, las tablas 2 y 3 resumen los principales datos publicados sobre el riesgo gonadotóxico de distintos agentes en hombres.
Riesgo estimado de infertilidad según los agentes quimioterapéuticos administrados
| Riesgo | Agentes |
|---|---|
| Alto• Riesgo de azoospermia de larga duración>80% | Ciclofosfamida>19g/m2Busulfán>600mg/m2Melfalán>140mg/m2Procarbazina 4g/m2Ifosfamida>52g/m2Cisplatino>600mg/m2Clorambucilo 1,4g/m2Carmustina 1g/m2Lomustina 500mg/m2a |
| Intermedio• 20-80% de riesgo de azoospermia de larga duración• Gonadotoxicidad transitoria• Azoospermia de larga duración aumenta si se combinan con otros agentes | Tiotepa 400mg/m2Doxorubicina>770mg/m2Cisplatino 400-600mg/m2Carboplatino>2g/m2Ciclofosfamida 7,5-19g/m2Ifosfamida 42-52g/m2 |
| Bajo• Riesgo de azoospermia de larga duración<20%• Disminución temporal de recuentos espermáticos por afectación de las espermatogonias en diferenciación | Citarabina NDBleomicina NDActinomicina D NDVincristina NDVinblastina NDMetotrexato ND6-Mercaptopurina ND5-Fluoracilo NDEtopósido ND |
ND: dosis no estimada.
a Si el tratamiento es antes de la pubertad.
Tabla adaptada y modificada a partir de las referencias4,38-44.
Riesgo estimado de infertilidad según la dosis de radioterapia administrada
| Riesgo | Comentarios |
|---|---|
| Alto• Irradiación corporal total previa a trasplante de progenitores hematopoyéticos• Irradiación testicular:>2,5Gy en adultos≥6Gy en prepúberes• Irradiación pélvica u abdominal total | Los efectos de la radiación en el epitelio seminífero afectan especialmente a las espermatogonias y sus efectos son dosis-dependientes:• <1Gy: Azoospermia prolongada/oligozoospermia (daño reversible con el tiempo).• >4Gy: Infertilidad permanente (daño irreversible).• 30Gy: Daño en células de células de Leydig en adultos. Dosis>20Gy se asocian con daño en células de Leydig en niños |
| Intermedio• Irradiación cráneo-espinal≥25-30Gy• Irradiación testicular de 1-6Gy dispersada de protocolos de irradiación abdominal o pélvica |
Tabla adaptada y modificada a partir de las referencias12,38,45-47.
Sin embargo, los criterios de selección de pacientes para técnicas de preservación de la fertilidad más agresivas o experimentales es un desafío para los médicos6,7, siendo el buen pronóstico clínico y el propósito curativo (no paliativo) del tratamiento los indicadores más realistas a la hora de seleccionar pacientes potencialmente beneficiarios de estas técnicas.
El banco de esperma como estrategia de referencia para la preservación de la fertilidad en los varonesLa criopreservación de espermatozoides es un método bien establecido y efectivo que se realiza rutinariamente en los centros de fertilidad desde que se logró por primera vez el primer embarazo humano exitoso con esperma congelado/descongelado en 19538. El almacenamiento de esperma en nitrógeno líquido a −196°C es una estrategia fácil, de bajo coste y efectiva para la preservación de la fertilidad, con tasas de éxito de fecundación que oscilan entre el 60 y 93%9. Además, es una técnica exitosa para la criopreservación a largo plazo, como demuestran los nacimientos a partir de esperma congelado por más de 40 años10. En base a esto, la crioconservación de espermatozoides obtenidos mediante eyaculado antes del inicio de un tratamiento potencialmente gonadotóxico es actualmente la estrategia de referencia para la preservación de la fertilidad en pacientes varones cuyo tratamiento implique riesgo gonadotóxico. Alternativamente, también es una técnica viable para criopreservar esperma obtenido mediante aspiración del epidídimo o biopsia de testículo en aquellos pacientes que sean incapaces de eyacular por causas físicas (azoospermia obstructiva) o psicológicas (estrés, inhibición psicógena…)11.
Sin embargo, la criopreservación de esperma no es una opción viable para pacientes prepúberes, incapaces de producir esperma en el momento del diagnóstico antes de iniciar cualquier tratamiento potencialmente gonadotóxico. Además, en el caso de pacientes adultos, la fiebre, el hipermetabolismo y alteraciones nutricionales comúnmente asociadas al cáncer en sí pueden afectar negativamente a la producción de esperma. Estas complicaciones, unidas al hecho de que la enfermedad en sí también puede alterar indirectamente la espermatogénesis por endocrinopatías en el caso del linfoma de Hodgkin12, dan lugar a que en muchos casos los pacientes no puedan producir una muestra de semen válida para congelar antes del inicio de su terapia antineoplásica.
La criopreservación del tejido testicular inmaduro como estrategia para preservar la fertilidad de pacientes prepúberesLas SSC son las células madre residentes en los testículos de los mamíferos, responsables del inicio y mantenimiento de la espermatogénesis durante la edad adulta. La población de SSC está compuesta por un subconjunto de espermatogonias localizadas en la lámina basal de los túbulos seminíferos desde el nacimiento13. Las SSC se describieron por primera vez utilizando un modelo de trasplante de células germinales murinas, y se definieron como «la subpoblación de SSC con la capacidad de colonizar el epitelio seminífero y reconstituir por completo la espermatogénesis»14.
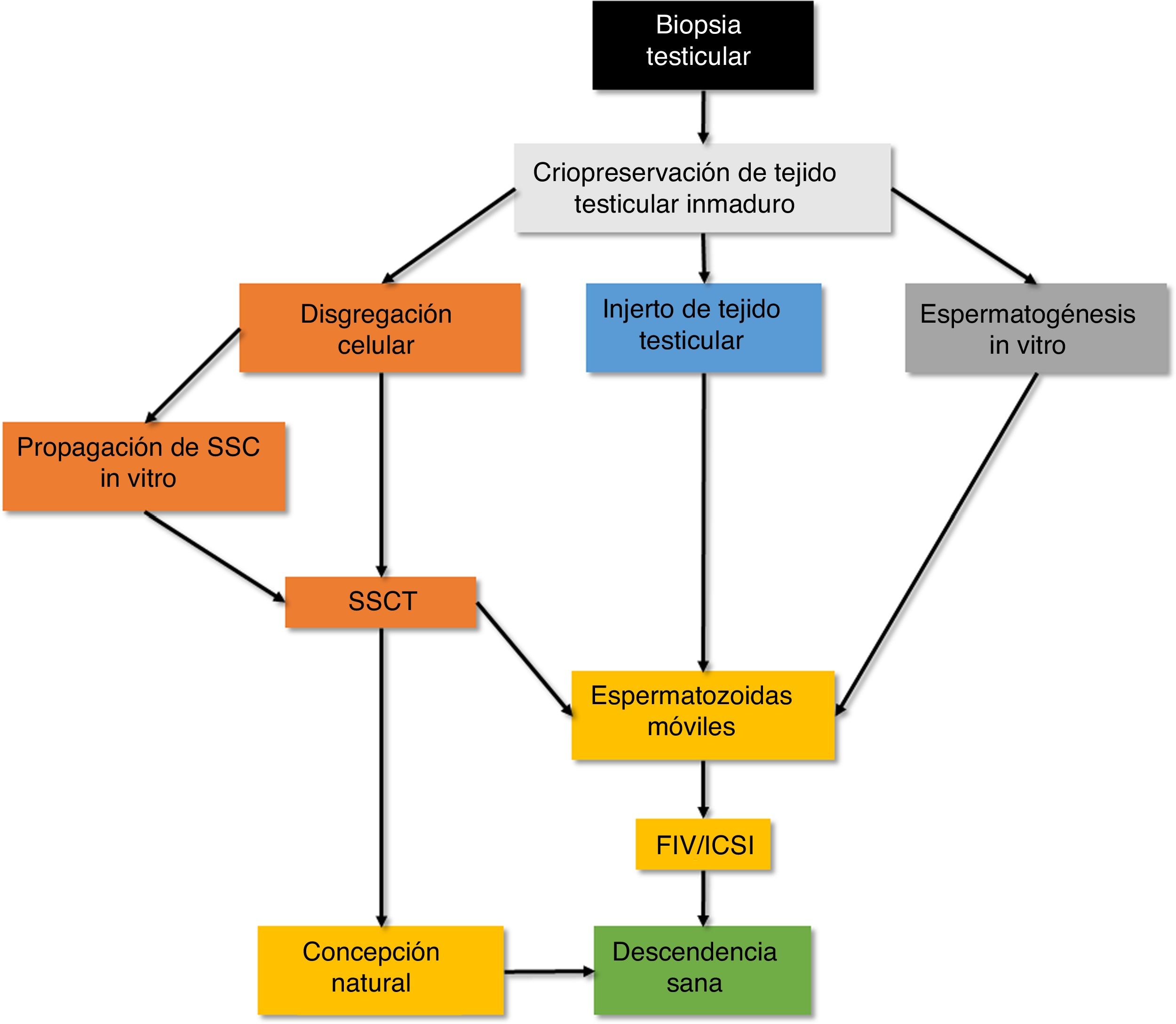
Debido a su potencial para restaurar la espermatogénesis al completo, existe un gran interés en el estudio y uso de las SSC como una herramienta para la restauración de la fertilidad (fig. 1). Específicamente, los pacientes que no pueden generar esperma para ser congelado antes del inicio de un tratamiento gonadotóxico, como puede ser el caso de los niños prepúberes, son beneficiarios potenciales del uso de esta técnica para restaurar su fertilidad. De hecho, según datos del Oncofertility Consortium de la Northwestern University, actualmente hay al menos 16 centros hospitalarios en todo el mundo, 8 de ellos en Europa, que ofrecen la criopreservación de tejido testicular inmaduro obtenido mediante biopsia de manera experimental a pacientes oncológicos prepúberes en riesgo de azoospermia permanente como consecuencia de su tratamiento gonadotóxico15.
Diagrama esquemático de las estrategias en desarrollo para restaurar la fertilidad a partir de tejido testicular inmaduro. FIV: fecundación in vitro; ICSI: inyección intracitoplásmica de espermatozoides; SSC: Spermatogonial Stem Cell (células madre espermatogoniales); SSCT: Spermatogonial Stem Cell Transplantation (trasplante de células madre espermatogoniales).
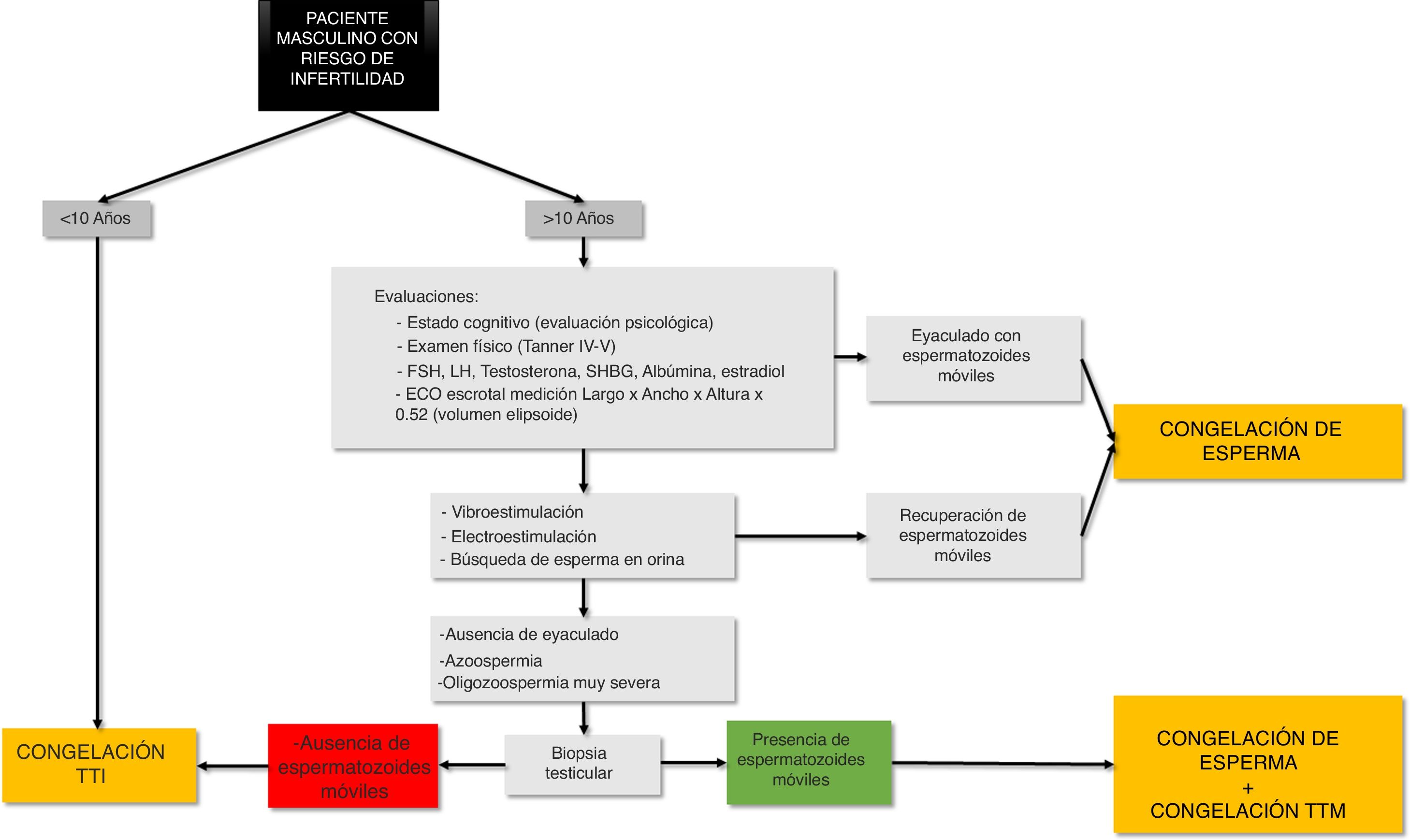
Basándose en que en hasta en un 50% de pacientes con un Tanner II-III para el vello púbico es posible encontrar espermatozoides móviles16, y teniendo en cuenta el carácter experimental de la criopreservación de tejido testicular inmaduro como técnica para preservar la fertilidad en humanos, es conveniente la completa evaluación física y psicológica desde un punto de vista madurativo de los pacientes, con el fin de categorizarlos como prepúberes o púberes y así priorizar en todo momento la congelación de esperma en aquellos pacientes en los que haya indicios clínicos de la posibilidad de encontrar espermatozoides móviles en orina, tras vibro/electroestimulación o intratesticularmente3. Además, en el caso de los pacientes pediátricos, se debe prestar especial atención a los desafíos prácticos y éticos para los pacientes y sus familias. En este contexto, es muy conveniente una estrecha coordinación entre los equipos oncológicos, quirúrgicos y urológicos para extraer el tejido testicular al mismo tiempo que otros procedimientos quirúrgicos ya programados (toma de una vía central venosa o cirugía terapéutica) para reducir el estrés en los pacientes y evitar intervenciones adicionales innecesarias6. En base a todo esto, la fig. 2 esquematiza el esquema de actuación seguido en el servicio de reproducción de nuestro hospital para preservar la fertilidad en pacientes pediátricos (fig. 2).
Estrategias basadas en el uso de tejido testicular inmaduro para restaurar la fertilidadEntre las estrategias diseñadas para restaurar la espermatogénesis en pacientes azoospérmicos basadas en el uso de tejido testicular inmaduro (fig. 1), el trasplante de SSC (SSCT) es probablemente el enfoque más prometedor17. En el modelo murino, el trasplante de suspensiones celulares testiculares en la luz del epitelio seminífero de ratones hospedadores tratados con busulfán resulta en su colonización y restablecimiento completo de la espermatogénesis, produciendo espermatozoides capaces de dar lugar a descendencia sana14. Además, esta técnica se ha aplicado a otros modelos animales, incluidos primates no humanos, con resultados exitosos y produciendo espermatozoides capaces de fecundar ovocitos, incluso con tejido crioconservado durante años18. Sin embargo, a pesar de los resultados alentadores en modelos animales, existen problemas importantes que resolver antes de la aplicación de la técnica en humanos. El SSCT de células espermatogoniales humanas en testículos de ratón da como resultado la colonización del epitelio seminífero, pero la maduración de las SSC queda bloqueada debido a la distancia filogenética entre las especies19. Por lo tanto, existe la necesidad de modelos apropiados para la restauración espermatogénica en humanos más allá de los ensayos técnicos realizados en testículos humanos cadavéricos que demuestran la viabilidad de la técnica20. Además, la eficiencia de colonización relativamente baja de las SSC, combinada con el tamaño limitado de las biopsias testiculares prepúberes, puede comprometer el éxito de la técnica. Por lo tanto, la propagación in vitro de SSC para aumentar su número es un paso necesario antes de realizar SSCT en humanos. Sin embargo, aunque la propagación in vitro a largo plazo de SSC de ratón ha sido reportada y replicada por varios grupos mediante la suplementación de Glial Cell line Derived Neurotrophic Factor (GDNF) como el principal efector para promover su autorrenovación21, la propagación in vitro de las SSC humanas usando el mismo enfoque22,23 ha sido difícil de replicar, dando lugar a una limitada capacidad de mantener las SSC humanas in vitro con baja tasa de propagación24. Además, teniendo en cuenta que alrededor del 21% de las leucemias pueden presentar infiltración testicular de células malignas, existe el riesgo de reintroducirlas en futuros SSCT. Por lo tanto, con la ausencia de marcadores específicos para aislar poblaciones SSC puras de muestras testiculares humanas21,25,26, la propagación in vitro de SSC puede ser una estrategia útil para enriquecerlas al mismo tiempo que elimina la presencia de células malignas contaminantes que podrían estar presentes en la biopsia testicular.
Una prometedora estrategia alternativa para restaurar la espermatogénesis es el injerto de tejido testicular. Originalmente, este enfoque consistía en el injerto de pequeñas piezas de tejido testicular prepúber bajo la piel de ratones hospedadores castrados. De este modo, los animales hospedadores actúan como biorreactores que activan la espermatogénesis del tejido injertado, manteniendo la arquitectura y las interacciones celulares dentro del tejido testicular y resultando en la producción de espermatozoides que pueden recuperarse para aplicaciones posteriores de fecundación in vitro o inyección intracitoplásmica (ICSI, del inglés Intracytoplasmic Sperm Injection)27. Como ocurre con el SSCT, esta técnica ha demostrado su viabilidad dando lugar a descendencia sana en varias especies animales, incluidos primates no humanos28. Sin embargo, los xenoinjertos testiculares de otras especies como el cerdo, la cabra y humanos en ratones hospedadores muestran una supervivencia limitada de los tejidos injertados y fibrosis probablemente debido a la isquemia causada por una vascularización insuficiente. Por lo tanto, aunque los datos indican que los injertos de tejido prepúber muestran una mejor resistencia a la isquemia debido a su naturaleza quiescente, nunca se ha observado una maduración del tejido injertado más allá del estadio de espermatocito29. Con el fin de prevenir la isquemia del tejido injertado, la suplementación de los injertos con factor de crecimiento endotelial vascular, así como la realización del injerto a nivel intratesticular intentando imitar el entorno natural del tejido, pueden mejorar la tasa de éxito de la técnica de xenoinjerto.
La espermatogénesis in vitro es un tercer enfoque que ha ganado interés en los últimos años. A pesar del logro de una reciente publicación que describe la producción in vitro de espermátidas humanas haploides capaces de fecundar ovocitos de ratón a partir de SSC obtenidas de pacientes con criptorquidia, mediante el tratamiento de los cultivos con factor de células madre y ácido retinoico30, debido a la compleja estructura tridimensional de la espermatogénesis, las estrategias más eficientes para lograr la producción de esperma a partir de SSC de ratón comprenden cocultivos tridimensionales de células germinales inmaduras y células somáticas31. Además, el uso de andamiajes citocompatibles de tejido testicular humano descelularizado puede ser un enfoque interesante para evaluar el potencial de las SSC humanas para madurar in vitro dentro de un nicho que imita la matriz extracelular donde lo hacen in vivo32. Sin embargo, ha sido un cultivo organotípico de tejido testicular, manteniendo las interacciones celulares y la integridad del tejido, el único modelo que ha permitido hoy en día la maduración completa de los espermatozoides funcionales capaces de ser utilizados en ICSI33,34. En su trabajo, los autores usaron fragmentos testiculares de ratones recién nacidos que expresaban de GFP bajo el control de los marcadores posmeióticos Gsg2 (Haspin) y Acrosina, y los cultivaron a 34°C en una interfase líquido-gas sobre balsas de agarosa empapadas en un medio suplementado con KOS (KnockOut Serum replacement). Después de 3 semanas de cultivo, se pudieron recuperar espermatozoides GFP, que se usaron para ICSI y dieron lugar a descendencia sana. Sin embargo, aunque esta técnica ha sido replicada en publicaciones posteriores en el modelo de ratón35,36, los datos sobre la viabilidad de esta técnica con tejido humano indican un bloqueo en la maduración de las espermatogonias, acompañado de una pérdida progresiva de células germinales a lo largo del tiempo in vitro37.
ConclusionesA pesar del éxito de la criopreservación de esperma para preservar la fertilidad masculina en el día a día clínico, esta técnica no es viable para los pacientes prepúberes que no pueden producir gametos funcionales en el momento del diagnóstico. En estos casos, la criopreservación de tejido testicular inmaduro puede ser una estrategia alternativa. Sin embargo, el uso de tejido testicular preservado para restaurar la fertilidad todavía se considera experimental, ya que nunca se ha demostrado su efectividad en humanos, poniendo de manifiesto la necesidad de fomentar la investigación con modelos humanos. Por tanto, la investigación actual se está orientando a optimizar los protocolos de propagación in vitro de SSC con el fin de obtener un número suficiente de SSC que permitan mejorar las tasas de éxito de SSCT, así como en la búsqueda de estrategias que mejoren la supervivencia del tejido testicular en modelos de xenoinjerto. Del mismo modo, la optimización de protocolos de espermatogénesis in vitro con tejido humano puede ser una importante alternativa que permita producir espermatozoides funcionales evitando el riesgo de reintroducción de células malignas.
Con una experiencia de más de 15 años criopreservando biopsias testiculares inmaduras de pacientes prepúberes, parece una cuestión de tiempo que comiencen a aparecer los primeros ensayos para la restauración de la fertilidad en hombres azoospérmicos. Sin embargo, a pesar del éxito de las diferentes técnicas aquí descritas para la restauración de la espermatogénesis en modelos animales, todavía hay problemas importantes que resolver antes de la aplicación de las SSC como terapia celular clínica en los próximos años, haciendo de esta posibilidad un procedimiento experimental que debería ofrecerse únicamente a pacientes con buen pronóstico, alto riesgo gonadotóxico, e incapaces de producir esperma en el momento del diagnóstico (determinando su ausencia tanto en eyaculado si lo hubiera, como en la orina y en la biopsia misma) (fig. 2).
Como conclusión, por primera vez en la historia reciente, la promesa de la Medicina Regenerativa como una herramienta para tratar todo tipo de enfermedades, incluidas las enfermedades reproductivas, puede no estar tan lejos de cumplirse.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo ha sido financiado por una donación privada de la peña Celtic Submarí-Villarreal C.F. al Hospital Universitario y Politécnico La Fe destinada a promover la investigación científica sobre la preservación de la fertilidad en niños con cáncer, y por un proyecto AES (PI16/00931) concedido por el Instituto de Salud Carlos III.
Conflicto de interesesLos autores no tienen ningún conflicto de intereses que declarar.