¿ Introducción
La retinopatía diabética (RD) es la principal causa de pérdida visual no recuperable en los países industrializados, prevaleciendo en pacientes entre los 20 y 64 años de edad, siendo responsable de 10% de nuevos casos de ceguera cada año. En los Estados Unidos de Norteamérica, la RD es causa de ceguera en aproximadamente 6% de su población.1 El riesgo de ceguera en pacientes diabéticos es aproximadamente 25 veces mayor al resto de la población.2 En un estudio de prevalencia de RD en diabéticos adultos mayores de 40 años de edad, en casi 10.2 millones se encontró 40.3% de RD con afección en la visión, aproximadamente 4.1 millones, uno de cada 12 diabéticos en este grupo de edad tienen RD en grado avanzado.3 En un estudio en Guanajuato, México con una cohorte de 100 diabéticos adultos tipo 2 en población abierta, se hizo un seguimiento durante 12 años. La incidencia y progresión de la RD proliferativa fueron de 14.3% y 32% respectivamente. La media de glucemia fue 193 mg/dL y de la hemoglobina glucosilada 11%. Falleció el 45%, la mitad por infarto agudo del miocardio.4 En otro estudio de población abierta, de 1840 pacientes diabéticos tipo 2, 309 tenían RD (17%); de ellos, 91% tenían RD en fase no proliferativa y 9% en fase proliferativa, sin embargo el edema macular fue en 11%.5
En un estudio de una población inglesa la RD se presentó en el 53% de diabéticos con pérdida significativa de la visión en el 22%, teniendo como factor de riesgo la hipertensión arterial.6
Dentro de los mejores estudios sobre epidemiología de la RD es el Wisconsin Epidemiology Study of Diabetic Retinopathy,7,8 es un estudio epidemiológico con un seguimiento a cuatro, 10 y 14 años que ha permitido conocer la historia natural de la RD y su relación con diferentes factores sistémicos. Sus principales hallazgos son: el evidenciar que la RD severa es muy rara en los cinco primeros años de diagnóstico, que el riesgo de progresión de la RD a una forma severa aumenta con la duración de la enfermedad y que los pacientes con cifras altas de HbA1c o con microalbuminuria tienen un riesgo tres veces mayor de presentar RD a corto plazo.
En Europa, el United Kingdom Prospective Diabetes Study (UKPDS), un estudio de cohortes de pacientes con DM tipo 2, en los que evalúan el beneficio del tratamiento optimizado con insulina sobre la aparición de complicaciones microvasculares no sólo a nivel ocular sino también sobre la nefropatía, la neuropatía y la enfermedad cardiovascular. Sus principales hallazgos fueron el observar cómo el control optimizado de la glucemia (HbA1c < 7%) se traducía en una disminución del riesgo de progresión de la RD, de la necesidad de fotocoagulación láser, de hemorragia vítrea y de cirugía de catarata. También demostró que el control de la HTA y la hiperlipemia hacía disminuir la aparición y progresión del edema macular.,9
En un estudio prospectivo aleatorizado, el Trial the Diabetes Control and Complications (TDCC) sobre dos cohortes de pacientes diabéticos tipo 1, una sin RD y otra con RD leve-moderada, en los que se investigó el efecto de la terapia intensiva con insulina sobre la aparición de RD y la progresión de la RD en el otro grupo. Sus principales conclusiones son que el tratamiento optimizado con insulina es beneficioso con cualquier tiempo o grado de evolución de la enfermedad, si bien su beneficio es mayor cuanto antes se instaura, que la terapia intensiva disminuye significativamente la incidencia de nuevos casos de RD y la progresión de la RD a forma severas y proliferantes, así como de edema macular.10
¿ Factores de riesgo
El tiempo de evolución de la diabetes y el tipo de diabetes. De forma que 98% de los diabéticos tipo 1 y el 60% de los tipo 2, sufren RD en algunos de sus grados después de 20 años de evolución de su enfermedad.
El deficiente control glucémico, habiéndose demostrado que el tratamiento optimizado de las cifra de Hba1c retrasa la aparición y progresión de la RD en ambos tipos de DM.
El control de la hipertensión arterial, de la hiperlipemia y de la anemia asociadas a la diabetes disminuyen la aparición y progresión de la RD en especial en su forma de edema macular.
Existen cambios hormonales asociados como la pubertad y el embarazo que pueden acelerar la aparición de la RD. Se puede considerar que existen factores genéticos investigados y relacionados con el desarrollo y progresión de la RD. Así los pacientes con HLA-DR4 tienen una mayor prevalencia de retinopatía proliferativa.
La aparición de microalbuminuria como marcador de enfermedad microvascular aumenta la probabilidad de desarrollar RD.11,12
Desde el punto de vista ocular existen algunos factores que pueden ser considerados de riesgo para el desarrollo y progresión de RD como son la hipertensión ocular, el antecedente de oclusión venosa retiniana, la presencia de inflamación ocular, traumatismos oculares y el tratamiento con radioterapia. De igual manera existen factores locales que protegen frente al desarrollo de la RD, como la miopía, la atrofia del epitelio pigmentado retiniano o el desprendimiento de vítreo posterior.
Etiopatogenia
Teoría de daño neuronal: En la retina, el metabolismo de la glucosa es la mayoría de las veces por glicólisis y sus metabolitos van del endotelio vascular a través de los astrocitos a las neuronas; mientras que desde el exterior el metabolismo es por fosforilación oxidativa y los metabolitos de la glucosa llegan a las células de Müller y a los fotoreceptores desde la coroides por el epitelio pigmentado. De tal manera que las capas internas de la retina son más susceptibles a los cambios hipóxicos que las capas externas que reciben mayor presión de oxígeno. Vías inducidas por el estrés del retículo endoplásmico se relacionan con la muerte neuronal. Una posible relación entre las anormalidades vasculares y las neurológicas pueden ser los cambios en las células gliales en la fase precoz de la RD. La barrera hematoretiniana puede alterarse por los niveles altos de glutamato, lo que puede conducir a la muerte neuronal debido a la alteración en la homeostasis del calcio por sobre-estimulación del glutamato.13
Algunos factores que están implicados con el exceso de glucosa incluyen el estrés oxidativo, la activación de la proteína C quinasa y la activación de los productos finales de la glucosilación y sus receptores.14,15 Los mecanismos de daño vascular son el incremento de la permeabilidad vascular y la leucostasis endotelial. En estudios posmortem, las retinas de los diabéticos muestran un incremento en los marcadores de apoptosis en células ganglionares.
La teoría del daño neuronal en la RD se demuestra en las pruebas funcionales como son las pruebas de discriminación en los colores, los campos visuales y la prueba de sensibilidad de contraste que presentan alteraciones antes que las microvasculares observadas por tomografía óptica coherente (OCT) o por fluorangiografía retiniana
La microglía se activa debido a la alteración de la expresión de los ligandos o receptores, lo cual produce citocinas proinflamatorias, así también la expresión de moléculas de adhesión que promueve la leucocitosis a expensas de monocitos y neutrófilos. La expresión de citocinas (VEGF, IGF-I) está aumentada en la diabetes, cerrando el círculo de hipoxia retiniana con un daño vascular progresivo resultando en edema macular y neovascularización.16
El estrés del retículo endoplásmico en el paciente diabético también participa en la pérdida de los pericitos y la neovascularización. La activación de la HRas, una proteína de bajo peso molecular incrementa la apoptosis del capilar retiniano en condiciones hiperglucémicas.17
En la Tabla 1 se enumeran los principales mecanismos patogénicos propuestos para la RD. La visión en la diabetes se afecta por incremento de la permeabilidad vascular y falta de perfusión capilar con la consecuente disminución de la visión, engrosamiento de la retina, edema macular y exudación de lípidos Además, la disfunción neuronal se manifiesta con disminución a la adaptación en la oscuridad y discromatopsia, que son pruebas funcionales.18
¿ Clasificación de la retinopatía diabética
En la práctica clínica es necesaria una clasificación oftalmoscópica de la RD, fácilmente memorizable y reproducible por oftalmólogos y por todos los demás clínicos que han de tratar pacientes diabéticos. En la actualidad, existe una clasificación elaborada por un grupo multidisciplinario, el Global Diabetic Retinopathy Project Group (GDRPG), cuya publicación en 2003 por la Academia Americana de Oftalmología se ha convertido en el estándar de trabajo para una práctica clínica de calidad. Esta clasificación está basada en el trabajo realizado por el Early Treatment Diabetic Retinopathy Study (EDTRS) por lo que podríamos encontrar publicaciones que trabajan con esta clasificación. La clasificación actual de la retinopatía diabética evalúa de manera separada el edema macular y se divide en los siguientes estadios según ETDRS:
Sin retinopatía: No se observan lesiones características al examen oftalmoscópico (nivel 10 de la EDTRS).
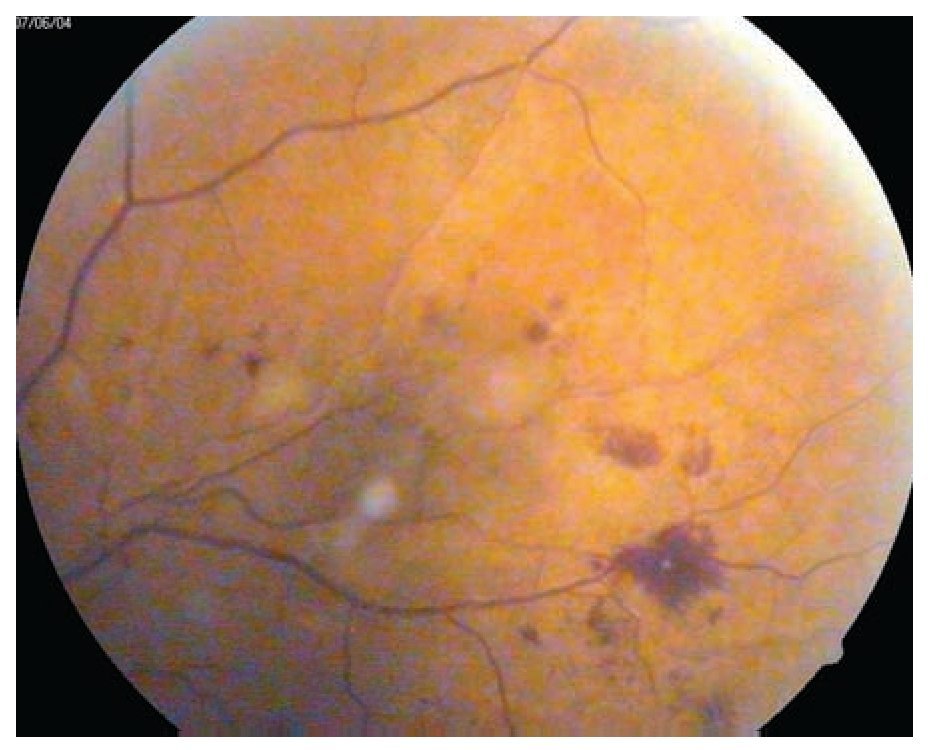
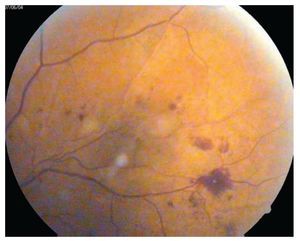
Retinopatía diabética no proliferativa (Figuras 1 y 2): A su vez se divide en leve, moderada, severa y muy severa. Al inicio sólo se encuentran microaneurismas retinianos, se observan como puntos rojos pequeños de bordes muy nítidos (nivel 20 de la EDTRS). Le siguen las hemorragias retinianas en número inferior a 20 en los cuatro cuadrantes. Pueden existir exudados duros o lipídicos y blandos o algodonosos y además dilataciones venosas arrosariadas en un solo cuadrante. Las dilataciones venosas consisten en zonas bien localizadas de dilatación con zonas de estrechez venosa, como cuentas de un rosario. El trayecto venoso se vuelve tortuoso y en ocasiones parece bifurcado (niveles 35 y 43) con probabilidad de progresión a RD proliferativa.
¿ Figura 1. Retinopatía diabética no proliferativa con hemorragias y exudados.
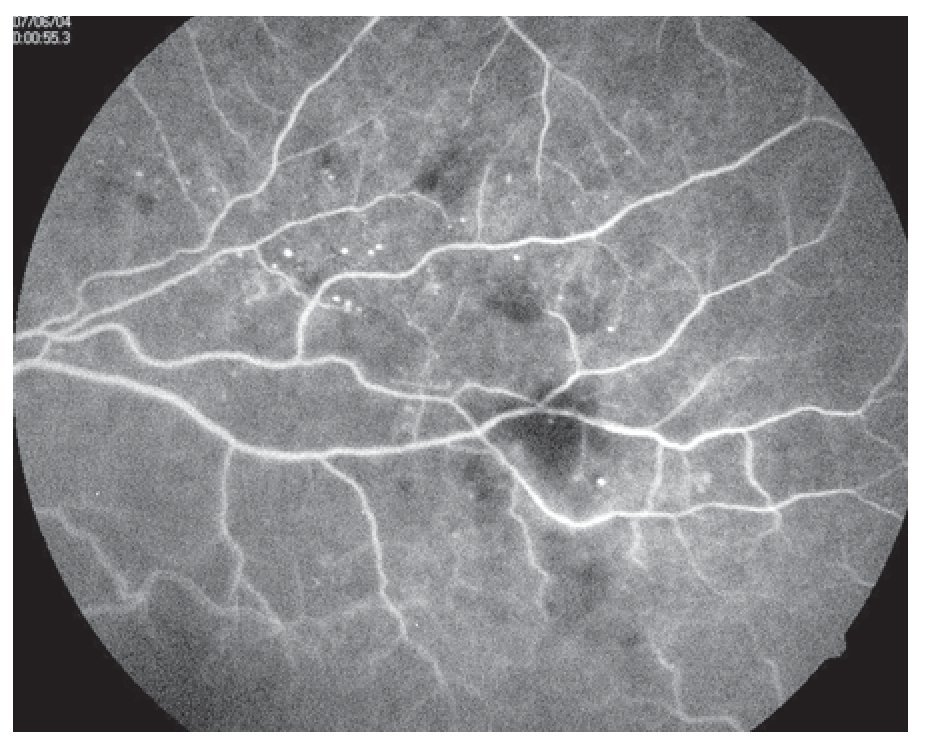
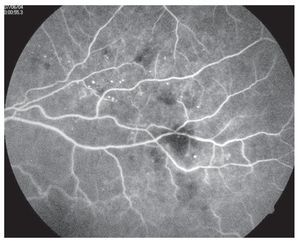
¿ Figura 2. Retinopatía diabética no proliferativa con fluorangiografía, las hemorragias son defectos en pantallas y los microaneurismas se notan como puntos brillantes.
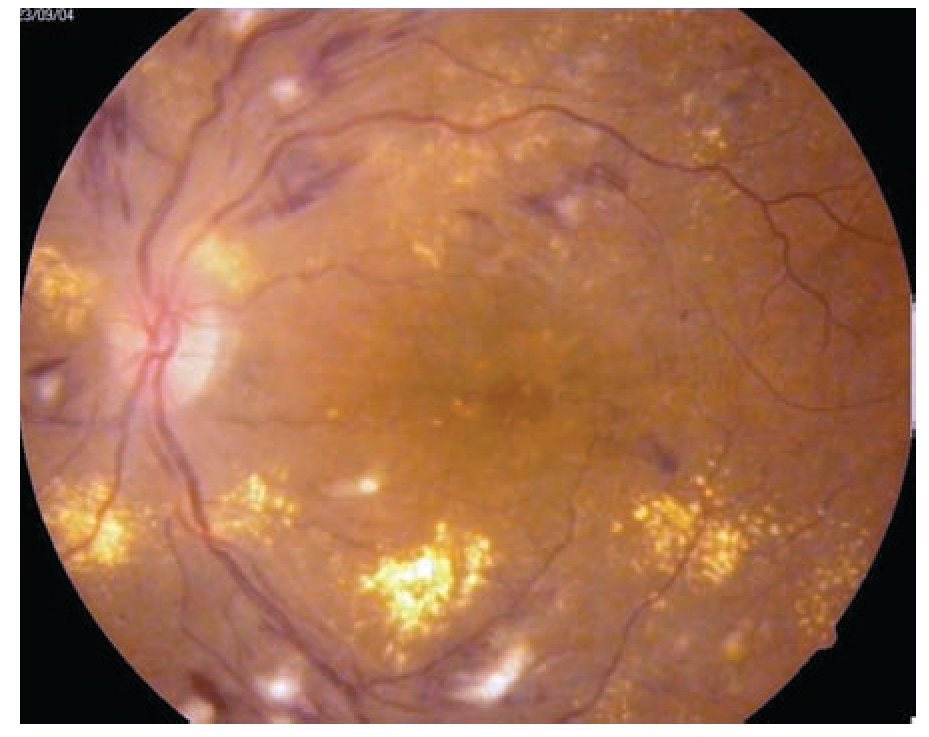
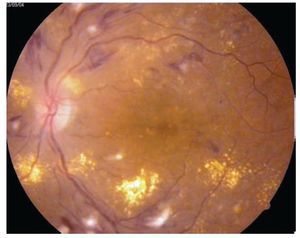
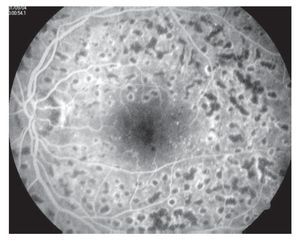
Edema macular clínicamente significativo: Se observa aumento del grosor de la retina en la mácula, (mayor de 250 micras a nivel foveal y perifoveal) puede ser focal, multifocal, difuso, isquémico y cistoide (Figuras 3 y 4).
¿ Figura 3. Retinopatía diabética no proliferativa con edema macular clínicamente significativo.
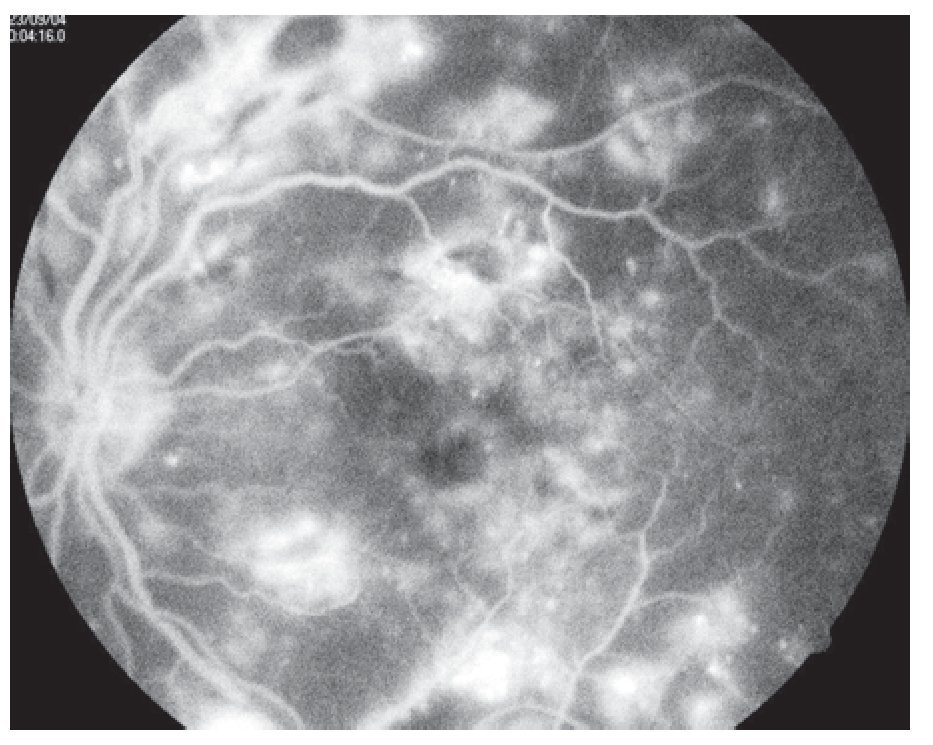
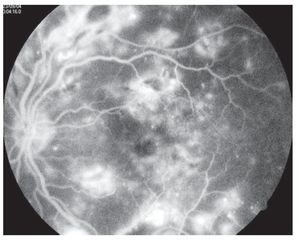
¿ Figura 4. Fluorangiografía de retina con edema macular difuso.
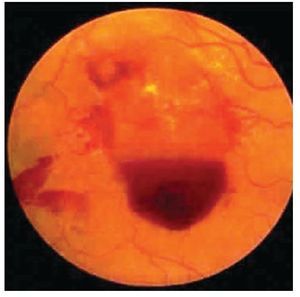
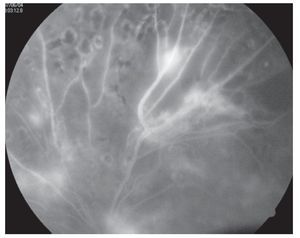
Retinopatía proliferativa: En estricto criterio corresponde a la presencia de vasos de neoformación con bandas por gliosis que terminan con tracción de la retina (Figuras 5 y 6).
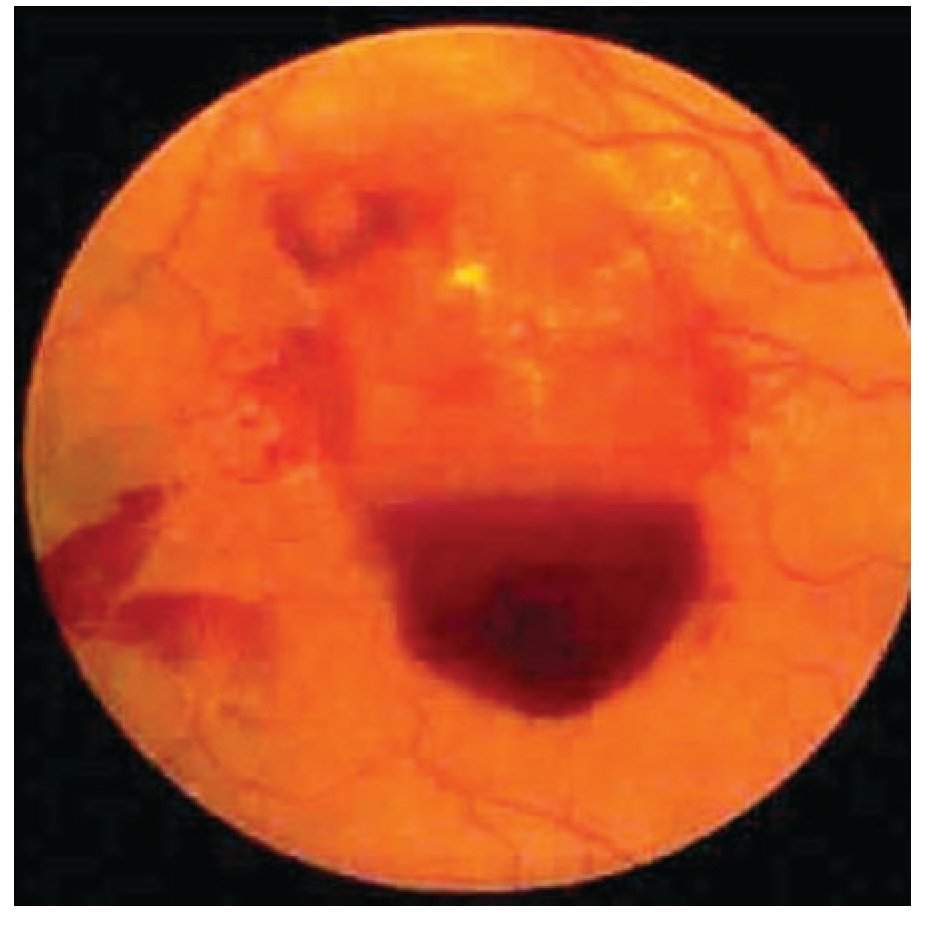
¿ Figura 5. Retinopatía diabética proliferativa con hemorragia subhialoidea.
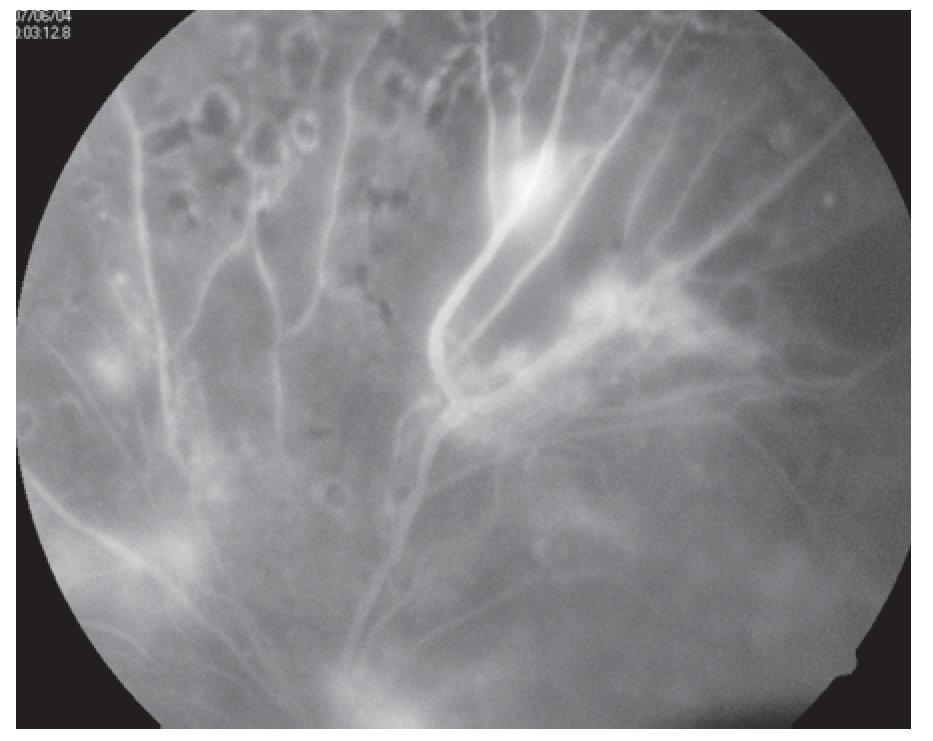
¿ Figura 6. Fluorangiografía de retinopatía diabética con bandas fibrogliales.
¿ Tratamiento
La mejor opción para la retinopatía diabética, es la prevención. Un control adecuado de los niveles de glucosa en sangre y de la hipertensión, una dieta sana, hacer ejercicio y buena educación sanitaria del paciente diabético son los elementos esenciales que pueden prevenir o demorar la aparición de la retinopatía diabética. Los estudios DCCT y el UKPDS2 realizados en pacientes diabéticos tipo 1 y 2, han demostrado claramente la importancia del control glicémico bajo tratamientos intensivos en la prevención y estabilización de la retinopatía diabética.1-19,20
El seguimiento de la glicemia ha de realizarse en base a los niveles de HbA1c por ser un parámetro de la glucemia media en las cuatro a seis últimas semanas. Desde el punto de vista oftalmológico, la prevención secundaria se basará en una detección temprana de la retinopatía y un adecuado seguimiento. De acuerdo a la Academia Americana de Oftalmología la frecuencia de revisiones del fondo de ojo deberá ser al momento del diagnóstico de la DM en los diabéticos tipo 2 y en los tipo 1 después de tres a cinco años de su diagnóstico y la norma será una revisión anual. Cuando se realice tratamiento médico, y en especial si es con insulina, las revisiones oftalmoscópicas se realizarán anualmente. Cuando exista una retinopatía no proliferativa leve o moderada se debe hacer fluorangiografía retiniana (FAG) misma que tiene sus indicaciones en retinopatía diabética las cuales son: guía para establecer el patrón de tratamiento del edema macular clínicamente significativo, evaluar pérdida visual inexplicable, determinar la zonas de no perfusión, diferenciar neovasos de anomalías microvasculares intraretinianas (AMIR). Cuando la severidad es mayor se reforzará la idea de que un control estricto con terapia intensiva con insulina puede frenar una mala evolución de la retinopatía, si bien se planteará ya el tratamiento con láser.21 También el control de la presión sanguínea reduce significativamente la incidencia y progresión de la RD.22
Con base en las guías de la Sociedad Alemana de Diabetes, el seguimiento de los pacientes con diagnóstico de diabetes tipo 1 se iniciará cinco años después del diagnóstico y en el caso de ser niños serán valorados con dilatación de pupila desde los once años de edad. Los portadores de diabetes mellitus tipo 2, deben ser referidos al oftalmólogo para el inicio de su seguimiento desde el momento en que son diagnosticados con este padecimiento. Si la retinopatía está ausente el seguimiento se hace de manera anual, en caso de estar presente la frecuencia de las revisiones será determinada por el oftalmólogo de acuerdo a los hallazgos.21
La fotocoagulación láser es hoy en día el estándar de tratamiento de la retinopatía diabética; recomendándose la aplicación de cerca de 2500 disparos (dividido en sesiones, generalmente tres) a través de la retina para considerarlo un tratamiento adecuado que disminuye hasta en 50% de los casos el riesgo de pérdida severa de la visión, lo cual, con el avance tecnológico, se puede facilitar la aplicación a través de los nuevos modelos de láser como el Pascal que es un láser con una doble frecuencia de 532 nm ND:Yag que es semiautomático permitiendo la aplicación de múltiples disparos para el tratamiento de la retinopatía diabética.23
Existen varios ensayos clínicos prospectivos, multicéntricos y aleatorizados que avalan la eficacia de la fotocoagulación en el tratamiento de la retinopatía diabética y del edema macular diabético.24-26
Si bien hoy en día existen nuevas posibilidades terapéuticas que, solas o combinadas a la fotocoagulación, pueden abrir nuevas perspectivas en el tratamiento de la RD. El Diabetic Retinopathy Study (DRS) es un estudio clínico prospectivo, multicéntrico respaldado por el National Eye Institute, diseñado para descubrir si la panfotocoagulación láser previene la pérdida de agudeza visual severa en RDNP en ambos ojos o RDP en al menos un ojo con visión superior a 20/100. La panfotocoagulación se aplicó en un ojo de manera aleatoria, siendo el contralateral el ojo control. A los 24 meses se evidenció una pérdida severa de visión en 16.3% de los ojos no tratados frente a 6.4% de los ojos tratados, con una diferencia relativa de 61%. El DRS identificó las características que denotaban un alto riesgo de progresión para pérdida visual severa: Neovascularización de la papila óptica (NVD) que incluya 1/3 o más del área de la misma.
Neovascularización del disco asociado a hemorragia vítrea o prerretiniana, neovascularización fuera de la papila óptica (NVE) de por lo menos la mitad del área del disco asociada a hemorragia vítrea. En la retinopatía diabética proliferativa con características de alto riesgo la panfotocoagulación disminuye el riesgo de pérdida visual severa: en ojos no tratados, el riesgo es de 50%, en los tratados, de 20%.27
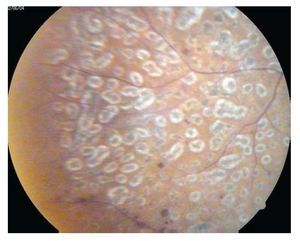
El Early Treatment Diabetic Retinopathy Study (ETDRS) fue diseñado para responder a esta cuestión de determinar el momento más adecuado para realizar el tratamiento láser en la evolución de la RD y para evaluar la eficacia del tratamiento láser en el edema macular diabético. Se realizó un estudio clínico prospectivo, multicéntrico, aleatorizado, en que se realizaba tratamiento en un ojo con RDNP moderada a severa y RDP sin signos de alto riesgo de manera temprana comparando con el otro ojo que se trató de forma diferida cuando presentaba algún signo de alto riesgo. La diferencia a los cinco años de pérdida visual severa de los ojos tratados tempranamente fue significativa con el grupo tratado de manera diferida. Sin embargo, a pesar de conservar la visión también se vieron efectos adversos en estos pacientes tratados tempranamente, como pérdidas de campo visual, progresión de catarata, aumento de la incidencia de edema macular, lo que llevó a dar la recomendación de no tratar las formas moderadas no proliferativas y tratar tempranamente las formas RDNP severas y las proliferativas. La fotocoagulación focal está indicada para pacientes con edema macular clínicamente significativo, reduce el riesgo de pérdida de visión en 50% de los pacientes con RDNP severa. Y aumenta la posibilidad de obtener una pequeña mejoría visual de los pacientes con RDNP severa (el EMCS puede presentarse en cualquier etapa de la RD (Figuras 7 y 8).27
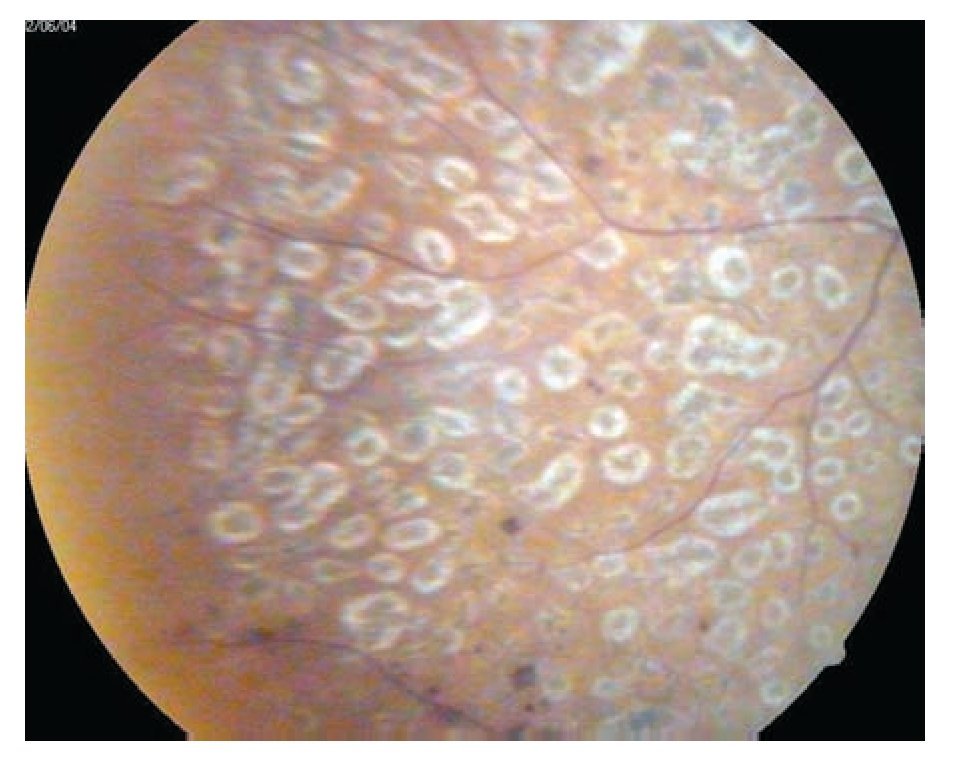
¿ Figura 7. Retina con huellas de fotocoagulación cerrada.
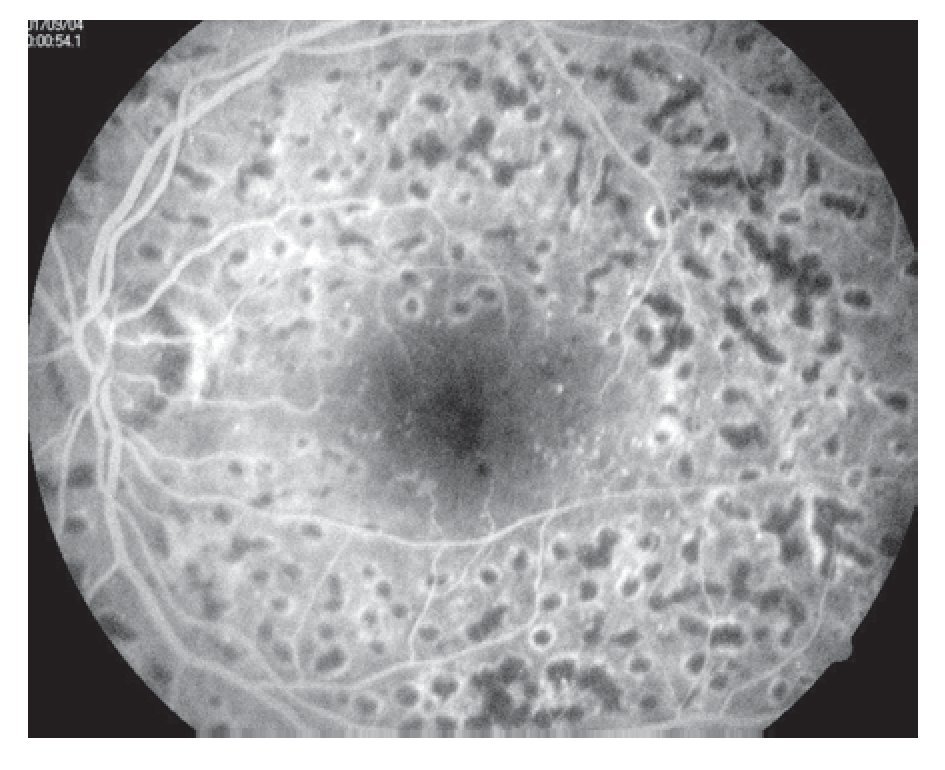
¿ Figura 8. Fluorangiografía retiniana con huellas de fotocoagulación en zona macular (rejilla macular).
Cuando una retinopatía diabética proliferativa presenta hemorragia vítrea que impide el tratamiento láser, se valorará la realización de una vitrectomía con endofotocoagulación láser. Cuando la retinopatía proliferativa sea severa con proliferación fibrovascular que traccione la retina o la mácula, la panfotocoagulación parece aumentar la contracción de la proliferación y por tanto la afectación macular, por lo que está indicada la vitrectomía con la remoción de las membranas y posterior endofotçocoagulación. En resumen la vitrectomía vía pars plana está indicada en aquellos casos en donde existe la presencia de una hemorragia vítrea que no se ha resuelto, hemorragia subhialoidea, glaucoma de células fantasma, desprendimiento traccional de la retina y edema traccional de la macula. También está indicada en el DR mixto, la HV con rubeosis en iris y en el glaucoma de células fantasma. 21,28,29
El Diabetic Retinopathy Vitrectomy Study fue un estudio aleatorizado, realizado sobre pacientes con hemorragia vítrea severa o neovascularización muy grave. Su objetivo fue demostrar los beneficios y riesgos de la vitrectomía en estos pacientes. Básicamente se realizaron tres grupos de pacientes: Grupo N (pacientes con retinopatía proliferativa muy grave), grupo NR (pacientes con retinopatía proliferativa grave con visión útil) y grupo H (pacientes con hemorragia vítrea grave de más de cinco meses de evolución). Los resultados demostraron que en los pacientes con hemorragia vítrea severa la probabilidad de lograr una buena visión era menor en el tratamiento convencional (vitrectomía demorada más de un año, o hasta que se produjera desprendimiento traccional). Los resultados eran especialmente significativos en los pacientes tipo I en los que la probabilidad de mantener visiones superiores a 0.5 a los dos años era de 36% con vitrectomía precoz frente a 12% de los tratados convencionalmente. En los pacientes con retinopatía proliferativa grave con agudeza visual superior a 0.05, mácula aplicada y proliferación extensa y activa, la vitrectomía permite absorber las hemorragias vítreas y un abordaje directo sobre la proliferación fibrovascular retiniana como realizar panfotocoagulación con endoláser e introducir nuevos fármacos para evitar la proliferación y estabilizar la barrera hematorretiniana. Durante el estudio existieron pacientes con complicaciones severas como ptisis bulbi, endoftalmitis, glaucoma neovascular, uveítis y queratopatías en ambos grupos.29
Los factores de crecimiento vascular endotelial aumentan significativamente en el vítreo de pacientes con RDP y disminuyen con la panfotocoagulación, Recientemente el uso de antagonistas de los factores de crecimiento vascular (pegaptanib, bevacizumab, ranibizumab) en inyecciones intravítreas han demostrado que reducen la neovascularización y el edema macular, facilitando la terapia con láser, pero se caracterizan por tener un efecto temporalmente limitado de cuatro a seis semanas es por esto que los inhibidores del VEGF no son inofensivos y se requieren hasta cuatro aplicaciones intravítreas que además de costosas pueden complicarse con desarrollo de catarata, uveítis, desprendimiento de retina y endoftalmitis. Son terapias coadyuvantes a la aplicación del láser, no definitivas dadas las características antes mencionadas.30-32
Las inyecciones intravítreas de acetónido de triamcinolona en un rango de dosis de 4 mg a 25 mg, son también medicamentos con un efecto temporalmente limitado de tres meses en promedio, han sido aplicadas para controlar el edema del diabético, sin embargo comparadas con la fotocoagulación focal de la mácula se han observado mejores resultados con la terapia con láser, además de que las inyecciones produjeron altos porcentajes de glaucoma y catarata secundaria al esteroide.33,34
Otras terapias en estudio: Considerando la degeneración capilar con el consecuente edema macular, el nepafenac (Nevanac®), es un inhibidor de las ciclooxigenasas que en aplicación tópica ocular inhibe la producción de prostaglandinas y la adhesión leucocitaria en vasos retinianos de ratas diabéticas.35 Las terapias que inhiben la permeabilidad capilar son: inhibidores de la aldosa reductasa; esta vía es de especial importancia en la neuropatía, sin embargo también está relacionada con la aparición de retinopatía diabética. Aunque desde el punto de vista teórico los inhibidores de aldosa reductasa como el bimoclomol o ARI-509, podrían constituir una alternativa en el tratamiento de la retinopatía diabética, los efectos obtenidos tras su utilización han dado lugar a controversia. Las elevadas concentraciones de productos metabólicos originados tras la inhibición de la enzima resultan tóxicas y pueden agravar la enfermedad.36,37
Los inhibidores de la proteína C quinasa (PCK) que se encuentran en estudio son: el compuesto natural rottlerin, los indolocarbazoles inhibidores de PCK α, β y γ, así como el bisindolilmaleilmides, que es menos potente que los indolocarbazoles. El LY333531, inhibidor selectivo de la PCK β se encuentra en fase III de ensayos clínicos. Otros fármacos en estudio son el ácido acetilsalicílico, los inhibidores COX-2, esteroides y otros inhibidores del VEGF; uno de los fármacos que se encuentra en estudio es el octreocide, análogo de la somastatina (inhibidor de factores de crecimiento), que ha mostrado buenos resultados en estudios in vitro al disminuir la proliferación del epitelio pigmentado de la retina. De igual forma, se ha comprobado que la administración de este fármaco tras el tratamiento con láser da lugar a una reducción de la hemorragia en el vítreo, conservando la aguda visual.38 Antagonistas de los receptores del TNF-alfa, diferentes antioxidantes (aspirina, sulfazalacina) inhiben la degeneración capilar y la pérdida de pericitos. Como ya se mencionó anteriormente, los inhibidores del VEGF son inyectados en el vítreo para las fases proliferativas y de edema macular.16
La glucosilación o glucación de proteínas da lugar a productos de glucosilación avanzada (AGEs), compuestos que pueden originar enlaces anormales entre moléculas, ocasionando efectos directos sobre proteínas y efectos mediatos a través de receptores específicos. Por estos mecanismos los AGEs participan en la génesis de las complicaciones diabéticas: retinopatía, nefropatía y neuropatía. El principal agente inhibidor de la formación de AGEs es la aminoguanidina, compuesto que ha demostrado ser capaz de retrasar la evolución de las lesiones microvasculares de la retina en animales diabéticos.39
La minociclina es una tetraciclina de segunda generación que ejerce acciones pleitrópicas, incluyendo efectos antiinflamatorios distintos a sus efectos antibacterianos. La minociclina tiene efectos neuroprotectores en animales de laboratorio. Se ha planteado que se debe a que inhibe la activación de las caspasas 1 y 3, y a la inhibición de la generación de IL-1beta y del óxido nítrico. Otro efecto de la minociclina es sobre la metaloproteinasas (MMPs); estas proteínas participan en la remodelación de la matrix extracelular, se han encontrado en el vítreo diabético relacionadas con el VEGF y la enzima convertidora de angiotensina.40 Sobre la regulación de las MMPS en el diabético se ha demostrado que la hiperglucemia aumenta la actividad y expresión de las MMP-2 y la MMP-9 en varios tejidos y se encuentran elevadas en el vítreo de individuos diabéticos con RDP. En un estudio experimental se determinó que el tratamiento de minociclina más aspirina revierte significativamente la amplitud de la onda B del electrorretinograma, comparando con grupo control. Concluyendo que la minociclina tiene un efecto significativo protector de la retinopatía diabética.41
¿ Conclusiones
La RD es la principal causa de ceguera en nuestro país, su diagnóstico y tratamiento dependen de la educación médica que debe ser accesible a todo médico y a la población en general, ya que se ha demostrado que un control metabólico adecuado y estricto reduce la incidencia y progresión de la RD. Sin embargo el problema actual de salud pública es muy grave si consideramos que varios millones de diabéticos mexicanos, pueden ser potencialmente ciegos. De aquí la importancia de la prevención con el desarrollo de programas de detección temprana en las instituciones de salud para diagnosticar y tratar oportunamente a una población tan grande y susceptible como la nuestra.
Correspondencia: Dra. Guadalupe Tenorio G. Zempoala N° 537 PB. Narvarte. México, D. F. 5672 4421.
Correo electrónico: mariategua@gmail.com