el carcinoma micropapilar infiltrante (CMI) es una variante histológica inusual y potencialmente agresiva caracterizada por primera vez en 1993 por Siriangkul et al. y que no formó parte de la clasificación de la Organización Mundial de la Salud (OMS) hasta 2003, como tumor mamario epitelial. Representa menos del 2% del total de carcinomas invasivos de la mama y se presupone que presenta un pronóstico desfavorable en comparación con otros carcinomas convencionales debido a su elevado tropismo vascular y linfático.
Material y métodoshasta la fecha no existe ningún estudio con un número elevado de pacientes procedentes de un único centro (> 100 casos) con un periodo de seguimiento largo (> 20 años) que compare la supervivencia del CMI con otros carcinomas convencionales no micropapilares. Se ha llevado a cabo un estudio retrospectivo, observacional con un total de 401 pacientes: 174 con CMI y 227 con otros carcinomas convencionales.
Resultadosel CMI presenta mayor grado histológico, mayor afectación ganglionar y mayor riesgo de metástasis a distancia en comparación con otros carcinomas convencionales de características similares. Sin embargo, en el análisis multivariante considerando factores pronósticos como edad, tamaño tumoral, afectación ganglionar y grado histológico, no se observan diferencias estadísticamente significativas para la supervivencia global y libre de enfermedad entre los CMI diagnosticados en el mismo periodo de tiempo que los casos pareados del grupo control y otros carcinomas convencionales.
Conclusiónla supervivencia global y libre de enfermedad es similar entre el CMI y otros carcinomas convencionales a igual edad, tamaño tumoral, grado histológico y afectación ganglionar.
Invasive Micropapillary Carcinoma of the breast (IMPC) is an unusual and aggressive histological variant characterized for the first time in 1993 by Siriangkul et al. and classified by the World Health Organization in 2003 as an epithelial breast tumor. It represents less than 2% of all invasive carcinomas of the breast and is presumed to have an unfavorable prognosis compared to other conventional carcinomas due to its high vascular and lymphatic tropism.
Material and methodsUntil now, there is no study with a large number of patients from a single center with a long follow-up period that compares the survival of IMPC with other conventional non-micropapillary carcinomas. A retrospective, observational study has been carried out with a total of 401 patients: 174 with IMPC and 227 with other conventional carcinomas.
ResultsIMPC has a higher histological grade, greater lymph node involvement and a higher risk of distant metastasis compared to other conventional carcinomas. However, in the multivariate analysis considering date of diagnosis, age, tumor size, lymph node involvement and histological grade as variables, no statistically significant differences were observed for overall and disease- free survival between IMPC and other conventional carcinomas.
ConclusionOverall and disease-free survival is similar between IMPC and other conventional carcinomas considering same age, tumor size, histological grade, and lymph node involvement.
El cáncer de mama es una enfermedad histológicamente heterogénea y se clasifica en 45 tipos histológicos distintos según la OMS. El carcinoma ductal infiltrante (carcinoma infiltrante de tipo no especial, NOS) (CDI) es el más frecuente, con una representación del 75%1. Recientemente se ha descrito una variante histológica inusual y agresiva, el carcinoma micropapilar infiltrante (CMI), caracterizada por primera vez en 19932 y que no formó parte de la clasificación de la OMS como tumor mamario epitelial hasta el 20031.
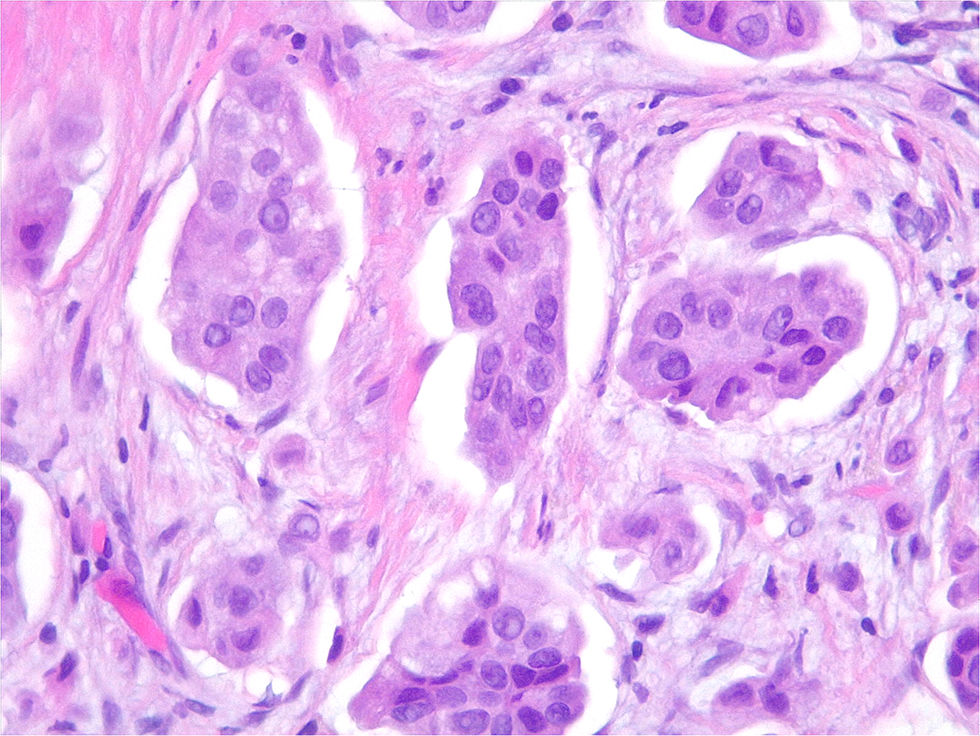
El CMI representa menos del 2% del total de carcinomas invasivos de la mama2–5. En la mayoría de los casos aparece de forma concomitante con otros subtipos histológicos, más comúnmente con el CDI6,7, siendo raro encontrarse con la forma pura8,9. A nivel histológico, las células se disponen formando pequeños nidos rodeados de un espacio claro sobre un estroma fibroso. Estas agrupaciones muestran polaridad invertida de tal forma que el polo apical de la membrana celular tumoral se orienta hacia el exterior, hacia el espacio estromal claro y no hacia el centro de las agrupaciones1. El CMI se considera una variante altamente agresiva debido a su gran tropismo vascular y linfático, pero su pronóstico en comparación con el CDI es controvertido2. Numerosos estudios retrospectivos han establecido la asociación del CMI con factores de mal pronóstico como un mayor tamaño tumoral, una mayor afectación ganglionar, un mayor número de ganglios linfáticos positivos y una mayor incidencia de invasión linfovascular3,5,10–13.
Hasta la fecha no existe ningún estudio con un número elevado de pacientes procedentes de un único centro (> 100 casos) con un periodo de seguimiento largo (> 20 años). Los primeros estudios publicados muestran debilidades, principalmente porque la mayoría incluyen muestras pequeñas de CMI y un estadio más avanzado en comparación con carcinomas de otras variedades, favoreciendo la aparición de sesgos14.
La hipótesis del presente estudio es que ante el hecho conocido de que el CMI muestra una mayor tendencia a presentar metástasis ganglionares, ello tendría que traducirse en una peor supervivencia global a largo plazo. El objetivo principal persigue estimar la supervivencia global y libre de enfermedad del CMI en comparación con otros carcinomas convencionales. Como objetivos secundarios se pretende analizar los factores asociados a la supervivencia global y libre de enfermedad del CMI y estimar si el CMI presenta un riesgo de recidiva superior al carcinoma infiltrante convencional (ductal o lobulillar).
Material y métodosSe ha llevado a cabo un estudio longitudinal retrospectivo observacional con un total de 401 pacientes diagnosticadas y tratadas en la Unidad de Patología Mamaria del Hospital Universitario Dexeus desde enero de 1996 hasta junio de 2020. El grupo de estudio está compuesto por 174 pacientes con CMI y el grupo control por 227 pacientes con carcinomas convencionales no micropapilares de la mama. Estas han sido seleccionadas de forma aleatoria y emparejando por año con la fecha de diagnóstico de los CMI para homogeneizar tanto tratamientos como seguimiento.
En cuanto a las variables estudiadas se establecieron 6 grupos. Por un lado, las características de la paciente, considerando la edad al diagnóstico, el índice de masa corporal (IMC), la paridad y edad en el primer embarazo, la edad de la menarquia y menopausia, la lateralidad de la lesión y la toma de terapia hormonal sustitutiva (THS) o anticoncepción hormonal (AH). En cuanto a las características morfológicas del tumor, se analizaron las características radiológicas, el tamaño, la presencia de carcinoma in situ, la multifocalidad de la lesión, el grado histológico, el estudio citológico cuando lo hubo y el tipo histológico en la pieza tumoral. Se consideró en este último CMI puro cuando el componente micropapilar se observaba en el 90% o más del área tumoral, y mixto cuando este porcentaje era inferior. El tercer grupo de variables analizadas correspondieron a los ganglios axilares, centinela y no centinela, clasificando el tamaño de los mismos de acuerdo con lo establecido en la clasificación TNM de los tumores de mama. En cuanto a los biomarcadores pronósticos y predictivos, se examinaron la expresión de receptores de estrógeno y progesterona, la sobreexpresión de HER2, el índice de proliferación o Ki67 y la expresión de la proteína p53. Finalmente, se analizaron los tratamientos llevados a cabo diferenciando entre mastectomía o tumorectomía, quimioterapia (QTA) primaria y secundaria, hormonoterapia (HT) y radioterapia (RDT). Con respecto a la evolución, se recogieron los casos con recidiva locorregional, afectación metastásica a distancia, el número de fallecimientos y el número de pacientes libres de enfermedad en la fecha de último contacto.
Acerca de los métodos estadísticos, las distribuciones de las variables continuas se compararon entre los grupos utilizando la prueba t de student, y las variables cualitativas con la prueba chi cuadrado o la prueba exacta de Fisher. Para la estimación de la supervivencia libre de enfermedad y de la supervivencia global se emplearon las curvas Kaplan-Meier y para la comparación de las mismas se aplicó la prueba log-rank. Por último, para el análisis de los factores asociados a la supervivencia se utilizaron los modelos de Cox. El tiempo de supervivencia libre de enfermedad se calculó desde la fecha del diagnóstico hasta la fecha de la primera progresión de la enfermedad o del fallecimiento por cualquier causa. El tiempo de supervivencia global se calculó desde el diagnóstico hasta la fecha de muerte. Todos los casos se censuraron en la fecha de último contacto con la paciente.
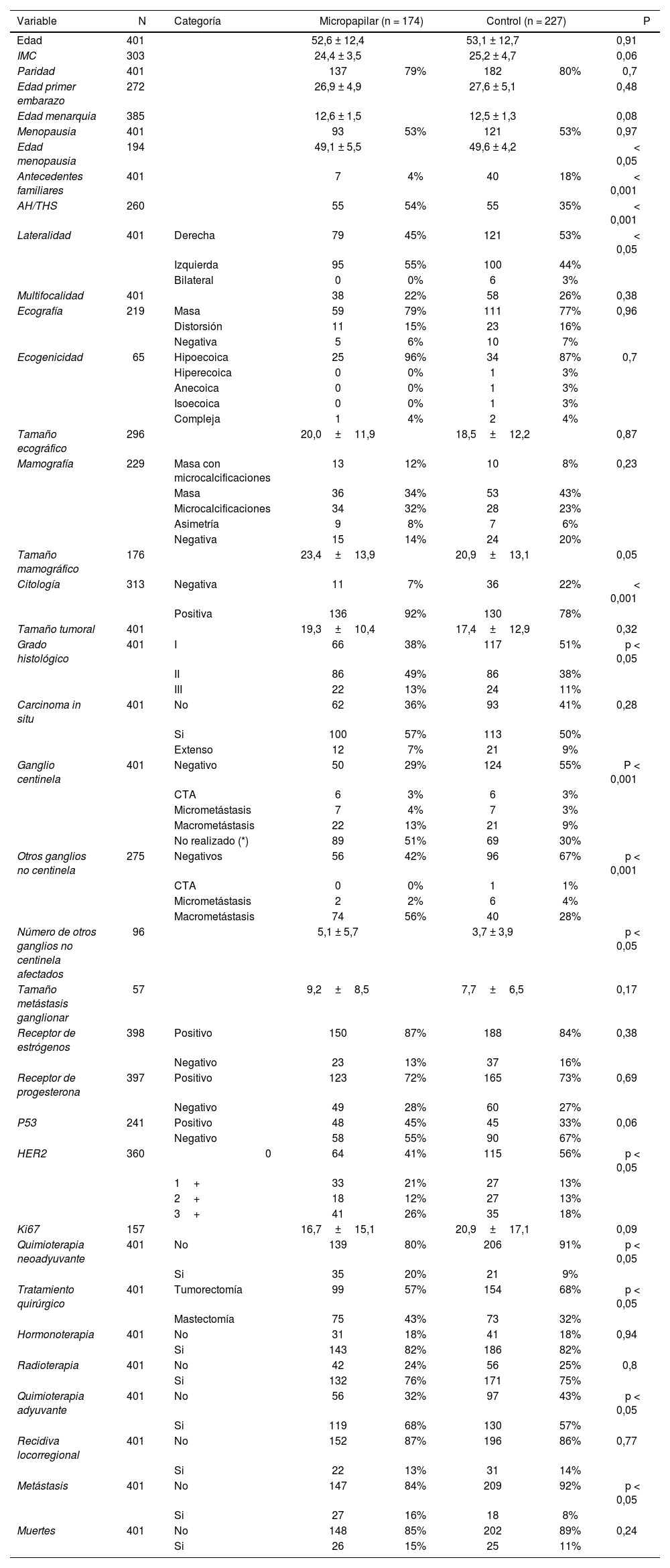
ResultadosEl total de casos estudiados fue de 401.174 casos de CMI y 227 casos controles (tabla 1). La histología de los casos que formaban el grupo control fue carcinoma infiltrante de tipo no especial (Ductal, NOS) en 186 (82%) casos, lobulillar en 32 (14%) y otros tipos 9 (4%). En el grupo de CMI, 92 (53%) casos fueron puros y 82 (57%) mixtos (fig. 1).
Variables consideradas en nuestra serie comparando CMI y grupo control con su correspondiente significación estadística
| Variable | N | Categoría | Micropapilar (n = 174) | Control (n = 227) | P | ||
|---|---|---|---|---|---|---|---|
| Edad | 401 | 52,6 ± 12,4 | 53,1 ± 12,7 | 0,91 | |||
| IMC | 303 | 24,4 ± 3,5 | 25,2 ± 4,7 | 0,06 | |||
| Paridad | 401 | 137 | 79% | 182 | 80% | 0,7 | |
| Edad primer embarazo | 272 | 26,9 ± 4,9 | 27,6 ± 5,1 | 0,48 | |||
| Edad menarquia | 385 | 12,6 ± 1,5 | 12,5 ± 1,3 | 0,08 | |||
| Menopausia | 401 | 93 | 53% | 121 | 53% | 0,97 | |
| Edad menopausia | 194 | 49,1 ± 5,5 | 49,6 ± 4,2 | < 0,05 | |||
| Antecedentes familiares | 401 | 7 | 4% | 40 | 18% | < 0,001 | |
| AH/THS | 260 | 55 | 54% | 55 | 35% | < 0,001 | |
| Lateralidad | 401 | Derecha | 79 | 45% | 121 | 53% | < 0,05 |
| Izquierda | 95 | 55% | 100 | 44% | |||
| Bilateral | 0 | 0% | 6 | 3% | |||
| Multifocalidad | 401 | 38 | 22% | 58 | 26% | 0,38 | |
| Ecografía | 219 | Masa | 59 | 79% | 111 | 77% | 0,96 |
| Distorsión | 11 | 15% | 23 | 16% | |||
| Negativa | 5 | 6% | 10 | 7% | |||
| Ecogenicidad | 65 | Hipoecoica | 25 | 96% | 34 | 87% | 0,7 |
| Hiperecoica | 0 | 0% | 1 | 3% | |||
| Anecoica | 0 | 0% | 1 | 3% | |||
| Isoecoica | 0 | 0% | 1 | 3% | |||
| Compleja | 1 | 4% | 2 | 4% | |||
| Tamaño ecográfico | 296 | 20,0±11,9 | 18,5±12,2 | 0,87 | |||
| Mamografía | 229 | Masa con microcalcificaciones | 13 | 12% | 10 | 8% | 0,23 |
| Masa | 36 | 34% | 53 | 43% | |||
| Microcalcificaciones | 34 | 32% | 28 | 23% | |||
| Asimetría | 9 | 8% | 7 | 6% | |||
| Negativa | 15 | 14% | 24 | 20% | |||
| Tamaño mamográfico | 176 | 23,4±13,9 | 20,9±13,1 | 0,05 | |||
| Citología | 313 | Negativa | 11 | 7% | 36 | 22% | < 0,001 |
| Positiva | 136 | 92% | 130 | 78% | |||
| Tamaño tumoral | 401 | 19,3±10,4 | 17,4±12,9 | 0,32 | |||
| Grado histológico | 401 | I | 66 | 38% | 117 | 51% | p < 0,05 |
| II | 86 | 49% | 86 | 38% | |||
| III | 22 | 13% | 24 | 11% | |||
| Carcinoma in situ | 401 | No | 62 | 36% | 93 | 41% | 0,28 |
| Si | 100 | 57% | 113 | 50% | |||
| Extenso | 12 | 7% | 21 | 9% | |||
| Ganglio centinela | 401 | Negativo | 50 | 29% | 124 | 55% | P < 0,001 |
| CTA | 6 | 3% | 6 | 3% | |||
| Micrometástasis | 7 | 4% | 7 | 3% | |||
| Macrometástasis | 22 | 13% | 21 | 9% | |||
| No realizado (*) | 89 | 51% | 69 | 30% | |||
| Otros ganglios no centinela | 275 | Negativos | 56 | 42% | 96 | 67% | p < 0,001 |
| CTA | 0 | 0% | 1 | 1% | |||
| Micrometástasis | 2 | 2% | 6 | 4% | |||
| Macrometástasis | 74 | 56% | 40 | 28% | |||
| Número de otros ganglios no centinela afectados | 96 | 5,1 ± 5,7 | 3,7 ± 3,9 | p < 0,05 | |||
| Tamaño metástasis ganglionar | 57 | 9,2±8,5 | 7,7±6,5 | 0,17 | |||
| Receptor de estrógenos | 398 | Positivo | 150 | 87% | 188 | 84% | 0,38 |
| Negativo | 23 | 13% | 37 | 16% | |||
| Receptor de progesterona | 397 | Positivo | 123 | 72% | 165 | 73% | 0,69 |
| Negativo | 49 | 28% | 60 | 27% | |||
| P53 | 241 | Positivo | 48 | 45% | 45 | 33% | 0,06 |
| Negativo | 58 | 55% | 90 | 67% | |||
| HER2 | 360 | 0 | 64 | 41% | 115 | 56% | p < 0,05 |
| 1+ | 33 | 21% | 27 | 13% | |||
| 2+ | 18 | 12% | 27 | 13% | |||
| 3+ | 41 | 26% | 35 | 18% | |||
| Ki67 | 157 | 16,7±15,1 | 20,9±17,1 | 0,09 | |||
| Quimioterapia neoadyuvante | 401 | No | 139 | 80% | 206 | 91% | p < 0,05 |
| Si | 35 | 20% | 21 | 9% | |||
| Tratamiento quirúrgico | 401 | Tumorectomía | 99 | 57% | 154 | 68% | p < 0,05 |
| Mastectomía | 75 | 43% | 73 | 32% | |||
| Hormonoterapia | 401 | No | 31 | 18% | 41 | 18% | 0,94 |
| Si | 143 | 82% | 186 | 82% | |||
| Radioterapia | 401 | No | 42 | 24% | 56 | 25% | 0,8 |
| Si | 132 | 76% | 171 | 75% | |||
| Quimioterapia adyuvante | 401 | No | 56 | 32% | 97 | 43% | p < 0,05 |
| Si | 119 | 68% | 130 | 57% | |||
| Recidiva locorregional | 401 | No | 152 | 87% | 196 | 86% | 0,77 |
| Si | 22 | 13% | 31 | 14% | |||
| Metástasis | 401 | No | 147 | 84% | 209 | 92% | p < 0,05 |
| Si | 27 | 16% | 18 | 8% | |||
| Muertes | 401 | No | 148 | 85% | 202 | 89% | 0,24 |
| Si | 26 | 15% | 25 | 11% | |||
(*) al comparar ganglio centinela realizado o no realizado entre ambos grupos, la significación estadística es < 0,001.
En relación con las características de la paciente, observamos diferencias estadísticamente significativas por lo que acontece a los antecedentes personales de cáncer de mama, a la edad de la menopausia y a la toma de THS o AH. Pese a no encontrar diferencias en la lateralidad de la lesión, sí las hubo en la bilateralidad (p < 0,05) de forma que no se observó ningún caso de tumor bilateral en el grupo de CMI y se detectaron 6 en el grupo control. Por lo que respecta a los antecedentes personales de cáncer de mama observamos mayor afectación en las pacientes del grupo control en comparación con el grupo de CMI (p < 0,001). En cuanto a la edad de la menopausia, se encontraron más pacientes postmenopáusicas en el momento del diagnóstico en el grupo de CMI que en el grupo control (p < 0,05). También hubo más pacientes que tomaban anticonceptivos o THS en el grupo de pacientes con CMI que en el grupo control. Estas diferencias fueron estadísticamente significativas (p < 0,001) si bien es cierto que únicamente se obtuvo el dato de si estaban tomando AH o THS en 260 pacientes.
Respecto a las características del tumor, no observamos diferencias estadísticamente significativas en el tamaño tumoral; sí en la punción citológica (< 0,001), observando más falsos negativos en el grupo de CMI que en el grupo control, considerando más difícil detectar por citología el CMI que el resto de carcinomas convencionales. Otro dato importante con significación estadística (p < 0,05) fue el grado histológico que según el sistema de Nottingham el más frecuente en el grupo de CMI fue el II y en el grupo control el I. Si consideramos únicamente el grado III, observamos también más casos en el grupo de CMI que en el grupo control. La técnica de biopsia selectiva del ganglio centinela (BSGC) fue menos frecuente en el grupo de CMI por tratarse de tumores superiores a 3 cm con mayor frecuencia que los del grupo control, tumores multifocales, haber recibido tratamiento con mastectomía y/o presentar afectación ganglionar clínica. Cuando pudo realizarse la BSGC, este estaba afectado de forma más frecuente en el grupo de CMI que en el grupo control (p < 0,05). También la incidencia de macrometástasis fue más alta en el grupo de CMI que en el grupo control (p < 0,001). En 275 casos se obtuvieron otros ganglios además del centinela siendo el número promedio de ganglios afectados estadísticamente superior en el grupo de CMI (p < 0,05).
Por lo que acontece a los factores pronósticos y predictivos inmunohistoquímicos, no hubo diferencias estadísticamente significativas para la expresión de estrógenos y progesterona ni tampoco para p53 y Ki67. En cuanto a la expresión de HER2, si el resultado se estratificaba en HER2 positivo (3+) o negativo (0+ y 1+), los tumores del grupo con CMI eran más frecuentemente HER2 positivos (p < 0,05).
Las pacientes del grupo CMI recibieron QTA tanto primaria como secundaria de forma más frecuente que las pacientes del grupo control con una diferencia estadísticamente significativa (p < 0,05). No percibimos diferencias para el tratamiento con HT ni RDT, sí por lo que respecta a la cirugía, donde observamos mayor incidencia de mastectomía frente a cirugía conservadora en el grupo de CMI (p < 0,05).
En las variables relacionadas con la evolución, observamos únicamente diferencias en la aparición de metástasis a distancia siendo más frecuentes en el grupo CMI (p < 0,05). Probablemente el hecho de que las metástasis a distancia no afecten al pronóstico pueda atribuirse a la localización de las mismas, aunque no se dispone de este dato en el estudio.
Las recidivas locorregionales observadas fueron similares en ambos grupos de la misma manera que el número de muertes y el número de pacientes libres de enfermedad en la fecha de último contacto.
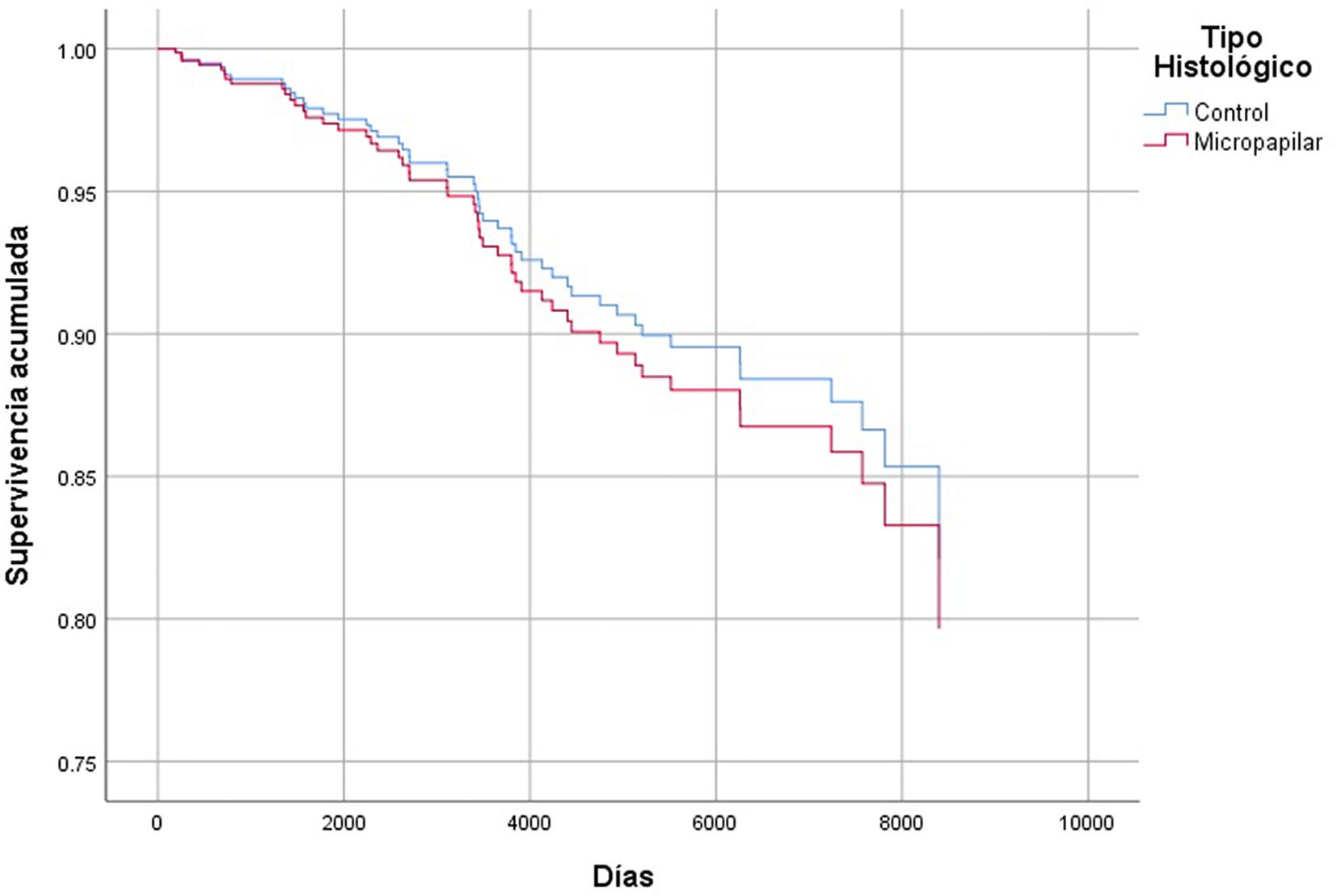
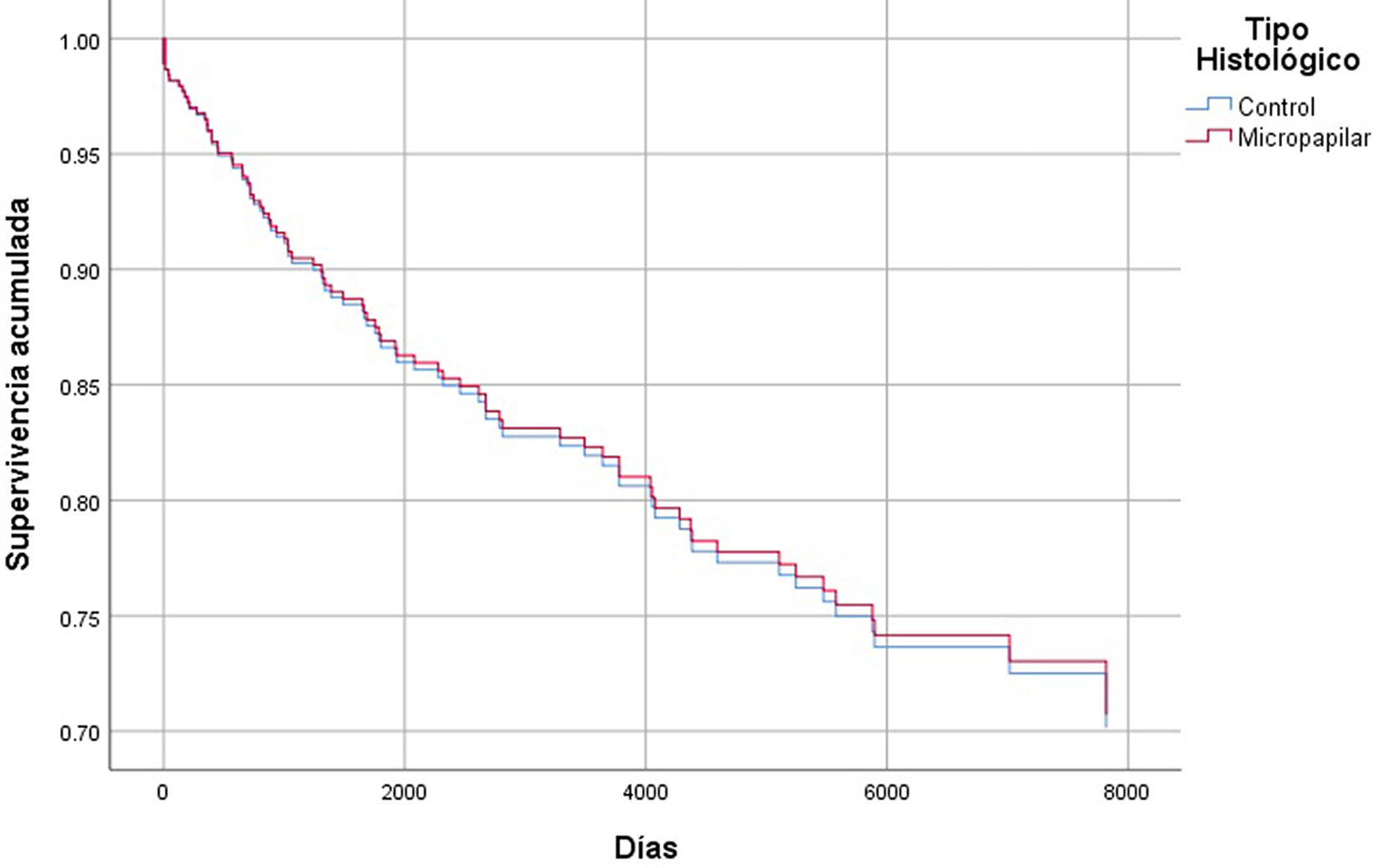
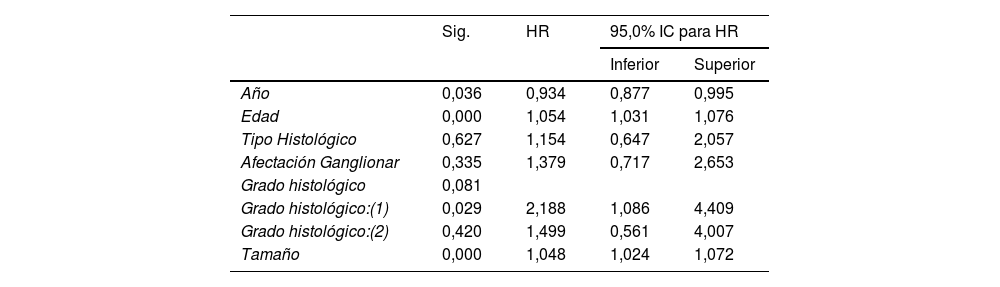
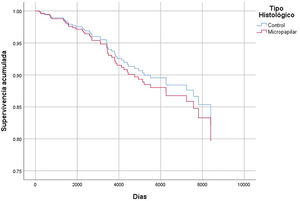
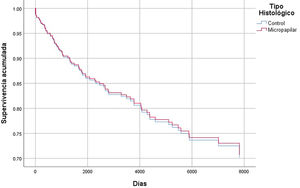
En cuanto al análisis de supervivencia, no encontramos diferencias estadísticamente significativas entre el grupo con CMI y el grupo control ni para la supervivencia global (p = 0,287) ni para la supervivencia libre de progresión (p = 0,259). Tampoco al comparar supervivencia entre CMI puros y mixtos (p = 0,390 y p = 0,209, respectivamente). En el análisis de regresión multivariable de Cox para la supervivencia global, las variables consideradas fueron: año del diagnóstico, edad, tipo histológico, afectación ganglionar, tamaño tumoral y grado histológico. No se observaron diferencias estadísticamente significativas en cuanto a la supervivencia global y libre de enfermedad en función de las variables consideradas. Es decir, a igual edad, tamaño tumoral, grado histológico y afectación ganglionar, la supervivencia global y libre de enfermedad era la misma para el grupo control que para el grupo de pacientes con CMI (figs. 2 y 3) (tabla 2).
Análisis multivariable para la supervivencia global (tabla con los HR de los modelos de COX)
| Sig. | HR | 95,0% IC para HR | ||
|---|---|---|---|---|
| Inferior | Superior | |||
| Año | 0,036 | 0,934 | 0,877 | 0,995 |
| Edad | 0,000 | 1,054 | 1,031 | 1,076 |
| Tipo Histológico | 0,627 | 1,154 | 0,647 | 2,057 |
| Afectación Ganglionar | 0,335 | 1,379 | 0,717 | 2,653 |
| Grado histológico | 0,081 | |||
| Grado histológico:(1) | 0,029 | 2,188 | 1,086 | 4,409 |
| Grado histológico:(2) | 0,420 | 1,499 | 0,561 | 4,007 |
| Tamaño | 0,000 | 1,048 | 1,024 | 1,072 |
El pronóstico del CMI ha sido objeto de especial atención en las últimas décadas debido a su naturaleza linfotrópica suponiendo que estas pacientes experimentan peores resultados que las que tienen CDI10,12,14–16. Los primeros estudios retrospectivos muestran inconsistencias principalmente porque el grupo de CMI en la mayoría de los estudios publicados presenta un estadio más avanzado y un tamaño de muestra menor que el grupo de CDI favoreciendo la aparición de un gran sesgo como consecuencia del desequilibrio entre los datos aportados14. Nosotros hemos llevado a cabo un estudio retrospectivo, observacional, con un total de 401 pacientes: 174 con CMI y 227 con carcinomas convencionales. Las pacientes del grupo control han sido seleccionadas de forma aleatoria y emparejando por año con la fecha de diagnóstico de CMI para homogeneizar tratamientos y tiempo de seguimiento. Es el estudio unicéntrico hasta la fecha con un periodo de seguimiento más largo que abarca desde enero de 1996 hasta junio de 2020. Algunos autores también publican estudios comparativos con periodos de seguimiento largos; sin embargo, no son unicéntricos5,10. Yu et al.10 comparan la supervivencia entre CMI y CDI a partir de datos obtenidos de 7 centros coreanos desde enero de 1999 hasta noviembre de 2011 y Chen et al.17 obtienen los datos a partir de una base de datos americana SEER (Surveillance, Epidemiology, and End Results database) analizando retrospectivamente la supervivencia entre enero de 2001 y diciembre de 2013.
En 2008, Chen et al.18 demostraron una supervivencia a 5 y 10 años significativamente menor en aquellas pacientes con CMI en comparación con el CDI. Vingiani et al.7 mostraron que la histología micropapilar no añadía información adicional al riesgo de recidiva locorregional o a distancia ni supervivencia global si lo comparaban con el CDI. Ye et al.14 publicaron en 2020 el último metaanálisis conocido hasta la fecha, que incluía 8 publicaciones con un total de 2.102 pacientes con CMI que comparaban los datos de supervivencia de este último con el CDI. Observaron que el CMI tiene una peor supervivencia libre de recaída en comparación con el CDI probablemente debido al mayor riesgo de recurrencia locorregional.
Al comparar la supervivencia global y la supervivencia libre de progresión entre el grupo de CMI puros y mixtos, tampoco hubo diferencias estadísticamente significativas (p = 0,390 y p = 0,209, respectivamente) coincidiendo con la literatura. Kaya et al.19 adoptan el 75% como límite entre CMI forma pura y mixta y observan que el riesgo de recidiva y las tasas de supervivencia no se ven afectadas por el ratio de componente micropapilar presente en el tumor.
En relación al tamaño tumoral, de la misma manera que Tang et al.20 (p = 0,654) y otros autores, no encontramos diferencias significativas con nuestros datos4,12,18,20,21.
La distribución de los receptores hormonales en el CMI ha variado considerablemente de la siguiente manera en los estudios publicados: ER 19-90%, PR 19-70%, HER2 36-100%3,13,22–24. La mayoría de los estudios muestran una mayor tasa de positividad de RE en el CMI en comparación con el grupo control de CDI4,7,8,17,25,26, sin embargo, hay 2 estudios publicados que muestran una tasa de positividad de RE inferior18 o similar10. En nuestra serie encontramos expresión de RE en el 87%, expresión de PR en el 71%, y Her2-neu en el 19,6% de los casos y contrario de lo que observaron otros autores5,17, las diferencias en la expresión de RE y RP no fueron significativas. En cuanto a la sobreexpresión de HER2, sí encontramos diferencias estadísticamente significativas igual que Paterakos et al.3 quienes reportan una sobreexpresión de HER2 significativamente mayor en el CMI al compararla con el CDI.
El CMI tiene una elevada propensión para la diseminación metastásica a ganglios linfáticos con tasas reportadas de entre el 68,8 y el 90,5%3,13,17,22,23,25,27,28 en comparación con el CDI que es del 34%29. En nuestro estudio, el número promedio de ganglios afectados además del centinela en el grupo CMI fue estadísticamente superior que en el grupo control. Para Chen et al.5,17 pese a que la positividad de ganglios linfáticos fue inferior al rango publicado por otros estudios, la diferencia entre ambos grupos fue estadísticamente significativa. En el análisis multivariante realizado en el estudio de Chen et al.17 sin embargo, el grado de positividad de los ganglios linfáticos no fue predictor independiente de supervivencia, sí el tamaño tumoral y la radioterapia.
DebilidadesA pesar de que los casos del grupo control han sido seleccionados de forma aleatoria y emparejando con el año de diagnóstico del CMI, al no tratarse de un estudio prospectivo aleatorizado no podemos garantizar de forma concluyente que no haya podido haber un efecto del tratamiento que sesgue los resultados.
Al tratarse de una serie de muy larga evolución hay determinaciones de algunos factores pronósticos que no estuvieron disponibles por no realizarse. El Ki67 por ejemplo, no empezó a determinarse de forma rutinaria en nuestro centro hasta mediados 2008. Es por ello que no disponemos de la clasificación molecular subrogada de muchos de los tumores lo que no ha permitido comparar esta clasificación con el tipo histológico micropapilar. Esto constituye sin duda una vía de estudio y de continuidad de este proyecto.
ConclusionesNuestra serie de CMI de la mama constituye una de las series con mayor periodo de seguimiento tanto de la supervivencia global como de la supervivencia libre de progresión de pacientes diagnosticadas en un mismo centro. Clínicamente, las pacientes con CMI muestran menor incidencia de antecedentes personales de neoplasia de mama, mayor incidencia de uso de AH o THS, y las pacientes menopaúsicas presentan una edad más joven de inicio de la menopausia en comparación con el grupo control. El CMI es un tipo histológico que en comparación con el carcinoma de mama convencional presenta mayor grado histológico. La realización de la técnica de la BSGC es una contraindicación más frecuente en las pacientes con CMI y cuando está indicada, la probabilidad de que el ganglio centinela esté afectado es mayor en comparación con el grupo control. La probabilidad de que además existan otros ganglios afectados además del centinela también es mayor. El CMI es HER2 positivo con mayor frecuencia que el grupo control, así mismo, no hay diferencias en cuanto a la expresión de receptores de estrógenos, progesterona, p53 ni índice proliferativo medido con Ki67. A pesar de que el grupo de pacientes con CMI han mostrado una mayor tasa de metástasis, no hay diferencias significativas en cuanto a las recidivas, la supervivencia global y la supervivencia libre de progresión cuando se comparan con un grupo control. Probablemente el que las metástasis a distancia no afecten al pronóstico pueda atribuirse a la localización de las mismas, aunque no disponemos de este dato en el estudio. El análisis multivariable demuestra que, a igual edad, tamaño tumoral, grado histológico y afectación ganglionar, la supervivencia global y supervivencia libre de progresión son las mismas tanto para el grupo control como para el grupo de pacientes con CMI.
FinanciaciónNo se ha recibido ninguna financiación para lleva a cabo este proyecto.
Responsabilidades éticasEl presente estudio cuenta con la aprobación del Comité Ético de Investigación con Medicamentos (CEIM) del Grupo Hospitalario Quirónsalud-Cataluña con el código de registro 2020/160-GIN-DEX en el acta 24/2020.
Conflicto de interesesFrancesc Tresserra es coeditor de la Revista de Senología y Patología Mamaria. Sonia Baulies y Rafael Fábregas son miembros de la Junta Directiva de la Sociedad Española de Senología y Patología Mamaria.
AgradecimientosEl presente estudio es un resumen de la tesis doctoral que forma el proyecto y que fue leída el día 4 de noviembre de 2022. El trabajo se ha realizado bajo los auspicios de la Cátedra de Investigación en Obstetricia y Ginecología. Universidad Autónoma de Barcelona.