Current Topics in Breast Pathology
More infoLas lesiones papilares de la mama representan un grupo heterogéneo de lesiones que se caracterizan por estar compuestas por papilas. Se clasifican en benignas y malignas, en función de la morfología del epitelio que las compone y de la distribución de las células mioepiteliales. Estas lesiones resultan difíciles en su diagnóstico, sobre todo cuando el diagnóstico se realiza en biopsia con aguja gruesa. Vamos a hacer una revisión de las principales lesiones papilares, sus características clínicas, morfológicas, inmunohistoquímicas y algunas peculiaridades moleculares.
Papillary lesions of the breast represent a heterogeneous group of lesions characterized by papillae. They are classified as benign and malignant, depending on the morphology of the epithelium of which they are composed and the distribution of myoepithelial cells (MECs). These lesions are difficult to diagnose, especially when the diagnosis is made by core needle biopsy. We will review the main papillary lesions, their clinical, morphological and immunohistochemical characteristics and some molecular peculiarities.
Las lesiones papilares de la mama, resultan un reto para su diagnóstico y su tratamiento, que se refleja en la publicación de numerosos trabajos describiendo estrategias para su reconocimiento histológico y su manejo1–5.
Se trata de un grupo clínico, histológico y biológico heterogéneo de lesiones que se caracterizan por mostrar papilas. Por eso, comenzaremos por recordar cómo se define una papila. Es una estructura formada por un tallo fibrovascular tapizado por células epiteliales y acompañado de células mioepiteliales (CME) o sin ellas según el tipo de lesión. El término deriva del latín papilla y significa pequeño botón o pezón.
El parénquima mamario normal no presenta papilas, y la morfogénesis de las lesiones papilares está todavía poco explicada4.
Las lesiones papilares de la mama se dividen según la última clasificación de World Health Organization(WHO) (2019)3 en lesiones benignas que corresponden a una sola entidad, el papiloma intraductal; y las lesiones malignas que incluye el carcinoma papilar in situ, carcinoma papilar encapsulado, carcinoma papilar-sólido (in situ e infiltrante) y por último el carcinoma papilar infiltrante (tabla 1).
Clasificación de las neoplasias papilares de la mama, según World Health Organization
| -Papiloma intraductal-Papiloma intraductal sin atipia-Papiloma intraductal con HDA-Papiloma intraductal con CIS-Carcinoma in situ papilar-Carcinoma papilar encapsulado-Carcinoma papilar-sólido-in situ-infiltrante-Carcinoma papilar infiltrante |
Fuente: Brogi E, et al.3.
CIS: carcinoma in situ; HDA: hiperplasia ductal atípica.
Para su diferenciación resulta esencial el estudio de las CME, y su presencia en las papilas y en el revestimiento de los ductos, nos indica su carácter benigno. En la descripción de las diferentes lesiones iremos describiendo el patrón de células mioepiteliales que los caracteriza y nos ayuda a su diagnóstico, sobre todo en la biopsia con aguja gruesa (BAG). Queremos introducir la utilidad de un marcador vascular (CD34), para facilitar el estudio de la arquitectura papilar.
Papiloma intraductalEl papiloma intraductal (PI) puede ser único, de tamaño medio y localizado en el área retroareolar. Los PI múltiples se distribuyen más extensamente, pero afectan también el área retroareolar. Todos ellos se suelen manifestar clínicamente con secreción sanguinolenta por el pezón.
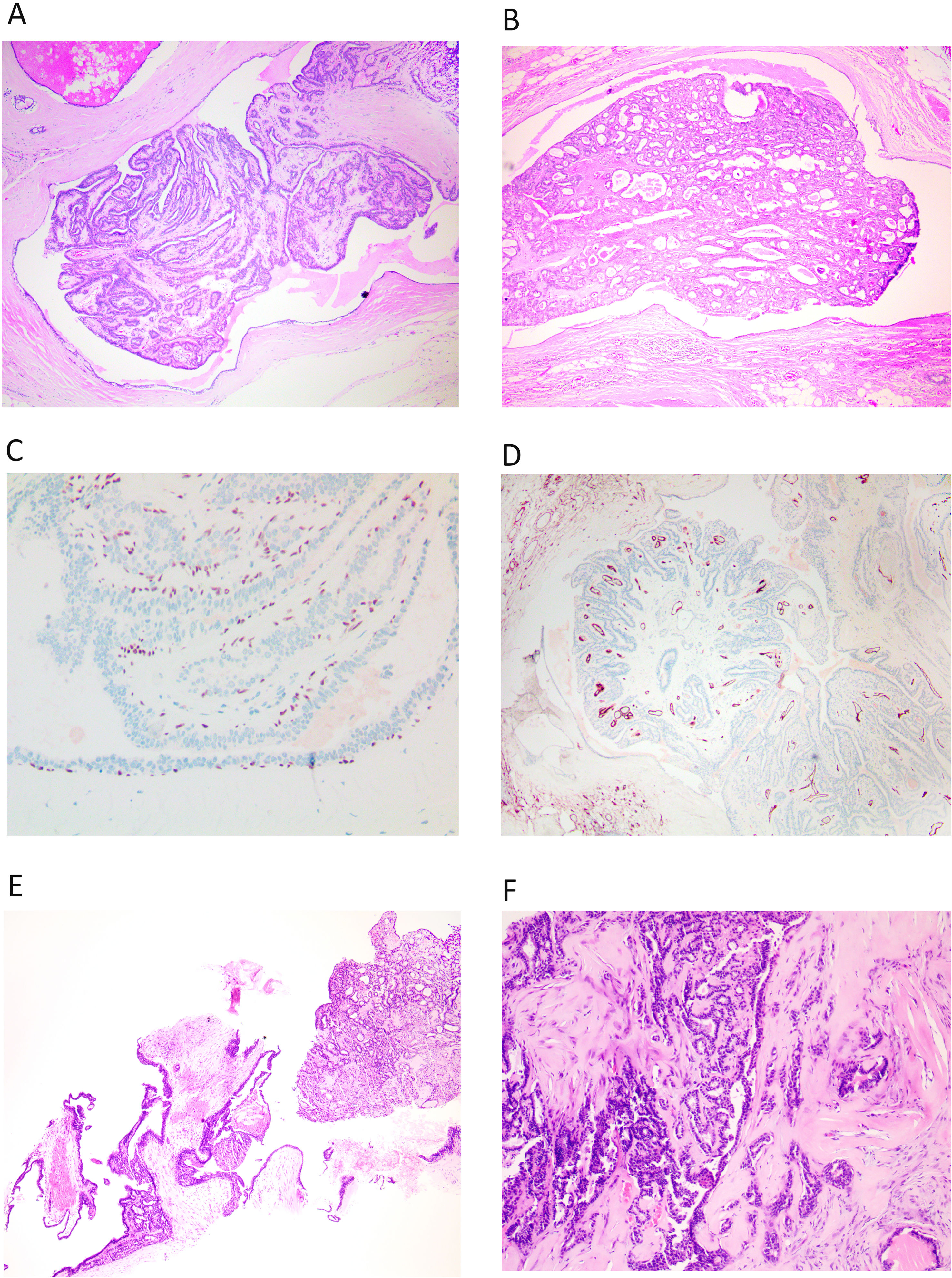
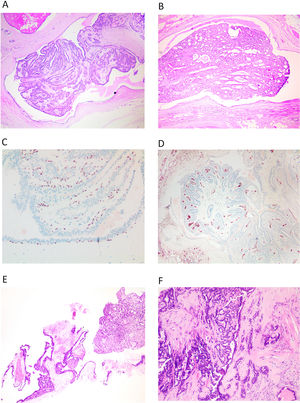
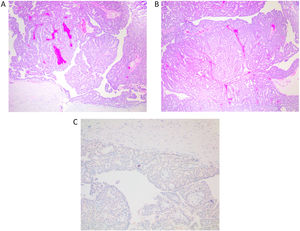
Histológicamente, se caracterizan por una estructura papilar alojada en un ducto dilatado (fig. 1A y B). En la pared del quiste se observa un revestimiento epitelio aplanado sobre un tejido fibroso y denso. El crecimiento papilar se caracteriza por septos fibrovasculares revestidos por 2 capas de células. Una capa de células luminales y otra capa de células basales (mioepiteliales). Estas células luminales pueden mostrar un cambio columnar o metaplasia apocrina. En muchas ocasiones existe una mezcla de ambos tipos celulares, este carácter mixto, es un criterio de benignidad. Los septos son en general finos, pero pueden mostrar diversos grados de fibrosis e incluso calcificación.
A y B) Imagen de PI, en hematoxilina eosina, correspondiente a una biopsia dirigida donde se puede ver la lesión completa dentro de un ducto dilatado (x100, H-E). C) Se observa la hilera completa de CME bajo el epitelio que reviste el ducto y en los tallos de las papilas, con inmunohistoquímica para p63 (x200). D) Con una tinción inmunohistoquímica para CD34, observamos los tallos vasculares en todas las papilas (x100). E) En una BAG, se entremezclan los fragmentos del ducto que aloja el PI, con los propios fragmentos papilares (x100, H-E). F) Si se produce fibrosis por isquemia en el PI, quedan atrapadas estructuras epiteliales, que simulan invasión (x100, H-E).
Hay que recordar que el PI está anclado a la pared del ducto y es a través de su anclaje por el que llega el aporte sanguíneo al PI. Se pueden producir problemas de aporte sanguíneo y se observan áreas de infarto, isquemia y fibrosis (fig. 1F). Estas modificaciones se relacionan a veces con la realización de la punción o la biopsia, que atraviesan ese anclaje vascular.
El PI presenta una hilera continua de CME en la pared del quiste que lo aloja y en todo el trayecto de las papilas, que se pueden poner de manifiesto mediante p63 o CK14 (fig. 1C). Se recomienda realizar más de un marcador de CME. Este hecho ayuda en el diagnóstico.
El diagnóstico de PI en BAG o biopsia asistida por vacío (BAV), resulta difícil. Podemos encontrar claros fragmentos de una lesión benigna (PI) (fig. 1E), pero ese hallazgo no excluye otras lesiones de mayor malignidad (CIS, hiperplasia, etc.). Esta incertidumbre que acompaña al diagnóstico del PI, se refleja en la categorización europea como lesión B3, aunque no presente atipia franca1. El PI en una BAG o BAV, mostrará en general fragmentos de la cavidad quística que lo aloja, y fragmentos unidos a ella o sueltos del PI. Las estructuras papilares se deben estudiar buscando los ejes vasculares. Tenemos que analizar el número de capas de células entre 2 ejes. Entre 2 ejes vasculares, debemos encontrar 4 capas de células (2 capas por papila). Si el espesor del epitelio entre 2 ejes vasculares, resulta mayor u observamos luces cribiformes, debemos considerar que existe una proliferación epitelial. Como hemos indicado, el estudio de las CME nos ayudará a analizar los ejes vasculares que se marcarán y nos permitirá analizar la distancia entre ellos. Podemos realizar también una técnica para resaltar las estructuras vasculares (CD34) para analizar mejor el epitelio y su posible proliferación (fig. 1D).
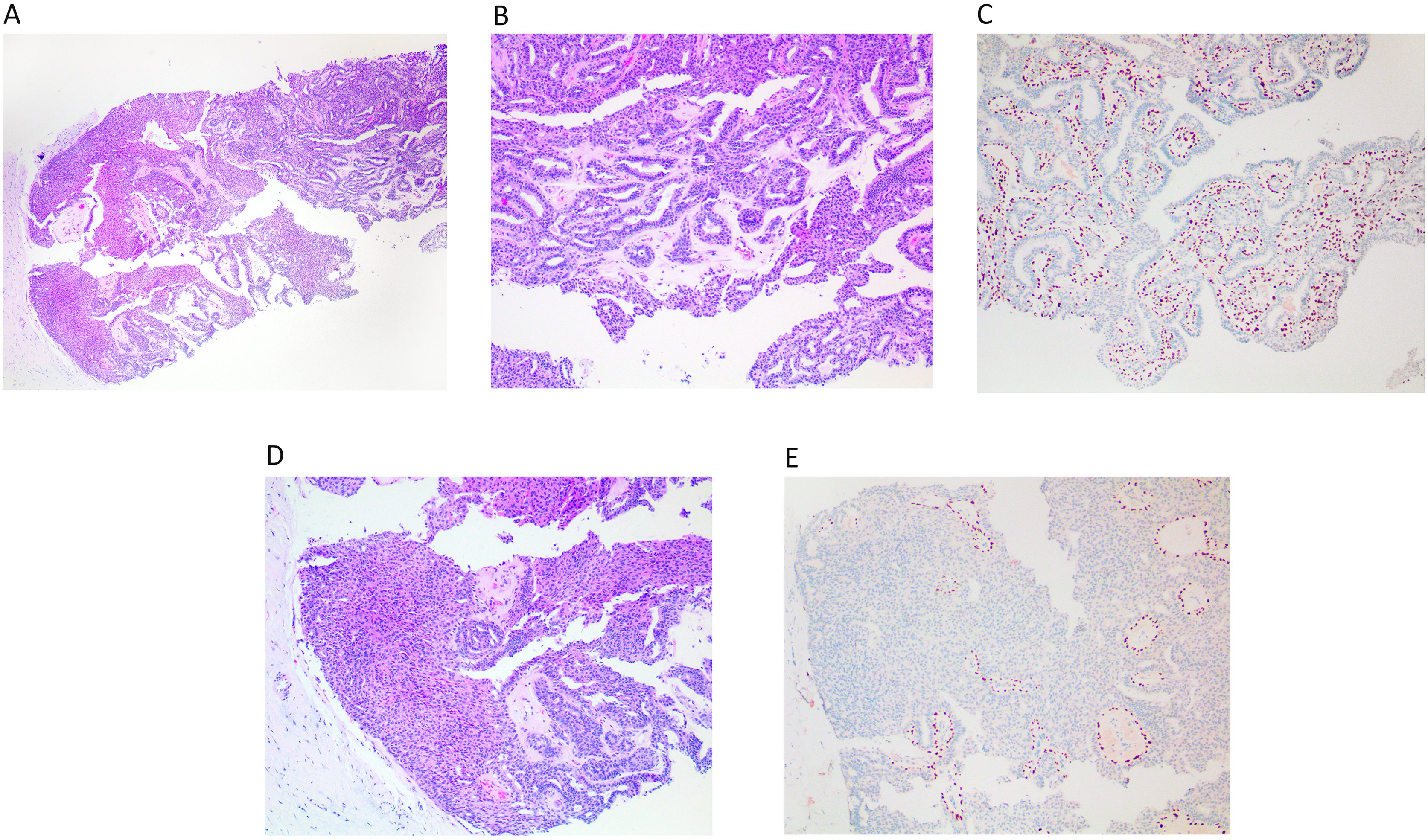
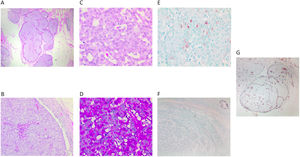
Cuando observamos un área de proliferación epitelial dentro de un PI (fig. 2A, B y C), podemos aplicar algunos de los criterios que se utilizan para evaluar la hiperplasia ductal atípica (HDA). Es decir, valoraremos el monomorfismo celular y nuclear (fig. 2D). La formación de luces de tamaño homogéneo o un crecimiento sólido. Todo esto se acompañará de aumento de la distancia de los ejes vasculares. A nivel inmunohistoquímico, se acompañará de expresión de RE y la pérdida de la trama de CME (fig. 2D y E). En las lesiones proliferativas dentro de un PI, se ha considerado que el límite de la extensión de la proliferación epitelial es de 3 mm3, siendo la HDA menor de 3 mm, y el carcinoma in situ mayor de 3 mm1–3.
A) En una BAG apreciamos un PI con área de proliferación epitelial, a la izquierda del cilindro (x100, H-E). B) La parte del cilindro que presenta un PI sin atipia (x200, H-E). C) Se observan papilas finas con su trama de CME intacta teñidas con p63 (x200, IHQ p63). D) Refleja un área de proliferación epitelial, monomorfa que no rebasa los 3 mm, y corresponde a HDA (x200, H-E). E) Se observa la gran distancia entre los ejes vasculares resaltados mediante p63 que marca las CME (x200, IHQ p63).
Con menos frecuencia, se puede observar en el seno de un PI, focos de neoplasia lobulillar. Estos deben ser reflejados en el informe anatomopatológico, pero no requieren de otros tratamientos quirúrgicos posteriores si existe una concordancia radiológica1.
También será importante si los fenómenos evolutivos han producido fibrosis y hay estructuras epiteliales englobadas y atrapadas. Tendremos que comprobar la presencia de CME, para confirmar que se trata de un área de seudoinvasión (fig. 1F)1,2.
Manejo del papiloma intraductal detectado con BAG/BAVEl sistema europeo de clasificación de las lesiones ha considerado al PI como lesión B3, y se recomienda su escisión. Sin embargo, se están publicando estudios que revisan los porcentajes de sobrediagnóstico (entre 0 y 16%)1 y la necesidad de escisión o la alternativa del control radiológico. El hallazgo de CID o C infiltrante se asocia preferentemente a las mujeres mayores de 50 años, con lesiones > de 1 cm, que se presentan como masa palpable o que la distancia de la lesión al pezón sea > 5 cm.
En 2018, en la segunda conferencia sobre lesiones B36, se concluyó que el seguimiento es apropiado para los PI extirpados completamente con la biopsia de vacío. Las lesiones grandes que no pueden ser extirpadas completamente por este método, precisarán de cirugía para su tratamiento. También, se concluyó que aquellos papilomas < 2 mm, pueden considerarse como lesiones B2.
El riesgo de que PI se asocie a una lesión premaligna o maligna se incrementa cuando suman más de 5, y resulta recomendable el seguimiento a largo plazo tras la extirpación quirúrgica6.
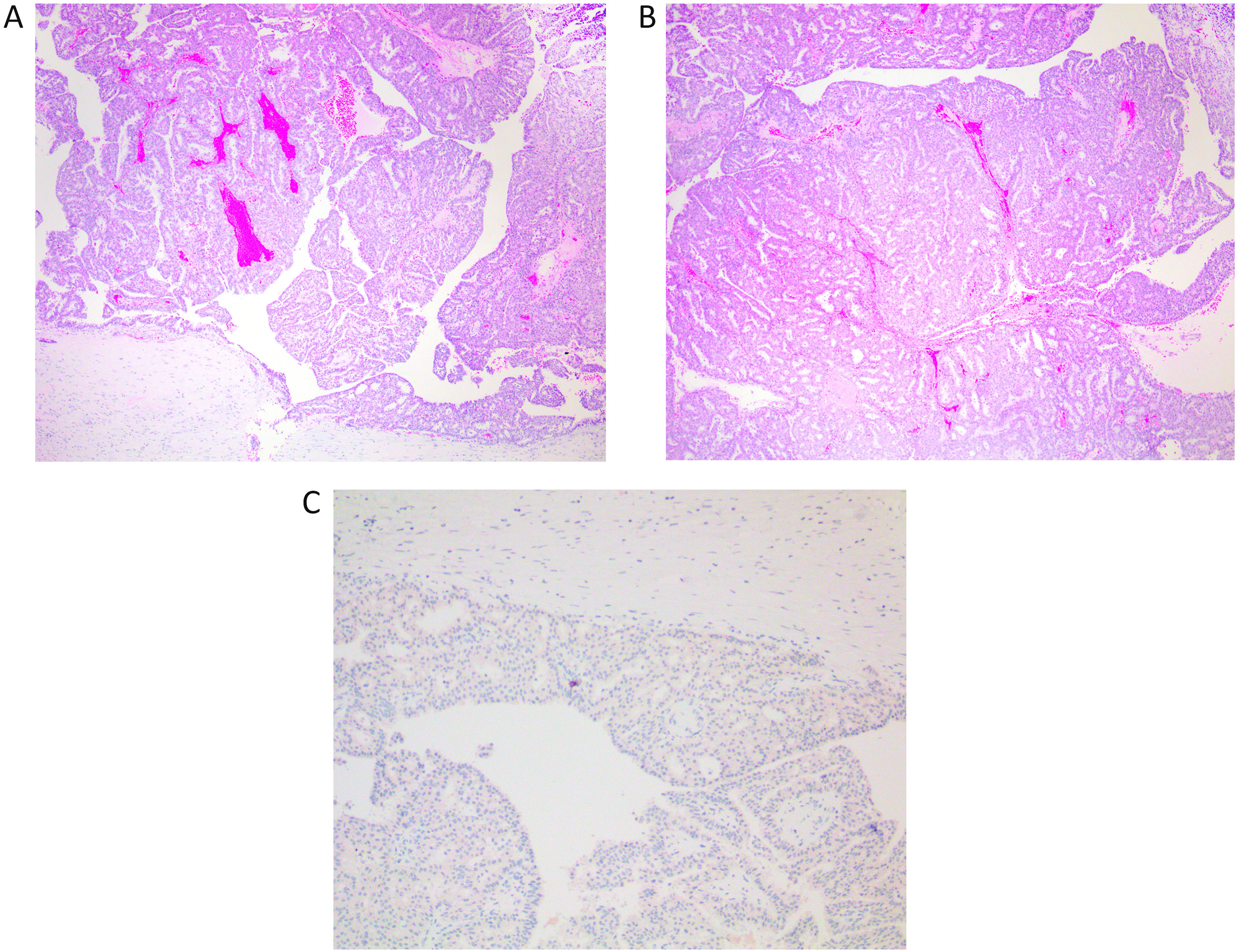
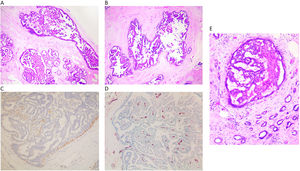
Carcinoma papilar in situEl carcinoma papilar in situ (CPIS) es una forma poco frecuente de carcinoma in situ (fig. 3A y B). Se caracteriza por presentar papilas, esto es, es la única forma de carcinoma in situ que presenta tallos fibrovasculares dentro de los ductos mamarios. Este es el hecho que lo diferencia del resto de los carcinomas in situ (fig. 3D). El resto de las formas de carcinoma in situ solo están formados por células epiteliales sin otros elementos acompañantes. La presencia de vasos intraluminales aumenta la probabilidad de hallar focos de hemorrágica, y macrófagos con hematoidina o hemosiderina. Si observamos este hallazgo poco habitual hay que pensar en el carcinoma in situ papilar. Los ductos afectados son de mediano y gran calibre y pueden presentarse agrupados o extenderse linealmente a lo largo del trayecto de un ducto. El CPIS no se presenta asociado a una lesión prexistente de PID, sino que se presenta de novo1,2.
A y B) Imagen de carcinoma papilar in situ ocupando varios ductos (x100, H-E). C) Se observa un revestimiento de CME en el ducto, con ausencia de trama de CME en las papilas (x200, IHQ p63). D) Se ponen de manifiesto las papilas por el eje vascular, que marca con CD34 (x200, IHQ CD34). E) En esta imagen se observa un CPIS rodeado por un carcinoma infiltrante de mama (x200, H-E).
El revestimiento epitelial suele ser columnar y su grado de atipia determina el grado del CPIS, pero en general es bajo o intermedio. Se presenta con arquitectura mixta con papilas y entremezclado con las áreas de patrón cribiforme y micropapilar.
Se describió un subtipo llamado dimórfico, por estar compuesto por 2 tipos celulares, uno columnar superficial, y por debajo una población de células redondeadas llamadas globoides, que no corresponden a CME7.
El diagnóstico diferencial se debe realizar con los papilomas intraductales de pequeño calibre, utilizando los marcadores mioepiteliales. Así, el papiloma mostrará un revestimiento continuo de CME, en las papilas y también bajo el epitelio del ducto que lo aloja. Sin embargo, el CPIS, solo mostrará una hilera de células mioepiteliales bajo el epitelio del ducto con ausencia de CME en las papilas (fig. 3C).
Debemos diferenciarlo también del carcinoma papilar encapsulado, en este caso la lesión papilar será única o constituida por pocos nódulos de gran calibre; con un diámetro muy superior al de los ductos. Además, en general, el carcinoma papilar encapsulado carece también de CME en la pared del ducto.
Carcinoma papilar encapsuladoEl carcinoma papilar encapsulado (CPE) es un subtipo que representa menos de un 2% de los carcinomas de la mama. Este subtipo recibió diferentes denominaciones como carcinoma papilar intraquístico, y en 2013, se eligió el nombre actual para homogeneizar los diagnósticos2. Se presenta habitualmente en las pacientes posmenopáusicas, su localización suele ser retroareolar, se manifiesta como masa palpable. Su imagen ecográfica es de masa redondeada, y puede confundir a los radiólogos con una lesión benigna (BRDS-4). Por su localización retroareloar y la ocupación de los ductos, suele manifestarse clínicamente con secreción sanguinolenta por pezón1,2.
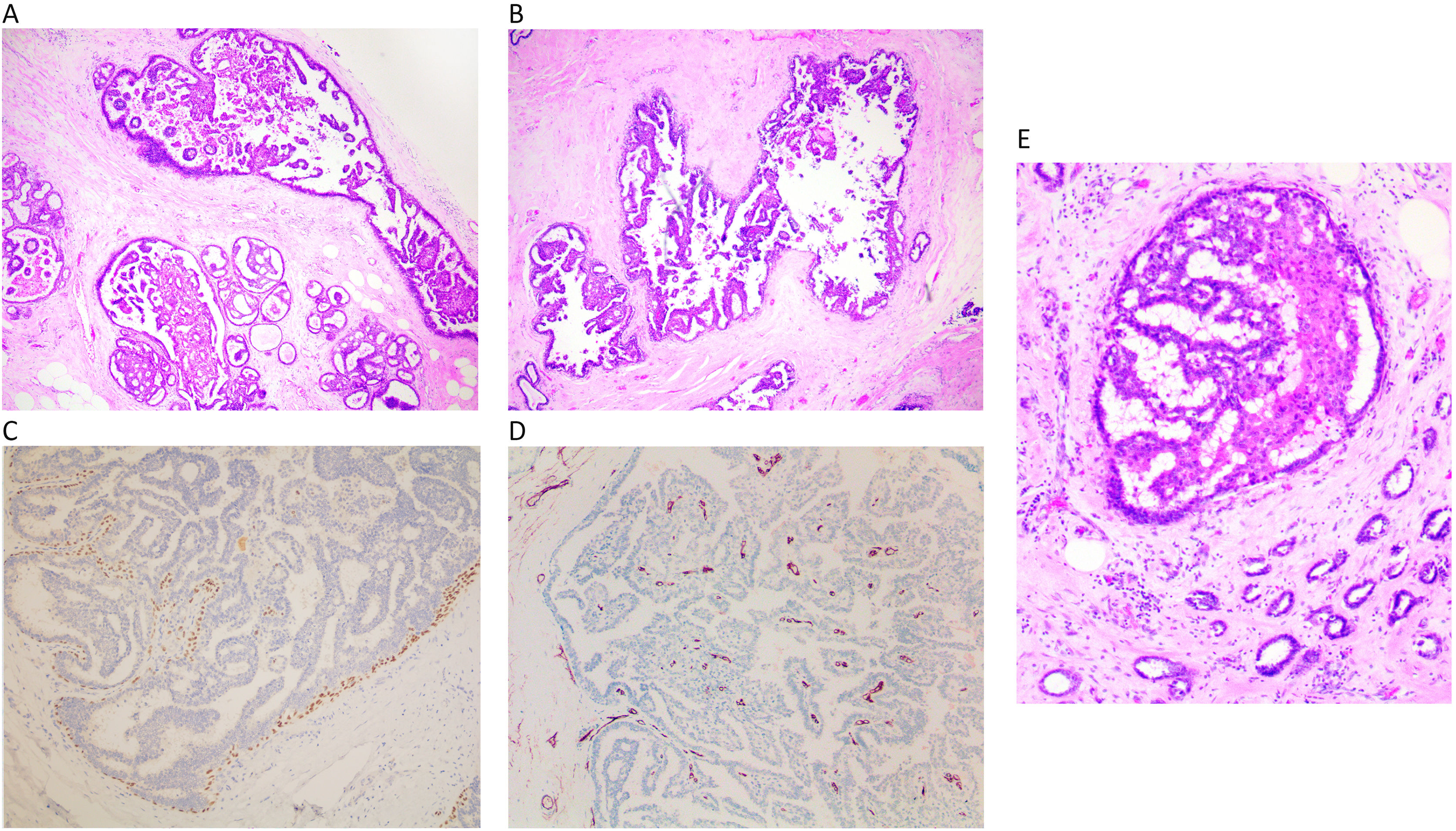
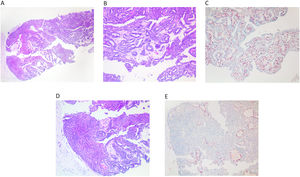
Se caracteriza histológicamente como un nódulo de tamaño superior a un ducto, en general más de 3–4 mm, y que puede alcanzar un tamaño muy grande de hasta 2 y 3 cm (fig. 4A). En ocasiones son 2 o 3 nódulos próximos. Los nódulos están compuestos por una pared quística con fibrosis concéntrica y grosor variable, y un contenido papilar. Estas papilas suelen tener una arquitectura compleja y se presentan muy empaquetadas dentro del nódulo (fig. 4B). Las papilas muestran un revestimiento epitelial de atipia baja o moderada. En el estudio de CME, se observa una falta de CME en las papilas y en la cápsula (fig. 4C). En esta última, puede quedar alguna CME aislada. Es muy frecuente la presencia de un componente de carcinoma in situ, que puede ser papilar o no. Es necesario realizar una inclusión extensa de la lesión (completa, si no es muy grande) para detectar la presencia de las áreas de invasión o rotura de la cápsula, que se asocian a las áreas de crecimiento infiltrante. Estas áreas, en general, corresponden a un carcinoma infiltrante no específico y no a un carcinoma papilar infiltrante.
A) CPE que muestra un crecimiento papilar alojado en una gran pared quística, que muestra contornos irregulares. El epitelio en la pared quística está compuesto por varias capas de células (x100, H-E). B) El crecimiento papilar está compuesto por células pequeñas y con escasa atipia (x100, H-E). C) Se observa una ausencia completa de CME, con p63 (x100, IHQ p63).
En una BAG, observamos la pared quística muy adherida al componente papilar interno. Otro rasgo característico es que el revestimiento epitelial de la pared quística es grueso de 4 o 5 capas de células. Este rasgo nos permite orientar el diagnóstico hacia el CPE y no hacia las lesiones papilares benignas o carcinoma in situ papilar. En ocasiones podemos observar en los cilindros carcinoma in situ papilar o no. En aconsejable informar estas lesiones como lesión papilar y añadir que es compatible o sugestiva de carcinoma papilar encapsulado.
El CPE es un carcinoma infiltrante que tiene un comportamiento biológico tan indolente, que se estadifica según el TNM8, como carcinoma in situ (pTIS)9. Este hecho conduce en algunos casos a la confusión, a la hora de establecer la indicación o no de realización de ganglio centinela. En mi opinión si no hay contraindicaciones, sería recomendable realizar el ganglio centinela10.
Aunque, en general, el CPE muestra un grado bajo o intermedio de Nottingham, se han descrito casos aislados con una atipia epitelial muy acusada, en estos casos se debe estadificar como si la lesión fuera infiltrante11,12.
Se ha observado que en general corresponden a un fenotipo luminal A, salvo los casos de alto grado. Se han detectado frecuentes mutaciones en PIK3CA, similar a otros carcinomas infiltrantes de bajo grado, estrógenos positivos13.
El diagnóstico diferencial se debe realizar con el PID, que muestra una arquitectura papilar. En el caso de PID, esta arquitectura es simple y las papilas se encuentran separadas, los tallos son más gruesos y sobre todo el grosor del epitelio es reducido de 1 a 3 células. La CME ayudan a diferenciar ambas lesiones por su presencia en el PID y su ausencia en el CPE. Lo debemos distinguir del CPIS por el diámetro de los nódulos y la presencia de CME en la pared del ducto. Como ya hemos señalado, es muy frecuente encontrar CPIS en la periferia del CPE.
Carcinoma papilar sólidoComo el CPE, el carcinoma papilar sólido (CPS) también es una variante rara de carcinoma de mama (1,3% del total de carcinomas de mama). Se presenta en las mujeres posmenopáusicas. Se localiza en posición retroareolar y se puede acompañar de clínica de secreción por pezón. Radiológicamente, se presenta como una lesión redondeada bien circunscrita, hipoecoica y heterogénea en la ecografía14,15.
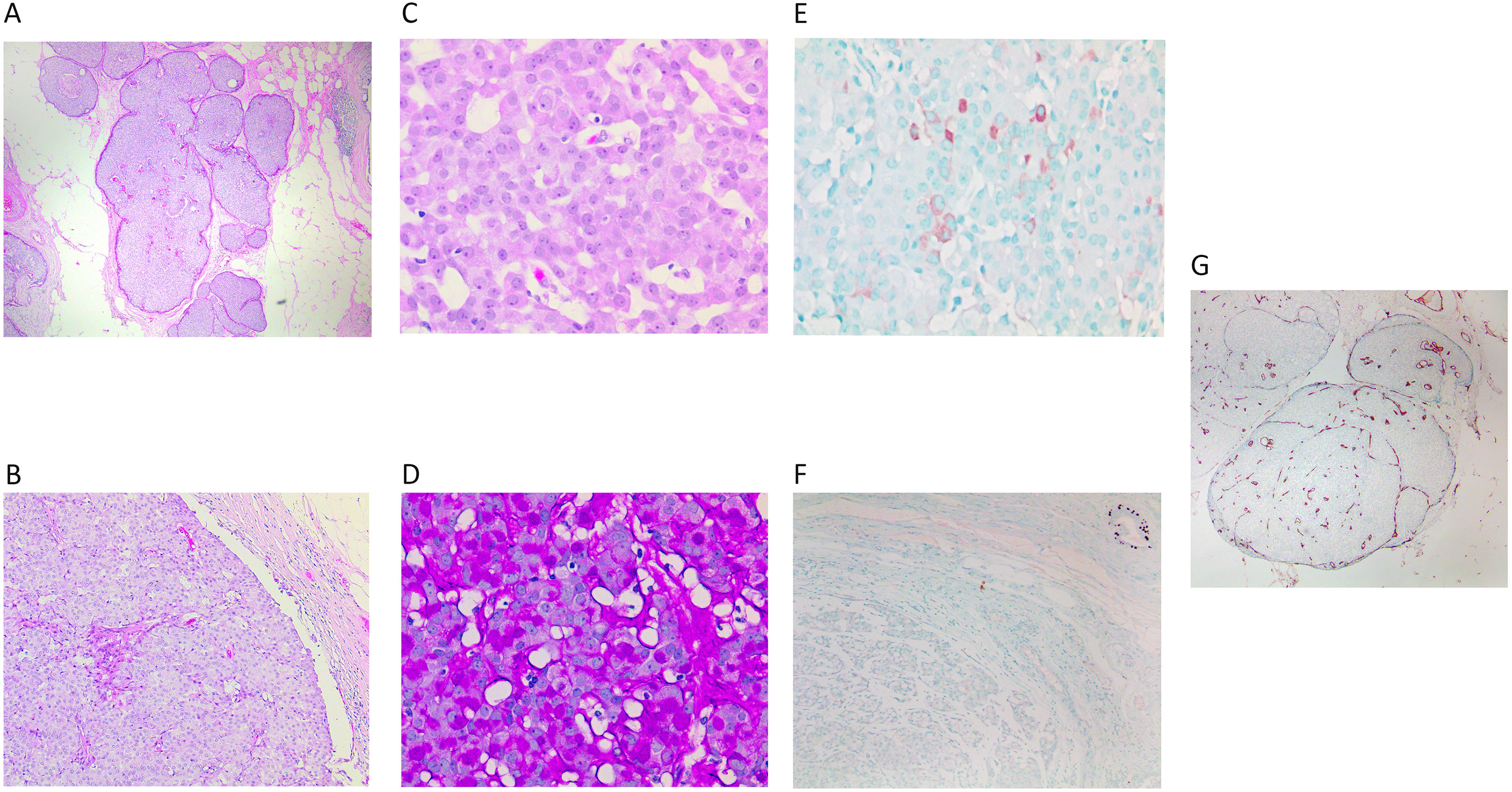
En el pasado no se distinguía entre el CPS in situ (fig. 5A) y su forma infiltrante, sin especificar la extensión de la infiltración. En la última clasificación de WHO4, se establecen los criterios para diferenciar entre ambas formas. Es muy característico que ambas formas muestren diferenciación neuroendocrina (fig. 5E) (entre el 30 y el 95% de los casos)14 y mucinosa (fig. 5D) (entre el 46 y el 100% de los casos)14, y eso no debe modificar su diagnóstico.
A) Panorámica de un carcinoma papilar-sólido in situ. Muestra nódulos de bordes romos (x40, H-E). B) Se compone de una celularidad monomorfa de crecimiento sólido, que se acompaña de septos vasculares finos (x100, H-E). C) Detalle de las células con espacios que alojan los finos capilares (x400, H-E). D) Con la tinción de PAS, se observan abundantes vacuolas ocupando el citoplasma de las células (x400, PAS). E) Se observa expresión muy focal de sinaptofisina (x400, IHQ sinaptofisina). F) Ausencia de marcaje para p63 en la lesión. Se observa el control positivo en un ducto cercano (ángulo superior derecho) (x200, IHQ p63). G) Con CD34 se resalta la trama vascular poco evidente en los nódulos sólidos (x40, IHQ CD34).
El CPS in situ se caracteriza por un crecimiento sólido y expansivo que oculta los finos septos vasculares que transcurren de forma muy delicada entre las células epiteliales. Se pueden poner de relieve mediante CD34 (fig. 5G). Se acompañan en general de una cápsula fibrosa y constituyen uno o 2 nódulos bien definidos. Están compuestas por células de pequeño calibre, con baja o moderada atipia (fig. 5B y C). Pueden mostrar núcleos en «sal y pimienta». El citoplasma puede ser intensamente granular. A veces se disponen en empalizada o trabéculas sobre los ejes vasculares. No se observan CME a lo largo de las papilas ni en el margen de la lesión, sin embargo, se clasifica como lesión in situ (pTis) (fig. 5F)4,14,15.
Los principales diagnósticos diferenciales se deben plantear con PID que muestre hiperplasia ductal atípica y carcinoma in situ, sobre todo en BAG. En este caso nos puede ayudar el estudio de la CME, que estarán presentes en el PID. Además, podemos utilizar los receptores de estrógeno que serán positivos en todos los núcleos, en el CPS y en el PID será una positividad parcheada. La citoqueratina 5/6, será negativa en CPS y parcheada en PID.
Para considerar el diagnóstico de CPS infiltrante se debe observar una franca infiltración. Es decir, los cordones tumorales se vuelven más irregulares y finos, de trazado en puzle; adquieren un patrón infiltrante. Se puede observar una reacción desmoplásica del estroma16. Este componente infiltrante, además del patrón papilar-sólido, puede mostrar también diferenciación neuroendocrina y mucinosa, como en la forma in situ3.
Se han estudiado las alteraciones moleculares en muy pocos casos17. No se han observado diferencias en el número de copias, entre CPE, CPS y carcinoma papilar infiltrante. Sin embargo, se ha observado mayor expresión de los genes reguladores de la diferenciación neuroendocrina (RET, ASCL1 y DOK7), en el CPE, a diferencia de CPS y carcinoma papilar infiltrante17.
Carcinoma papilar infiltranteEl carcinoma papilar infiltrante es una variante de carcinoma de mama muy infrecuente. Está formado por estructuras papilares revestidas de un epitelio atípico que se asienta sobre los ejes fibrovasculares. El patrón de crecimiento es claramente invasivo. En el estudio de las CME, se aprecia una falta completa de estas células en el crecimiento tumoral. A diferencia del CPE y el CPS, en este caso no se observa ninguna cápsula fibrosa. El epitelio tumoral muestra grado intermedio y alto. Se debe graduar atendiendo al sistema de Nottingham16. En general, el CPI está compuesto por células luminales que expresan receptores de estrógeno, progesterona y son negativas para Her-2. En ocasiones, se observa un componente de carcinoma in situ. En caso de no observarlo, resulta necesario plantearse la posibilidad de una metástasis. Sobre todo, de origen ovárico (carcinoma seroso de ovario) que resulta también positivo para receptores de estrógeno. El CPI será positivo también para GATA 3, Sox 10; mientras que el carcinoma seroso de ovario resultará positivo para PAX-8.
Existe poca información sobre el seguimiento de este subtipo, y en general se considera que presenta un pronóstico pobre2.
Algunas lesiones especialesEn este apartado voy a destacar alguna excepción a los criterios generales de diagnóstico en las lesiones papilares y las CME, que hemos revisado en estas páginas. Estos criterios no se cumplen en las lesiones que siendo papilares muestran un revestimiento apocrino.
En 2011, Cserni observó que algunas lesiones papilares con revestimiento apocrino carecían totalmente de revestimiento mioepitelial. Estudió las CME con múltiples marcadores como p63, citoqueratina 14, calponina, S-10018,19. Y confirmó que no se identificaban CME. Resulta un hecho sorprendente que puede conducir a un error diagnóstico, y considerar que se trata de un CPE. Posteriormente, Tramm observó que este hecho no se limita a las lesiones papilares benignas, sino a todas las lesiones apocrinas, tanto benignas como malignas20. Por ello, en las lesiones papilares con revestimiento apocrino, debemos atender a otros rasgos morfológicos como la atipia celular, la complejidad arquitectural, la integridad de la cápsula, para poder clasificar las lesiones papilares.
Mensajes finales-El diagnóstico de las lesiones papilares de la mama es complejo y resulta necesario un conocimiento profundo de las claves morfológicas para su diagnóstico certero.
-El diagnóstico definitivo solo puede realizarse en la pieza de extirpación, por lo cual conviene utilizar un nombre genérico en la BAG (lesión papilar), y un diagnóstico probable (compatible con…).
-Todas las lesiones papilares deben ser extirpadas, salvo el PID sin atipia, y se propone un manejo cada vez más conservador con las lesiones benignas.
-El estudio de las CME es imprescindible para la correcta clasificación de las lesiones papilares de la mama.
-El comportamiento de los carcinomas papilares es bueno, salvo el CPI.
Responsabilidades éticasAl tratarse de un artículo de revisión no aplica la aprobación por parte del comité de ética.
FinanciaciónNo se ha recibido ningún fondo de financiación específico para la realización de esta revisión.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.