Introducción
El éxtasis es el nombre comúnmente utilizado para designar a un derivado anfetamínico, la 3,4-metilendioximetanfetamina (MDMA), prototipo de las denominadas «drogas de diseño o de síntesis». Estas sustancias (tabla 1), de características parecidas a la anfetamina y la mescalina, no son productos de nueva síntesis, al contrario de lo que podría parecer, sino que proceden de fármacos que nunca llegaron a comercializarse o que se abandonaron por falta de eficacia clínica y que pasaron posteriormente al mercado clandestino1.
El consumo de drogas de síntesis ha adquirido, en los últimos años, gran relevancia en ciertos grupos de jóvenes, básicamente en medios urbanos y bajo un patrón de uso de fin de semana, asociado a actividades lúdicas, aunque, en la actualidad, existe un fenómeno de amplia expansión hacia los medios rurales. Entre los motivos de esta rápida expansión hay que mencionar la falsa idea de los consumidores de una nula toxicidad y de la inexistencia de riesgo para la salud, junto al convencimiento de que su uso mejora ostensiblemente la capacidad de relación interpersonal y de diversión2.
Antecedentes históricos
La MDMA fue sintetizada en Alemania en 1914, por Merck Pharmaceutical Company y patentada como anorexígeno, con el número de patente 274.350. Sin embargo, pese a que nunca llegó a comercializarse, el Departamento Edgewood Chemical Warfare Service de la Armada norteamericana se interesó por esta sustancia (denominada por ellos como «agente de experimentación número 1478») y, en 1953, realizó diversas pruebas experimentales en la Universidad de Míchigan, que determinaron su toxicidad en animales, resultados que no fueron publicados hasta 20 años después, cuando la información fue desclasificada3. El primer informe sobre los efectos psicoactivos de la MDMA en el humano fue publicado por Shulgin y Nichols, en 1976, y en él se apunta: «Dentro de la gama de dosificación efectiva, entre 75 y 150 mg tomados oralmente, los efectos se notan muy rápidamente, casi siempre media hora después de su administración... Hay pocos indicadores físicos de intoxicación y las secuelas psicológicas son prácticamente inexistentes. Cualitativamente, la droga parece evocar un estado de conciencia alterado, fácilmente controlable, con sugerencias emocionales y sensuales»4.
En la década de los setenta, se utilizó el éxtasis por parte de un colectivo de psiquiatras norteamericanos, como coadyuvante de la psicoterapia, dada su capacidad para facilitar la comunicación entre el paciente y su psiquiatra5. A pesar de que la toxicidad en el humano no fue estudiada, esta droga comenzó a hacerse popular a finales de los años setenta, en el marco de la cultura psicodélica y underground, cuando un laboratorio californiano llegó a manufacturar la MDMA, acompañada de una publicidad que invitaba a vivir una experiencia extasiante. La droga se vendió en el mercado con distintos nombres: «emphaty», «love-drug», «essence», «adam», «clarity», «XTC», «zen», «banana split», «M&M», y se consagró como más popular el nombre de «éxtasis»6. Desde 1983, se comenzó a documentar su uso como droga recreacional. Entre las características más comentadas de esta sustancia y otras relacionadas se encontraban la intensificación de la comunicación y la exploración de las relaciones interpersonales, por lo que fueron denominadas «empatógenas» (generadoras de empatía). Pero, por otro lado, la capacidad descrita por algunos sujetos de que el éxtasis les permitía mantener un contacto interior o entrar en contacto con uno mismo, y facilitaba la comunicación de sus estados emotivos internos, ha condicionado que, tanto al propio éxtasis, como a algunas sustancias parecidas, como la 3,4-metilendioxianfetamina (MDA) o la 3,4-metilendioxietilanfetamina (MDEA), se las conozca también con el nombre de «entactógenos», término compuesto de raíces latinas, que viene a significar precisamente «permitir un contacto interior»4.
Sin embargo, en 1985, por el procedimiento de urgencia, la DEA (Drug Enforcement Administration) de Estados Unidos y la Comisión sobre Estupefacientes de la OMS, en 1986, incluyeron al éxtasis en la Lista I del Convenio de Sustancias Psicotrópicas de las Naciones Unidas (Convención de Viena, 21 de febrero de 1971). En España, quedó incluida en su correspondiente lista, por Orden Ministerial de 6 de junio de 1986. Estas prohibiciones desencadenaron una enorme polémica, ya que su inclusión en la citada lista tuvo lugar sin que se hubieran realizado estudios específicos sobre ésta en seres humanos, basándose fundamentalmente en la neurotoxicidad provocada en el ratón por el análogo MDA. La confusión creada llegó a nuestro medio y, mientras que la Audiencia Nacional (sentencia de la Sección 1.a de la Sala de lo Penal de 12 de enero de 1994), basándose en informes de expertos, calificó a la MDMA como una substancia de baja peligrosidad, el Tribunal Supremo la consideró como «muy nociva para la salud» y, por tanto, su tráfico ilegal fue calificado como delito contra la salud pública5-6. La controversia se ha ido trasladando a diferentes estamentos sociales, existiendo grupos favorables al consumo, que emplean como elemento de comunicación la red de Internet7, frente a autores que consideran que el consumo supone un alto riesgo8, o los que señalan que no existen evidencias tangibles de neurotoxicidad9.
Con el nacimiento, a finales de los ochenta, del movimiento Acid House, el consumo de éxtasis experimentó su mayor auge, coincidiendo con la aparición en el mercado de las primeras pastillas manufacturadas en grandes laboratorios holandeses. Se trataba de reuniones de carácter ritual en las que, según la prensa de la época, se conjugaba la mística del trance, el consumo de drogas y las prácticas sexuales10. Este movimiento encontró su máxima expresión, con las correspondientes peculiaridades, en la isla de Ibiza, y de allí se exportó al entorno londinense. Precisamente, los primeros casos de intoxicaciones agudas y muertes por consumo de MDMA se reportaron en el Reino Unido durante la segunda mitad de 199111. En nuestro medio, la «Ruta del Bakalao» es herencia de estos movimientos, que bajo la bandera de la «música máquina», gozó de gran predicamento entre ciertos grupos de jóvenes durante los años 1993-1996, y se asoció a una gran accidentalidad en los fines de semana y a los primeros grandes decomisos policiales de drogas de diseño. En 1996 se comunicó en España el primer caso de muerte por reacción aguda durante el consumo de éxtasis.
Datos epidemiológicos y patrones de consumo
Aunque los estudios epidemiológicos sobre el consumo de éxtasis poseen un importante sesgo, debido a la falta de muestras representativas, a la falta de veracidad en la respuesta a las encuestas, dada la ilegalidad de la sustancia, etc., se han publicado algunos datos que pueden dar idea de la magnitud de este tipo de consumo1: en Estados Unidos, un 2% de los estudiantes de institutos de enseñanzas medias reportaron haber consumido éxtasis en los 12 meses previos a la encuesta del National Institute on Drug Abuse de 1993 y un 5% de los jóvenes de 16 años consumieron MDMA en 1996; un 5% de la población estudiantil holandesa (12-18 años) consumió MDMA en alguna ocasión, cifra que se elevó al 9% de los estudiantes de cursos especiales y al 29% de los estudiantes conflictivos12; en el Reino Unido, un 13% de una muestra de 3.699 estudiantes de segundo curso universitario declararon haber consumido esporádicamente MDMA, mientras un 3% era consumidor habitual13. A modo de resumen, el porcentaje de consumidores entre escolares europeos en 1995-1996 osciló entre el 8-9% de los Países Bajos, el Reino Unido e Irlanda y el 1-2% de Dinamarca, Finlandia y Suecia12. En términos globales, Landry14 estima que la MDMA ha sido consumida por 6,4 millones de individuos.
En España, según las Encuestas Domiciliarias sobre Consumo de Drogas, el uso de estas anfetaminas de diseño, en los últimos 12 meses, fue del 3% de la población estudiantil de edades comprendidas entre 14 y 18 años en 1994 y del 3,9% en 1996, mientras que en la encuesta de 1994, un 3,5% de los encuestados reconoció haberla consumido alguna vez y en la de 1996, un 5,1%15. En la Comunidad de Madrid, estas cifras alcanzan el 3,9% de la población trabajadora ocupada y el 6,4% de los parados, y destaca el rango de edad comprendido entre los 16 y 24 años16, porcentajes parecidos a los obtenidos en el País Vasco, donde un 4,1% de los jóvenes entre 13 y 19 años refirió haber consumido estas sustancias17. En un estudio realizado sobre una muestra de 3.634 jóvenes que cumplieron el servicio militar en Asturias entre 1995 y 1999, Bobes et al18 encontraron una prevalencia de consumo de MDMA a lo largo de la vida del 10,9% (7,8% en el año previo y 4,5% en el mes previo). A pesar de que los datos aportados por el Observatorio Español sobre Drogas (OED)19 en su Encuesta sobre Drogas a la Población Escolar, realizada en 1998, confirmaron una cierta desaceleración en el consumo habitual y esporádico de drogas de diseño, que bajaban a las cifras publicadas en 1994, en el Informe número 5 de este observatorio20, donde se recogen los datos de la Encuesta sobre Drogas a la Población Escolar durante el período 1998-2000, se confirma un incremento de consumidores de éxtasis, mientras que se reducen los de anfetaminas, alucinógenos y cocaína. El 5,7% de los estudiantes encuestados refirió haber consumido drogas de diseño alguna vez en su vida, el 4,8% en los últimos 12 meses y el 2,5% en el último mes.
Hay que tener presente también, que una característica importante del consumo de éxtasis es lo infrecuente de su uso único, ya que es habitual el policonsumo con otras sustancias: cannabis (90,9%), alcohol (87,2%), anfetaminas (41,3%), cocaína (40%), opiáceos (8,9%), etc.16. Cifras parecidas son reportadas en el informe número 5 del OED en relación con la población estudiantil de secundaria: cocaína (50,9%), cannabis (88,7%), alucinógenos (48,8%), alcohol (98,1%), tabaco (80,5%). Por otro lado, la mayoría de los consumidores de esta sustancia (hasta un 80%) dejan de consumirla antes de los 30 años21.
En relación con los patrones de consumo, parecen existir distintos tipos. Por un lado, se ha propuesto el empleo de esta droga, bajo un cierto control sanitario, como agente psicoterapéutico, con el fin de facilitar la comunicación entre el paciente y su entrevistador. Sin embargo, este método carece de la autorización de la FDA y otras administraciones sanitarias, y es puramente anecdótico. Además, como refiere Schuckit22, los escasos estudios controlados en este tipo de uso concluyen que no existe ningún beneficio terapéutico con el empleo de esta sustancia.
El principal y más problemático patrón de consumo hay que circunscribirlo en su utilización como sustancia recreativa. De esta forma, el éxtasis se consume preferentemente en fiestas con música repetitiva a alto volumen (fiestas con música «máquina», «ácida», «raves», «bakalao» o «Baleares sound») y en zonas donde suele existir una temperatura elevada, que pueden producir efectos psíquicos y físicos diferentes23-24. La dosis habitual, en este tipo de consumo recreacional, suele ser 1-2 comprimidos, cuyo contenido de MDMA oscila entre 60-120 mg por comprimido25. En nuestro país, se ha realizado un estudio del perfil psicosocial y psicopatológico de los consumidores de éxtasis, por el Grupo de Psiquiatría de la Universidad de Oviedo, en el que se destaca que ninguno de los sujetos estudiados había solicitado previamente asistencia clínica pública o privada. Estos sujetos mantienen contactos habituales con consumidores de otras drogas y consumen el éxtasis de forma exclusiva durante los fines de semana, consumo que relacionan con actividades lúdicas y siempre en compañía de otras personas. El perfil del grupo se corresponde con el buscador de sensaciones, con estados anímicos cambiantes y elevados niveles de ansiedad e impulsividad. La búsqueda de nuevas formas de divertirse o escapar del aburrimiento serían el motivo aparente que podría llevar a estas personas al consumo de este tipo de drogas de diseño26. La edad media de inicio en el consumo de éxtasis en España, durante el año 2000, fue los 17,9 años20.
Finalmente, existe un tercer tipo de consumo, que no parece estar implantado en nuestro medio, denominado «new age». Se trata de un movimiento espiritualista que considera a la MDMA como una sustancia que facilita la comunicación y es capaz de inducir estados de humor positivos, sensación de intimidad y tranquilidad, que mejoran la empatía y la comunicación entre los practicantes de esta ideología27.
El atractivo de la MDMA, por tanto, se puede justificar en 2 razones principales. La atribución de sus beneficios terapéuticos y/o espirituales y sus reputadas propiedades euforizantes y sensuales. La mayoría de los usuarios agradecen ambas cualidades, aunque muestran un desacuerdo considerable en cuanto a su importancia relativa. En líneas generales, los individuos que usan la MDMA como coadyuvante terapéutico y espiritual realmente no utilizan otras drogas, exceptuando las psicodélicas. Por el contrario, los que buscan euforia o sensualidad asociada al éxtasis usan en general un amplio espectro de drogas y describen encontrar en el éxtasis algunas de las cualidades previamente buscadas con otras sustancias, como por ejemplo la cocaína26.
En los últimos años, como relatan Boot et al25, los patrones de uso de la MDMA parecen cambiar, ya que ha aumentado el consumo vía parenteral, los intervalos entre consumos se han reducido, así como la ingesta de múltiples comprimidos en una única vez. En estos casos, el riesgo de neurotoxicidad es, evidentemente, bastante mayor.
Propiedades fisicoquímicas
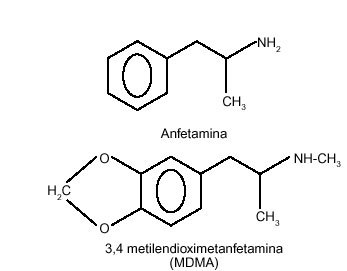
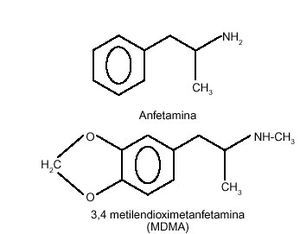
La MDMA es, como se ha comentado, un derivado de la feniletilamina, al igual que la mescalina y la anfetamina. La figura 1 representa la estructura química de la MDMA; se trata, en su forma pura, de un polvo blanco de sabor amargo. Inicialmente, estos productos se presentaron en forma de cápsulas, pero en la actualidad se encuentran habitualmente en forma de comprimidos (250-350 mg de peso), con diversos colores, entre los que destacan el blanco, gris, beige y amarillo pálido, y vistosamente decorados. Es importante destacar que la fabricación ilícita del éxtasis es relativamente sencilla y que, en la mayoría de los casos, estos preparados galénicos contienen otras sustancias en su composición, en ocasiones incluso en mayor proporción que la propia MDMA. Entre los componentes habituales del éxtasis se suelen encontrar anfetaminas y otros derivados de éstas, como MDEA, MDA, MDB (3,4-metilendioxifenilbutanamina), cafeína, LSD, cocaína, codeína, fenciclidina, estricnina, ketamina o efedrina. En ocasiones, el éxtasis está adulterado por soportes galénicos como almidón, sacarosa o lactosa, celulosa, etc. En España es muy habitual la N-etil-MDMA, que, en algunos momentos, ha podido superar proporcionalmente a la MDMA28. Por otro lado, hay que tener presente también que el contenido de principio activo puede diferir tremendamente entre los diferentes comprimidos existentes en el mercado clandestino (diferencias de hasta 5 veces en la cantidad de MDMA o alguno de sus derivados).
Figura 1. Estructura química de la MDMA.
Finalmente, hay que considerar también que la MDMA se presenta como mezcla racémica, y contiene una cantidad similar de los 2 enantiómeros. Algunos autores apuntan que la forma S-(+)-MDMA es más tóxica29 y responsable de los efectos dopaminérgicos precoces del éxtasis30.
Aspectos farmacológicos
Características farmacocinéticas de la MDMA
El estudio específico de las propiedades farmacocinéticas de la MDMA en el humano es muy escaso31, dadas las características ilícitas de su consumo y utilización. Por tanto, la mayor parte de los datos existentes hasta mediados de los noventa procedían de la farmacocinética general de las feniletilaminas y de ciertos estudios metabólicos en roedores32. Posteriormente, se realizaron algunos estudios farmacocinéticos específicos en humanos33-35.
La vía de administración más frecuente de la MDMA es la oral, y los consumidores de esta sustancia suelen hacerlo con el estómago vacío, con objeto de lograr una absorción más rápida. A pesar de que no existen estudios específicos rigurosos, el proceso de absorción debe ser muy rápido36, ya que al cabo de 20-60 min se observan los primeros efectos de la sustancia. Si extrapolamos este parámetro al de otras anfetaminas, la absorción podría ser completa a las 3-6 h de la ingesta. Helmlin et al34, en un estudio con 2 sujetos, obtuvieron, tras la administración oral de éxtasis, una Tmáx de 2 h para la MDMA y 6,3 h para el metabolito MDA. Hay que tener presente, en este sentido, que aunque la vía de administración oral es la más empleada, existen otras 3 vías posibles: intravascular, intranasal e inhalatoria (éxtasis fumado).
La distribución orgánica de las fenil-isopropil-aminas es muy amplia, ya que son sustancias que atraviesan bien la barrera hematoencefálica, con el consiguiente riesgo de acumularse en el sistema nervioso central (SNC). También se distribuyen ampliamente, aunque en menor medida, en el riñón y en los pulmones. Tampoco se conocen los índices de unión a proteínas plasmáticas de las nuevas drogas de diseño, aunque las anfetaminas, como grupo, poseen unas tasas de unión muy bajas (15% el metilfenidato, 16% la anfetamina y 34% la fenfluramina).
Por su parte, el metabolismo de las anfetaminas es hepático, y se elimina una alta proporción sin metabolizar por la orina. De hecho, en un caso estudiado, correspondiente a la administración a un solo sujeto de 50 mg de MDMA, un 7% se metabolizó a MDA y un 65% se excretó sin metabolizar2. En la rata, el metabolismo hepático de la MDMA es similar al de las anfetaminas, y se obtienen 2 metabolitos principales, uno vía N-desmetilación, que da lugar a MDA, y otro vía O-dealquilación, que origina DHMA (3,4-dihidroximetanfetamina)32. En la génesis de DHMA participaría el complejo enzimático del citocromo P-450, en concreto las subfamilias enzimáticas CYP2D y CYP2B37. Por su parte, en humanos, se ha comprobado in vitro la participación de la isoenzima CYP2D6 en el metabolismo de MDMA a DHMA33. Ciertos autores estiman que el metabolismo de la MDMA puede ser saturable, con el subsiguiente riesgo de acumulación e inducción de fenómenos tóxicos36. Además, es preciso mencionar que aproximadamente en el 10% de la población caucásica, la actividad de la isoenzima CYP2D6 está notoriamente reducida, lo que prolonga la vida media de eliminación, y hace a estos sujetos especialmente susceptibles a las reacciones adversas de la sustancia33.
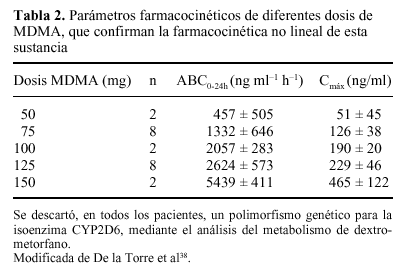
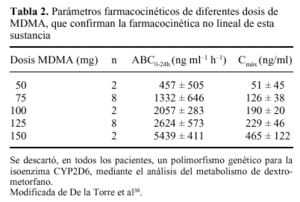
Por otro lado, Camí et al35 han confirmado que la MDMA posee una farmacocinética no lineal, de for ma que pequeños incrementos en la dosis administrada se traducen en aumentos desproporcionados en las concentraciones plasmáticas (tabla 2), lo que puede suponer un notable riesgo de intoxicaciones agudas y explicar ciertos casos de muerte por consumo de éxtasis38. Asímismo, este hecho también puede explicar el porqué de la mayor proporción de efectos adversos físicos y psicológicos observados en mujeres39, habida cuenta de su menor peso corporal medio.
El porcentaje de eliminación urinaria de la MDMA depende del pH de la orina, de forma que su acidificación incrementa notoriamente la eliminación, por lo que esta estrategia suele usarse en los casos de intoxicación. Por su parte, la vida media de eliminación, en alguno de los estudios comentados, fue de 7,6 h2.
Mecanismo de acción de la MDMA
En relación con el mecanismo de acción de la MDMA hay que tener presente que casi todos los estudios que se han llevado a cabo han sido realizados en animales de laboratorio, básicamente en roedores y en primates, y que los resultados obtenidos no son siempre extrapolables al ser humano.
En los animales de laboratorio, los efectos conductuales agudos de la MDMA parecen ser más parecidos a los de los psicoestimulantes que a los de los alucinógenos. Estudios de discriminación de drogas muestran que la MDMA es sustituida por anfetamina, pero no es sustituida por el agente alucinógeno DOM (2,5-dimetoxi-4-metilanfetamina). Asimismo, distintos agentes serotoninérgicos de gran potencia son capaces también de sustituir, en las pruebas de discriminación, a la MDMA, como por ejemplo la fenfluramina, la norfenfluramina y el homólogo de la MDMA, N-metil-1-(1,3-benzodioxol-5)-2-butanamina (MBDB). En líneas generales, los efectos de la MDMA sobre la actividad locomotora son diferentes a los de la anfetamina y parecen estar mediados por un mecanismo serotoninérgico, mientras que los efectos de la MDMA sobre respuestas en conducta operante parecen ser más del tipo estimulante que del tipo alucinógeno40.
En cualquier caso, en los experimentos realizados en animales de laboratorio, se describen 2 fases diferentes en relación a la acción de la MDMA; una fase aguda, que dura aproximadamente unas 24 h, y una fase crónica, cuyos efectos duran hasta 12 meses o incluso más. El mecanismo de acción de ambas etapas no tiene porqué estar asociado41.
Efectos neuroquímicos inducidos por la MDMA en administración aguda
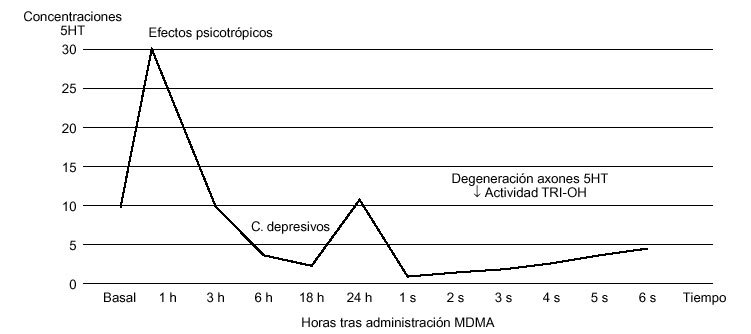
Estudios realizados en sinaptosomas cerebrales de rata muestran que la aplicación de MDMA produce una liberación de serotonina (fig. 2), así como de dopamina, fenómeno que no depende del calcio. De hecho, una dosis aguda de MDMA puede ocasionar la liberación de hasta el 80% de la serotonina almacenada a nivel central43. En este sentido, hay que señalar que la MDMA es un agente liberador de serotonina en mayor medida que de dopamina in vitro. Así, a nivel estriatal, la liberación de serotonina se produce a concentraciones 10 veces inferiores a las necesarias para estimular la liberación de dopamina44. Por otro lado, estudios recientes, que utilizan técnicas in vitro, han confirmado también la capacidad de la MDMA para liberar noradrenalina, con una potencia incluso similar a la de la serotonina45.
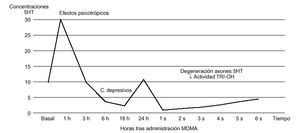
Figura 2. Curso temporal de las concentraciones corticales de serotonina en la rata. TRI-OH (triptófano-hidroxilasa).
El mecanismo por el cual la MDMA libera serotonina, parece estar mediado por una modificación del transportador de membrana de ésta, ya que el efecto es bloqueado por la fluoxetina, el citalopram o la imipramina. Estudios preclínicos han confirmado que la fluoxetina disminuye, de forma dependiente de la dosis, la liberación de serotonina inducida por la MDMA en la corteza prefrontal y el núcleo estriado46. Asimismo, la liberación de noradrenalina producida por la MDMA en cortes de hipocampo es bloqueada por la desmetilimipramina, lo que indica que este efecto se produce también en el transportador de noradrenalina. Puesto que la MDMA no se acumula en los sinaptosomas, se piensa que la capacidad de liberar monoaminas se produce mediante el cambio de la dirección del flujo del transportador de éstas o, lo que es lo mismo, la MDMA revertiría la dirección del flujo del neurotransmisor47.
Además de estimular la liberación de serotonina, dopamina y noradrenalina, la MDMA también aumenta las concentraciones de las tres monoaminas en la hendidura sináptica, al inhibir su recaptación48 y al retrasar su metabolización, gracias a su capacidad de inhibir a la monoaminooxidasa (MAO). También se ha postulado la posibilidad de que la MDMA estimule de forma aguda la síntesis de dopamina en el núcleo estriado49, efecto que parece estar mediado vía estímulo de receptores 5HT2.
Todas estas observaciones sugieren que el mecanismo principal por el que la MDMA puede afectar de forma aguda la excitabilidad neuronal en el cerebro es por aumentar las concentraciones extracelulares de serotonina y catecolaminas y, consecuentemente, activar los receptores serotoninérgicos, dopaminérgicos y noradrenérgicos. Pero, además de estos hechos, se han podido comprobar cambios en la neurotransmisión neuropeptídica inducidos por la MDMA. Así, la administración aguda de MDMA aumentó la concentración de neurotensina en homogeneizados de neoestriado, accumbens y sustancia negra50. Sin embargo, estos cambios parecen ser secundarios a la estimulación dopaminérgica51, ya que pueden ser bloqueados por antagonistas de receptores D1.
Como consecuencia de los mecanismos descritos, se ha podido demostrar, a través de estudios de microdiálisis realizados in vivo, que la administración de MDMA provoca un marcado incremento de dopamina extracelular en las regiones cerebrales que están ricamente inervadas por axones de neuronas dopaminérgicas. La inyección sistémica aguda de MDMA aumenta las concentraciones extracelulares de dopamina en el núcleo estriado. Asimismo, en este núcleo cerebral también aumentan las concentraciones de serotonina, pero en mucha menor medida de lo que sucede con los de dopamina52.
Independientemente de los efectos indirectos provocados por la liberación de monoaminas inducida por la MDMA, esta sustancia exhibe acciones directas, como consecuencia de su capacidad para estimular distintos tipos de receptores53: 5HT2, *2-adrenérgicos (incremento de la presión arterial), histaminérgicos H1 y muscarínicos M1 (efectos sobre la actividad motora y la memoria). Los efectos globales de la MDMA, por tanto, son una consecuencia de ambas acciones, y su desglose es aún más difícil dada la existencia de estos receptores pre y postsinápticos. No obstante, la mayoría de los estudios indican que los efectos predominantes son consecuencia de la liberación de monoaminas41.
Efectos neuroquímicos inducidos por la administración repetitiva de MDMA
La administración de forma repetitiva de MDMA al animal de experimentación (ratas, cobayas y primates) provoca una disminución, de larga duración, de los parámetros neuroquímicos y pruebas histológicas de funcionalismo serotoninérgico en el tronco cerebral. En este sentido, la administración de MDMA induce una reducción de las concentraciones tisulares de serotonina, así como de su metabolito, el ácido 5-hidroxi-indol-acético (5-HIAA), y de la actividad de la triptófano-hidroxilasa, paso limitante de la síntesis de serotonina44. Los déficit descritos pueden persistir durante meses o incluso años, dependiendo del área estudiada y del tipo de animal de experimentación (fig. 2).
Además de los cambios descritos, también se produce una disminución de los locus de recaptación de serotonina en distintas áreas cerebrales (corteza, núcleo caudado, hipocampo, núcleo accumbens, tubérculo olfatorio y otros núcleos talámicos). Estos cambios parecen ser específicos del transportadorserotoninérgico, mientras no se afectan los atecolaminérgicos54. Dosis más elevadas de MDMA (hasta 40 mg/kg) producen también una disminución de las concentraciones de noradrenalina y dopamina en núcleos cerebrales del cobaya55. Asímismo, se ha descrito, en la rata, una regulación al alza de los receptores postsinápticos 5-HT2A en la corteza occipital debido, posiblemente, a un efecto compensador de las bajas concentraciones de serotonina sináptica56.
Los efectos neurobiológicos comentados son más pronunciados y más intensos en los primates que en la rata. La depleción serotoninérgica y la disminución en los locus de recaptación de serotonina en la corteza cerebral de monos ocurren de forma más acusada y a dosis inferiores a las utilizadas en la rata. A título de ejemplo, una dosis repetida de 2,5 mg/kg de MDMA ocasiona una reducción de la densidad de axones serotoninérgicos en el primate similar a la ocasionada en la rata por una dosis repetida de 4 mg/kg57. Del mismo modo, mientras que en este roedor los cambios bioquímicos detectados persisten hasta 32 semanas, en los primates estas modificaciones son más duraderas, se han estudiado hasta 18 meses, y pueden llegar a ser permanentes58. Asimismo, los cambios neurohistológicos son más pronunciados en el mono; mientras que en la rata se ha descrito una regeneración axonal y una reinervación de la región afectada, a partir de los somas neuronales del los núcleos del rafe, que no se ven afectados (patrón denominado de «poda neuronal»), los cambios histológicos detectados en el primate parecen ser permanentes59.
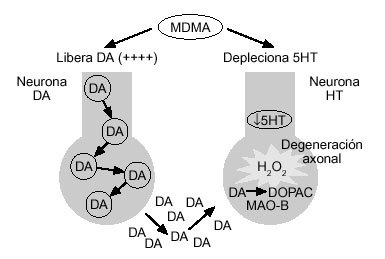
La lesión de los axones serotoninérgicos, observada en ratas y en primates, se produce por un mecanismo no perfectamente dilucidado, pero en el que parece jugar un papel fundamental la dopamina. Así, se sabe que sustancias que disminuyen la liberación de dopamina inducida por MDMA, como puede ser la alfa-metil-paratirosina, la reserpina, antagonistas D2, como el haloperidol, o los antagonistas 5HT2, disminuyen la toxicidad serotoninérgica producida por la MDMA60-62. Por el contrario, aquellas sustancias que potencian la liberación de dopamina inducida por MDMA, como pueden ser la L-dopa o los agonistas 5HT2, aceleran e incrementan la agresión serotoninérgica producida por la droga63 (fig. 3).
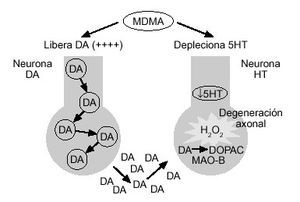
Figura 3. Mecanismo hipotético de toxicidad por MDMA sobre las neuronas serotoninérgicas. DA: dopamina; 5HT: serotonina; DOPAC: ácido 3,4-dihidroxifenilacético; H2O2: peróxido de hidrógeno; MAO-B: monoaminooxidasa tipo B.
En definitiva, algunos autores64 sugieren que el mecanismo íntimo por el que se produce la degeneración axonal serotoninérgica podría seguir la secuencia siguiente (fig. 3): la MDMA deplecionaría de forma brusca las concentraciones neuronales de serotonina, lo que haría más vulnerables a estas neuronas al proceso tóxico. A su vez, la MDMA aumentaría, de forma importante, la síntesis y liberación de dopamina, que sería captada hacia el interior de las terminales serotoninérgicas, donde sería desaminada por la MAO-B, generando peróxido de hidrógeno, que daría lugar a la peroxidación de los lípidos de la membrana celular. Este último proceso ocasionaría el fenómeno de degeneración y destrucción de los axones serotoninérgicos. En este sentido, inhibidores de la MAO-B, como el de prenilo, serían capaces de proteger la destrucción axonal serotoninérgica, debido a que disminuiría la peroxidación de los lípidos de la membrana neuronal64.
En el mecanismo de neurotoxicidad de la MDMA parecen intervenir también mecanismos de tipo extradopaminérgico. Así, los aminoácidos excitatorios podrían estar implicados. En este sentido, si bien no se observa un aumento de ácido glutámico tras la administración de MDMA, Colado et al65 demostraron que los antagonistas de receptores glutamatérgicos, como la dizolcipina, protegen de la toxicidad inducida por la MDMA. No obstante, este efecto parece ser debido a que la dizolcipina protege de la hipertermia inducida por MDMA, ya que este fármaco es ineficaz si se mantiene al animal a la temperatura de 38,4 °C. Un hecho que habla a favor de lo comentado es que la MDMA no ejerce una acción tóxica sobre el axón serotoninérgico cuando se mantienen temperaturas bajas en el animal de experimentación. Por otra parte, los inhibidores selectivos de la recaptación de serotonina (ISRS), como la fluoxetina y el citalopram66, antagonizan la neurotoxicidad inducida por la MDMA, sin necesidad de modificar la temperatura. Por consiguiente, la hipertermia producida por la MDMA y la liberación de serotonina producida por esta sustancia parecen contribuir, de manera independiente, a la neurotoxicidad ejercida por esta sustancia.
Por otra parte, como ya hemos comentado, si bien la mayoría de los efectos inducidos por la MDMA son secundarios a la liberación de monoaminas, la MDMA per se también puede estimular receptores 5HT2, 5HT1, receptores *2 y receptores muscarínicos, mientras que, por el contrario, presenta una escasa afinidad sobre receptores dopaminérgicos53 D1 y D2. El estímulo indirecto de los receptores 5HT1B podría jugar un papel relevante en la hiperactividad mediada por la MDMA. De hecho, experimentalmente, los antagonistas 5HT1B son capaces de revertir la hiperactividad inducida por dosis bajas de MDMA, efecto no observado con antagonistas 5HT1A, mientras que el antagonista 5HT2A bloquearía la hipermotilidad inducida por dosis altas de MDMA67-68. Por su parte, el estímulo de los receptores 5HT2 es más manifiesto tras tratamiento crónico, cuando ya se ha producido la depleción de serotonina. Esta afinidad 5HT2 podría explicar ciertas características etológicas descritas por Navarro y Maldonado69 en ratones macho, como una marcada reducción de las conductas ofensivas y de la investigación social o un incremento de la exploración a distancia y de la conducta defensiva. Por su parte, en los humanos, la estimulación de estos receptores podría explicar ciertos síntomas psicológicos de tipo visual, como los flashbacks y las alucinaciones70, que son ligeramente atenuados con la coadministración del antagonista 5HT2 ketanserina71.
Otros autores postulan como mecanismo de la neurotoxicidad por MDMA la generación de un metabolito tóxico de esta droga72. Como se ha comentado, la MDMA se metaboliza in vitro dando lugar al metabolito DHMA, merced a la acción catalizadora de la enzima debrisoquina-hidroxilasa. A su vez, este metabolito es oxidado, por lo que genera los correspondientes compuestos con estructura catecol y quinona33, cuyo posterior metabolismo ocasiona la formación de radicales libres, que inducirían un fenómeno de estrés oxidativo y el correspondiente daño neuronal72. En este sentido, la administración de compuestos atrapadores de radicales libres, como la alfa-fenil-N-terbutil-nitrona (PBN), evita la génesis de radicales libres inducida por MDMA y protege frente a la acción neurotóxica de esta sustancia73.
En conclusión, la administración de MDMA ocasiona una serie de efectos a largo plazo en axones serotoninérgicos y, probablemente, dopaminérgicos en el núcleo estriado y el núcleo accumbens. Estos cambios tardíos pueden explicar las manifestaciones psicopatológicas descritas por los pacientes, después de largos periodos de la última exposición a la MDMA74.
Papel de la vía mesolimbocortical en los fenómenos de dependencia a la MDMA
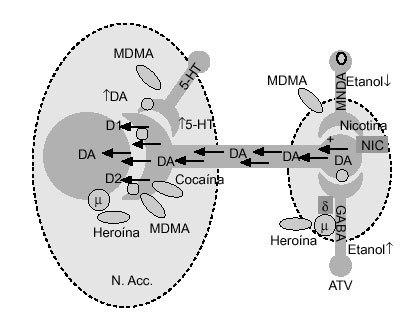
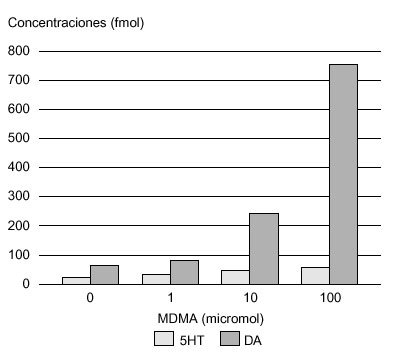
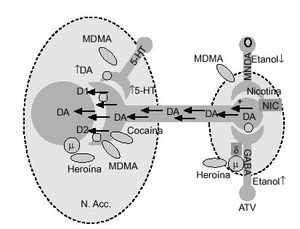
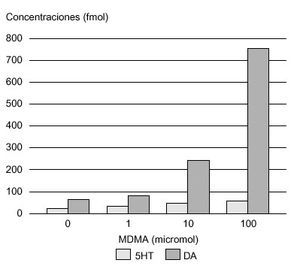
La vía dopaminérgica mesolimbocortical, y en concreto el núcleo accumbens, parece capital en los fenómenos de recompensa provocados por diversas drogas de abuso75. Esta vía, está originada principalmente en el área tegmental ventral (ATV), región de donde los axones dopaminérgicos son proyectados, predominantemente, al núcleo accumbens, aunque también alcanzan el tubérculo olfatorio, la corteza frontal, la amígdala y el área septal. Distintos agentes farmacológicos, como los opiáceos, el alcohol, las anfetaminas y la cocaína tienen la propiedad común de aumentar las concentraciones extracelulares de dopamina en dicho núcleo76 (fig. 4). De forma similar, la administración sistémica de MDMA también incrementa las concentraciones extracelulares de dopamina en esta región, lo que podría explicar las propiedades reforzadoras de esta sustancia, observadas experimentalmente (tabla 3). Además, White et al78, demostraron que la MDMA administrada de forma directa en el núcleo accumbens de rata aumenta las concentraciones extracelulares tanto de dopamina como de serotonina, incremento que es esencial en las propiedades reforzadoras de estas sustancias. Desde un punto de vista cuantitativo, este incremento de dopamina, tras la administración aguda de MDMA, fue superior en este núcleo al de serotonina (fig. 5). La infusión de serotonina o de agonistas serotoninérgicos a este nivel, aumenta la liberación de dopamina, por lo que se piensa que en el efecto liberador de dopamina inducido por MDMA participan mecanismos serotoninérgicos51.
Figura 4. Efecto de la MDMA y de otras drogas de abuso sobre la vía dopaminérgica mesocorticolímbica. La administración de estos agentes ocasiona un aumento de las concentraciones extracelulares de dopamina en el núcleo accumbens. N. Acc: núcleo accumbens; ATV: área tegmental ventral; DA: dopamina.
Figura 5. Concentraciones de monoaminas en núcleo accumbens de rata, tras la administración de MDMA. DA: dopamina; 5HT: serotonina.
El papel de la serotonina en el núcleo accumbens es menos conocido que el de la dopamina, aunque es sabido que muchas drogas de abuso aumentan las concentraciones extracelulares de serotonina en dicho núcleo78. Además, la serotonina incrementaría la liberación de dopamina a este nivel. De igual modo, es poco conocido el papel de los aminoácidos excitatorios (glutamato y/o aspartato) que están presentes en esta vía mesolímbica79 (fig. 4).
También se ha constatado que la administración de MDMA reduce la actividad excitadora de otras vías implicadas en estos fenómenos, como consecuencia del incremento de la serotonina extracelular que produce. Tal es el caso de las vías excitadoras que, procedentes de la corteza prefrontal medial, llegan hasta el núcleo accumbens. El núcleo dorsal del rafe es la fuente más importante de fibras serotoninérgicas que terminan en el núcleo accumbens, y son éstas las más vulnerables a la acción repetitiva de la MDMA. La MDMA puede actuar directamente en el núcleo dorsal del rafe, liberando serotonina, hecho que, en definitiva, inhibe la descarga de estas neuronas sobre el núcleo accumbens. Sin embargo, estos efectos pueden verse contrarrestados por la liberación directa de la serotonina y la dopamina en el ATV y el núcleo accumbens51.
La administración aguda de MDMA inhibe parcialmente las descargas espontáneas de las neuronas dopaminérgicas del ATV y de la sustancia negra, efecto mediado por un aumento en la liberación de dopamina y parcialmente contrarrestado por la liberación de serotonina80. En este sentido, el exacto mecanismo por el que la MDMA inhibe las descargas dopaminérgicas en el ATV no es conocido. Sin embargo, este efecto inhibitorio, provocado por otras drogas, como la cocaína, se debe a una hiperpolarización por bloqueo de recaptación de dopamina y por la inhibición de la liberación de ácido gammaaminobutírico (GABA), como consecuencia del bloqueo de la recaptación de serotonina81. En ambos casos, la complejidad de acciones es manifiesta, debido a la capacidad adicional para liberar dopamina y serotonina de las terminaciones presinápticas.
Por otro lado, los datos que implican al núcleo accumbens en la mediación de la recompensa inducida por drogas de abuso, tanto estimulantes (cocaína, anfetamina, MDMA), como depresoras (opiáceos, alcohol y ciertos alimentos), son múltiples76. En este sentido, la aplicación microiontoforética de MDMA provoca una inhibición de la descarga eléctrica inducida por ácido glutámico, parecida a la producida por dopamina o por serotonina, por lo que se piensa que el efecto provocado por la MDMA sea mediado, al menos en parte, por la liberación de estas aminas, las cuales, al actuar sobre la terminal presináptica, reducirán el tono excitatorio78 (fig. 4).
De hecho, en ratas tratadas con MDMA durante 4 días se observó que el efecto inhibitorio de la dopamina y la serotonina sobre la descarga eléctrica producida por el glutamato en neuronas del núcleo accumbens, fue virtualmente abolido tras más de una semana de la última administración de la droga. Por tanto, el tratamiento con dosis neurotóxicas de MDMA reduce selectivamente los efectos inhibitorios de la dopamina y de la serotonina sobre las neuronas del núcleo accumbens, más allá de una semana de la última administración. Este fenómeno es opuesto al esperado con dosis repetitivas de cocaína, ya que repetidas administraciones de cocaína se acompañan de un aumento de las concentraciones, tanto de dopamina como de serotonina. Por el contrario, dosis repetitivas de MDMA pueden provocar sólo un episodio inicial de aumento de dopamina y serotonina, seguido por repetidos episodios de aumento extracelular de, únicamente, dopamina. Puesto que la cocaína no es neurotóxica en los axones serotoninérgicos, este hecho puede explicar los efectos opuestos que se observan con ambas drogas de abuso, así como la ausencia de craving observada con la MDMA durante el período de abstinencia, fenómeno que se presenta en consumidores de cocaína.
Desde la perspectiva clínica, y teniendo presentes todos estos acontecimientos neurobiológicos, Cottler et al82 han estudiado recientemente y por primera vez la capacidad de la MDMA de ocasionar trastornos de abuso y dependencia en humanos. Estos autores han utilizando criterios diagnósticos DSM-IV, y han confirmado que el 34% de una muestra de 52 adolescentes y jóvenes consumidores de éxtasis cumplía requisitos de abuso y el 43% criterios de dependencia, lo que confirma el presunto carácter adictivo de esta sustancia, demostrado experimentalmente. Además, al igual que sucede con las anfetaminas y la cocaína, existe un acusado fenómeno de tolerancia farmacodinámica a los efectos de la administración crónica del éxtasis83.
Efectos farmacológicos y toxicológicos del éxtasis en humanos
Factores que limitan el conocimiento de las bases neurobiológicas de la acción del éxtasis
El conocimiento de las bases neurobiológicas por las que actúa cualquier sustancia psicoactiva no es sencillo, pero en el caso de la MDMA existen distintos problemas adicionales que dificultan este objetivo41. Por una parte, al ser una droga incluida en la Lista I de la OMS, el estudio de sus acciones farmacológicas y terapéuticas sólo puede realizarse con estrictos permisos oficiales, lo que dificulta enormemente la puesta en marcha de estudios clínicos controlados con esta droga. Desde la perspectiva ética, algunos autores84 han defendido su negativa a la administración experimental de MDMA en humanos, a pesar de que los datos que se pudieran obtener fueran tremendamente interesantes, pues afirman que los efectos neurotóxicos a largo plazo, demostrados experimentalmente y en pequeñas poblaciones de consumidores de MDMA, invalidarían moralmente la puesta en marcha de este tipo de estudios. En este sentido, el diseño de ensayos doble-ciego, controlados con placebo y con dosis repetidas, reúne todos los requisitos para considerarlos inviables éticamente83. Por otra parte, la gran cantidad de sustancias contaminantes que forman parte del denominado «éxtasis», hace que muchos de los efectos toxicológicos que se observan tras el consumo de esta sustancia sean debidos a otros principios activos que, en ocasiones, son incluso más peligrosos que la propia MDMA o que pueden potenciar sus efectos tóxicos y conductuales. Además, las acciones neurobiológicas del éxtasis parecen ser diferentes, de acuerdo con sus distintos patrones de uso.
Todos estos factores, que condicionan un cuerpo documental científico sobre los efectos tóxicos de la MDMA relativamente escaso en comparación con otras sustancias de abuso, como la cocaína y la heroína, hacen que algunos autores85, al contrario que los comentados previamente, se planteen ciertos dilemas éticos sobre las restricciones de investigación en humanos, máxime teniendo en cuenta la elevada prevalencia del uso de esta sustancia.
Efectos subjetivos del consumo del éxtasis en humanos
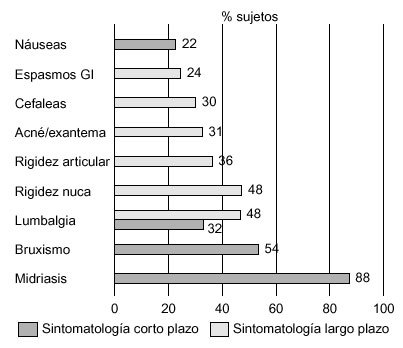
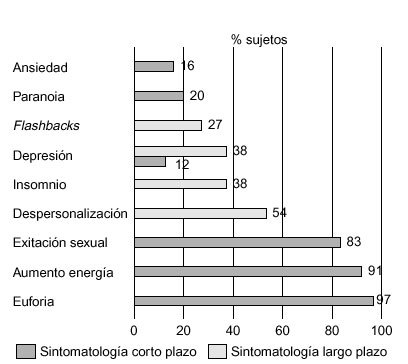
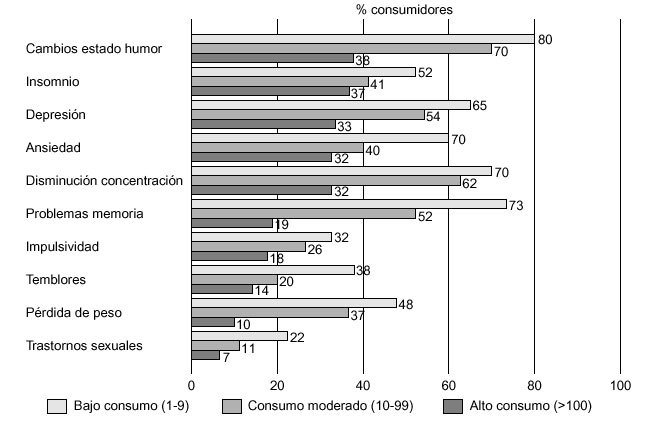
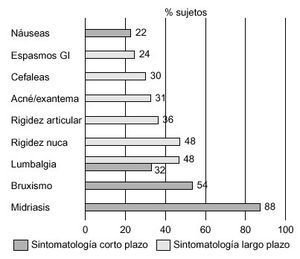
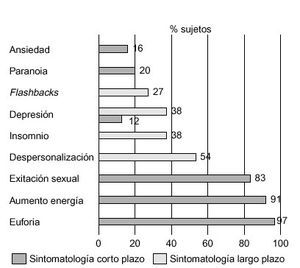
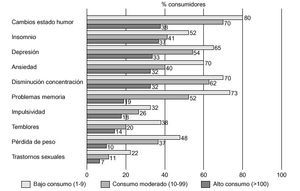
La descripción de los efectos subjetivos provocados por el consumo de éxtasis es muy variable; por ello, nos hemos centrado fundamentalmente en los trabajos de Cohen86 y Parrott et al87. En el primero de ellos se entrevistó a un total de 500 consumidores de éxtasis sobre la sintomatología psíquica y física percibida por estos individuos, a corto y largo plazo, mientras en el segundo se encuestó sobre este tipo de sintomatología a una muestra de 282 sujetos, clasificados en consumidores ocasionales (1-9 ocasiones), consumidores moderados (10-99 ocasiones) y grandes consumidores (> 100 ocasiones). Los resultados de estas entrevistas vienen recogidos en las figuras 6-8.
Figura 6. Sintomatología física de los consumidores de éxtasis (n = 500). Diferenciación entre sintomatología a corto y a largo plazo.
Figura 7. Sintomatología psíquica de los consumidores de éxtasis (n = 500). Diferenciación entre sintomatología a corto y a largo plazo.
Figura 8. Principales síntomas observados en consumidores de éxtasis, según la frecuencia e intensidad del consumo (n = 282).
En líneas generales, los estados subjetivos inmediatos inducidos con más frecuencia por la MDMA incluyen un cierto grado de euforia, que es diferente según las descripciones subjetivas de cada individuo, aumento de la energía, y excitación sexual. La mayoría de los consumidores señalan que la droga provoca sensación de «amor», felicidad, paz y capacidad de «conectar». Sin embargo, se relatan una serie de efectos menos confortantes, como bruxismo, que obliga en ocasiones a solicitar asistencia clínica, y náuseas. Los efectos residuales incluyen insomnio, sensación de despersonalización, depresión y flashbacks, junto con efectos físicos del tipo de cefaleas, vómitos y lumbalgias (tabla 4). Muchos de estos síntomas continúan tiempo después del consumo de MDMA. Algunos individuos presentan depresión, que puede aparecer meses e incluso años más tarde, tras la finalización de los efectos placenteros de la droga. Bobes et al18 confirman que los jóvenes consumidores de MDMA puntúan, durante el año previo al consumo, significativamente más en las subescalas de neuroticismo y psicoticismo del Cuestionario de Personalidad de Eysenck, así como en la Escala de Búsqueda de Sensaciones de Zuckerman. En contra de lo que sucede con otros agentes psicodélicos, la MDMA produce con poca frecuencia cambios en la percepción visual86. Fox et al88 han confirmado recientemente el efecto negativo de la MDMA en los procesos de consolidación del aprendizaje y de la memoria. Estos efectos estarían relacionados con una disfunción serotoninérgica en el lóbulo temporal.
Como se ha apuntado anteriormente, la MDMA ocasiona un incremento de la liberación de serotonina, al interactuar sobre el transportador de esta indolamina. Este estado de «hiperserotoninergia» sería el responsable de gran parte de los síntomas subjetivos de naturaleza psicológica que reportan los consumidores de éxtasis, así como de otros efectos adversos, como los de la esfera cardiovascular (tabla 4). Precisamente, algunos estudios han confirmado que estos cambios psicofisiológicos se reducen con la coadministración de ISRS, como la fluoxetina y el citalopram71. No obstante, estos efectos adversos, aun reducidos en intensidad, pueden prolongarse más en el tiempo en consumidores simultáneos de MDMA e ISRS, ya que estos antidepresivos son agentes inhibidores de los isoenzimas hepáticos CYP2D6, precisamente los responsables de gran parte del metabolismo de la MDMA. Por otro lado, se ha observado que el pretratamiento con haloperi dol, un antagonista dopaminérgico D2, ocasiona una reducción del estado eufórico inducido por la MDMA, dando lugar a un estado disfórico y a un ligero incremento de los niveles de ansiedad71.
De las investigaciones clínicas comentadas anteriormente se puede concluir que no existe un criterio uniforme a la hora de relacionar los problemas ocasionados por la MDMA con el número de veces que se ha consumido la sustancia. Así, Cohen86 afirma que no existe relación alguna entre el número de veces en que el sujeto se ha expuesto a la droga y la aparición de sintomatología, lo que podría sugerir que los efectos adversos achacados a la MDMA pudieran presentarse incluso tras una exposición mínima a esta sustancia. Por su parte, Parrott et al87 concluyen que la incidencia de problemas atribuidos a la MDMA está directamente relacionada con el número de veces que ha sido consumida, destacando, en este sentido, los problemas de memoria, reportados en un 19% por los consumidores ocasionales, en un 52% de los consumidores moderados y hasta el 73% de los grandes consumidores.
En líneas generales, desde el punto de vista conductual, se puede señalar que la MDMA presenta similitudes tanto con las anfetaminas como con el LSD. Sus efectos simpaticomiméticos y alertizantes son similares a los que se observan con la anfetamina, mientras que la propensión para intensificar las experiencias sensoriales parece más cercana a los del LSD89. Estos autores realizaron un estudio con 21 polidrogodependientes, usuarios de MDMA, LSD y anfetaminas, que completaron un cuestionario modificado del perfil de estado del humor, con el fin de indicar sus sensaciones típicas con cada droga. Los resultados de este trabajo muestran que la MDMA fue considerada como un agente con actividad intermedia, superior al LSD e inferior a las anfetaminas, en lo que se refiere a la sensación de energía, de seguridad y lucidez mental. Sin embargo, en otros perfiles del humor, la MDMA fue más específica, y provocaba mayor sensación de bienestar, de serenidad y euforia que el LSD o las anfetaminas. Estos resultados son similares a los reportados por otros autores en distintos países90-93. En resumen, mientras que algunos autores categorizan a la MDMA como una anfetamina alucinógena, otros han sugerido que el perfil de la MDMA le permite ser incluida en una nueva clase, que han denominado como sustancias «entactógenas».
Síntomas físicos del consumo del éxtasis en humanos
Además de los síntomas subjetivos referidos anteriormente, se han descrito otra serie de síntomas físicos (tabla 4), característicos de una hiperestimulación simpática, de naturaleza cardiovascular y neurológica. Entre ellos, cabe destacar sequedad de boca, hipersudoración e hiperreflexia, midriasis, aumento de la presión arterial y nistagmus horizontal, así como ciertos efectos residuales, como insomnio y anorexia94. Algunos de estos pacientes, sobre todo tras el consumo de altas dosis de MDMA, pueden presentar hipertermia y convulsiones, y pueden evolucionar a rabdomiolisis, coagulación intravascular diseminada, insuficiencia renal aguda y muerte94. Davison y Parrott95 confirmaron, mediante informes subjetivos, que entre el 80 y el 90% de los consumidores de éxtasis en clubes y discotecas experimentaban un incremento de la temperatura corporal, sudoración y deshidratación.
Ciertas complicaciones cardiovasculares observadas en consumidores de éxtasis podrían estar relacionadas con anormalidades en el funcionalismo catecolaminérgico, según han confirmado Stuerenburg et al96. Estos autores han determinado las concentraciones plasmáticas de noradrenalina, adrenalina y dopamina en 159 consumidores de éxtasis, y han confirmado un incremento de éstas, así como una persistencia de esta hiperactividad noradrenérgica en los intervalos interconsumo, lo que podría explicar los fenómenos de taquicardia, arritmias y crisis hipertensivas descritos en estos sujetos.
Por su parte, Sthephenson et al97 han demostrado experimentalmente, como la administración de MDMA se asocia a un incremento de la expresión del gen de respuesta inmediata c-fos en distintas áreas cerebrales relacionadas con los síntomas comentados. Así, a título de ejemplo, observaron unas concentraciones elevadas de la expresión c-fos en los núcleos supraóptico, preóptico medio, masticatorio, así como en el flóculo cerebeloso, centros relacionados con el control del balance de líquidos, de la temperatura corporal, de la actividad motora de la masticación y del equilibrio y la coordinación motora general, y posiblemente involucrados en los fenómenos comentados de hiponatremia, hipertermia, bruxismo e hiperactividad locomotora, respectivamente.
Por otro lado, algunos autores han descrito cómo el uso regular y frecuente de MDMA ocasiona un fenómeno de tolerancia a los efectos buscados del éxtasis, así como un aumento de los efectos adversos de esta sustancia90, entre los que destaca una pérdida de memoria98, trastornos del sueño y una mayor incidencia de trastornos psiquiátricos99,100. De hecho, la MDMA y sus derivados son las sustancias de abuso que ocasionan proporcionalmente más reacciones psicopatológicas agudas que requieren asistencia de urgencia (un 24,3% de los 110 episodios de urgencias comunicados en España en 2000 relacionados directamente con el consumo de estas sustancias), según datos del OED20.
Los efectos tóxicos más graves descritos en consumidores de MDMA pueden englobarse en 4 grandes grupos: accidentes cerebrovasculares, como hemorragias, trombosis e infartos cerebrales; insuficiencias hepáticas agudas, algunas de ellas con resultado mortal; hiponatremias, bien de tipo dilucional, por consumo excesivo de agua, o por una secreción inadecuada de hormona antidiurética; hipertermias malignas, que pueden acompañarse de coagulopatías y/o rabdomiolisis, que pueden llevar a una insuficiencia renal aguda. También hay que tener presente la posibilidad de aparición de un síndrome serotoninérgico, con todo su cortejo sintomatológico; hiperactividad, confusión mental, agitación, hiperreflexia, fiebre, taquicardia, mioclonus, nistagmus, temblores, etc. En España, los últimos datos del OED, correspondientes al año 2000, reflejan 110 casos de asistencia en urgencias por éxtasis, de los que el 58,3% fueron debidos a sobredosis o intoxicación aguda, y 7 casos de muerte por reacción aguda (un 1,6% del total de muertes por reacción aguda durante el consumo de drogas)20.
Efectos neurotóxicos de la MDMA en humanos
La neurotoxicidad del éxtasis ha sido demostrada en distintas especies animales, incluidos los primates. En humanos, no se han realizado estudios histopatológicos en este sentido. No obstante, se sabe que la MDMA en el humano disminuye el recambio de serotonina, como se pone de manifiesto por la disminución de las concentraciones del principal metabolito de la serotonina, el ácido 5-hidroxi-indol-acético (5HIAA) en líquido cefalorraquídeo de consumidores de esta droga, tras 2 semanas de abstinencia, con respecto a individuos control101. También se ha descrito en estos consumidores una disminución de la respuesta de la prolactina a agonistas serotoninérgicos, como el l-triptófano102, la m-clorofenilpiperazina103 o la
d-fenfluramina104. Estos datos, junto a ciertos síntomas observados en estos pacientes, como la alteración de la arquitectura de sueño y los trastornos de la impulsividad, hacen pensar en una posible lesión de neuronas serotoninérgicas.
El gran desarrollo que en los últimos años ha tenido lugar en el campo de las técnicas de neuroimagen ha permitido obtener importantes avances en el estudio de los efectos neurotóxicos de la MDMA, y se han confirmado en humanos las observaciones descritas previamente con técnicas invasivas en animales de experimentación. Así, McCann et al105 han descrito, por primera vez, mediante la utilización de tomografía por emisión de positrones (PET), los efectos tóxicos de la MDMA en neuronas serotoninérgicas cerebrales. Para ello, utilizaron 11C-McM-5652 como ligando del transportador de serotonina, y observaron, en consumidores crónicos de éxtasis, una marcada reducción de este transportador, así como una pérdida de terminales serotoninérgicos, en todas las regiones cerebrales, salvo en el tálamo. Por su parte, Semple et al106 también han confirmado estos datos, mediante tomografía computarizada por emisión de fotón único (SPECT) y la utilización de 123I-ß-CIT como ligando del transportador de serotonina, y han observado una disminución significativa de la densidad de este transportador, sobre todo en el neocórtex. Al utilizar este mismo ligando (123I-ß-CIT), algunos autores han replicado los resultados previos, y han confirmado el efecto neurotóxico del consumo de dosis altas de MDMA sobre neuronas serotoninérgicas, en varias regiones cerebrales ricas en este tipo de neuronas. Además, se ha observado que este efecto es más significativo en mujeres, lo que sugiere una mayor susceptibilidad de género en los efectos neurotóxicos de esta sustancia107.
Reneman et al108 han estudiado también en humanos el efecto del consumo de MDMA sobre la densidad de receptores 5HT2A (mediante técnicas de SPECT con el ligando 123I-R-91150) y sobre el flujo sanguíneo cerebral (mediante técnicas de resonancia magnética de perfusión), así como la relación entre ambos parámetros. Tras un período de ausencia de consumo de 7 semanas, estos autores encontraron, en determinadas regiones corticales, un incremento de la densidad de receptores 5HT2A (indicativo de una tasa sináptica de serotonina baja), que se correlacionaba con un valor elevado en las determinaciones del flujo sanguíneo cerebral (indicativo de vasodilatación local), mientras que en las zonas donde la densidad de receptores 5HT2A era baja, el flujo sanguíneo estaba reducido (vasoconstricción regional). Estos hechos indican que la MDMA puede afectar también al sistema vascular cerebral.
El efecto neurotóxico de la MDMA sobre el sistema serotoninérgico en humanos también se ha puesto de manifiesto mediante estudios electrofisiológicos publicados recientemente109. Estos autores han evaluado el funcionalismo serotoninérgico en 22 consumidores habituales de MDMA, mediante la medida de la atenuación de la respuesta neurológica a estímulos auditivos, obtenida en un registro electroencefalográfico (potenciales evocados auditivos), y han confirmado una disfunción serotoninérgica asociada a la cantidad total de la droga consumida (dosis acumulada) y no a la frecuencia de consumo.
Los efectos neurotóxicos del uso crónico de MDMA en el humano pueden no circunscribirse a los sistemas de neurotransmisión serotoninérgicos, como parece desprenderse del estudio de Obrocki et al110. Estos autores han medido los índices de consumo metabólico cerebral de glucosa con PET, utilizando 2-(18F)-fluoro-2-deoxi-D-glucosa (FDG) y han confirmado una disminución de su consumo en diferentes áreas cerebrales, como la amígdala, el hipocampo y la corteza cingulada, y un incremento en los núcleos caudado y putamen y las áreas de Brodmann 10 y 11. Los autores afirman que estos hechos pueden reflejar secundariamente efectos transneuronales mediados por lesiones neurotóxicas de fibras serotoninérgicas aferentes.
Estos hallazgos obtenidos con técnicas de neuroimagen podrían correlacionarse con la elevada incidencia de secuelas neuropsiquiátricas de tipo conductual, cognitivo y afectivo25, observadas a largo plazo en los consumidores crónicos de MDMA (tabla 5): síntomas psicóticos, alucinaciones, ataques de pánico, trastornos de ansiedad, agresividad, cuadros depresivos, ideación suicida, etc.112. De hecho, recientemente, Lieb et al113, en un estudio retrospectivo longitudinal, con una muestra de 2.462 sujetos, han confirmado que los consumidores de MDMA presentan un riesgo significativamente mayor de padecer un trastorno psiquiátrico, según criterios DSM-IV, que los no consumidores. Por otra parte, ya que la serotonina está estrechamente relacionada con otros fenómenos fisiológicos, como el apetito o la termorregulación, así como con ciertos procesos cognitivos, es posible que las alteraciones de estos fenómenos, observados en consumidores de éxtasis, sean expresión de lesiones en regiones serotoninérgicas25. De hecho, el grupo de Reneman ha confirmado una estrecha correlación entre las lesiones observadas con las técnicas de neuroimagen (SPECT) comentadas previamente y un déficit de la función cognitiva, en el que la capacidad de memoria era evaluada mediante una prueba de repetición de palabras (Rey Auditory Verbal Learning Test)107. Del mismo modo, Dafters et al114 han encontrado, en consumidores crónicos de MDMA, unos registros electroencefalográficos similares a los de individuos ancianos y afectos de demencia.
No obstante, la observación de algunas de estas alteraciones en sujetos consumidores de cantidades poco importantes de éxtasis, no sea la manifestación de daño cerebral, sino más bien la evidencia de una predisposición o vulnerabilidad a padecer estas enfermedades, mediada por una droga capaz de modificar el funcionalismo aminérgico central115. Por otro lado, la lesión de neuronas serotoninérgicas puede ser inicialmente asintomática y manifestarse muchos años después, cuando la función serotoninérgica esté muy menguada. En este sentido, es destacable la opinión de C. Schuster, cuando, siendo director del NIDA (National Institute of Drug Abuse) en Estados Unidos, afirmaba que «no sabemos si los jóvenes consumidores de MDMA dentro de 20 o 30 años, cuando tengan 45, empezarán a manifestar los síntomas y signos de degeneración del sistema nervioso central que habitualmente no empiezan a observarse hasta los 70 u 80 años».
Abordaje terapéutico de los trastornos inducidos por el consumo de éxtasis
En primer lugar, hay que diferenciar entre el tratamiento de la conducta propiamente adictiva y de las complicaciones derivadas de su consumo crónico, y el abordaje del paciente bajo una intoxicación aguda por MDMA. En relación con este último aspecto, además del lavado gástrico y el tratamiento sintomatológico puntual (convulsiones, arritmias, manifestaciones psiquiátricas agudas, etc.), existen aspectos específicos que hay que considerar116, como un rápido enfriamiento del paciente hipertérmico, con objeto de evitar la rabdomiolisis y los riesgos de la coagulación intravascular diseminada117, y una correcta hidratación. Algunos autores recomiendan la administración intravenosa (i.v.) de dantroleno para el tratamiento de la hipertermia118, así como los calambres y espasmos musculares. Se ha confirmado que la acidificación de la orina facilita la eliminación de la MDMA, pero hay que ser prudentes, pues puede facilitar la insuficiencia renal al disminuir el aclaramiento de mioglobina5. En pacientes con ansiedad, agitación, ataques de pánico o convulsiones puede ser de utilidad el empleo de benzodiazepinas de vida media corta, como el lorazepam i.v. o intramuscular (i.m.), y en caso de arritmias se puede recurrir a la administración de bloqueadores beta o antagonistas de los canales del calcio27.
En relación con los problemas psíquicos ocasionados por el consumo de éxtasis (trastornos de ansiedad, psicóticos y afectivos, alucinaciones y/o flashbacks, etc.), se recomienda el uso de los mismos agentes farmacológicos que se emplearían en el manejo de estos cuadros, independientemente de que sean inducidos por la MDMA (benzodiazepinas, antipsicóticos o antidepresivos).
Por otro lado, en el tratamiento farmacológico del consumo crónico existen muy pocos datos publicados, aunque una serie de fármacos, como los ISRS, agentes antioxidantes y precursores serotoninérgicos (triptófano o tirosina), se están ensayando experimentalmente. Ciertos autores han publicado algunos casos que confirman la posible utilidad clínica de los ISRS en aquellos pacientes con dificultad para dejar de consumir éxtasis119. Por último, se destaca el importante papel que se está concediendo en toda Europa a una serie de medidas de carácter ambiental y educativo dirigidas a la reducción de daños (consumo en ambientes con elevadas temperaturas, realización de ejercicio intenso, deshidratación, policonsumo de substancias, etc.)120. Recientemente, la Sociedad Española de Psiquiatría ha publicado unos Documentos de Consenso sobre el «Diagnóstico y Tratamiento del Alcoholismo y Otras Dependencias»121, en los que recogen las pautas a seguir en el abordaje terapéutico de base de los trastornos inducidos por las drogas de diseño.
Aspectos criminológicos y médico-legales
El consumo de sustancias psicotrópicas y sus consecuencias (abuso y/o dependencia) no sólo ocasionan a la sociedad actual problemas de índole sanitario, sino que esta problemática trasciende a otras esferas, como la política, la económica y, por supuesto, la legal. Centrándonos en el consumo de éxtasis, su interés, desde el punto de vista criminológico y médico-legal, estriba, como mencionábamos anteriormente, en que esta sustancia, prototipo de las denominadas «drogas de diseño o de síntesis», es una droga clasificada por las autoridades como ilegal o no institucionalizada y procede, por tanto, de un importante mercado clandestino.
Teniendo esto en consideración, es evidente la relación entre el tráfico y consumo de esta sustancia y los fenómenos de delictogénesis, hecho que se pone de manifiesto de forma periódica en las memorias de la Fiscalía General del Estado, así como en los informes del OED del Ministerio del Interior. La delincuencia originada en torno al éxtasis se enmarca en la categoría de «delincuencia como conducta»», esto es, se trata de una conducta opuesta a las leyes sociales, que puede realizarla cualquiera, que no se relaciona con anomalías neurobiológicas y que está determinada por factores externos. Esta conducta antisocial queda contemplada, desde la perspectiva legal española, en la Ley 10/95, de 23 de Noviembre (Código Penal, artículo 10, «delitos y faltas»).
En el ámbito de la relación existente entre el consumo de éxtasis y la delictogénesis, es conveniente establecer una diferenciación práctica. Así, habría que delimitar los fenómenos de delincuencia relacional, es decir, aquellas actividades delictivas relacionadas con su posesión y tráfico, siendo los delitos más comunes aquellos recogidos en los artículos 368 al 378 del Código Penal (delitos relacionados con el tráfico, la elaboración, la facilitación y la inducción al consumo, es decir, delitos contra la salud pública), de los fenómenos de delincuencia inducida, o sea, la que se origina a causa de los efectos producidos por la ingesta de la droga. Entre los delitos más comunes observados dentro de esta categoría destacan los delitos contra la seguridad del tráfico (artículo 379 del Código Penal) y, aunque no son englobables como tales, los actos de suicidio. Como factor común a los delitos inducidos, se encuentra el empleo de la violencia, teniendo una especial significación el policonsumo de drogas, en especial la coadministración de alcohol, que potencia, de forma sustancial, los efectos de ambas drogas sobre el SNC. Por último, hay que destacar que la delincuencia denominada funcional (aquella fundamentada en las conductas que tienen por objeto continuar con la administración de la sustancia para evitar las consecuencias indeseables de la falta de consumo, y que se traducen fundamentalmente en delitos contra la propiedad, así como en conductas de prostitución) no es habitual en los consumidores de éxtasis.
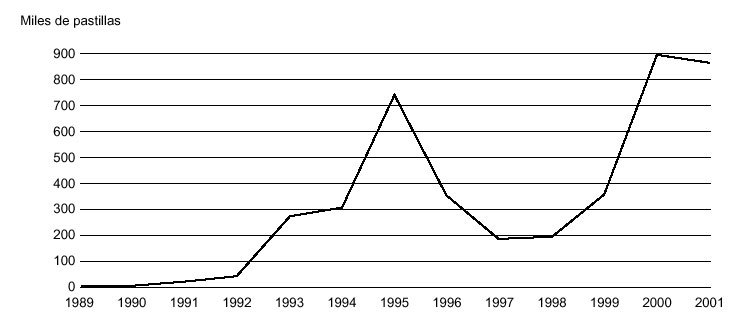
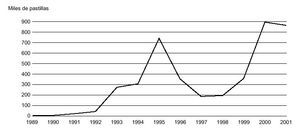
En relación con la delincuencia relacional, las primeras detenciones de traficantes de éxtasis en España (2 ciudadanos belgas y 4 italianos) tienen lugar en agosto de 1987 en Ibiza, por posesión de 120 comprimidos o cápsulas, y su juicio, también el primero por tráfico de éxtasis, se celebró en febrero de 1988 en la Audiencia de Palma de Mallorca. Los datos correspondientes a decomisos policiales en España (fig. 9) confirman un enorme incremento de las incautaciones en los años sucesivos, que han pasado de las 187 pastillas en 1987 a las 891.652 en 2000. Los datos sobre aprehensiones realizadas en España confirman a las comunidades de Valencia, Madrid y Baleares como las de mayor tráfico de drogas de diseño. Además, cada vez son más habituales los casos de detección de estas drogas de síntesis en fluidos biológicos de sujetos detenidos por actos delictivos.
Figura 9. Evolución de los decomisos de MDMA en España durante el período 1989-2001.
Por su parte, en materia de delincuencia inducida, hay que tener presente que las Naciones Unidas reconocieron, en 1994, que estas sustancias eran directamente responsables de numerosos accidentes de tráfico en jóvenes de 18 a 25 años durante los fines de semana. En España, la Dirección General de Trafico también se pronunció en esta línea, en relación con la alta siniestralidad observada en la carretera Madrid-Valencia durante el apogeo de la denominada «ruta del bakalao». En la Encuesta sobre Drogas a la Población Escolar, realizada por el OED19, se aportan datos muy preocupantes en este sentido. Un 22% de los estudiantes encuestados en 1998 consumidores de éxtasis afirmó que habían conducido ciclomotores bajo los efectos de dicha sustancia y un 51% habían viajado en algún vehículo conducido por una persona que también estaba bajo dichos efectos. En este sentido, es conocido que la MDMA disminuye la capacidad de concentración, los reflejos y la visibilidad, incrementa el tiempo de reacción y puede ocasionar alucinaciones visuales y auditivas, hechos que condicionan una gran merma en la capacidad de conducir de forma segura un automóvil.
Estos datos se han puesto de manifiesto en un estudio específico realizado por la Dirección General de Tráfico, en colaboración con la Universidad de Valladolid. Se trata de un estudio realizado sobre una muestra de 144 personas fallecidas en accidentes de circulación. De esta muestra, se detectaron mezcla de alcohol y otras drogas (opiáceos, cocaína, anfetaminas, cannabis y drogas de diseño) en un 18% de los casos. El éxtasis, como tal, se detectó en 4 casos, ocurridos precisamente durante fines de semana. El estudio concluye con la existencia de un incremento de las conductas de riesgo y accidentalidad entre consumidores de distintas sustancias de abuso, incluido el éxtasis122. Un estudio parecido es el realizado por el Ministerio del Interior y publicado en el informe número 5 del OED20. En este informe se recogen los resultados de los análisis toxicológicos practicados por el Instituto Nacional de Toxicología a 1.363 conductores fallecidos en accidente de tráfico durante 2000. En las muestras biológicas analizadas se detectó MDMA o derivados en 12 sujetos (un 0,9% del total), cifra que duplicó a la obtenida en el año previo (0,4%).
Por otro lado, la MDMA comparte algunas propiedades conductuales con los psicoestimulantes (cocaína, anfetamina) y los psicodislépticos (alucinógenos), que facilitarían un incremento de las conductas agresivas y, por ende, de delitos de lesiones. La ejecución del delito se produciría, sobre todo, en los momentos de intoxicación, durante los cuales el sujeto pudiera presentar una conducta desorganizada. En este sentido, el 12% de los jóvenes que habían consumido éxtasis entrevistados en la última Encuesta sobre Drogas a la Población Escolar (año 2000), refirieron haber tenido problemas del tipo de irritabilidad, discusiones y riñas durante el momento del consumo. Con respecto a este posible tipo de delitos, el Código Penal español (Ley Orgánica 10/1995, de 23 de Noviembre), en su artículo 20, especifica como causas eximentes de responsabilidad, de naturaleza biológica, además del síndrome de abstinencia, la intoxicación plena por sustancias psicotrópicas, siendo estas mismas causas atenuantes (artículo 21) cuando no concurren todos los requisitos necesarios para eximir de responsabilidad. Si la acción delictiva tiene lugar cuando el sujeto está inmerso en uno de los 2 supuestos, y su intensidad impide al sujeto comprender la ilicitud de su conducta o altera su capacidad de actuar con arreglo a esta comprensión, la imputabilidad quedaría mermada, e incluso anulada por completo, y con ella la responsabilidad. En este marco, habría que situar la figura del trastorno mental transitorio secundario a la intoxicación por consumo de sustancias de abuso, siempre y cuando se genere una anulación completa del conocimiento y de la libertad volitiva, pero cuya duración sea limitada y remita sin secuelas y sin probabilidades de repetición.
Conclusiones
Independientemente de las controversias que, tanto en el ámbito científico como en el popular, tuvieron lugar durante la pasada década en relación a los efectos tóxicos del éxtasis, un editorial de The Lancet, ya en 1996, señalaba que la MDMA carecía de un potencial terapéutico identificado, no era una droga blanda y era responsable directa de un número desproporcionado de efectos tóxicos y muertes123. En la actualidad, cada vez son más numerosos los informes sobre la intoxicación aguda y crónica asociadas a la MDMA y, a pesar de que se desconocen los datos sobre la prevalencia real del consumo de esta sustancia y de los graves problemas causados por la misma, su consumo se ha convertido, al menos en un determinado sector de la población, en un autentico problema sociosanitario124.
Los efectos psíquicos ocasionados por la MDMA parecen deberse al incremento de las tasas de monoaminas en el SNC, por lo que el éxtasis mimetizaría las acciones neurofisiológicas de éstas. Además, la MDMA facilita la excitabilidad nerviosa motora (mediada por vías noradrenérgicas, dopaminérgicas o serotoninérgicas), lo que explica la hipertonía musculotendinosa observada en consumidores de éxtasis. El mecanismo principal de la euforia inducida por MDMA es el incremento serotoninérgico y dopaminérgico que provoca esta sustancia en el núcleo accumbens, propiedad que c omparte con otras drogas de abuso, como la cocaína, el alcohol y los opiáceos, entre otras. Precisamente, las conexiones de las neuronas postsinápticas del núcleo accumbens son vitales en el fenómeno de recompensa inducido por la MDMA.
La administración de MDMA de forma repetitiva da lugar a un proceso de destrucción, en ocasiones de modo definitivo, de axones serotoninérgicos. En este sentido, la neurotoxicidad descrita en animales de experimentación y en humanos, junto con los cuadros psicopatológicos observados en consumidores de éxtasis, sugieren que la MDMA no es una sustancia apta para su uso recreativo.
La morbimortalidad por éxtasis se debe a la hipertermia fulminante, arritmia cardíaca, coagulación intravascular diseminada, rabdomiolisis, insuficiencia renal aguda y toxicidad hepática27. Desde el punto de vista clínico, la intoxicación por éxtasis se puede encuadrar entre un cuadro de síndrome serotoninérgico y un cuadro de síndrome neuroléptico maligno125.