En un modelo de clampaje aórtico, estudiamos el uso de un sensor multiparamétrico para determinar los valores de PO2, PCO2 y pH en líquido cefalorraquídeo (LCR) durante y después del clampaje aórtico. El presente estudio abordó las alteraciones mencionadas previamente y su relación de acuerdo con intervalos de tiempo. En 31 cerdos, se introdujo un sensor en el espacio intratecal y se utilizó fluximetría láser Doppler para determinar el flujo sanguíneo de la médula espinal (FME). Aplicando el clampaje a diferentes niveles, se obtuvieron tres grupos distintos de isquemia de médula espinal (leve, moderada y grave). Las variables del LCR con FME se estudiaron para cambios del 25%, 50% y 100% de acuerdo con el nivel basal. En el período de clampaje, el FME disminuyó un 71,5%, 40,0%, y 33,3% en el grupo 1, 2 y 3, respectivamente. La tensión de O2 en LCR alcanzó 0 en el grupo 1, disminuyó un 74,8% en el grupo 2, y fue del 12,7% en el grupo 3. La tensión de CO2 en LCR aumentó un 247,2% y un 202,0% en los grupos 1 y 2, respectivamente, pero aumentó ligeramente en el grupo 3. El tiempo de reacción máxima de la tensión de O2 en el LCR fue de alrededor de 16,7-26,9 min, aunque este intervalo fue de 34,5-49,8 min en la tensión de CO2 en LCR. Comprobamos que la tensión de O2 reacciona con más rapidez que la PCO2 y el pH. Es posible que en un medio isquémico la tensión de O2 se use con más rapidez que el CO2 producido, aunque es bien conocido que la tasa de difusión de éste es mucho mayor. La monitorización de la tensión de O2 en la médula espinal es un importante método para detectar los cambios isquémicos.
Durante la oclusión aórtica, se requieren métodos fiables de monitorización de los cambios isquémicos de la médula espinal. Para prevenir los déficits neurológicos secundarios a una lesión isquémica de esta estructura, la evaluación perioperatoria del líquido cefalorraquídeo (LCR) puede contribuir a monitorizar los cambios isquémicos. Previamente documentamos el uso de la monitorización continua de PO2, PCO2 y pH en un modelo experimental de oclusión aórtica torácica1. Los resultados de estos estudios indicaron que, durante el clampaje aórtico en cerdos, la monitorización intratecal de PO2 y PCO2 se correlacionó con los cambios de la médula espinal evaluados mediante microscopía electrónica2. Puesto que el método permite la monitorización continua, en el presente estudio analizamos los registros en línea durante períodos de clampaje y reperfusión para proporcionar información más detallada sobre las alteraciones de la PO2 y PCO2 en LCR con respecto al grado de isquemia de la médula espinal.
Materiales y MétodosEn el presente estudio se usaron un total de 31 cerdos1,3 (13 machos y 18 hembras, que pesaban 27 ± 0,7 kg). Todos los animales se trataron en cumplimiento con los Principles of Laboratory Animal Care y la Guide for the Cared and Use of Laboratory Animals (National Institutes of Health, publication 86-23, revisada en 1985). Se obtuvo la aprobación del estudio del comité de investigación en animales.
Previamente se han descrito el método de anestesia y el modelo experimental2. En pocas palabras, se utilizó anestesia intravenosa con ketamina (Ketaminol, Intervet, Skovlunde, Dinamarca), morfina y pancuronio y los animales se conectaron a un respirador después de la traqueostomía. Se registraron las determinaciones hemodinámicas durante todos los experimentos. Se efectuó una esternotomía media, y la disección se extendió hasta la aorta abdominal y la arteria ilíaca común izquierda a través de un abordaje retroperitoneal paramedial izquierdo. Se disecaron ambas arterias subclavias, la aorta torácica descendente y la aorta abdominal, junto con las arterias ilíacas, viscerales abdominales, intercostales (T4-T13) y lumbares. Se efectuó una laminectomía torácica limitada y sobre un introductor arterial con aguja, se introdujo un sensor multiparamétrico de PO2, PCO2, pH y temperatura (Paratrend 7; Biomedical Sensors, High Wycombe, Reino Unido) en el espacio intratecal para la monitorización continua de PO2, PCO2, y pH en LCR. Previamente se han descrito los principios y el uso de este método para la detección de isquemia de la médula espinal durante el clampaje aórtico experimental y clínico preliminar1-3. Esta sonda consiste en un sistema combinado de electrodos-fibra óptica que, después de un período de calibración de 30 min, determina simultáneamente los valores de PO2, PCO2, pH y temperatura. Se obtuvieron continuamente determinaciones derivadas del sensor Paratrend durante todo el estudio. Se introdujo una sonda de láser Doppler (sonda T201; Perimed, Suecia) posterior a la duramadre (craneal al nivel de inserción del catéter Paratrend) y conectada con un fluxímetro de láser Doppler (Pf2B; Perimed, Estocolmo, Suecia) para determinar el flujo sanguíneo de la médula espinal (FME). Los valores se muestran como porcentaje de los basales.
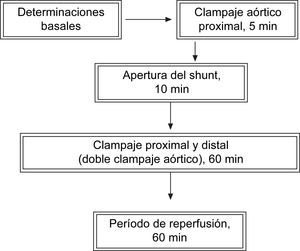
Como shunt aórtico, se insertó un tubo de plástico no heparinizado a través de la arteria subclavia izquierda proximal, cerca del cayado aórtico, y hasta la aorta abdominal distal a través de la arteria ilíaca común izquierda proximal. Se clampó la aorta torácica distal a la arteria subclavia izquierda (período de clampaje aórtico proximal de sólo 5 min). También se clampó la arteria subclavia derecha, seguido de la interrupción de las arterias lumbares con ligaduras. Antes de restablecer la presión aórtica distal a través del shunt aórtico durante 10 min (período de shunt abierto de 10 min), se permitieron 5 min para los registros en LCR. El flujo a través del shunt se monitorizó continuamente mediante ecografía a través del tiempo de tránsito (sonda 6RB32; Transonic Systems, Ithaca, NY). El flujo medio del shunt fue de 971,8 ± 59,3 ml/min. A continuación, se clampó la aorta torácica distal durante 60 min (doble clampaje aórtico de 60 min), seguido de reperfusión de 60 min (fig. 1).
En algunos de los animales se ligaron las arterias entre T11 y L1 para obtener diversos grados de isquemia de la médula espinal. Además, en 17 animales el nivel de clampaje aórtico distal fue inferior a L1, lo que permitió la perfusión de tan sólo las arterias viscerales a través del shunt (11 animales del grupo 1, tres del grupo 2 y tres del grupo 3). En 14 animales (uno del grupo 1, seis del grupo 2 y siete del grupo 3), el clampaje aórtico distal se efectuó por encima de T12 y se mantuvo la perfusión de la médula espinal (T12-L1) junto con las arterias viscerales a través del shunt. Algunos de los animales se habían incluido previamente en otros estudios de modo que agrupamos dos modelos diferentes de isquemia.
Treinta y un animales se dividieron en tres grupos con una agrupación retrospectiva de los animales de acuerdo con el grado de los valores de PO2 en LCR antes del desclampaje (en el período de isquemia): grupo 1 (n = 12 animales), la PO2 alcanzó 0 kPa; grupo 2 (n = 9), los valores de PO2 variaron entre 0 kPa y el 50% del estado previo al clampaje; grupo 3 (n = 10), PO2 ≥ 50% del estado previo al clampaje.
En los cálculos estadísticos, para la comparación entre grupos, se utilizó la prueba de la U de Mann-Whitney, y para las medidas repetidas la prueba de Wilcoxon para datos apareados. Todos los valores se expresan como medias ± error estándar de la media. Se consideró estadísticamente significativo un valor de p < 0,05.
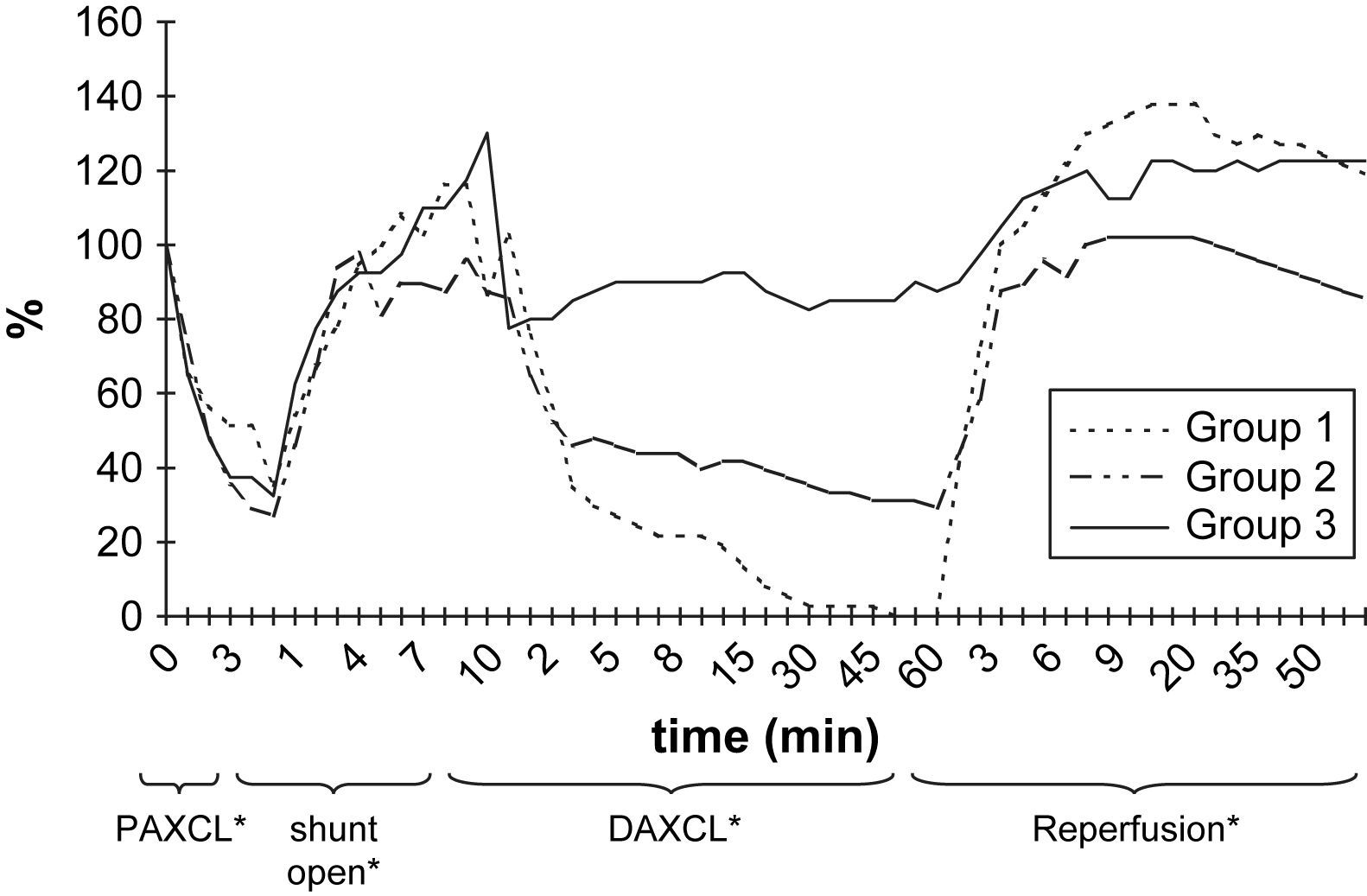
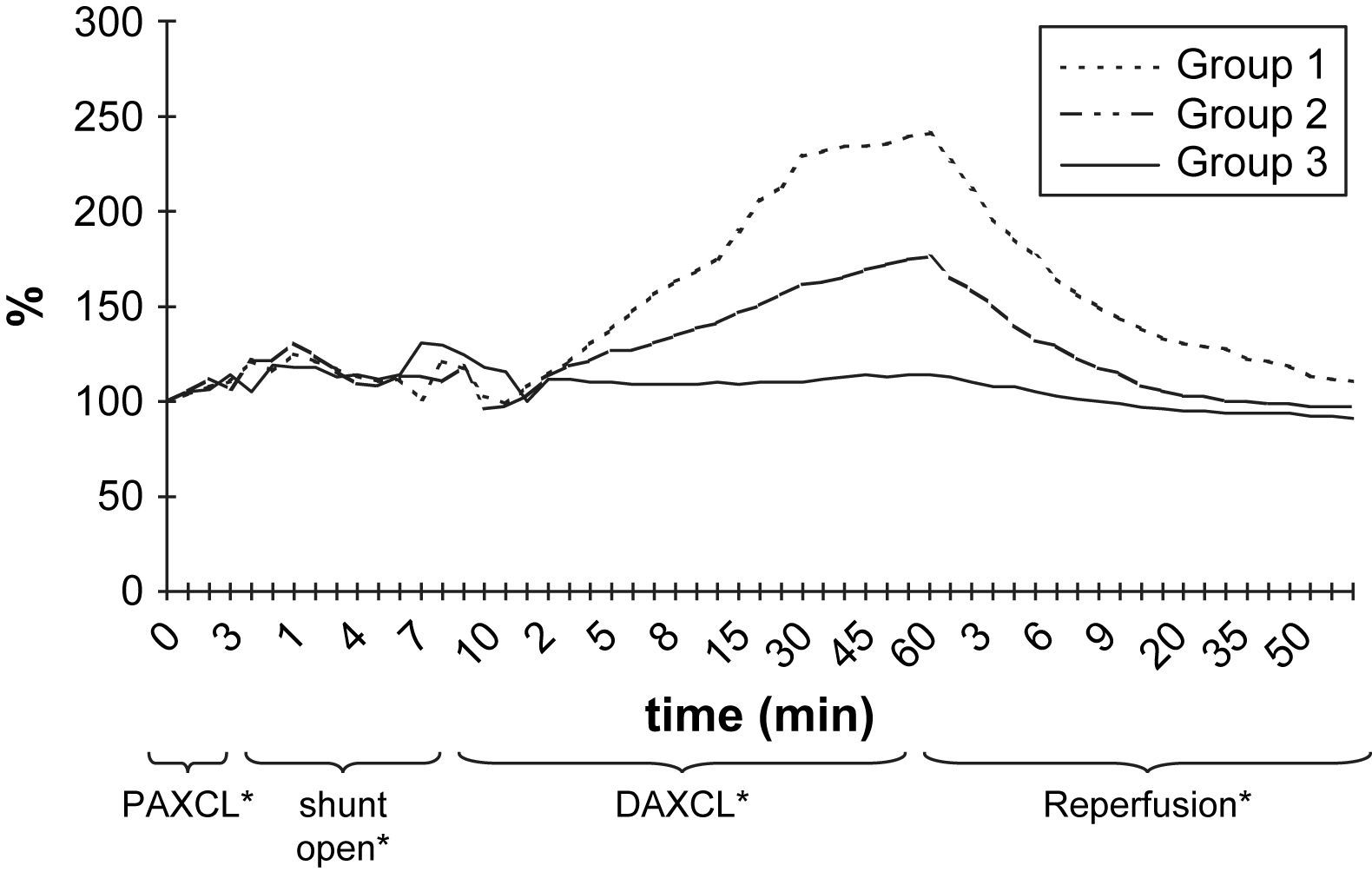
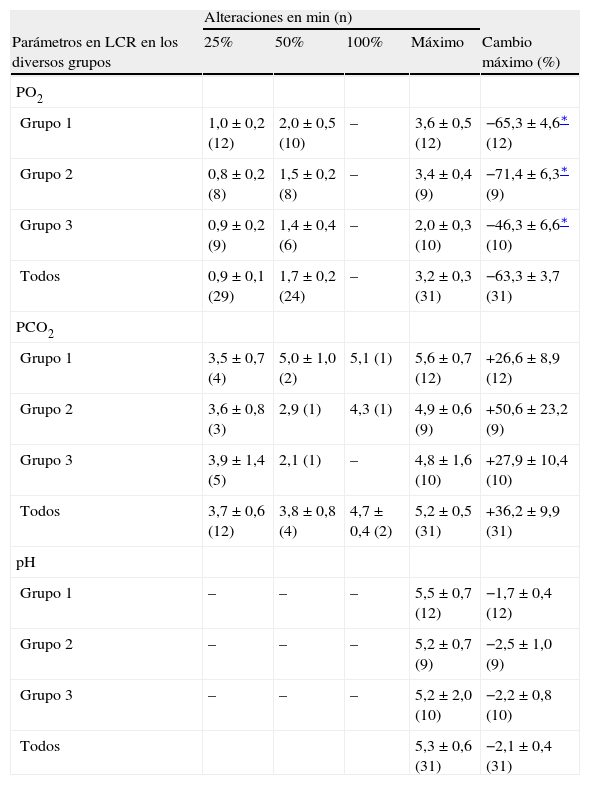
ResultadosEn la tabla I y en las figuras 2 y 3 se resumen las alteraciones de los valores de PO2 y PCO2 en LCR después del clampaje aórtico proximal. Durante el período de 5 min, la PO2 en LCR disminuyó un 46-71% comparado con los valores basales en los tres grupos. El valor más bajo fue de 71 ± 6% en el segundo grupo. En 24 animales (77%) se observó, como mínimo, una disminución del 50% de la PO2 en LCR. Sólo en el 32% de los animales estos valores disminuyeron hasta el 25% de los basales. Después del clampaje aórtico proximal en todos los animales el tiempo hasta alcanzar el valor más bajo máximo de PO2 en LCR fue de 3,2 ± 0,3 min. Durante el inicial, no se observó un aumento significativo de la PCO2 en LCR (período isquémico de 5 min).
Determinaciones de los valores de PO2, PCO2, y pH en líquido cefalorraquídeo (LCR) como cambios del 25%, 50% y 100% de acuerdo con los valores basales y tiempos de reacción después de clampaje aórtico proximal
| Alteraciones en min (n) | |||||
| Parámetros en LCR en los diversos grupos | 25% | 50% | 100% | Máximo | Cambio máximo (%) |
| PO2 | |||||
| Grupo 1 | 1,0 ± 0,2 (12) | 2,0 ± 0,5 (10) | – | 3,6 ± 0,5 (12) | −65,3 ± 4,6∗ (12) |
| Grupo 2 | 0,8 ± 0,2 (8) | 1,5 ± 0,2 (8) | – | 3,4 ± 0,4 (9) | −71,4 ± 6,3∗ (9) |
| Grupo 3 | 0,9 ± 0,2 (9) | 1,4 ± 0,4 (6) | – | 2,0 ± 0,3 (10) | −46,3 ± 6,6∗ (10) |
| Todos | 0,9 ± 0,1 (29) | 1,7 ± 0,2 (24) | – | 3,2 ± 0,3 (31) | −63,3 ± 3,7 (31) |
| PCO2 | |||||
| Grupo 1 | 3,5 ± 0,7 (4) | 5,0 ± 1,0 (2) | 5,1 (1) | 5,6 ± 0,7 (12) | +26,6 ± 8,9 (12) |
| Grupo 2 | 3,6 ± 0,8 (3) | 2,9 (1) | 4,3 (1) | 4,9 ± 0,6 (9) | +50,6 ± 23,2 (9) |
| Grupo 3 | 3,9 ± 1,4 (5) | 2,1 (1) | – | 4,8 ± 1,6 (10) | +27,9 ± 10,4 (10) |
| Todos | 3,7 ± 0,6 (12) | 3,8 ± 0,8 (4) | 4,7 ± 0,4 (2) | 5,2 ± 0,5 (31) | +36,2 ± 9,9 (31) |
| pH | |||||
| Grupo 1 | – | – | – | 5,5 ± 0,7 (12) | −1,7 ± 0,4 (12) |
| Grupo 2 | – | – | – | 5,2 ± 0,7 (9) | −2,5 ± 1,0 (9) |
| Grupo 3 | – | – | – | 5,2 ± 2,0 (10) | −2,2 ± 0,8 (10) |
| Todos | 5,3 ± 0,6 (31) | −2,1 ± 0,4 (31) | |||
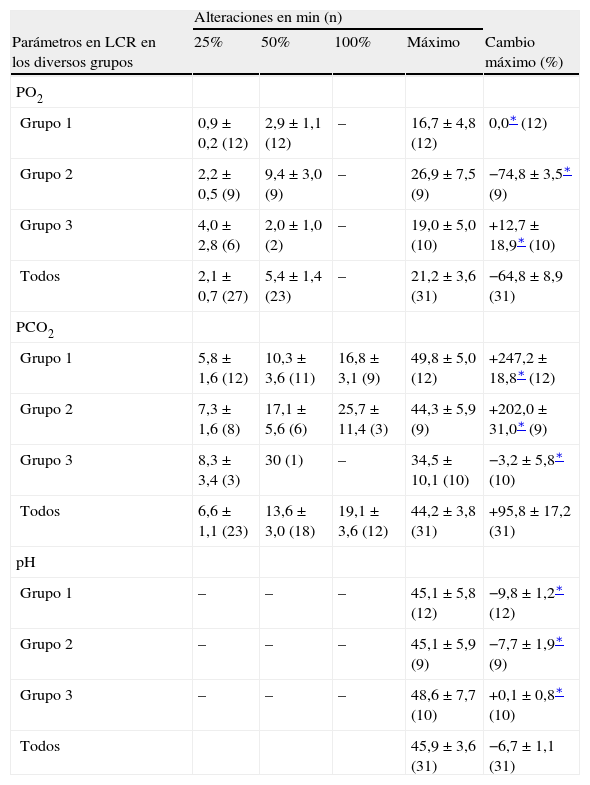
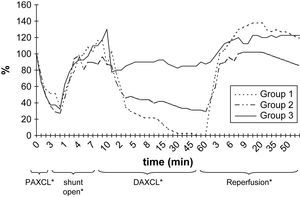
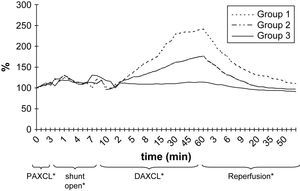
Durante la perfusión aórtica distal a través del shunt, antes de la aplicación del segundo clampaje aórtico, los valores de PO2 y PCO2 en LCR fueron ligeramente más bajos que los basales. Las alteraciones en LCR observadas durante el período inicial de 5 min después de la aplicación del segundo clampaje aórtico fueron similares a las obtenidas tras el clampaje aórtico proximal (tabla II, figs. 2 y 3). En el grupo 1, la PO2 en LCR disminuyó hasta 0 kPa después de 16,7 ± 4,8 min. En los grupos 1 y 2 se observó un aumento de PCO2 en LCR de, como mínimo, un 200% con un aumento gradual continuo durante el período de clampaje de 60 min.
Determinaciones de los valores de PO2, PCO2, y pH en líquido cefalorraquídeo (LCR) como cambios del 25%, 50% y 100% de acuerdo con los valores basales y tiempos de reacción después de doble clampaje aórtico
| Alteraciones en min (n) | |||||
| Parámetros en LCR en los diversos grupos | 25% | 50% | 100% | Máximo | Cambio máximo (%) |
| PO2 | |||||
| Grupo 1 | 0,9 ± 0,2 (12) | 2,9 ± 1,1 (12) | – | 16,7 ± 4,8 (12) | 0,0∗ (12) |
| Grupo 2 | 2,2 ± 0,5 (9) | 9,4 ± 3,0 (9) | – | 26,9 ± 7,5 (9) | −74,8 ± 3,5∗ (9) |
| Grupo 3 | 4,0 ± 2,8 (6) | 2,0 ± 1,0 (2) | – | 19,0 ± 5,0 (10) | +12,7 ± 18,9∗ (10) |
| Todos | 2,1 ± 0,7 (27) | 5,4 ± 1,4 (23) | – | 21,2 ± 3,6 (31) | −64,8 ± 8,9 (31) |
| PCO2 | |||||
| Grupo 1 | 5,8 ± 1,6 (12) | 10,3 ± 3,6 (11) | 16,8 ± 3,1 (9) | 49,8 ± 5,0 (12) | +247,2 ± 18,8∗ (12) |
| Grupo 2 | 7,3 ± 1,6 (8) | 17,1 ± 5,6 (6) | 25,7 ± 11,4 (3) | 44,3 ± 5,9 (9) | +202,0 ± 31,0∗ (9) |
| Grupo 3 | 8,3 ± 3,4 (3) | 30 (1) | – | 34,5 ± 10,1 (10) | −3,2 ± 5,8∗ (10) |
| Todos | 6,6 ± 1,1 (23) | 13,6 ± 3,0 (18) | 19,1 ± 3,6 (12) | 44,2 ± 3,8 (31) | +95,8 ± 17,2 (31) |
| pH | |||||
| Grupo 1 | – | – | – | 45,1 ± 5,8 (12) | −9,8 ± 1,2∗ (12) |
| Grupo 2 | – | – | – | 45,1 ± 5,9 (9) | −7,7 ± 1,9∗ (9) |
| Grupo 3 | – | – | – | 48,6 ± 7,7 (10) | +0,1 ± 0,8∗ (10) |
| Todos | 45,9 ± 3,6 (31) | −6,7 ± 1,1 (31) | |||
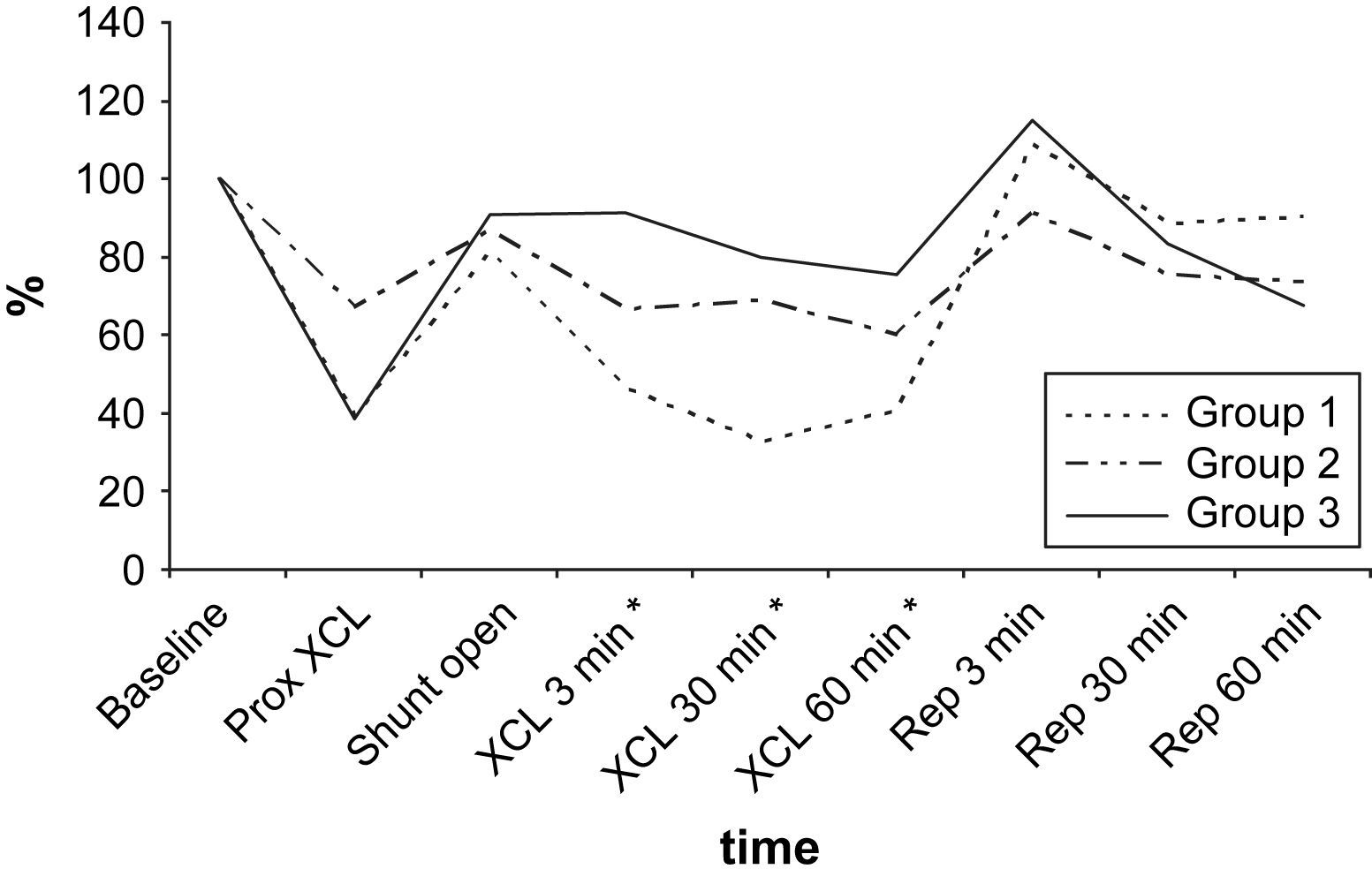
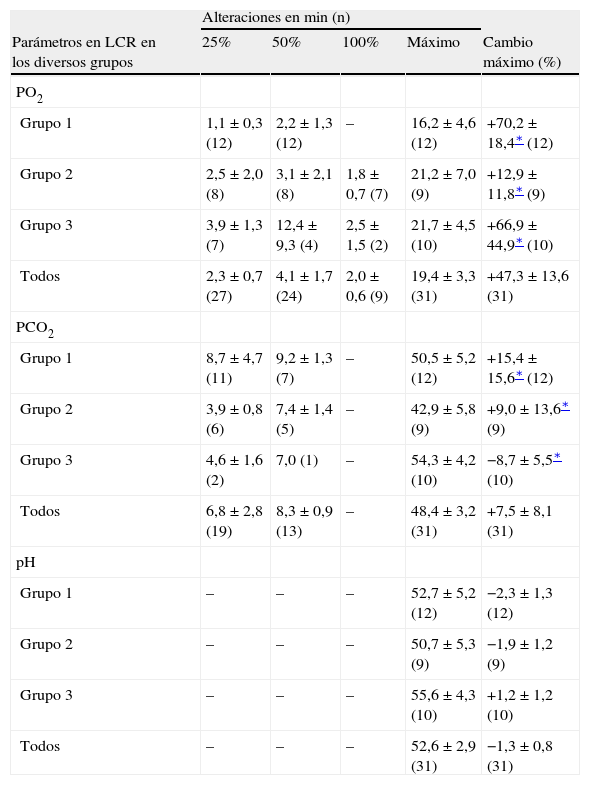
En todos los grupos, los valores de PO2 en LCR aumentaron durante el período de reperfusión (tabla III, fig. 2). El aumento máximo se observó en el grupo 1, en el que fue significativamente mayor que en los otros grupos de acuerdo con el período de doble clampaje aórtico (p = 0,003). Cuando comparamos el período de reperfusión, la diferencia entre grupos no fue estadísticamente significativa de acuerdo con el período basal. Al término del período de reperfusión, los valores de PO2 seguían siendo más altos que las determinaciones obtenidas en el período basal (p < 0,05).
Determinaciones de los valores de PO2, PCO2, y pH en líquido cefalorraquídeo (LCR) como cambios del 25%, 50% y 100% de acuerdo con los valores basales y sus tiempos de reacción durante la reperfusión
| Alteraciones en min (n) | |||||
| Parámetros en LCR en los diversos grupos | 25% | 50% | 100% | Máximo | Cambio máximo (%) |
| PO2 | |||||
| Grupo 1 | 1,1 ± 0,3 (12) | 2,2 ± 1,3 (12) | – | 16,2 ± 4,6 (12) | +70,2 ± 18,4∗ (12) |
| Grupo 2 | 2,5 ± 2,0 (8) | 3,1 ± 2,1 (8) | 1,8 ± 0,7 (7) | 21,2 ± 7,0 (9) | +12,9 ± 11,8∗ (9) |
| Grupo 3 | 3,9 ± 1,3 (7) | 12,4 ± 9,3 (4) | 2,5 ± 1,5 (2) | 21,7 ± 4,5 (10) | +66,9 ± 44,9∗ (10) |
| Todos | 2,3 ± 0,7 (27) | 4,1 ± 1,7 (24) | 2,0 ± 0,6 (9) | 19,4 ± 3,3 (31) | +47,3 ± 13,6 (31) |
| PCO2 | |||||
| Grupo 1 | 8,7 ± 4,7 (11) | 9,2 ± 1,3 (7) | – | 50,5 ± 5,2 (12) | +15,4 ± 15,6∗ (12) |
| Grupo 2 | 3,9 ± 0,8 (6) | 7,4 ± 1,4 (5) | – | 42,9 ± 5,8 (9) | +9,0 ± 13,6∗ (9) |
| Grupo 3 | 4,6 ± 1,6 (2) | 7,0 (1) | – | 54,3 ± 4,2 (10) | −8,7 ± 5,5∗ (10) |
| Todos | 6,8 ± 2,8 (19) | 8,3 ± 0,9 (13) | – | 48,4 ± 3,2 (31) | +7,5 ± 8,1 (31) |
| pH | |||||
| Grupo 1 | – | – | – | 52,7 ± 5,2 (12) | −2,3 ± 1,3 (12) |
| Grupo 2 | – | – | – | 50,7 ± 5,3 (9) | −1,9 ± 1,2 (9) |
| Grupo 3 | – | – | – | 55,6 ± 4,3 (10) | +1,2 ± 1,2 (10) |
| Todos | – | – | – | 52,6 ± 2,9 (31) | −1,3 ± 0,8 (31) |
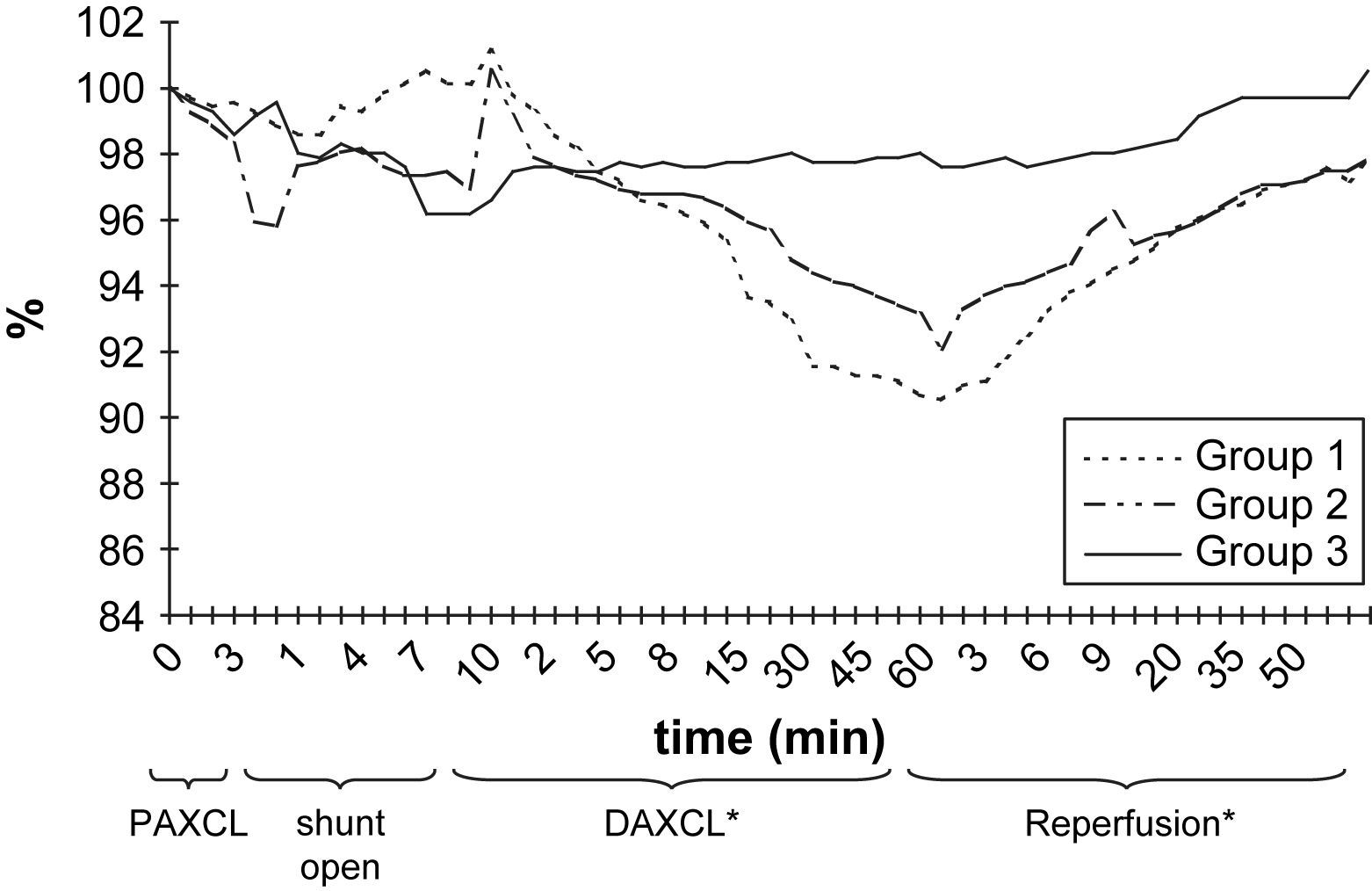
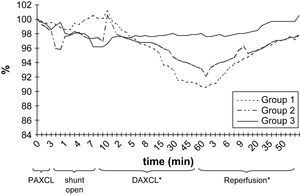
El pH de LCR no mostró cambios significativos después del período inicial de clampaje proximal de 5 min (tabla I). Durante el doble clampaje aórtico, se observó una disminución gradual y progresiva del pH en los grupos 1 y 2 y, al término del período de reperfusión, en estos grupos, las determinaciones siguieron siendo más bajas que los valores basales (p > 0,05) (fig. 4).
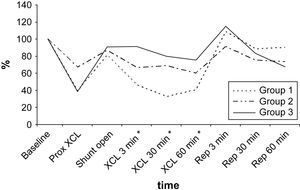
Según lo determinado mediante la sonda de láser Doppler, el FME disminuyó durante el clampaje proximal de 5 min y aumentó tras el flujo de shunt. El flujo sanguíneo disminuyó y, más tarde, aumentó durante los períodos de isquemia y reperfusión puesto que el O2 reaccionó de acuerdo con los grupos de isquemia del estudio. Durante los períodos de isquemia, en los grupos 1, 2 y 3, respectivamente se alcanzaron disminuciones máximas del 67,2%, 39,3% y 24,6% (fig. 5). Para alcanzar niveles máximos, se requirieron 30-60 min.
DiscusiónPara la detección de isquemia de la médula espinal durante la cirugía de bypass aórtico toracoabdominal se han propuesto diversos métodos de monitorización intraoperatoria pero ninguno ha obtenido una aplicación generalizada4. Svensson et al5 describieron el uso de un electrodo de platino intratecal en una tentativa de identificar los vasos que irrigan la médula espinal durante la inyección intraaórtica de iones hidrógeno. A pesar de la prometedora experiencia inicial, tanto experimental como clínica, el método no se ha evaluado en series a mayor escala.
Wadouh et al6 determinaron directamente la PO2 de la superficie de la médula espinal en cerdos, tras el clampaje aórtico torácico, y describieron que la causa de la lesión de la médula espinal era una deficiencia de O2 distal a la oclusión. Mediante un catéter montado en balón intraaórtico, Ishizaki et al7 determinaron la tensión de O2 intratecal, epidural y en la médula espinal con un espectrómetro de masas rígido en perros, en los que se produjo una isquemia graduada en la médula espinal. Estos autores describieron que la concentración intratecal y epidural de O2 reflejó con precisión su contenido en la médula espinal. Sugirieron que la determinación intratecal de PO2 podría usarse como un nuevo indicador de isquemia de la médula espinal durante la oclusión aórtica. Recientemente, el mismo grupo ha descrito la monitorización de la tensión intratecal de O2 durante la oclusión aórtica en perros para identificar las arterias nutricias de la médula espinal8. La perfusión selectiva de estas arterias mejoró la tensión intratecal de O2 y los potenciales evocados raquídeos, que la isquemia disminuyó significativamente. Los autores señalaron que la principal preocupación de la monitorización de la tensión de O2 en LCR era la sonda de PO2. Era una sonda rígida, no apropiada para su utilización en humanos debido al riesgo de lesión de la médula espinal durante su inserción. Destacaron la necesidad de desarrollar sondas blandas y flexibles.
Los primeros estudios publicados por Wadouh et al6 e Ishizaki et al7 sobre el uso de la determinación de la tensión de O2 en la médula espinal durante la oclusión aórtica torácica propiciaron que evaluáramos la aplicación de un nuevo catéter flexible multiparamétrico para la monitorización continua de PO2, PCO2 y pH en LCR durante la oclusión aórtica experimental en cerdos. Previamente hemos descrito diversos aspectos de la monitorización de oxígeno en LCR9. El catéter intratecal utilizado en el presente estudio se ha usado clínicamente durante años para la monitorización en línea de los gases en sangre arterial10. Se ha validado usando un análisis convencional de gases sanguíneos y se ha demostrado una correlación apropiada. También se ha utilizado en otros lugares, sobre todo con objetivos de investigación11,12.
En el presente estudio, que incluyó algunos de los animales descritos previamente, se analizaron con detalle las alteraciones de PO2, PCO2 y pH en LCR con respecto al tiempo de reacción y al cambio máximo de cada parámetro derivado de la sonda Paratrend durante y después del clampaje aórtico. Los resultados deben considerarse complementarios de nuestras observaciones previas.
Los resultados del presente estudio demostraron que, después de clampaje aórtico torácico, la PO2 de LCR disminuyó hasta como mínimo el 50% de los valores basales en 1,7 ± 0,2 min (límites 0,5-5,7). El restablecimiento del flujo sanguíneo aórtico distal a través del shunt dio lugar a una respuesta rápida similar y a un aumento de los valores de PO2 en LCR. No se observaron cambios significativos de la PCO2 y el pH en LCR durante el período isquémico inicial de 5 min tras el clampaje aórtico, pero hubo un aumento gradual y progresivo de la PCO2 y una disminución del pH durante el doble clampaje de 60 min. El grado de alteraciones de estos dos parámetros durante el clampaje aórtico prolongado se correlacionó con el grado de isquemia de la médula espinal evaluado mediante los valores más bajos de PO2 en LCR antes del desclampaje. En animales con 0 kPa de PO2 en LCR durante el clampaje se demostraron los mayores aumentos de PCO2.
La reperfusión de la aorta dio lugar a una respuesta hiperémica, según lo observado con valores más altos de PO2, comparado con las determinaciones basales. Esta respuesta se observó incluso en animales, con una disminución < 50% de PO2 en LCR después del clampaje aórtico (grupo 3, grupo de isquemia leve). Previamente, con microscopía electrónica, hemos demostrado imágenes normales o cambios leves de la médula espinal en animales similares2. Es probable que, incluso en la isquemia leve de la médula espinal con cambios reversibles, tenga lugar una respuesta hiperémica. Los hallazgos no demostraron una correlación clara entre el grado de isquemia de la médula espinal y el tipo de respuesta hiperémica.
El flujo sanguíneo de la médula espinal se correlacionó significativamente con la PO2 de LCR, pero no alcanzó los niveles de PCO2 y no reaccionó con la misma rapidez. De acuerdo con los resultados del presente estudio, la monitorización de la PO2 en LCR es sensible y fiable para evaluar los cambios circulatorios en la médula espinal durante la oclusión arterial. Recientemente, Lips et al13 documentaron que la determinación intratecal de PO2 es una técnica de monitorización sensible para detectar los cambios en tiempo real de la oxigenación local de la médula espinal y que la monitorización continua de PO2 en LCR podría aplicarse para la evaluación de pacientes en riesgo de isquemia de la médula espinal.
En conclusión, la monitorización intratecal de PO2 es sensible para la evaluación de los cambios circulatorios en tiempo real en la médula espinal durante la oclusión aórtica y, debido a su rápida respuesta a la isquemia, podría usarse para la detección de las arterias segmentarias críticas durante el bypass aórtico. Se han programado estudios futuros para abordar la correlación entre la oxigenación intratecal y el desenlace neurológico durante la oclusión aórtica torácica experimental.
Presentado en la 16 Reunión Anual de la Mediterranean Association of Cardiology and Cardiac Surgery, Bodrum, Turquía, 26-29 de septiembre de 2004.