El síndrome de robo asociado a diálisis (SRAD) es una complicación potencialmente devastadora. Recientemente se ha descrito la proximalización del flujo arterial aferente (PFA) como nueva técnica quirúrgica con buenos efectos en casos de SRAD. Dado que aún no existe mucha familiarización con esta técnica, nuestro objetivo con este estudio prospectivo fue establecer su indicación para un grupo especial de pacientes que desarrollaron un SRAD avanzado (necrosis de los dedos) tras crear un abordaje para hemodiálisis (AH) autólogo. Veintitrés pacientes (18 AH braquiales, 5 en la muñeca) con SRAD avanzado fueron sometidos a PFA. Para el injerto se utilizó material protésico de politetrafluoroetileno heparinizado (13 pacientes) o no heparinizado (10 pacientes). La función vascular se evaluó pre y postoperatoriamente mediante eco-Doppler. El éxito de la intervención se determinó mediante la restitución de la circulación en la extremidad y la preservación del AH. En 15 casos (65%) los síntomas de SRAD desaparecieron por completo y en 6 pacientes (26%) se logró la cicatrización adecuada de la herida con mejoría de los síntomas. Éstos persistieron en 2 pacientes (9%) que presentaban una pérdida tisular>1cm en las yemas de los dedos. En conjunto se produjo un aumento significativo en la velocidad del flujo de la arteria radial (de 35,65±7,69 a 55,21±8,51cm/s, p<0,005) tras la PFA. Se detectó una reducción del flujo de la fístula (de 1,38±0,48 a 0,94±0,14 l/min, p=0,003) en pacientes con AH en el codo pero no en pacientes con AH en la muñeca. La permeabilidad secundaria tras 18 meses fue del 85%. La PFA provocó una mejoría en la circulación de la arteria radial distal con banding adicional en el AH del codo. Observamos que la PFA fue satisfactoria desde el punto de vista clínico, especialmente en pacientes que desarrollaron necrosis del dedo meñique como forma de SRAD avanzado. Sin embargo, la PFA no tuvo éxito en casos de pérdidas tisulares severas (> 1cm de diámetro) (n=2). En tales casos deben considerarse otras opciones terapéuticas.
El síndrome de robo asociado a diálisis (SRAD) se produce en el 2-8% de los pacientes tras la creación de un abordaje arteriovenoso para hemodiálisis1-5 (AH). El SRAD puede provocar diferentes problemas clínicos. En un estadio avanzado, el SRAD suele provocar dolor, alteraciones funcionales y necrosis de los dedos6-8. Los tratamientos en el pasado han sido la ligadura del AH, banding y la revascularización distal con ligadura intermedia9,10 (DRIL). La ligadura del abordaje mejora la circulación periférica de forma inmediata, siendo necesario un nuevo abordaje. El banding tiene resultados satisfactorios en pacientes con una fístula de alto flujo, especialmente (como ha demostrado nuestro grupo) en caso de inicio agudo de los síntomas. Sin embargo, no parece ser suficiente en casos de SRAD avanzado con desarrollo de necrosis5,8,11. La intervención DRIL es una técnica establecida en todos los tipos de SRAD9,10; sin embargo, requiere la ligadura de una arteria permeable como elemento clave. En el AH braquial, que provoca un SRAD con mayor frecuencia que el AH en la muñeca3, esto supondría la ligadura de la arteria humeral. Al igual que otros autores, consideramos desaconsejable este tipo de procedimiento. La proximalización del flujo arterial aferente (PFA) es un nuevo método que ha demostrado ofrecer buenos resultados en el SRAD12 (n=30). No se ha publicado ningún otro informe (con un número adecuado de pacientes) sobre esta técnica. La PFA puede ser muy ventajosa en pacientes con SRAD avanzado que tienen un riesgo elevado de perder la funcionalidad del brazo o el abordaje actual. Por tanto (al contrario que en el primer estudio mencionado), los objetivos de este estudio prospectivo fueron: 1) evaluar la eficacia de la PFA en pacientes con SRAD avanzado y 2) presentar una experiencia adicional con este nuevo método prometedor.
Materiales y métodosRealizamos un estudio prospectivo en el que participaron 23 pacientes que fueron sometidos a la técnica de la PFA en nuestro departamento desde 2003 hasta 2007. Entre ellos había 6 pacientes de otros centros; la intervención de AH primario se había realizado en nuestro departamento en 17 pacientes. La indicación para la PFA fueron síntomas de SRAD avanzado tras un AH arteriovenoso. El SRAD se definió como avanzado en los casos en los que existió lesión isquémica del tejido acral combinada con síntomas como dolor en reposo, distrofia y alteraciones funcionales. Los criterios diagnósticos del SRAD se basaron en los exámenes clínicos (anamnesis, examen físico) y exploraciones complementarias (eco-Doppler, angiografía). No se realizaron determinaciones del índice de presión ya que, según nuestra experiencia, los resultados de la ecografía son mucho más precisos y se correlacionan muy bien con los síntomas clínicos (datos no publicados). Los siguientes pacientes fueron excluidos del estudio:
- •
Pacientes con fístulas protésicas (en asa o rectas). Una característica importante de la PFA es que preserva la vena de la fístula existente, lo que no es posible en casos de fístula en asa preexistente.
- •
Pacientes con SRAD de alto flujo y síntomas como dolor, adormecimiento y palidez pero sin cambios tróficos. Otras técnicas, como el banding de la fístula, pueden ofrecer mejores resultados (estudio separado6).
- •
Pacientes con excesiva pérdida tisular, especialmente gangrena de uno o varios dedos. En estos casos, se realizó el cierre del AH con la amputación de la extremidad afectada.
Para el estudio, se obtuvo un historial médico preoperatorio que incluyó información específica sobre el SRAD. Probablemente de relevancia para el desarrollo de un SRAD avanzado, muchos de nuestros pacientes tienen esclerosis de la media y/o arteriopatía periférica oclusiva (APO) de las arterias distales6,8. La esclerosis de la media se diagnosticó en función de la estructura de la pared arterial; la APO se consideró adecuada si las zonas estenósicas llegaron al 60% como mínimo. Por tanto, se realizó un examen con eco-Doppler (Voluson 730 Expert, sonda de disposición lineal SP6-12, frecuencia de la imagen central 8,0MHz, frecuencia Doppler 5,0-7,5MHz; GE Medical Systems Kretz Ultrasound, Solingen, Alemania) en cada paciente para evaluar la velocidad del flujo de las arterias periféricas antes y después de la cirugía. Esto se realizó midiendo la velocidad del flujo AH (en la arteria radial o braquial en litros por minuto) y la velocidad máxima en la arteria radial distal (centímetros por segundo). En un caso en que no se pudo obtener un resultado ecográfico exacto (ausencia total de señal ecográfica debido a una calcificación severa del vaso), se realizó preoperatoriamente una arteriografía selectiva del brazo afectado. Por la misma razón, en 3 pacientes se realizó una angiografía por tomografía computarizada (TC), como nuevo método, para descartar una estenosis arterial proximal o distal que no se pudo evaluar adecuadamente mediante ecografía.
Durante el postoperatorio, todos los pacientes fueron sometidos a un segundo examen con eco-Doppler para evaluar el flujo AH postoperatorio. Así mismo se midió la velocidad máxima en la arteria radial distal. Dado que las determinaciones del flujo pueden variar debido a la presión arterial y a otros motivos, su variación antes y después de la cirugía solamente se consideraron apropiadas si la diferencia fue>200ml/min.
Además se realizaron dos sesiones de hemodiálisis en nuestro Departamento de Nefrología para demostrar que el nuevo abordaje funcionaba de forma correcta. Se obtuvo documentación fotográfica de las lesiones acrales en el preoperatorio y 4-6 semanas después de la cirugía. Los pacientes se visitaron trimestralmente en nuestro hospital de día.
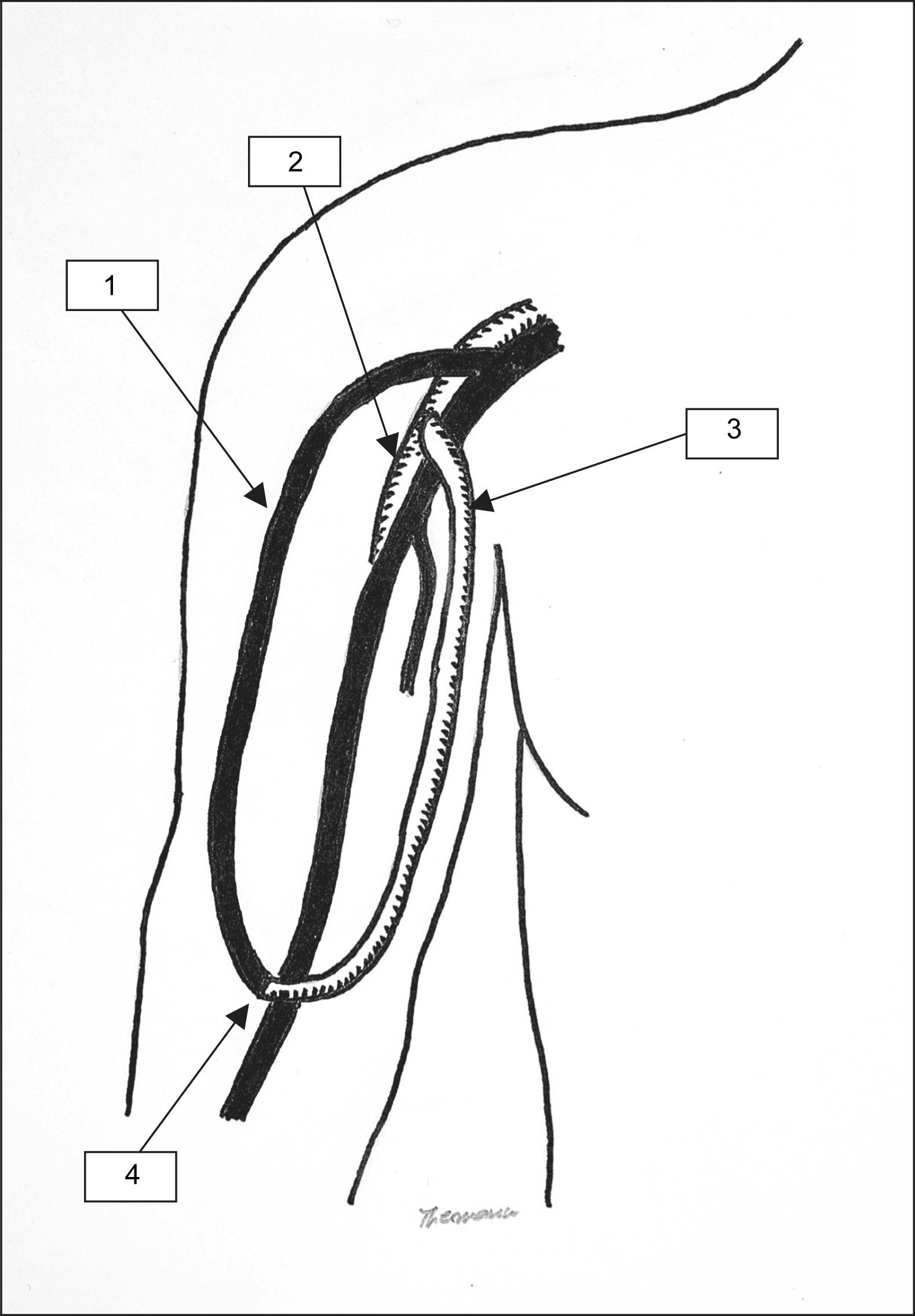
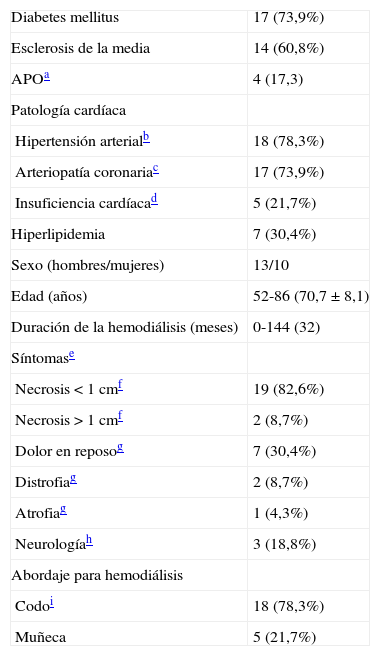
Técnicamente, la intervención quirúrgica se realizó de la forma descrita recientemente12. En primer lugar, el AH se cerró ligando la vena cefálica (=fístula) cerca de la primera anastomosis arteriovenosa. Posteriormente se colocó un implante protésico entre la arteria axilar (o la arteria braquial en el AH de la muñeca) y la vena cefálica (o la vena cefálica antebraquial en el AH de la muñeca) (fig. 1). Esto da lugar a un asa arteriovenosa formada en parte por material protésico y en parte por la antigua vena de la fístula. Como material protésico utilizamos un implante de politetrafuoroetileno (PTFE) expandido y heparinizado (Propaten®; W. L. Gore, Putzbrunn, Alemania) en 13 pacientes y no heparinizado (Venaflo®; Bard, Karlsruhe, Alemania) en 9 pacientes. La elección del injerto heparinizado o no se hizo de forma individual. En ambos casos, el implante se colocó entre la arteria proximal y la vena de la forma descrita. No utilizamos prótesis cónicas ya que la vena cefálica precondicionada era distensible con un caso de 6 (13 pacientes) o 7 (10 pacientes) mm en todos los casos. Sin embargo, en casos de incompatibilidad entre el calibre de la vena y el implante podría ser útil escoger el tamaño más adecuado de forma individualizada. En dichos casos debe determinarse el flujo intraoperatoriamente para evitar un flujo excesivo en el AH (diámetro demasiado grande) o inadecuado (diámetro demasiado pequeño). Las anastomosis arteriales (terminolateral) y venosas (terminoterminal) se llevaron a cabo con suturas no reabsorbibles de 6-0. En el postoperatorio, la vena de la fístula se canuló inmediatamente para realizar la hemodiálisis. El implante no se puncionó para reducir al mínimo el riesgo de hematoma e infección. La intervención se consideró satisfactoria si se produjo la cicatrización de las lesiones y se conservó el abordaje para diálisis. En este estudio se registraron las complicaciones quirúrgicas, los índices de permeabilidad del implante y las reintervenciones. La comparación de los datos se realizó mediante el software Statistical Package for the Social Science, versión 10 (SPSS, Inc., Chicago, IL), utilizando el test de Wilcoxon de dos muestras. Los resultados se consideraron significativos con p<0,05. Se utilizó el análisis de la tabla de vida para evaluar los índices de permeabilidad.
ResultadosDe los 23 pacientes (18 AH braquiales, 5 en la muñeca; 13 hombres, 10 mujeres, edad 52-86 [70,7±8,1] años) sometidos a PFA, todos presentaron pruebas clínicas de lesión isquémica del tejido acral y 15 presentaron adicionalmente dolor en reposo de la mano. Tres de los casos también mostraron alteraciones neurológicas, y un paciente desarrolló atrofia muscular (tabla I). Veintiún pacientes (91%) tenían insuficiencia renal terminal (IRT) que requería hemodiálisis en el momento de la PFA, y 2 (9%) desarrollaron IRT 2 meses después de la intervención. Diecisiete pacientes (74%) tenían diabetes mellitus. La evaluación preoperatoria de la función arterial reveló una APO distal a la fístula y esclerosis de la media en 4 pacientes (17%) y solamente esclerosis de la media en 14 casos (61%) (tabla I). La anamnesis reveló hipertensión arterial, arteriopatía coronaria isquémica e insuficiencia cardíaca en 18 (78%), 17 (74%), y 5 (22%) pacientes, respectivamente (tabla I). Todos los pacientes fueron visitados periódicamente por su cardiólogo y tomaban la medicación adecuada.
Características de los pacientes
| Diabetes mellitus | 17 (73,9%) |
| Esclerosis de la media | 14 (60,8%) |
| APOa | 4 (17,3) |
| Patología cardíaca | |
| Hipertensión arterialb | 18 (78,3%) |
| Arteriopatía coronariac | 17 (73,9%) |
| Insuficiencia cardíacad | 5 (21,7%) |
| Hiperlipidemia | 7 (30,4%) |
| Sexo (hombres/mujeres) | 13/10 |
| Edad (años) | 52-86 (70,7±8,1) |
| Duración de la hemodiálisis (meses) | 0-144 (32) |
| Síntomase | |
| Necrosis<1cmf | 19 (82,6%) |
| Necrosis>1cmf | 2 (8,7%) |
| Dolor en reposog | 7 (30,4%) |
| Distrofiag | 2 (8,7%) |
| Atrofiag | 1 (4,3%) |
| Neurologíah | 3 (18,8%) |
| Abordaje para hemodiálisis | |
| Codoi | 18 (78,3%) |
| Muñeca | 5 (21,7%) |
APO: arteriopatía periférica oclusiva.
No se produjeron complicaciones postoperatorias tempranas en ninguno de los pacientes. En 15 de ellos (65%), la PFA logró la restitución completa de la extremidad, en 6 pacientes (26%) mejoraron los síntomas incluida la cicatrización de las úlceras, la reducción del dolor y la normalización de la funcionalidad de la mano. En todos los casos se pudo realizar la hemodiálisis a través del AH recién creado.
Los síntomas persistieron en 2 pacientes (9%) con necrosis inicial de los dedos>1cm, diabetes mellitus y arteriosclerosis severa. En ambos casos (ambos con AH en el codo), el AH tuvo que cerrarse tras 1 y 4 meses, respectivamente.
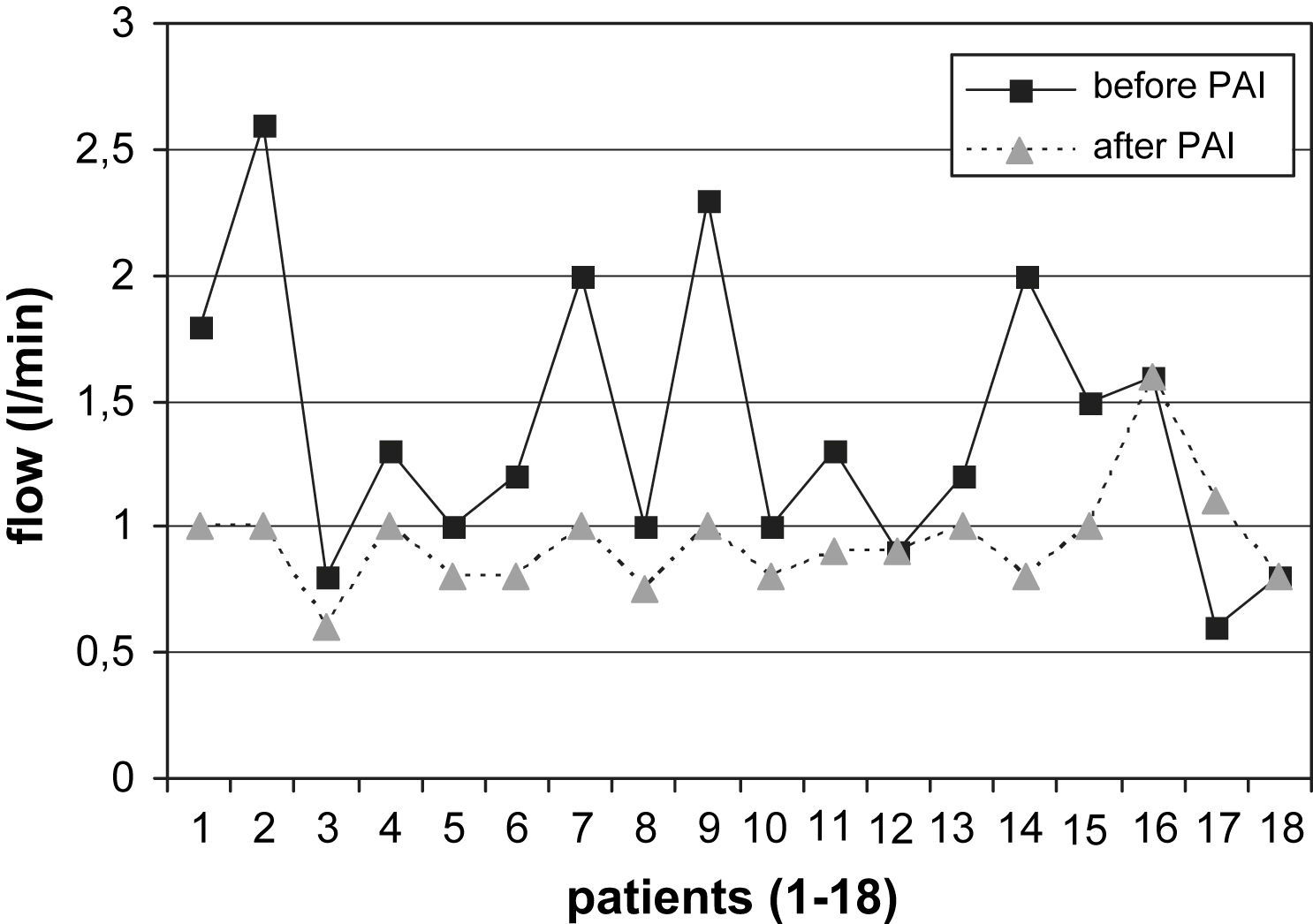
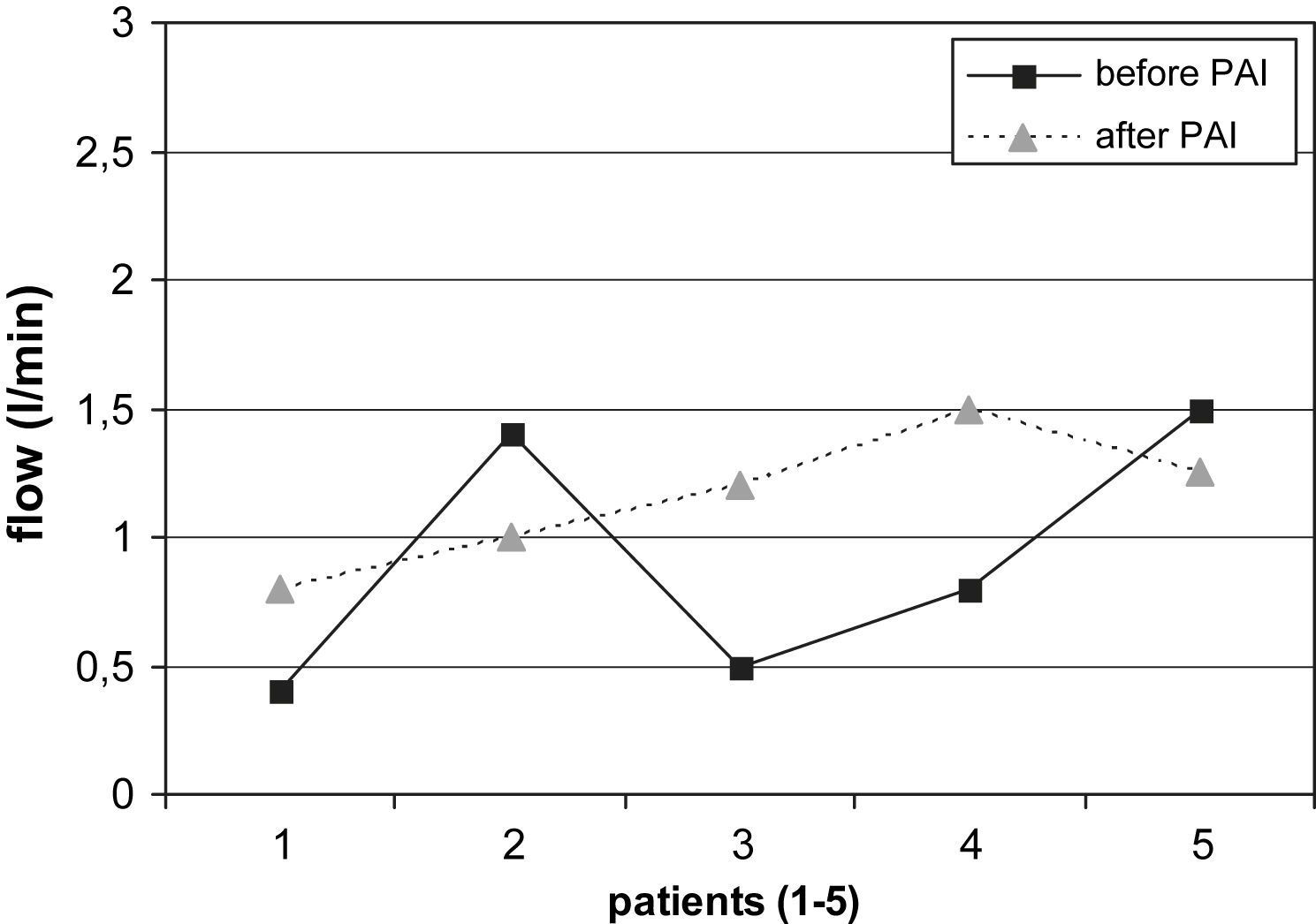
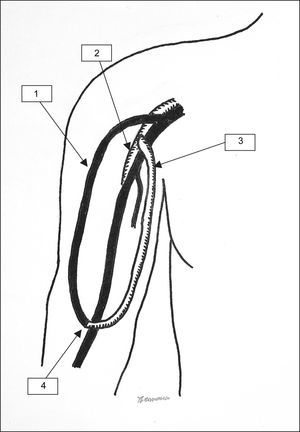
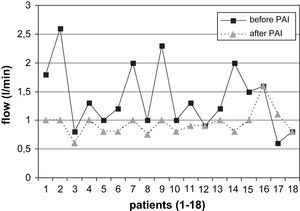
La comparación de los resultados del examen con eco-Doppler pre y postoperatorio mostró los siguientes resultados. Se determinó una reducción adecuada del flujo en el AH (> 200ml/min) en el 74% (14/19) de los pacientes con AH en el codo (desde 1,38±0,48 hasta 0,94±0,14 l/min, fig. 2). De los 2 pacientes sin éxito clínico (ambos con AH en el codo), uno no presentó una reducción apropiada del flujo. El cálculo estadístico mostró diferencias significativas en la reducción del flujo en el AH de las fístulas del codo durante el postoperatorio (p=0,003) pero no en los pacientes con AH en la muñeca. Por el contrario, de los 5 pacientes con AH en la muñeca, el flujo de la fístula fue más elevado tras la PFA en 3 casos (en conjunto 0,92±0,42 a 1,15±0,2 l/min, fig. 3).
Flujo de la fístula en pacientes con AH en la muñeca antes y después de la PFA (reducción no significativa del flujo sanguíneo). after PAI: después del flujo arterial aferente; before PAI: antes del flujo arterial aferente; flow (l/min): flujo (l/min); patients (1-5): pacientes (1-5).
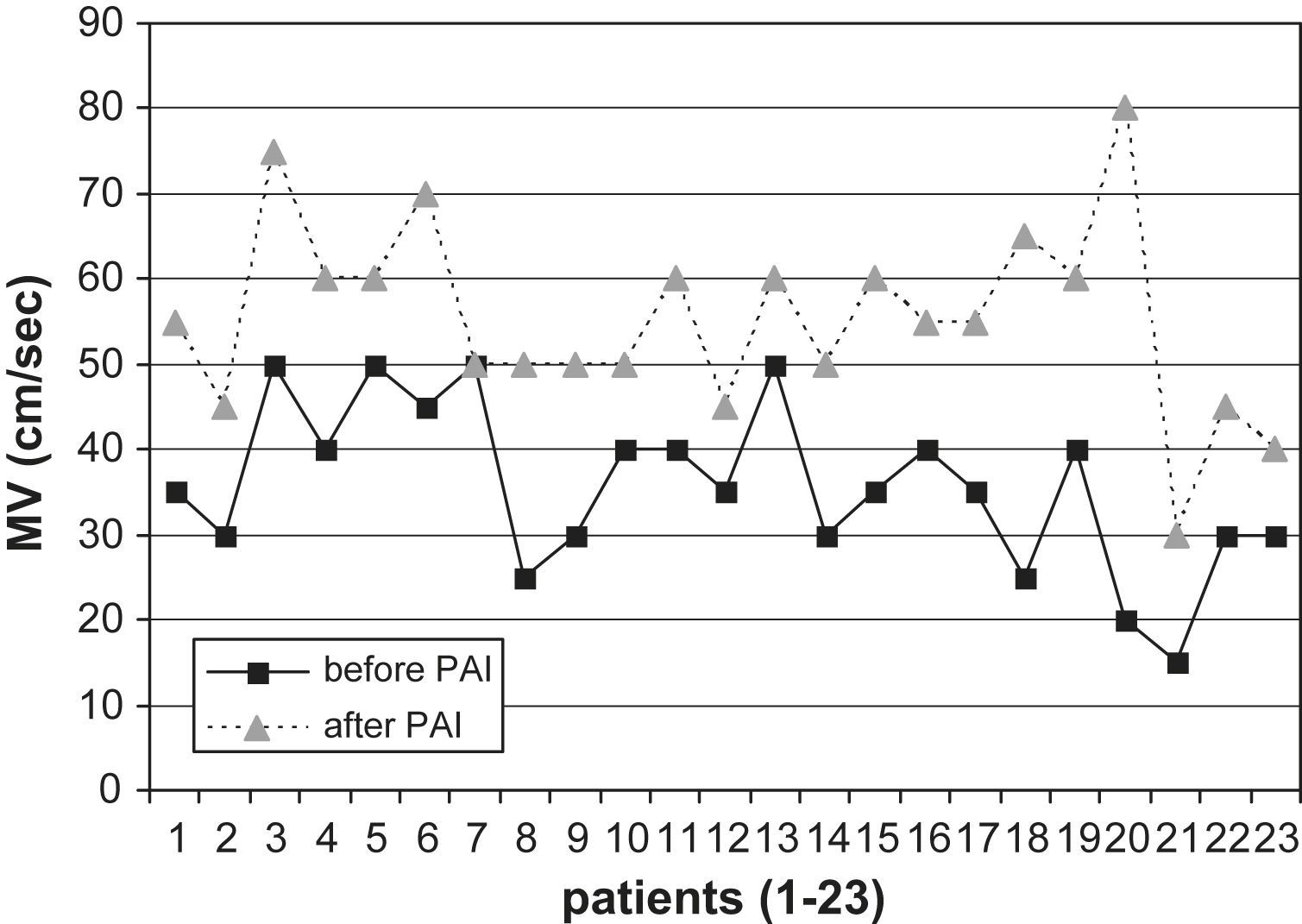
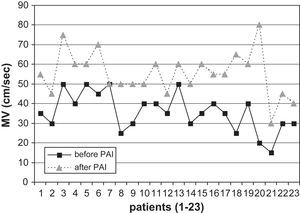
Veintidós pacientes (AH braquial y en la muñeca, 96%) presentaron una velocidad máxima (VM) mayor en la arteria radial en el postoperatorio (de 35,65±7,69 a 55,21±8,51cm/s) (fig. 4). Un paciente (mejoría clínica, reducción del flujo de 2 a 1 l/min en el postoperatorio, VM inicial 50cm/s) no presentó diferencias con respecto al flujo sanguíneo en la arteria radial distal tras la PFA. Los resultados fueron estadísticamente significativos (p<0,005).
El período de seguimiento fue de 9-40 meses (promedio 18,7±8,7). Cuatro implantes se explantaron al cabo de 1 y 4 meses (SRAD sin cicatrizar), 5 meses (infección), y 9 meses (reacción periimplante). Tres pacientes necesitaron una revisión debido a una trombosis temprana (que se produjo antes de 4 semanas). Uno de estos pacientes seguía presentando permeabilidad a los 17 meses. Dos casos necesitaron revisiones posteriores. Uno de ellos fue debido a una estenosis anastomósica entre el implante y la vena de la fístula. Las revisiones se realizaron a los 4 y 6 meses. En el segundo paciente se había suspendido la administración de cumarina por error y la revisión se realizó a los 12 meses. No se produjeron complicaciones después de estas revisiones.
Tres pacientes fueron sometidos a una trombectomía no complicada debido a una trombosis de la fístula que se produjo después de 12 meses. En estos casos, la arteriografía intraoperatoria no mostró una razón clara para esta trombosis diferida. Todos estos AH siguieron siendo permeables posteriormente. Un paciente falleció al cabo de 4 semanas debido a su mal estado general. Un paciente falleció a los 6 meses debido a una infección tras una cirugía de bypass infrainguinal estando el AH permeable. En conjunto, los índices de permeabilidad primaria y secundaria fueron del 73% tras 6 meses y del 59% tras 12 meses, respectivamente; la permeabilidad secundaria tras 18 meses fue del 85%. No existieron diferencias en los índices de permeabilidad entre pacientes con implantes heparinizados y no. Es más, pareció existir una tendencia hacia mejores resultados a largo plazo con los implantes heparinizados, aunque el número reducido de pacientes en ambos grupos dificultó las comparaciones.
DiscusiónEl SRAD es un problema del AH potencialmente devastador. Las experiencias con nuestros pacientes grupos muestran que el SRAD tiene diferentes manifestaciones clínicas6. La gravedad también es variable e incluye la posibilidad de pérdida amplia de tejido acral de consecuencias altamente mutilantes. Es más probable que las complicaciones graves del SRAD afecten a pacientes con cambios arteriales y/o diabetes mellitus3,6. Además, la mayoría de los pacientes que participaron en este estudio eran ancianos y sufrían cardiopatías.
La opción terapéutica de cerrar un AH suele conducir a la cicatrización de la herida, pero requiere abandonar una vena potencialmente útil y crear un nuevo lugar para el AH. El banding a menudo no es adecuado para aliviar los síntomas isquémicos, especialmente en pacientes con pérdida tisular6,8,11. La intervención DRIL, por otro lado, se ha mostrado muy útil para interrumpir el flujo sanguíneo retrógrado, un componente patológico significativo en casos de SRAD avanzado9,10. Sin embargo, esta intervención requiere la ligadura de una arteria permeable. Por tanto, utilizamos una nueva técnica (PFA), como describieron recientemente Zanow et al12. La PFA combina dos características: conversión del aporte arterial al AH a una arteria proximal y (en el AH de la muñeca) interrupción del flujo retrógrado. Otras posibles ventajas son una reducción de la velocidad del flujo similar a la obtenida con el banding. Esto es consecuencia de la prolongación del AH al interponer un implante de PTFE no expandible, como describieron Henriksson y Bergqvist1. Nuestros resultados mostraron una variabilidad considerable en los índices de flujo pre y postoperatorio en el AH del codo y la muñeca. Por consiguiente, la eficacia del banding sigue sin estar clara y parece tener importancia solamente en el AH del codo. Por otro lado, especialmente en pacientes con AH en la muñeca, el posible efecto del banding podría verse igualado por la mejoría del flujo aferente.
Técnicamente, la PFA es una intervención relativamente sencilla, especialmente si se compara con la DRIL. Hasta la fecha solamente existen unos pocos informes sobre el tratamiento del SRAD mediante PFA. De hecho, no se ha publicado ningún otro estudio prospectivo (exceptuando el de Zanow et al12, n=30) sobre la PFA. Jendrisak y Anderson13 describieron una intervención similar (la diferencia es que utilizaron una rama lateral de la arteria axilar) que logró buenos resultados. No está claro si el mecanismo básico de su modificación fue una reducción del flujo debido al menor tamaño de la rama vascular lateral o debido a la proximalización, como en la técnica PFA. En ambas intervenciones, sin embargo, la preservación del aporte arterial nativo sigue siendo la principal ventaja, ya que evita la necesidad de utilizar una vena para el bypass.
Dado el tamaño reducido de nuestra muestra no pudimos detectar una diferencia significativa en los índices de permeabilidad entre los pacientes con implantes heparinizados y no heparinizados. En general, los implantes no heparinizados pueden pincharse de forma segura para la diálisis, pero en nuestros pacientes el implante sirvió solamente como vaso nutricio y, por tanto, no se puncionó para reducir al mínimo el hematoma o la infección relacionados.
Aunque nuestra experiencia con esta nueva técnica se limitó a un grupo de pacientes relativamente pequeño, creemos que los resultados clínicos fueron buenos. Los índices de permeabilidad son similares a los descritos con la intervención DRIL12. Además, las complicaciones técnicas, incluidas las relativas a las anastomosis, se produjeron con una frecuencia aceptablemente baja. Por último, en los casos que requirieron la explantación de la prótesis, la técnica de la PFA no complica otras intervenciones. Esto contrasta con la intervención DRIL, que puede comprometer la perfusión distal.
Sin embargo, los riesgos de trombosis de la fístula y de infección de la prótesis son más altos que con las técnicas que usan material autólogo. En nuestro grupo de estudio existieron algunos pacientes que desarrollaron una trombosis recurrente inexplicable. Así pues, a diferencia de Zanow et al12, que realizaron la PFA en cualquier paciente con SRAD, nosotros escogimos la PFA solamente en pacientes con SRAD en estadio avanzado. Nuestros resultados indican que estos pacientes obtuvieron el mayor beneficio con esta técnica. No obstante, en casos de SRAD agudo (pacientes con fístula de alto flujo pero sin lesiones acrales), el banding de la fístula proporciona resultados satisfactorios6-8,11. El banding se realiza fácilmente y no requiere la interposición de material alógeno.
A pesar de los buenos resultados clínicos tras la PFA, no realizamos esta técnica en pacientes con amplia pérdida tisular (p. ej., gangrena de uno o varios dedos). En general, los pacientes con SRAD avanzado tienen un mayor riesgo debido a la edad avanzada y a las patologías cardíacas concomitantes. Compartimos la opinión de restringir al máximo la implantación de material protésico. Dado que no tenemos experiencia con la PFA en casos de amplia pérdida tisular, nos preocupa la posibilidad de empeorar la lesión isquémica de la extremidad y la infección del implante. Sin embargo, sigue sin estar claro en qué estadio de pérdida tisular puede intentarse realizar la PFA en lugar del cierre del AH. En 6 pacientes con gangrena de un dedo, cerramos el AH de forma inmediata. En 2 pacientes (incluidos en el grupo de estudio) con lesiones>1cm que solamente afectaban a las yemas de los dedos, realizamos la PFA sin éxito. Por tanto, necesitamos más experiencia sobre la diferenciación entre lesiones ‘‘leves'’ y ‘‘severas'’. En general, son necesarios más estudios para establecer la eficacia de la PFA en casos más avanzados de lesión tisular isquémica distal después de realizar un AH autólogo.
ConclusiónLa PFA supuso una mejoría en la circulación de la arteria radial distal con un componente adicional de banding en el AH en el codo. Observamos que la PFA proporciona buenos resultados clínicos, especialmente en pacientes que desarrollan pequeñas necrosis en los dedos como forma de SRAD avanzado. Sin embargo, en casos de pérdida tisular severa (> 1cm), hay que contemplar otras opciones terapéuticas. En general son necesarios más estudios para establecer la eficacia de la PFA en casos más avanzados de lesión tisular isquémica distal tras realizar un AH autólogo.