American Diabetes Association
colesterol LDL
diabetes mellitus
hemoglobina glucosilada
índice de masa corporal
insulina protamina neutra de Hagedorn
Estamos ante una paciente con diabetes mellitus (DM) tipo 2 de 9 años de evolución, con múltiples factores de riesgo cardiovascular asociados, en tratamiento con tres antidiabéticos orales y actualmente con una hemoglobina glucosilada (HbA1c) dentro de los objetivos de control (6,9%), tal como han sido definidos por la American Diabetes Association y la European Association for the Study of Diabetes (ADA-EASD)1, a la que se va a prescribir prednisona oral.
Los corticoides orales inducen, en los individuos con DM, una alteración metabólica importante, con hiperglucemias exageradas fundamentalmente posprandiales y escasa alteración de las glucemias basales2,3. Los mecanismos fisiopatológicos no son bien conocidos, habiéndose postulado un aumento de la producción hepática de glucosa y un incremento de la resistencia a la insulina. Los efectos sobre la glucemia dependerán de la dosis de corticoides, la vía de administración, la duración del tratamiento y el momento del día en que se administran. A todo ello hay que sumar la gran variabilidad individual que provocan en relación con la sensibilidad a la insulina tanto endógena como exógena.
El objetivo general es conseguir unas glucemias lo más estables posible, con pocas fluctuaciones, reduciendo las hiperglucemias posprandiales, previniendo probables descompensaciones agudas que puedan conducir al enfermo a situaciones graves (por ejemplo, coma hiperosmolar), así como evitando el riesgo de hipoglucemias. Por ello, sería aconsejable planificar con antelación un esquema terapéutico adecuado para evitar imprevistos. En este sentido, es oportuno informar al médico que va a seguir a la paciente del planteamiento farmacológico indicado.
En situaciones basales estables, como es el caso que nos ocupa, y en el supuesto de que se tratara de un tratamiento corto (cosa que desconocemos con los datos de que disponemos), quizá reforzar la dieta e intentar controles más estrictos sería suficiente, aumentando la frecuencia de estos últimos e incrementando las dosis de los antidiabéticos orales, si bien nos plantearíamos algunas modificaciones. En este caso en que la prednisona se va a administrar por la mañana, el objetivo específico sería corregir las elevadas glucemias vespertinas que provocan los corticoides en dosis única matutina. Por tanto, tendríamos que instruir a la paciente en la técnica del autoanálisis antes de iniciar el tratamiento, para valorar los niveles de glucemia preprandiales y posprandiales y hacer las modificaciones pertinentes en función del resultado de dicho autoanálisis.
Parece razonable continuar con metformina en las dosis que estaba tomando la paciente (máximas), dado que se trata de una persona obesa, con un índice de masa corporal (IMC) de 31kg/m2, y que presenta una aceptable función renal. Por otra parte, hay estudios que muestran la utilidad de glimepirida en individuos con DM con terapia corticoidea4. Sin embargo, creo que sería más apropiado en este caso sustituirla por un secretagogo de semivida más corta y acción más rápida, como una glinida.
Repaglinida es casi tan eficaz como las sulfonilureas5, y con ella se aseguraría un mejor control posprandial. Comenzaríamos por 1mg antes de las comidas, e iríamos subiendo la dosis si fuera necesario según los autocontroles. En cuanto a sitagliptina, hay actualmente un estudio en marcha, el SPHINX (Sitagliptin Prophylaxis for Glucocorticoid-Induced Impairment of Glucose Metabolism in Males with the Metabolic Syndrome), del que aún no se dispone de datos. En principio se podría mantener, incluso en el supuesto de que tuviésemos que administrar insulina, dado que el uso conjunto acaba de aprobarse en nuestro país. No obstante, hay que tener en cuenta que es el fármaco menos potente de los tres comentados.
Sin embargo, y a juzgar por el diagnóstico que motivó la indicación de los corticoides, parece probable que se trate de un tratamiento prolongado, y es por ello por lo que tarde o temprano habrá que insulinizar a esta paciente. De hecho, el tratamiento esteroideo es una de las indicaciones de insulinización temporal o transitoria6. A esto se une el hecho de que la paciente lleva 9 años de evolución de su enfermedad, y por tanto su reserva pancreática de insulina es previsible que esté ya muy agotada. Al final, a nuestra paciente probablemente haya que pautarle insulina si queremos alcanzar los objetivos de control. Se puede comenzar con insulina basal (levemir o glargina) si la glucemia preprandial es >150mg/dL y las posprandiales <200mg/dL, en dosis de 0,2 UI/kg/día al inicio. La meta es conseguir unas glucemias preprandiales por debajo de 130mg/dL y posprandiales inferiores a 180mg/dL, ajustando en función de las glucemias capilares en ayunas y aumentando de dos en dos UI cada 3 días hasta alcanzar una dosis final de 0,3-0,5 UI/kg/ día. En el caso de repaglinida, haríamos lo mismo teniendo en cuenta las mediciones de la glucemia tras las comidas. Otra alternativa es la insulina NPH (protamina neutra de Hagedorn), con similar eficacia pero que tiene la desventaja de producir más hipoglucemias nocturnas y mayor ganancia de peso. Las insulinas premezcladas estarían indicadas si las glucemias capilares preprandiales y posprandiales estuvieran continuamente en niveles superiores a 200mg/dL, debiendo suspender los antidiabéticos orales, excepto metformina, que podría dejarse. Empezaríamos por 0,3-0,5 UI/kg repartidas en un 60% antes del desayuno y un 40% antes de la cena. Si, como es de esperar, las glucemias posprandiales fueran muy elevadas tras la ingesta, la terapia debería contemplar el uso de insulina prandial antes de cada comida –o bien rápida (regular), o bien análogos de insulina de acción rápida (aspart, lispro o glulisina)– en dosis de 0,4-0,6 UI/kg, e ir incrementado 1-2 UI por cada 30-50mg/dL de glucemia por encima del objetivo de control. En esta paciente la dosis sería entre 31 y 47 UI al día, pudiendo empezar con 30 UI, por ejemplo, distribuidas en las principales comidas. Si optamos por la terapia bolo-basal, administraríamos un 60% en forma de insulina prandial antes del almuerzo y la cena, y un 40% en forma de insulina basal.
Si la prednisona se mantiene de forma prolongada y las cifras de insulina y glucosa permanecen más o menos estables tras los ajustes iniciales de las primeras semanas, se puede intentar cambiar a mezclas fijas de análogos 30/70 o bien 50/50.
Debemos estar especialmente atentos a la hora de bajar la dosis de corticoides y tras la supresión de éstos (por la posibilidad de aparición de hipoglucemias), e ir modificando el tratamiento antidiabético a la par que aquéllos.
¿Qué número de controles glucémicos le parecería idóneo durante el tiempo de tratamiento con esteroides?Si bien en la DM tipo 1 la frecuencia y el número de controles glucémicos están claramente definidos, no se puede decir lo mismo en el caso de la DM2, y menos aún cuando se recurre a la terapia oral. En general, no hay acuerdo sobre la frecuencia de controles glucémicos que es preciso realizar7,8, y dependerá del grado de control previo, del tratamiento y de las modificaciones de éste que se lleven a cabo.
Revisando la bibliografía encontramos que, para pacientes con antidiabéticos orales, la International Diabetes Federation (IDF) recomienda tres determinaciones antes de las comidas 1 día/semana, mientras que para pacientes en tratamiento con insulina se aconseja un perfil mínimo semanal completo con tres determinaciones antes y tres determinaciones después de cada comida. Asimismo, en caso de enfermedad intercurrente o situaciones de estrés o tratamientos farmacológicos que supongan una alteración glucémica importante (como sería el caso que estamos analizando), se preconiza el aumento en la frecuencia de las mediciones hasta que el control sea estable.
Yo indicaría a nuestra paciente un perfil completo diario los primeros días, ya que es previsible que, al tomar el corticoide por la mañana, se eleven de forma exagerada las glucemias posprandiales de la comida y las preprandiales de la cena. Posteriormente, y una vez que sus cifras de glucemia no sufrieran ya grandes cambios, disminuiríamos la frecuencia de los controles indicando, por ejemplo, un perfil a la semana o bien tres determinaciones preprandiales y posprandiales semanalmente en días distintos (lo que los anglosajones llaman «sliding scale»).
¿Cuándo cree que debería revisar los controles glucémicos de la paciente?Durante la primera semana citaríamos a la paciente cada 2 días para ajustar el tratamiento en función de los perfiles, prestando especial atención a las glucemias posprandiales sobre todo de la tarde, y cuando éstas estuvieran en el objetivo de control (<180mg/dL)1 y las preprandiales por debajo de 130mg/dL1, nos plantearíamos espaciar las visitas, citándola cada 7-10 días. Deberíamos aprovechar cada control para incidir en el resto de los factores de riesgo (peso y PA periódicos).
Indicaremos a la paciente que deberá comunicarnos el momento en que se inicie el descenso de los corticoides, e incrementar de nuevo los controles a partir de entonces ante la posibilidad de aparición de hipoglucemias, instruyéndola en el reconocimiento y manejo de éstas.
Hay que seguir revisando a la paciente aun después de haber finalizado la corticoterapia, dado su efecto prolongado tras el cese de ésta, por ejemplo una vez a la semana, hasta que apreciemos una tendencia estable de las glucemias y la probabilidad de hipoglucemias sea prácticamente nula.
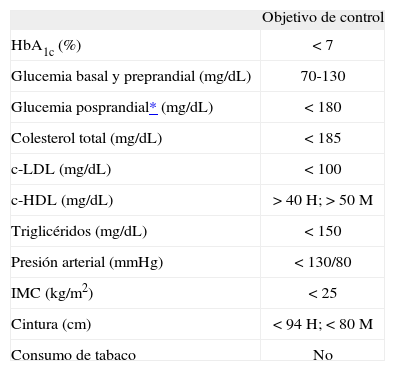
¿Haría cambios en el tratamiento del resto de factores de riesgo cardiovascular?Las diferentes guías de práctica clínica marcan objetivos de control en la DM no sólo dirigidos al control de la glucemia, sino al de todos los factores de riesgo cardiovascular9 (tabla 1). Por tanto, se debe hacer un abordaje terapéutico multidisciplinar e integral de dichos factores. A pesar de las controversias surgidas por la reciente publicación de tres estudios que vieron la luz a finales del año 2008 y principios del 2009 (el ADVANCE [Action in Diabetes and Vascular Disease: Preterax and Diamicron MR Control Evaluation], el ACCORD [Action to Control Cardiovascular Risk in Diabetes] y el VADT [Veterans Affairs Diabetes Trial]), en los que no se demostró reducción del riesgo cardiovascular, la ADA sigue recomendando como objetivo a alcanzar cifras de HbA1c <7%, ya que estas cifras han demostrado reducir las complicaciones microvasculares a corto plazo y las macrovasculares a más largo plazo.
Objetivos de control en la diabetes mellitus tipo 2 (ADA, 2009)1
| Objetivo de control | |
| HbA1c (%) | <7 |
| Glucemia basal y preprandial (mg/dL) | 70-130 |
| Glucemia posprandial* (mg/dL) | <180 |
| Colesterol total (mg/dL) | <185 |
| c-LDL (mg/dL) | <100 |
| c-HDL (mg/dL) | >40H; >50M |
| Triglicéridos (mg/dL) | <150 |
| Presión arterial (mmHg) | <130/80 |
| IMC (kg/m2) | <25 |
| Cintura (cm) | <94H; <80M |
| Consumo de tabaco | No |
En el caso que se expone, nuestra paciente cumple además todos los criterios de síndrome metabólico descritos por el National Cholesterol Education Program-Adult Treatment Panel III (NCEP-ATP III): 1) hipertensión arterial en tratamiento; 2) obesidad central, con un diámetro abdominal >88cm; 3) dislipemia en tratamiento farmacológico; 4) diabetes mellitus, y 5) c-HDL <50mg/dL (en mujeres). Por consiguiente, vamos a desarrollar una por una las modificaciones que introduciríamos, excepto las referentes a la DM que ya han quedado ampliamente revisadas.
- •
En primer lugar, el control de la PA ha mostrado ser tan importante como el control glucémico en la prevención de complicaciones en el paciente diabético. Para conseguir este objetivo hay que intentar reducir las cifras tensionales por debajo de 130/80mmHg, según las recomendaciones actuales de la ADA1. Me plantearía añadir al tratamiento actual de la paciente un diurético tiacídico o un antagonista del calcio. A favor de este último fármaco está el hecho de que tiene un perfil metabólico neutro, pero dados los antecedentes vasculares de nuestra paciente en los miembros inferiores, en principio lo descartaría y me decantaría por el diurético, aun a sabiendas de que puede elevar los niveles de ácido úrico, por lo que insistiría bastante en el aspecto dietético, aconsejando evitar las carnes rojas, el marisco, el alcohol y las vísceras.
- •
En cuanto a la obesidad que presenta, nuestros esfuerzos deben dirigirse a conseguir un IMC inferior a 25kg/m2, intentando si es posible que la paciente pierda un 5-10% del peso corporal, elaborando si fuese necesario una dieta personalizada e insistiendo en la necesidad de practicar ejercicio físico aeróbico regular, por ejemplo caminar, tal como recomienda la ADA (al menos 150 minutos a la semana)1.
- •
Respecto a los lípidos, la analítica muestra un c-HDL bajo y un c-LDL de casi 170mg/dL, calculado mediante la fórmula de Friedewald. Podemos valorar duplicar la dosis de simvastatina o multiplicarla por cuatro, pero sólo conseguiríamos disminuir el c-LDL entre un 6 y un 24%, según la regla del 6 (aplicable para todas las estatinas). Y necesitamos más de un 30% de reducción para alcanzar el objetivo de <100mg/dL. En consecuencia, pensamos que la mejor opción sería iniciar tratamiento con atorvastatina 40mg al día, que nos aseguraría un descenso de más del 40%. Ambas disponen de amplio respaldo científico.
- •
Por último, en cuanto a la utilización de antiagregantes, cabe señalar que el uso del AAS como estrategia de prevención primaria, tanto en pacientes con DM1 como en pacientes con DM2, sigue siendo recomendado por las principales guías europeas y americanas a pesar de que en el último año haya sido publicado algún estudio que cuestione dicha intervención10. Creemos que hay que ser cautelosos en este sentido hasta no disponer de más evidencia, y por tanto, en lo que respecta a nuestra paciente, seguiríamos manteniendo el ácido AAS tal como lo tiene pautado. ¿
Actualmente el autor declara no tener ningún conflicto de intereses en relación con el contenido de este artículo.