El catéter venoso central (CVC) es necesario para la monitorización y tratamiento de pacientes en estado crítico; sin embargo, su uso incrementa el riesgo de bacteriemia. El objetivo del estudio fue cuantificar la incidencia de bacteriemia relacionada con catéter venoso central (BRCVC) e identificar los factores asociados con esta infección.
MétodosSe realizó un estudio de cohorte prospectivo en un hospital de concentración del occidente de México. Para conocer la asociación entre BRCVC y las variables en estudio, se realizó un análisis multivariado con regresión de Cox.
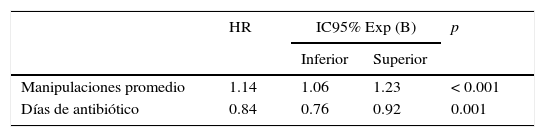
ResultadosSe estudiaron 204 pacientes con CVC. La edad promedio fue de 4.6 años; el 66.2% fue del sexo masculino. Los sitios de inserción del catéter fueron la vena subclavia (72.5%, n = 148), la vena yugular (20.1%, n = 41) o la vena femoral (7.4%, n = 15). La incidencia de BRCVC fue de 6.5 eventos por 1,000 días catéter. Los microorganismos identificados fueron cocos Gram positivos (37.5%, n = 6), bacilos Gram negativos (37.5%, n = 6) y Candida albicans (25%, n = 4). Se observó que la mayor manipulación del catéter por día se asoció con bacteriemia (HR 1.14, IC95% 1.06-1.23), mientras que el uso de antibióticos intravenosos mostró un efecto protector (HR 0.84, IC95% 0.76-0.92).
ConclusionesAdemás de las medidas máximas de precaución al momento de colocar o manipular el catéter, es conveniente disminuir lo más posible las desconexiones entre el equipo de venoclisis y el CVC. Los antibióticos mostraron un efecto protector; sin embargo, se debe considerar el riesgo de favorecer resistencias antimicrobianas.
Central venous catheters (CVC) are needed for monitoring and treatment of critically ill patients; however, their use increases the risk of bacteremia. The aim of the study was to quantify the incidence of central venous catheter-related bacteremia (CVCRB) and to identify factors associated with this infection.
MethodsA prospective cohort study was conducted in a concentration hospital of western Mexico. The association of CVCRB and study variables was investigated using multivariate Cox regression analysis.
ResultsTwo hundred four patients with CVC were studied. The average age was 4.6 years; 66.2% were male. Insertion sites of the catheters were subclavian vein 72.5% (n = 148), jugular vein 20.1% (n = 41) and femoral vein 7.4% (n = 15). CVCRB incidence was 6.5 events/1,000 catheter days; microorganisms identified were gram-positive cocci 37.5% (n = 6), gram-negative bacilli 37.5% (n = 6) and Candida albicans 25% (n = 4). It was observed that the increase in catheter manipulations per day was associated with bacteremia (HR 1.14, 95% CI 1.06 - 1.23), whereas the use of intravenous antibiotics showed a protective effect (HR 0.84, 95% CI 0.76-0.92).
ConclusionsIn addition to strategies of maximum caution when placing or manipulating the catheter, we recommend decreasing, as much as possible, disconnects between the CVC and infusion line. Antibiotics showed a protective effect, but the outcome is uncertain and promotion of antimicrobial resistance should be considered.
El catéter venoso central (CVC) es necesario para la monitorización y tratamiento de pacientes en estado crítico; sin embargo, su uso incrementa el riesgo de bacteriemia (OR 4.51 IC95% 2.49-8.18, p < 0.001)1–4. La presencia de dispositivos intravasculares ha llegado a ser la principal causa de bacteriemia nosocomial, con una mortalidad atribuible de hasta el 25%5–11.
La flora microbiana de la piel migra a través de la superficie externa e interna del catéter o accede al torrente sanguíneo mediante soluciones contaminadas. En dispositivos intravasculares de corta duración, la mayoría de eventos de bacteriemia relacionada con catéter venoso central (BRCVC) se originan por la colonización de la superficie externa, mientras que en los de larga permanencia las infecciones se producen principalmente por la contaminación de la superficie interna9,12–14.
Una hora después de que el catéter es colonizado, los microorganismos pueden identificarse a 4cm de distancia del sitio de colonización2,12. Posteriormente, los patógenos se adhieren a la superficie del catéter y forman una película protectora de polímeros extracelulares que rodea las bacterias y retiene nutrimentos. En estas condiciones, los microorganismos pueden ser resistentes al tratamiento antimicrobiano y a la actividad fagocítica del sistema inmune2,15.
El diagnóstico clínico de BRCVC es poco específico. Solamente del 15 al 39% de los pacientes con manifestaciones clínicas tienen estudios microbiológicos que confirman la infección. Los hemocultivos por tiempo diferencial permiten tener mayor exactitud en el diagnóstico6,16,17.
Diferentes condiciones se han asociado con el aumento del riesgo de BRCVC: la edad del paciente (< 10 años), la inserción del catéter sin barreras estériles, las dificultades durante la colocación, la colonización bacteriana del sitio de inserción, la localización de la vía en la vena femoral, la nutrición parenteral total, las transfusiones y la permanencia del catéter por más de 7 días7,10,11,14,18–23. La planeación de estrategias preventivas de BRCVC requiere de conocer la epidemiología de la infección. El objetivo del estudio fue cuantificar la densidad de incidencia de BRCVC e identificar los factores de riesgo en un hospital de concentración en el occidente de México.
2MétodosSe realizó un estudio de cohorte, prospectivo, en el Nuevo Hospital Civil de Guadalajara Dr. Juan I. Menchaca (HCGJIM) de la ciudad de Guadalajara, Jalisco. La investigación se efectuó del 18 de marzo del 2011 al 24 de junio del 2012. El estudio fue aprobado por los Comités de Ética e Investigación de la institución.
Se ingresaron a la cohorte los pacientes de la Unidad de Terapia Intensiva Pediátrica (UTIP) y Urgencias de Pediatría (UP) a quienes se les insertó un CVC y que no presentaban bacteriemia al momento de la colocación. Aunque los pacientes fueran trasladados a otro departamento del HCGJIM, se continuaba con la vigilancia. Fueron egresados de la cohorte los pacientes que fallecieron, a quienes se les retiro el catéter, quienes presentaron bacteriemia y los que fueron trasladados a otra unidad hospitalaria. La inserción del dispositivo intravascular se realizó previa antisepsia del sitio de colocación con yodopovidona y lavado exhaustivo de manos del personal médico; durante el procedimiento, se utilizaron barreras estériles máximas (guantes, bata, gorro y cubrebocas)24.
2.1VariablesSe registraron los datos de los pacientes de la cohorte a partir del expediente clínico: edad, sexo, diagnóstico, región anatómica donde se insertó el catéter, tipo de catéter y complicaciones durante la inserción. Se vigiló diariamente el uso de ventilación mecánica, antibióticos, nutrición parenteral total, transfusiones. En los registros de enfermería se cuantificó el número de manipulaciones del catéter. Se definió como manipulación del catéter cualquier procedimiento que requirió la desconexión del CVC y el equipo de venoclisis.
2.2Obtención y procesamiento de muestrasA los pacientes que presentaron manifestaciones clínicas sugestivas de infección relacionada con el catéter (fiebre, hipotermia, taquicardia, bradicardia, leucocitosis, leucopenia, eritema o secreción en el sitio de entrada del catéter), se les tomaron, por lo menos, dos hemocultivos: uno a través del CVC y otro de vena periférica. En cada frasco Pediatric FAN BacT/ALERT®PF (bioMérieux) se inocularon ≥ 2ml de sangre. Antes de la toma de muestras se realizó antisepsia con yodopovidona en el sitio de punción y en el lumen de entrada del catéter. En cada frasco de hemocultivo se inocularon cantidades similares de sangre25.
Los cultivos se incubaron en sistema automatizado de detección de crecimiento microbiano BacT/ALERT®3D (bioMérieux). En caso de presentar crecimiento bacteriano, el sistema registró la hora de detección de positividad. Los cultivos positivos fueron resembrados en agar sangre y MacConkey. La identificación de la especie bacteriana se realizó en sistema MicroScan autoSCAN-4 System® (Beckman Coulter, Inc.) Los cultivos sin crecimiento se monitorizaron durante 7 días antes de clasificarlos como negativos.
El diagnóstico de BRCVC se estableció cuando ambos hemocultivos (catéter y periférico) presentaron crecimiento del mismo microorganismo y si se presentó antes en el hemocultivo de catéter, con una diferencia de tiempo de positividad de ≥ 2h. Si ambos cultivos fueron positivos al mismo germen con tiempo de positividad < 2 horas o si solo el cultivo periférico fue positivo, se clasificó como bacteriemia no asociada con el catéter. Si solo el cultivo tomado de CVC presentó crecimiento, se diagnosticó como colonización del catéter.
2.3Análisis estadísticoSe estimó la densidad de la incidencia de BRCVC con intervalos de confianza (IC) al 95%. De las variables cuantitativas se calcularon media y desviación estándar (DE); de las variables cualitativas, frecuencias y porcentajes. La búsqueda de asociación entre variables cuantitativas y BRCVC (bi-variado) se realizó con el modelo de riesgo proporcional de Cox. Para variables cualitativas, se estimó el riesgo relativo (RR) con IC95%. Las variables que presentaron un valor de p ≤ 0.2 se incluyeron en el análisis multivariado con regresión de Cox. El análisis se realizó en el programa IBM-SPSS Statistics 20.
3ResultadosSe estudiaron 204 pacientes con CVC. La edad promedio fue de 4.6 años (mínima 0.08, máxima 16, DE 5.17). El 66.2% (n = 135) fueron de sexo masculino. Los diagnósticos más frecuentes (CIE-10) fueron neoplasias (28.9%, n = 59), enfermedades infecciosas distintas a bacteriemia (19.6%, n = 40), enfermedades del sistema nervioso central (15.2%, n = 31) y enfermedades del aparato genitourinario (5.9%, n = 12).
La inserción del catéter se realizó en la vena subclavia (72.5%, n = 148), la vena yugular (20.1%, n = 41) o la vena femoral (7.4%, n = 15). El 80.4% (n = 164) fue con catéter multilumen. Tres pacientes presentaron complicaciones inmediatas a su colocación. El promedio de días-catéter por paciente fue de 11.2 (mínimo 1, máximo 58, DE 8.9) y la estancia hospitalaria promedio al momento de colocar el catéter fue de 7.5 días (mínimo 0, máximo 143, DE 17.2).
Los catéteres estudiados (n = 204) acumularon 2,294 días-catéter. Se identificaron 15 eventos de BRCVC, nueve de bacteriemia no relacionada con catéter y 20 catéteres colonizados. La densidad de incidencia de BRCVC fue 6.5 eventos por 1,000 días (IC95% 3.8-10.5).
Los pacientes que no presentaron BRCVC (n = 189) finalizaron el estudio por los siguientes motivos: retiro del catéter (71.4%, n = 135), defunción (22.8%, n = 43), traslado a otra unidad hospitalaria (1%, n = 2) o bacteriemia no relacionada con catéter (4.8%, n = 9).
Los microorganismos aislados (n = 16) fueron Staphylococcus coagulasa negativo (n = 5), Candida albicans (n = 4), Enterobacter cloacae (n = 2), Staphylococcus aureus (n = 1) y otros bacilos Gram negativos con un aislamiento cada uno (Escherichia coli, Acinetobacter baumannii, Serratia marcescens, Stenotrophomonas maltophilia). En un mismo evento se aislaron dos bacterias (Escherichia coli y Enterobacter cloacae).
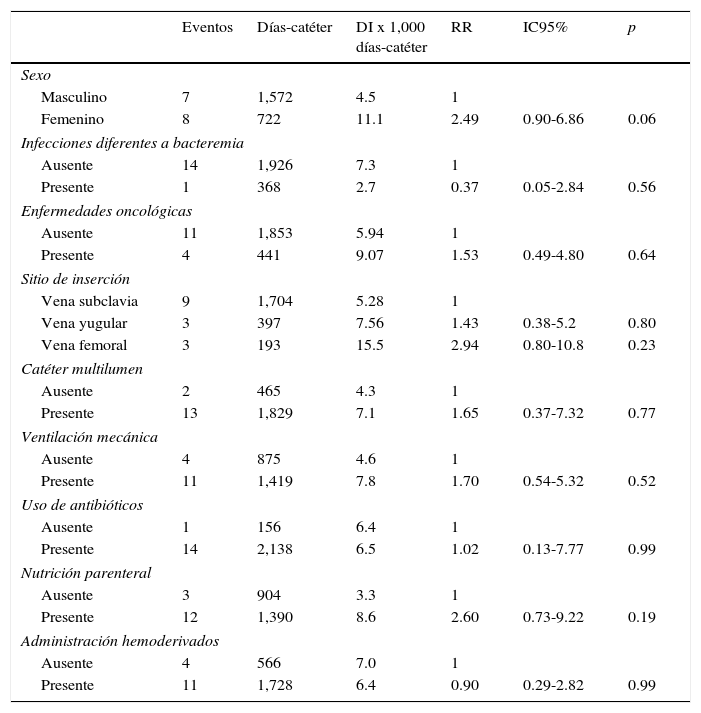
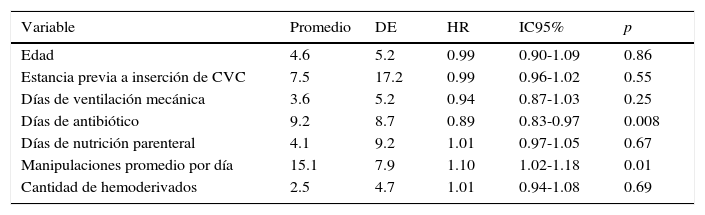
La incidencia de BRCVC en función de las variables cualitativas, RR e IC 95%, se enlista en la tabla 1. El promedio y la DE de las variables cuantitativas y análisis bi-variado con BRCVC se muestran en la tabla 2. No se observaron diferencias de la permanencia del catéter en pacientes con o sin BRCVC (p < 0.56).
Densidad de incidencia de bacteriemia relacionada con catéter venoso central en función de variables cualitativas
| Eventos | Días-catéter | DI x 1,000 días-catéter | RR | IC95% | p | |
|---|---|---|---|---|---|---|
| Sexo | ||||||
| Masculino | 7 | 1,572 | 4.5 | 1 | ||
| Femenino | 8 | 722 | 11.1 | 2.49 | 0.90-6.86 | 0.06 |
| Infecciones diferentes a bacteremia | ||||||
| Ausente | 14 | 1,926 | 7.3 | 1 | ||
| Presente | 1 | 368 | 2.7 | 0.37 | 0.05-2.84 | 0.56 |
| Enfermedades oncológicas | ||||||
| Ausente | 11 | 1,853 | 5.94 | 1 | ||
| Presente | 4 | 441 | 9.07 | 1.53 | 0.49-4.80 | 0.64 |
| Sitio de inserción | ||||||
| Vena subclavia | 9 | 1,704 | 5.28 | 1 | ||
| Vena yugular | 3 | 397 | 7.56 | 1.43 | 0.38-5.2 | 0.80 |
| Vena femoral | 3 | 193 | 15.5 | 2.94 | 0.80-10.8 | 0.23 |
| Catéter multilumen | ||||||
| Ausente | 2 | 465 | 4.3 | 1 | ||
| Presente | 13 | 1,829 | 7.1 | 1.65 | 0.37-7.32 | 0.77 |
| Ventilación mecánica | ||||||
| Ausente | 4 | 875 | 4.6 | 1 | ||
| Presente | 11 | 1,419 | 7.8 | 1.70 | 0.54-5.32 | 0.52 |
| Uso de antibióticos | ||||||
| Ausente | 1 | 156 | 6.4 | 1 | ||
| Presente | 14 | 2,138 | 6.5 | 1.02 | 0.13-7.77 | 0.99 |
| Nutrición parenteral | ||||||
| Ausente | 3 | 904 | 3.3 | 1 | ||
| Presente | 12 | 1,390 | 8.6 | 2.60 | 0.73-9.22 | 0.19 |
| Administración hemoderivados | ||||||
| Ausente | 4 | 566 | 7.0 | 1 | ||
| Presente | 11 | 1,728 | 6.4 | 0.90 | 0.29-2.82 | 0.99 |
DI: densidad de incidencia; RR: riesgo relativo; IC95%: intervalo de confianza al 95%.
Análisis bi-variado de variables cuantitativas y bacteriemia relacionada con catéter venoso central
| Variable | Promedio | DE | HR | IC95% | p |
|---|---|---|---|---|---|
| Edad | 4.6 | 5.2 | 0.99 | 0.90-1.09 | 0.86 |
| Estancia previa a inserción de CVC | 7.5 | 17.2 | 0.99 | 0.96-1.02 | 0.55 |
| Días de ventilación mecánica | 3.6 | 5.2 | 0.94 | 0.87-1.03 | 0.25 |
| Días de antibiótico | 9.2 | 8.7 | 0.89 | 0.83-0.97 | 0.008 |
| Días de nutrición parenteral | 4.1 | 9.2 | 1.01 | 0.97-1.05 | 0.67 |
| Manipulaciones promedio por día | 15.1 | 7.9 | 1.10 | 1.02-1.18 | 0.01 |
| Cantidad de hemoderivados | 2.5 | 4.7 | 1.01 | 0.94-1.08 | 0.69 |
DE: desviación estándar; HR: hazard ratio; IC95%: intervalo de confianza al 95%; CVC: catéter venoso central.
Las variables que presentaron un valor de p ≤ 0.2 se incluyeron en el análisis multivariado, y paso a paso se excluyeron las no significativas. El modelo final se integró con las siguientes variables: días de administración de antibióticos y manipulaciones promedio por día (tabla 3).
Variables asociadas con bacteriemia relacionada con catéter venoso central identificadas con el análisis multivariado con regresión de Cox
| HR | IC95% Exp (B) | p | ||
|---|---|---|---|---|
| Inferior | Superior | |||
| Manipulaciones promedio | 1.14 | 1.06 | 1.23 | < 0.001 |
| Días de antibiótico | 0.84 | 0.76 | 0.92 | 0.001 |
HR: hazard ratio; IC95%: intervalo de confianza al 95%.
Información de la National Healthcare Safety Network (NHSN) del año 2012 indicó que, en departamentos de atención pediátrica no oncológica, la tasa de BRCVC se cuantificó de 0.5 a 1.4 eventos por 1,000 días catéter. La mayor frecuencia se observó en las áreas de cirugía y cardiología quirúrgica. En pacientes de servicios oncológicos, se ha reportado una frecuencia de BRCVC de 2.3 eventos por 1,000 días-paciente26. En este estudio, la incidencia de BRCVC fue de 6.5 eventos por 1,000 días-catéter, y en pacientes con enfermedades oncológicas, 9.07 eventos por 1,000 días. Ambas frecuencias fueron mayores a lo reportado por la NHSN. Se ha identificado que los dispositivos intravasculares colocados en las unidades de cuidados intensivos (UCI) presentan mayor probabilidad de asociarse con bacteremia18. Abramczyk y colaboradores, del Hospital São Paulo, Universidad de São Paulo, cuantificaron una incidencia de BRCVC de 10.2 eventos por 1,000 días catéter en niños de una UCI27.
En relación con los agentes etiológicos de BRCVC en pacientes del HCGJIM, se observó una alta frecuencia de aislamientos de bacilos Gram negativos. Esta condición probablemente se asocie con la contaminación externa, y no con gérmenes comensales de la piel, que son los más frecuentemente reportados en diferentes estudios9,12. Safdar y Maki describieron que el 45% de las BRCVC se originan por colonización externa del catéter,9 mientras que Garland y colaboradores identificaron que el 67% (n = 10) de eventos de BRCVC fueron secundarios a la colonización de lumen interno en pacientes recién nacidos. En ambos estudios, la bacteria aislada con mayor frecuencia fue Staphylococcus coagulasa negativo (77.1 y 93.3%, respectivamente)12. Hammarskjöld y colaboradores cuantificaron una incidencia de colonización del catéter de 7.6 eventos por 1,000 días. La bacteria predominante fue Staphylococcus coagulasa negativo (60%), y el tiempo de permanencia del catéter mostró una tendencia a incrementar la probabilidad de colonización (RR 1.009, IC 95% 1.003-1.015)3. En la cohorte aquí estudiada, la incidencia estimada de colonización fue de 8.7 eventos por 1,000 días catéter y el 75% de las bacterias fueron especies de Staphylococcus. Aunque se ha propuesto que la colonización del catéter puede preceder a las infecciones, esta condición no es un predictor específico de bacteriemia. Koh y colaboradores observaron que solo el 5.8% de las vías arteriales y el 7.5% de las vías venosas colonizadas desarrollaron BRCVC. No se identificaron diferencias en la frecuencia de colonización entre ambos tipos de líneas vasculares (RR 1.17, IC95% 0.41-3.36), y presentaron mayor riesgo los catéteres colocados en un servicio de urgencias (RR 4.45, IC95% 1.42-13.9)8.
En este estudio, realizado en el HCGJIM, se observó que el incremento de las manipulaciones del catéter por día se relaciona con la bacteriemia (RR 1.14, IC95% 1.06-1.23) mientras que el uso de antibióticos intravenosos mostró un efecto protector (RR 0.84, IC95% 0.76-0.92). Algunos factores de riesgo ya descritos para BRCVC (edad < 10 años, dificultades durante la inserción, nutrición parenteral, ventilación mecánica, transfusiones, catéter con múltiples lumen o inserción en vena femoral)7,19,21 no mostraron asociación significativa. Sin embargo, este resultado puede deberse al tamaño de la muestra. Mahieu y colaboradores estudiaron la influencia de diferentes formas de manipulación de los catéteres sobre la frecuencia de BRCVC. La desconexión del catéter para limpieza del reservorio (OR 1.2, IC95% 1.1-1.3) y la extracción de muestras sanguíneas (OR 1.4, IC95% 1.1-1.8) incrementaron el riesgo de bacteriemia, mientras que la heparinización de la vía (OR 0.9, IC95% 0.8-1.0) y la antisepsia del sitio de inserción (OR 0.9, IC95% 0.8-1.0) mostraron un efecto protector13.
Además del lavado de manos y el uso de barreras estériles máximas al momento de insertar el catéter12,24, se propone disminuir lo más posible las desconexiones entre el equipo de venoclisis y el CVC. Se deben administrar medicamentos con el menor número de dosis al día; los preparados de soluciones intravenosas preferentemente deben ser cada 24h en lugar de cada 8h, y se recomienda utilizar bombas de infusión28, especialmente para medicamentos que requieren modificaciones frecuentes de las dosis.
En un estudio similar a este, Vilela y colaboradores observaron que el uso concomitante de antibióticos en pacientes con CVC disminuye el riesgo de infección (OR 0.06, IC95% 0.016-0.29)20. Sin embargo, el efecto protector de los antimicrobianos es incierto debido a la probabilidad de resultados falsos negativos de los hemocultivos si la prueba fue tomada cuando se utilizaron antibióticos. También se debe considerar el riesgo de resistencia antimicrobiana de los microorganismos adheridos a los catéteres y protegidos por polisacáridos extracelulares.
De acuerdo con información de la NHSN, los hospitales escuela presentan mayor frecuencia de infecciones relacionadas a CVC26. Por ello, en estos nosocomios se deben reforzar las medidas de prevención, que incluyen la capacitación para la correcta inserción y mantenimiento del catéter, la vigilancia continua de las tasas de infecciones, la higiene de manos, el utilizar equipos para infusión de soluciones, el uso de guantes estériles para la manipulación de las vías intravenosas y el retirar el catéter tan rápido como sea posible6,29.
Una limitación que presenta este estudio es el tamaño de muestra, lo cual puede explicar la ausencia de la asociación entre las variables descritas como factores de riesgo y la BRCVC. El efecto protector de los antibióticos para BRCVC debe valorarse mediante pruebas diagnósticas diferentes a hemocultivos, debido a la probabilidad de resultados falsos negativos.
Por último, se sugiere disminuir lo más posible las desconexiones entre la línea de infusión y el CVC. Las estrategias para lograrlo incluyen administrar los medicamentos con el menor número de dosis posible, indicar infusiones de soluciones para 24h y el uso de bombas de infusión continua. Aunque los antibióticos tienen un efecto protector para BRCVC, no se recomienda su indicación hasta valorar el impacto sobre las resistencias antimicrobianas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Fuente de financiaciónNo existió financiamiento externo. Los recursos para la realización de pruebas y procedimientos fueron financiados por la institución, y el resto de gastos derivados de la investigación fueron financiados por los autores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses