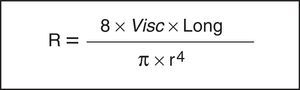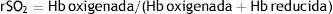La monitorización respiratoria representa un importante rol en el cuidado del niño con falla respiratoria aguda. Por tanto, su apropiado uso y correcta interpretación (reconociendo qué señales y variables deben ser priorizadas) deberían ayudar a un mejor entendimiento de la fisiopatología de la enfermedad y de los efectos de las intervenciones terapéuticas. Asimismo, la monitorización del paciente ventilado permite, entre otras determinaciones, evaluar diversos parámetros de la mecánica respiratoria, conocer el estado de los diferentes componentes del sistema respiratorio y guiar los ajustes de la terapia ventilatoria.
En esta actualización se describe la utilidad de diversas técnicas de monitorización respiratoria (incluyendo métodos convencionales y otros más recientes), se definen conceptos básicos de mecánica ventilatoria, su interpretación y cómo el adecuado análisis de la información puede ocasionar un impacto en el manejo clínico del paciente.
Respiratory monitoring plays an important role in the care of children with acute respiratory failure. Therefore, its proper use and correct interpretation (recognizing which signals and variables should be prioritized) should help to a better understanding of the pathophysiology of the disease and the effects of therapeutic interventions. In addition, ventilated patient monitoring, among other determinations, allows to evaluate various parameters of respiratory mechanics, know the status of the different components of the respiratory system and guide the adjustments of ventilatory therapy.
In this update, the usefulness of several techniques of respiratory monitoring including conventional respiratory monitoring and more recent methods are described. Moreover, basic concepts of mechanical ventilation, their interpretation and how the appropriate analysis of the information obtained can cause an impact on the clinical management of the patient are defined.
Al reconocer que los objetivos de la ventilación mecánica (VM) han cambiado en el transcurso de las últimas décadas1–5 (tabla 1), y que van más allá de la exclusiva adecuación del intercambio gaseoso, el médico tratante debe lograr el monitoreo de un conjunto de parámetros fisiológicos, además de las posibles alteraciones que ocasionen daño pulmonar o disfunción orgánica distante.
Objetivos clínicos, de laboratorio y complicaciones a monitorizar en ventilación mecánica
| Adecuado intercambio gaseoso | Mantener volumen pulmonar | Disminuir trabajo respiratorio | Mejorar oxigenación tisular | Sincronía paciente/ ventilador | Evitar complicaciones |
|---|---|---|---|---|---|
| Revertir hipoxemia (PaO2) | Capacidad residual funcional | Revertir fatiga muscular | Redistribución de flujo desde musculatura ventilatoria | Confort | Daño inducido por VM |
| Corregir acidosis respiratoria aguda (PaCO2) | Volumen de fin de inspiración | Disminuir costo de O2 de ventilar (VO2) | Hiperinflación dinámica | ||
| Aumentar distensibilidad | Aumento espacio muerto | ||||
| Protectora y óptimo reclutamiento (SDRA) | Deterioro hemodinámico (DO2) | ||||
| Prevenir daño diafragmático |
PaO2: presión arterial de oxígeno; VM: ventilación mecánica; PaCO2: presión arterial de dióxido de carbono; VO2: consumo de oxígeno; SDRA: síndrome de dificultad respiratoria aguda; DO2: transporte de oxígeno.
El monitoreo clínico ideal debe describir cambios anatómicos y fisiológicos a nivel regional, ser de naturaleza no invasiva, ser de procesamiento rápido y estar disponible a la cabecera del paciente.
En la actualidad se dispone de múltiples parámetros que entregan datos objetivos, los cuales permiten evaluar determinadas intervenciones terapéuticas, establecer diagnósticos, lograr metas y evitar complicaciones ocasionadas por los cambios dinámicos en el paciente.
Habitualmente, en el paciente crítico, se enfatiza la monitorización de la mecánica respiratoria para ajustar la estrategia e individualizar la prescripción de la VM; sin embargo, es necesario tener presente que esta es solo un aspecto a evaluar.
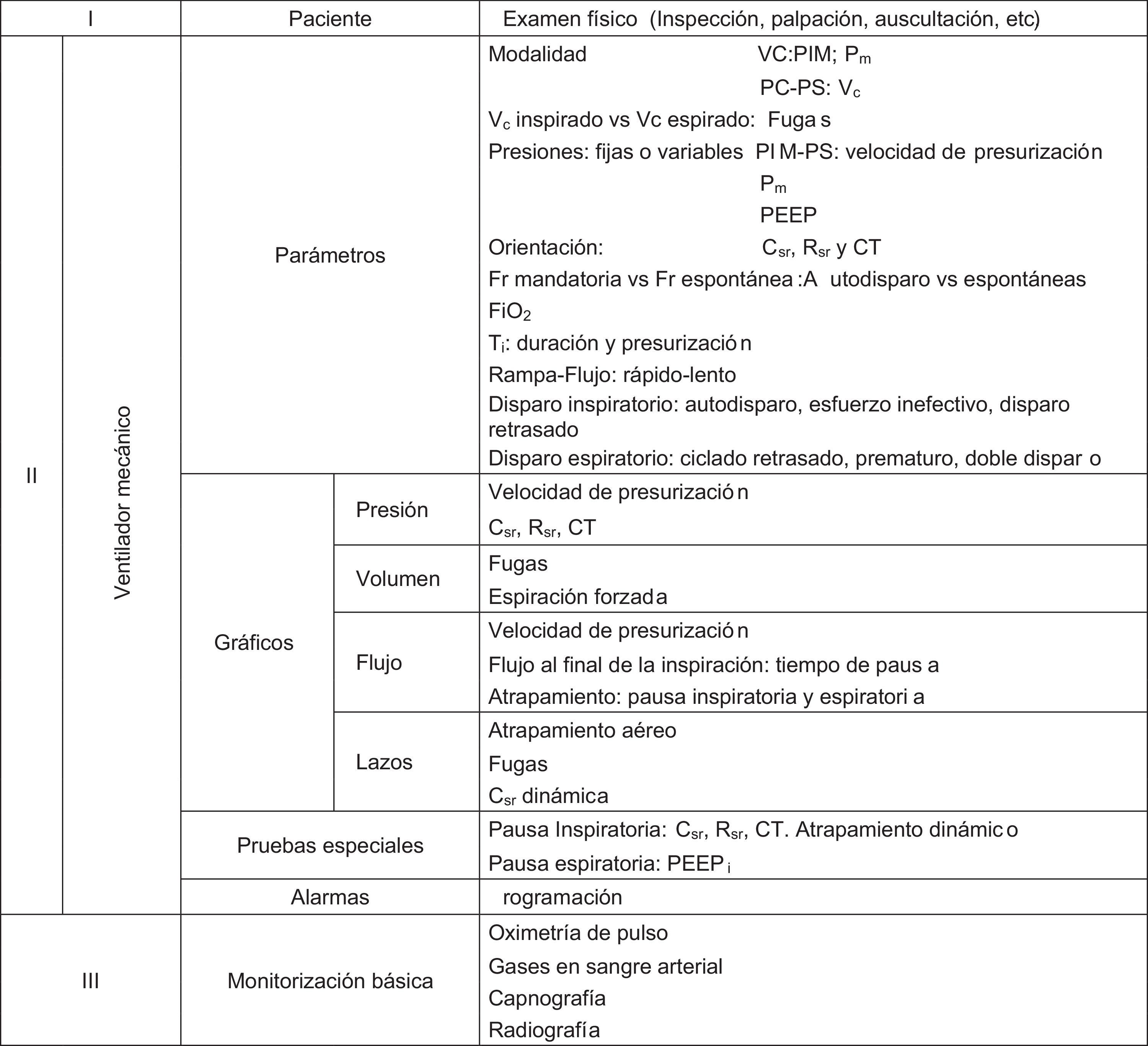
El objetivo del presente trabajo fue revisar la evaluación del intercambio de gases, las principales técnicas de monitorización disponibles, maniobras y cálculos de mecánica respiratoria y estudios de imagen en el paciente pediátrico. En la tabla 2 se resume la monitorización multimodal a considerar en el paciente ventilado. Finalmente, se discuten futuras modalidades de monitorización, específicamente los biomarcadores.
Monitorización multimodal a considerar en el paciente ventilado mecánicamente
VC: ventilación controlada por volumen; PIM: presión inspiratoria máxima; Pm: presión meseta; PC: ventilación controlada por presión; PS: presión de soporte; Vc: volumen corriente; PEEP: presión positiva al final de la espiración; Csr: distensibilidad del sistema respiratorio; Rsr: resistencia del sistema respiratorio; CT: constante de tiempo; Fr: frecuencia respiratoria; FiO2: fracción inspirada de oxígeno; Ti: tiempo inspiratorio; PEEPi: PEEP intrínseca.
Como en todo acto médico, es trascendente la adecuada inspección del paciente en VM. Una vez que se realiza la intubación endotraqueal y el paciente es conectado al ventilador, se debe evaluar la expansión torácica, la auscultación pulmonar y la perfusión tisular periférica. Se puede valorar si el soporte ventilatorio es adecuado para la demanda del paciente a través de la verificación de signos indirectos, como sudoración, taquicardia e hipertensión arterial (respuesta adrenérgica).
Es importante señalar que la auscultación se debe entender como un complemento de métodos diagnósticos más precisos. Han transcurrido dos siglos desde que René Théophile Hyacinthe Laënnec (1781-1826) inventó el estetoscopio6, el cual se constituyó en un elemento de disponibilidad inmediata y de ayuda diagnóstica. No obstante, presenta inconvenientes, ya que la interpretación de la información obtenida es de carácter subjetivo y con escasa concordancia interobservador7, por lo que se considera un instrumento más descriptivo que cuantitativo en la valoración pulmonar.
2.1Monitorización respiratoria básicaConsiderando que la falla respiratoria aguda es una de las principales causas de admisión en las unidades de cuidados intensivos pediátricos (UCIP), la monitorización continua, confiable y precisa de diversos parámetros respiratorios tanto en la admisión del paciente como en el manejo posterior, permite al clínico la detección temprana de falla respiratoria aguda, la evaluación de la necesidad de soporte ventilatorio, la respuesta al tratamiento, minimizar las complicaciones asociadas a la VM, optimizar la interacción paciente-ventilador y determinar cuándo el paciente está en condiciones de comenzar el destete de la VM. Sin embargo, la monitorización, por sí sola, no implica un manejo específico para el paciente y tampoco conduce a un determinado resultado terapéutico; todo dependerá del conocimiento y de la habilidad de quien interprete la información.
En términos generales, siempre se deben evaluar indicadores de intercambio gaseoso, como oxigenación, ventilación, espacio muerto y los referentes a mecánica pulmonar.
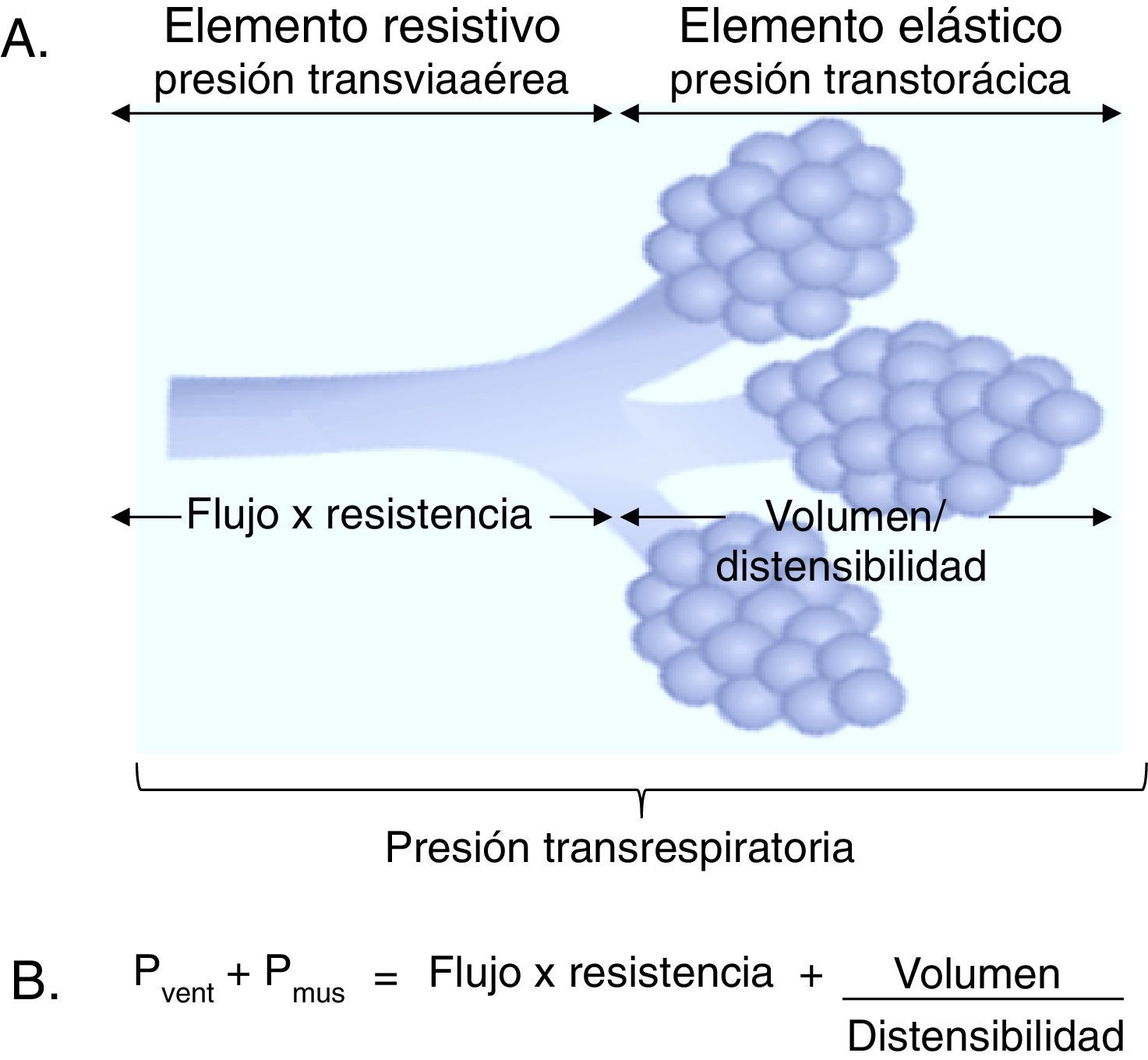
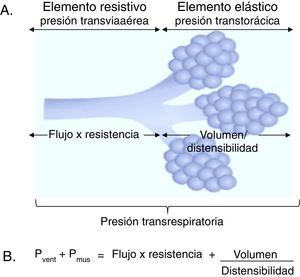
3Fundamentos de la monitorización de la mecánica ventilatoria3.1Propiedades mecánicas del sistema respiratorioSe definirán tres conceptos básicos para comprender el comportamiento del sistema respiratorio: se entenderá como flujo a la unidad de volumen desplazada por unidad de tiempo; como resistencia, la oposición al flujo de aire causada por las fuerzas de fricción; y como presión, la fuerza que ejerce un gas sobre una superficie. Si se considera que el desplazamiento de un gas se produce siempre en respuesta a gradientes de presión, sean estos ocasionados por la contracción de la musculatura respiratoria, o bien por la acción de un ventilador mecánico, el gradiente de presión transrespiratoria entre la vía aérea superior (Pao, airway opening pressure) y la existente a nivel alveolar (Palv) será la que determinará la magnitud del flujo tanto inspiratorio (Pao > Palv) como espiratorio (Palv > Pao) (fig. 1A).
Elementos determinantes de la presión transrespiratoria. A. Representación esquemática de los elementos determinantes de la presión transrespiratoria. B. Ecuación de movimiento del sistema respiratorio. Pvent corresponde a la presión generada por el ventilador y Pmus a la presión generada por los músculos ventilatorios para expandir la caja torácica y los pulmones. Cuando Pvent = 0, corresponde a una ventilación espontánea y cuando Pmus = 0, corresponde a una modalidad controlada. Entre ambos se encuentra el grupo de soportes ventilatorios parciales.
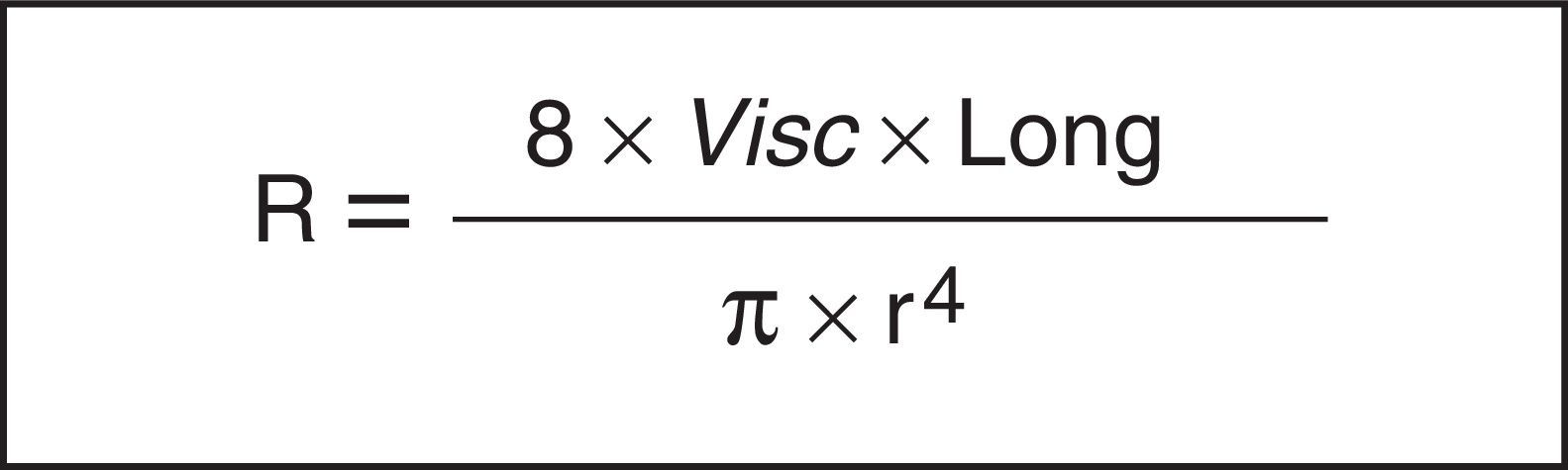
Como es sabido, la ley de Hagen-Poiseuille señala que una disminución relativa del radio (r) produce un aumento notable en la resistencia del sistema respiratorio (Rsr) (fig. 2). Aquí, la constante de proporcionalidad es una propiedad mecánica del sistema respiratorio que llamamos resistencia (R =ΔP/V’, donde ΔP corresponde al gradiente de presión y V’ al flujo).
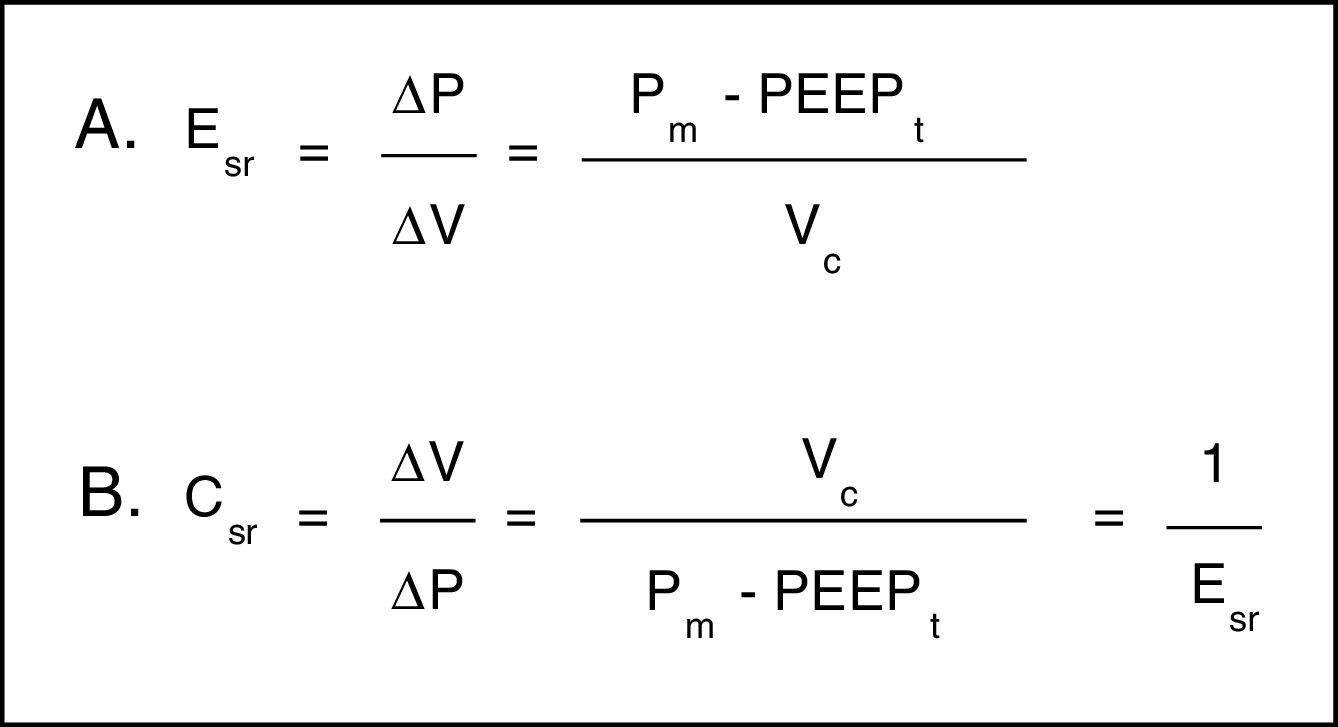
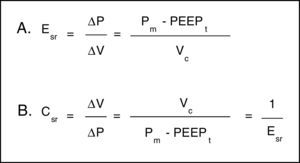
Para analizar las propiedades de estructuras elásticas, se cuenta con la ley de Hooke, la cual señala que el ΔP es proporcional al cambio de volumen (ΔV). La constante de proporcionalidad es la propiedad mecánica del sistema respiratorio que se conoce como elastancia del sistema respiratorio (Esr), y se define como presión por unidad de volumen (fig. 3A). Habitualmente en la monitorización clínica se utiliza su inversa, la distensibilidad (Csr) (fig. 3B). Esta propiedad determina el valor de la Palv en cualquier momento del ciclo respiratorio y es la causa de la fuerza de retracción elástica para la espiración pasiva.
Propiedades mecánicas del sistema respiratorio. A. Ecuación de elastancia del sistema respiratorio (Esr). Propiedad mecánica del sistema respiratorio que relaciona cambios de volumen (ΔV) con cambios de presión (ΔP). Pm: presión meseta; PEEPt: presión positiva total al final de la espiración; Vc: volumen corriente. B. Ecuación de la distensibilidad del sistema respiratorio. La distensibilidad corresponde a la inversa de la elastancia. Vc: volumen corriente; Pm: presión meseta; PEEPt: presión positiva total al final de la espiración.
Por último tenemos la inercia, que es la resistencia a la deformación del parénquima pulmonar y la pared torácica; en este caso, prácticamente despreciable en la mayoría de las situaciones clínicas.
En conjunto, estas variables constituyen las propiedades mecánicas del sistema respiratorio; por ende, la caracterización de cada ciclo respiratorio (ya sea en magnitud del ΔV o V’, como los cambios de presión de la vía aérea y alveolar) es consecuencia de la interacción de las fuerzas que originan el movimiento de aire y las propiedades mecánicas.
3.2Ecuación de movimiento del sistema respiratorioComo se señaló anteriormente, la presión en el sistema respiratorio en cada momento tiene un componente elástico necesario para la distensión del parénquima pulmonar, un componente de resistencia al avanzar el flujo de aire por la vía aérea y un componente inercial (despreciable para frecuencias respiratorias < 1Hz)8.
En la ventilación en modo espontáneo, la presión generada por los músculos respiratorios (Pmus) es directamente proporcional al volumen corriente (Vc), al flujo con que se moviliza dicho volumen, a la resistencia ofrecida por la vía aérea e inversamente proporcional a la Csr. La interacción anteriormente mencionada se describe en la expresión matemática conocida como ecuación de movimiento del sistema respiratorio [Otis, (fig. 1B)], que establece la relación entre la presión en la vía aérea (Pva), el componente elástico, el de resistencia y el esfuerzo de los músculos inspiratorios9. De esta manera, la interacción del ventilador y el paciente está gobernada por dicha ecuación. Por lo tanto, la importancia de la ecuación de movimiento radica en los siguientes puntos:
- 1)
Expresar el volumen y V’ en cualquier instante de ciclo respiratorio (determinados por la Csr y Rsr, como ya se detalló).
- 2)
Señalar la Pmus o del ventilador en un determinado tiempo inspiratorio (Ti) a un determinado V’, para ocasionar un aumento del volumen pulmonar superando la carga (Csr y Rsr).
En términos sencillos, a la presión positiva creada por el ventilador se opone otra de diferente magnitud relacionada, por una parte, con la resistencia al flujo aéreo ofrecida por el árbol traqueobronquial [elemento de resistencia, incluida la instrumental (presión transviaérea)] y, por otra, relacionada con el aumento de volumen sobre la capacidad residual funcional (CRF) que corresponde a la fuerza de retracción elástica del parénquima pulmonar y la pared torácica [elemento elástico (presión transtorácica)].
Se debe considerar que en una modalidad ventilatoria parcial o asistida, el trabajo respiratorio es compartido tanto por los músculos respiratorios como por el ventilador mecánico, y este aumenta con la presencia de una presión positiva intrínseca al final de la espiración (PEEPi).
De este modo se pueden identificar las siguientes variables y constantes:
- •
Variables: Presión, V’ y Vc, las cuales cambian permanentemente (manipuladas por el ventilador).
- •
Constantes: Csr y Rsr, las que permanecen habitualmente sin variación en el paciente sano.
Independientemente del uso de cualquier modalidad ventilatoria, el operador debe tener en mente que “si el ventilador controla el volumen, se debe monitorizar la presión” o “si el ventilador controla la presión, se debe monitorizar el volumen”.
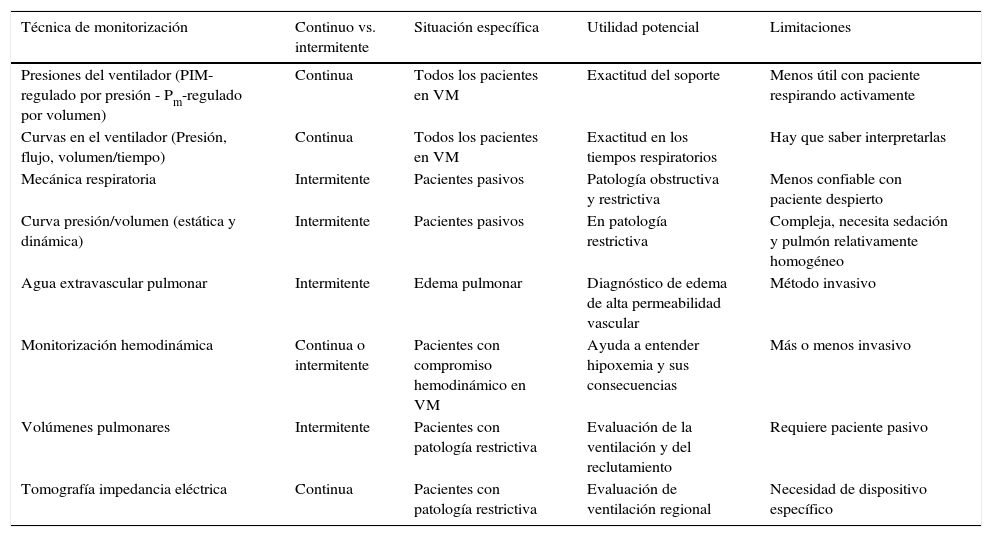
4Técnicas de monitorizaciónEn la actualidad, es factible disponer de diversas técnicas de monitorización para el paciente con falla respiratoria aguda, aunque todavía existe una falta de consenso con respecto a la correcta priorización de la señal y variable adquirida, el instante (continuo versus intermitente) y la modalidad empleada (estático versus dinámico). Cada una de estas técnicas es de utilidad en situaciones específicas, y presenta potenciales ventajas como también limitaciones (tabla 3).
Técnicas disponibles para monitorización ventilatoria con sus principales características y limitaciones
| Técnica de monitorización | Continuo vs. intermitente | Situación específica | Utilidad potencial | Limitaciones |
|---|---|---|---|---|
| Presiones del ventilador (PIM-regulado por presión - Pm-regulado por volumen) | Continua | Todos los pacientes en VM | Exactitud del soporte | Menos útil con paciente respirando activamente |
| Curvas en el ventilador (Presión, flujo, volumen/tiempo) | Continua | Todos los pacientes en VM | Exactitud en los tiempos respiratorios | Hay que saber interpretarlas |
| Mecánica respiratoria | Intermitente | Pacientes pasivos | Patología obstructiva y restrictiva | Menos confiable con paciente despierto |
| Curva presión/volumen (estática y dinámica) | Intermitente | Pacientes pasivos | En patología restrictiva | Compleja, necesita sedación y pulmón relativamente homogéneo |
| Agua extravascular pulmonar | Intermitente | Edema pulmonar | Diagnóstico de edema de alta permeabilidad vascular | Método invasivo |
| Monitorización hemodinámica | Continua o intermitente | Pacientes con compromiso hemodinámico en VM | Ayuda a entender hipoxemia y sus consecuencias | Más o menos invasivo |
| Volúmenes pulmonares | Intermitente | Pacientes con patología restrictiva | Evaluación de la ventilación y del reclutamiento | Requiere paciente pasivo |
| Tomografía impedancia eléctrica | Continua | Pacientes con patología restrictiva | Evaluación de ventilación regional | Necesidad de dispositivo específico |
PIM: presión inspiratoria máxima; Pm: presión meseta; VM: ventilación mecánica.
Siempre se debe propender a la monitorización multimodal e, idealmente, evaluar la oxigenación, la eficiencia ventilatoria, la función de la pared del tórax, la interacción paciente-ventilador, la permeabilidad vascular, y específicamente en el paciente con síndrome de dificultad respiratoria aguda (SDRA), el potencial de reclutamiento alveolar, la sobredistensión y la apertura-cierre cíclico alveolar.
5Monitorización del intercambio gaseoso5.1Oximetría de pulso. Saturación arterial de oxígenoLa oximetría de pulso (SpO2) es considerada una forma de monitorización imprescindible en todo paciente con alteraciones respiratorias o en riesgo de presentarlas. Sin embargo, su uso no ha demostrado afectar el pronóstico del paciente. Constituye un método no invasivo de monitorización continua de la saturación percutánea de oxígeno (SatO2), cuya utilidad radica en la detección precoz de hipoxemia10,11.
Como es sabido, la hemoglobina oxigenada (HbO2) y la hemoglobina desoxigenada o reducida (Hb) absorben y transmiten determinadas longitudes de onda del espectro luminoso: en torno a 660nm para la luz roja y en torno a 940nm para la luz infrarroja. Estas variaciones se miden mediante un sistema pulsátil basado en la ley de Beer-Lambert, que relaciona la intensidad de luz entrante en un medio con la intensidad saliente luego de producida la absorción, en el que se encienden alternativamente dos led (uno para cada longitud de onda). Así, la luz atraviesa el árbol arterial y la SpO2 se determina por la proporción de luz roja e infrarroja que llega al fotodetector (R/Ir), lo que permite estimar la SatO2 arterial12.
Para una óptima interpretación es esencial que la perfusión sea adecuada13, al igual que las condiciones de luz y temperatura ambiental14. Habitualmente, la sensibilidad es mejor con el dispositivo digital que con el auricular14; las “falsas” alarmas son muy frecuentes en niños, generalmente por los movimientos corporales.
Este método se destaca por ser de bajo costo, estar ampliamente disponible y presentar escasas limitaciones en la confiabilidad de su información. En cuanto a sus desventajas intrínsecas se encuentran ser insensible a cambios de presión arterial de oxígeno (PaO2) frente a elevados niveles de esta, y no distinguir entre Hb normal y carboxihemoglobina o metahemoglobina.
En relación con la curva de disociación de la oxihemoglobina, esta es casi lineal cuando la SatO2 se encuentra entre el 80-97%. Por tanto, se podría cuantificar la magnitud de la hipoxemia de forma eficaz al utilizar la relación entre la saturación y la fracción inspirada de oxígeno (índice SatO2/FiO2).
Se ha validado la relación entre la SatO2/FiO2 y la PaO2/FiO2 (o índice de Kirby) en una muestra heterogénea de niños críticamente enfermos, y se ha encontrado una fuerte correlación entre ambas15, por lo que la SatO2/FiO2 puede ser utilizada como parámetro diagnóstico no invasivo en el SDRA. Además, cabe mencionar que posee una buena correlación tanto en pacientes adultos como en pediátricos16, y que puede ser útil para detectar falla en el uso de ventilación mecánica no invasiva (VMNI)17,18.
Finalmente, no debe olvidarse que en el paciente con insuficiencia respiratoria aguda grave, esta técnica no reemplaza a la gasometría arterial. En la tabla 4 se resumen algunas limitaciones de la oximetría de pulso.
Limitaciones de la oximetría de pulso
| • Lapso de tiempo variable (> 15-20 s) para detectar hipoxemia aguda. • Medida no fiable en situaciones que alteren la perfusión periférica (shock, frío). • Mala correlación con PaO2 con valores de SatO2 >97% (posibilidad de hipoxemia inadvertida) y SatO2 < 80%. • La presencia de Hb anómalas dan valores no fiables. MetaHb: valores en torno al 85%; COHb: valores de SatO2 falsamente elevados. • Poco fiable para valorar la gravedad inicial de una obstrucción de vías aéreas superiores, por no tener utilidad para detectar hipoventilación. • Artefactos: movimiento, colocación inadecuada del sensor, ondas electromagnéticas, excesiva luz ambiental, piel oscura, colorantes empleados para diagnóstico o tratamiento (azul de metileno, verde de indocianina, índigo carmín), ritmos cardiacos irregulares (sobre todo taquiarritmias). |
SatO2: saturación percutánea de oxígeno; PaO2: presión arterial parcial de oxígeno; MetHb: metahemoglobina; COHb: carboxihemoglobina; Hb: hemoglobina.
La espectroscopia de luz en la región cercana al infrarrojo (near-infrared spectroscopy, NIRS) es una modalidad de diagnóstico óptico no invasivo, la cual proporciona información sobre la entrega y demanda de oxígeno. Monitoriza de forma continua, mediante oximetría no pulsátil, la SatO2 a partir de la fracción de oxihemoglobina y desoxihemoglobina presente en un volumen de tejido19. La saturación regional de O2 (rSO2) se obtiene de los registros obtenidos de los electrodos ubicados en el paciente, a partir de la siguiente fórmula:
Las variaciones de rSO2 reflejan cambios en la demanda o suministro metabólico de la región explorada, lo cual depende del gasto cardíaco (GC) y del contenido arterial de O2 (CaO2). Por tanto, frente a un descenso de la rSO2 se está ante una disminución en la perfusión o un incremento en la extracción de O2. Por lo contrario, valores altos de rSO2 pueden indicar un incremento de la perfusión o una menor extracción de O2. Ambas situaciones pueden revelar estados patológicos aunque, en la clínica, la tendencia sería más útil que el número absoluto20.
Aún queda por definir su papel exacto en el cuidado del paciente crítico21,22; sin embargo, puede ser efectivo y beneficioso como monitor hemodinámico23.
5.3Gases en sangre arterialA pesar de que existen métodos no invasivos para la valoración del intercambio gaseoso, la medición de gases arteriales es fundamental para el diagnóstico y monitorización de la suficiencia del aparato respiratorio en pacientes críticamente enfermos, especialmente en aquellos con riesgo de presentar falla respiratoria. La medición de gases arteriales permite la evaluación de la oxigenación, ventilación y del estado metabólico. Su adecuada interpretación es crucial; sin embargo, se debe considerar que la punción arterial es intermitente y se requiere de la destreza del operador.
5.4Presión parcial de oxígeno en sangre arterialPara medir la magnitud de la hipoxemia se han empleado numerosos índices, como gradiente o diferencia alvéolo-arterial de O2 (DA-aO2), índice de Fick (PaO2/PAO2), PaO2/FiO2, contenido arterial de O2, entre otros24. El de mayor uso es la PaO2/FiO2, actualmente incorporada en la definición de SDRA25. Esta última varía con la magnitud del corto circuito, la condición hemodinámica del paciente (presión venosa de oxígeno mixta, PvO2), el valor de Hb, la diferencia en el contenido arterio-venoso de oxígeno y la FiO226,27. Es importante destacar que debe ser evaluada en el contexto del soporte ventilatorio empleado, pues se ve influenciada por el uso de VM y la presión positiva al final de la espiración (PEEP)27–33.
Otro indicador es el índice de oxigenación (IO), el cual señala el “costo de oxigenar” o la intensidad del soporte ventilatorio. Su fórmula (IO = [Pmva x FiO2 x 100]/PaO2) incluye a la presión media de la vía aérea (Pmva), la que mejor se correlaciona con el grado de distensión alveolar y oxigenación (representando adecuadamente la presión media alveolar, salvo en condiciones de aumento de la resistencia de la vía aérea)34. En aquellos pacientes sin acceso vascular, se puede utilizar el índice de saturación de oxígeno (ISO = [FiO2 x Pmva x 100]/SatO2) como alternativa para evaluar la magnitud de la hipoxemia16.
Cabe señalar que un reciente consenso de daño pulmonar agudo en pediatría recomienda el IO por sobre la PaO2/FiO2 como métrica primaria de gravedad para definir el SDRA pediátrico. Si este no está disponible, se recomienda el uso del ISO para estratificar el riesgo18. En la tabla 5 se puede observar la clasificación de la gravedad del SDRA según la PaFi, IO, ISO y SatO2/FiO2.
Clasificación de gravedad en el síndrome de dificultad respiratoria aguda (SDRA) en pediatría según el grado de hipoxia
| PaFi= PaO2/FiO2 | IO= FiO2 x Pmva/PaO2 | *SF= SatO2/FiO2 | *ISO= FiO2 x Pmva/SatO2 |
|---|---|---|---|
| < 100: SDRA grave 100-200: SDRA moderado 200-300: SDRA leve | > 16: SDRA grave 8-16: SDRA moderado 4-8: SDRA leve | < 264 equivale a PaFi < 300 < 221 equivale a PaFi < 200 | >12.3: SDRA grave 7.5-12.3: SDRA moderado 5-7.5: SDRA leve |
Estos índices no deben aplicarse a niños con cardiopatía congénita cianógena.
PaFi: cociente presión arterial de oxígeno/fracción inspirada de oxígeno; IO: índice de oxigenación; PaO2: presión arterial de oxígeno; FiO2: fracción inspirada de oxígeno; Pmva: presión media de vía aérea; SF: cociente saturación de oxígeno/fracción inspirado de oxígeno; ISO: índice de oxigenación en base a saturación.
La presión alveolar de CO2 (PACO2) es el parámetro que mejor define el estado de ventilación pulmonar, y depende directamente de la producción de CO2 e inversamente de la ventilación alveolar. Debido a que el CO2 se difunde rápidamente a través de la membrana alveolar (veinte veces más que el oxígeno), la PACO2 está en equilibrio con la presión arterial de CO2 (PaCO2), por lo que se considera a esta última como el medio más sencillo para valorar la ventilación35.
5.6Monitorización transcutánea de CO2La monitorización transcutánea de CO2 (transcutaneous carbon dioxide, tcPCO2) nace de la necesidad de valorar continuamente la ventilación alveolar, sin requerir la toma de gases arteriales en forma repetida (procedimiento estándar para su valoración) y como método alternativo, ya que la correlación de la presión parcial de CO2 al final de la espiración (end tidal CO2concentration, EtCO2) con la PaCO2 puede verse afectada por varios factores, como alteraciones en la relación ventilación-perfusión (V/Q), utilización de Vc pequeños, etcétera.
En relación con los aspectos técnicos, los sensores tcPCO2 calientan la piel a una temperatura de 42-43°C, lo que da lugar a la vasodilatación del lecho capilar, y conduce a una aproximación de la presión de CO2 capilar y arterial. Esta vasodilatación facilita, además, la difusión de CO2 del capilar a la membrana del monitor, resultando en la lectura del tcPCO2. El calor aplicado externamente altera la solubilidad del CO2 en la sangre, y aumenta la tasa metabólica del tejido en aproximadamente 4-5% por cada grado Celsius; por tanto, incrementa la producción local de CO2, lo que es corregido mediante el uso de un factor.
Aunque se ha utilizado con mayor frecuencia en el paciente recién nacido, el desarrollo tecnológico ha conducido a su aplicación fuera de la población neonatal, específicamente en la evaluación continua de la ventilación durante la insuficiencia respiratoria en pacientes que requieren ser intubados, así como durante la ventilación de alta frecuencia oscilatoria, donde la vigilancia del EtCO2 no es factible36.
5.7CapnografíaLa capnografía es el método estándar que permite monitorizar la eliminación del CO2 sanguíneo durante el ciclo respiratorio en forma continua y en tiempo real. Su representación gráfica corresponde al capnograma, que entrega información cualitativa acerca de la ventilación y perfusión.
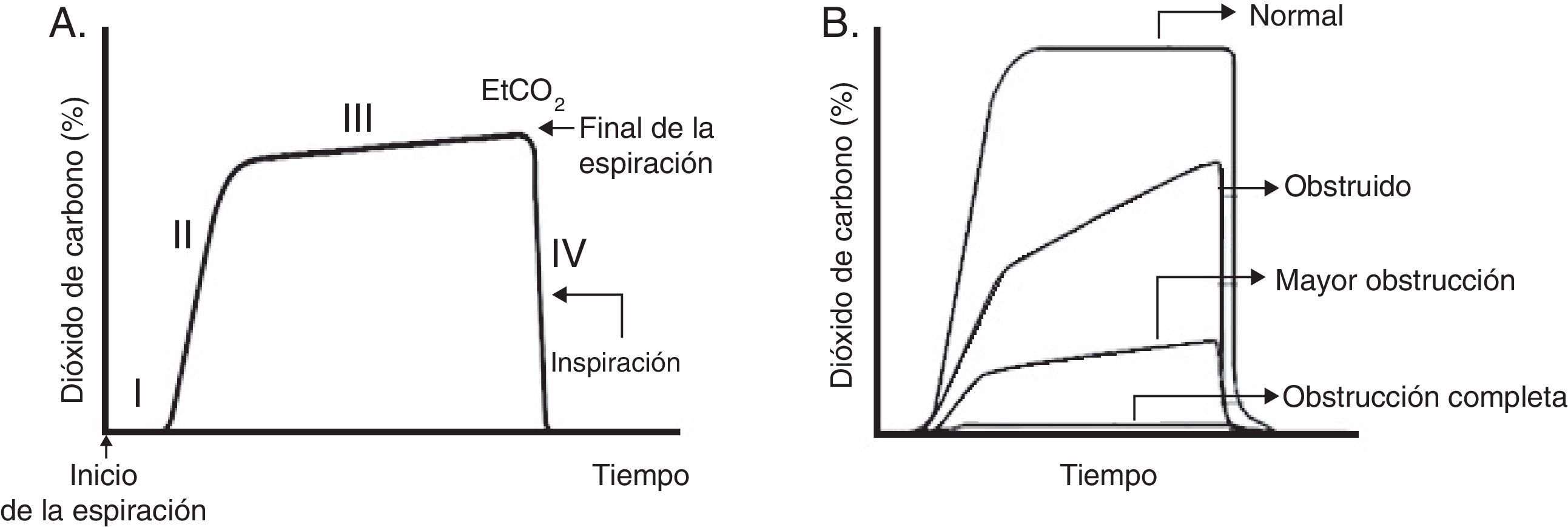
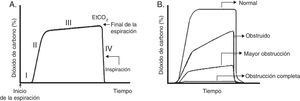
Habitualmente se describen cuatro fases (fig. 4A). La fase III (a menudo referida como meseta) es la que muestra el EtCO2, que representa la remoción de CO2 desde el gas alveolar y entrega una medición indirecta de la PaCO2.
Gráficas de capnograma. A. Capnograma normal. Fase I: final de la inspiración y comienzo de la espiración (ventilación del espacio muerto). Fase II: rápido ascenso del CO2 al inicio de la espiración por la eliminación de CO2 del espacio muerto mezclado con CO2 alveolar. Fase III: meseta alveolar. Se produce la exhalación del CO2 proveniente de los alvéolos. Alcanza un pico donde la presión parcial de CO2 es máxima. Fase IV: la presión parcial de CO2 decrece rápidamente al comienzo de la inspiración. PCO2 corresponde a la presión parcial de CO2 y EtCO2 (end tidal CO2 concentration) a la presión parcial de CO2 al final de la espiración. B. Cambios de morfología del capnograma y del porcentaje de dióxido de carbono en el tiempo según la magnitud de obstrucción de la vía aérea.
La diferencia normal entre la PaCO2 y la EtCO2 (gradiente arterio-alveolar de CO2, a-ACO2) es de 2-3mmHg (PaCO2 40mmHg y PACO2 37-38mmHg). Cuando existe una adecuada ventilación y perfusión pulmonar, la a-ACO2 es pequeña, por lo tanto la EtCO2 puede ser utilizada para monitorizar al paciente ya que refleja la PaCO2.
Se debe recordar que la heterogeneidad pulmonar crea diferencias regionales en las concentraciones de CO2, y que los gases provenientes de zonas con una elevada V/Q son los primeros en aparecer en la vía aérea superior durante la exhalación. Este vaciamiento secuencial contribuye al incremento de la pendiente de la meseta alveolar. A mayor heterogeneidad V/Q es más pronunciada la pendiente de la meseta alveolar (forma de “aleta de tiburón”), y se correlaciona con la gravedad de la obstrucción de la vía aérea37 (fig. 4B). El gradiente entre PaCO2 y EtCO2 es mayor en pacientes con SDRA y se correlaciona con los distintos niveles de espacio muerto fisiológico38. Además de la monitorización ventilatoria, la capnografía se puede utilizar para asegurar la correcta intubación endotraqueal.
5.8Capnografía volumétrica. Cálculo del espacio muertoA diferencia de la capnografía estándar, la capnografía volumétrica (CV) permite medir el volumen de CO2 espirado en el Vc (mediante el cual se puede calcular el espacio muerto respiratorio), ajustar un PEEP óptimo (obteniendo de esta forma una mejor oxigenación) y valorar la ventilación y perfusión pulmonar, que pueden variar en cada ciclo respiratorio y cardiaco, de forma dinámica. Se debe considerar, en general, que el niño con SDRA presenta un incremento del espacio muerto39, y que su fracción alveolar (Vdalv) correlaciona con la mortalidad40,41, por lo que se le ha dado un valor pronóstico. En relación con las ventajas y aplicaciones clínicas, estas son las mismas de la capnografía estándar.
La CV es considerada el estándar de oro para la evaluación de la eficacia de la ventilación alveolar a la cabecera del enfermo, ya que es la manera más simple y efectiva de monitoreo en los pacientes con lesión pulmonar grave.
En la tabla 6 se resumen las técnicas de monitorización del intercambio gaseoso que se han mencionado.
Técnicas y parámetros de monitorización del intercambio gaseoso
| Técnica/parámetro | Situación específica | Ventajas | Limitaciones |
|---|---|---|---|
| Oximetría pulso (SatO2) | • Todos | • Detección de hipoxemia | • Mala interpretación en • Choque séptico • Alteración de la circulación periférica • Carboxi/metahemo-globinemia |
| NIRS (rStO2) | • Perioperatorio • Cuidados intensivos | • Monitorización no invasiva del VO2 y función microcirculatoria | • Obstrucción flujo arteria radial • Entrega información sólo a nivel local |
| Gases arteriales | • Todos | • Diagnóstico y monitorización del sistema respiratorio y metabólico | • La toma de reiteradas muestras |
| Capnografía (EtCO2) | • Monitorizar vía aérea y ventilación • Detectar hipo e hiperventilación (transporte) • Problemas obstructivos • Neuromonitorización | • Información cuantitativa y cualitativa • Exactitud del soporte | • Excesiva fuga por TET |
| CO2 transcutáneo (TcPCO2) | Todos | • Monitorización no invasiva | • Costos relativamente altos |
| Capnografía volumétrica (EtCO2) | • SDRA | • Cálculo del espacio muerto • Ajuste de la PEEP | • Análisis complejo |
Se señalan las situaciones en las que se utilizan, además de ventajas y limitaciones. SatO2: saturación de oxígeno; VO2: consumo de oxígeno; NIRS: (near-infrared spectroscopy) espectroscopia cercano al infrarrojo; EtCO2: (end tidal CO2concentration) presión parcial de CO2 al final de la espiración; TEC: traumatismo encéfalo craneano; TET: tubo endotraqueal; TcPCO2: presión parcial transcutánea de CO2; SDRA: síndrome de dificultad respiratoria aguda; PEEP: (positive end expiratory pressure), presión positiva al final de la espiración.
No solo la exploración clínica permanente y la monitorización del intercambio gaseoso son esenciales para el control del paciente en asistencia ventilatoria invasiva sino también la monitorización de la mecánica respiratoria, la cual debe ser un componente integral de la atención diaria. La medición de esta se puede efectuar en el paciente en condiciones estáticas (técnicas de oclusión) o dinámicas (sin interrupción del flujo).
Los avances tecnológicos en el campo de la VM permiten disponer de una amplia variedad de parámetros y gráficas en tiempo real, que generan una monitorización más precisa del paciente, lo que ayuda a minimizar las complicaciones, optimizar la sincronía paciente-ventilador y, finalmente, mediante su correcta interpretación, lograr diagnósticos más precisos, y por ende enfoques terapéuticos más adecuados.
7Monitorización de las presiones de vía aérea7.1Presión inspiratoria máximaLa presión inspiratoria máxima (PIM) es la presión máxima registrada al final de la inspiración, y resulta de la resistencia friccional de la vía aérea. Entre sus factores determinantes se encuentran los siguientes: flujo, resistencia [incluido el tubo endotraqueal (TET)] y Csr.
Su valor no debe exceder los 30-35 cmH2O. Por tanto, ante altas presiones, se debe descartar un problema obstructivo relacionado ya sea con el paciente (broncoespasmo, secreciones), con la tubuladura (tapón, torsión), o con el uso de un flujo inspiratorio excesivo, lo que afecta significativamente el valor de la PIM42.
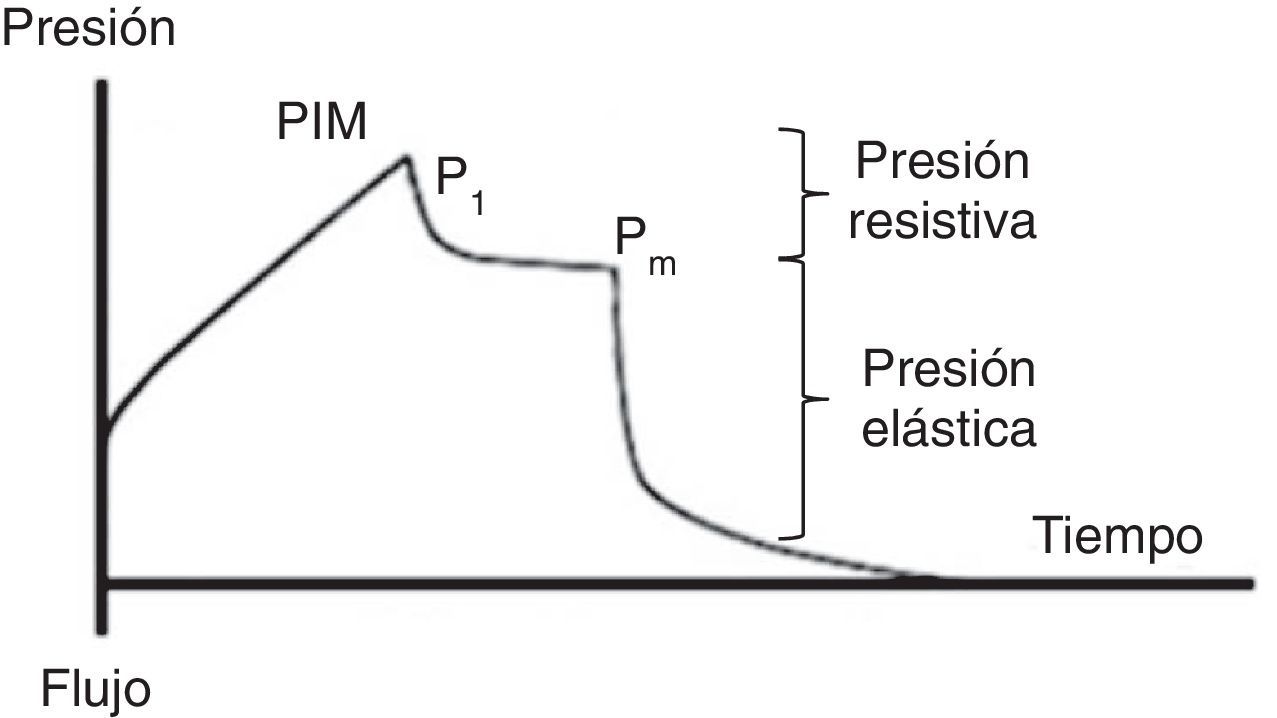
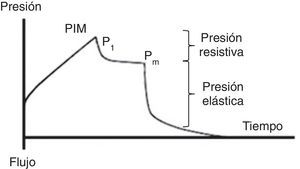
7.2Presión mesetaPara la evaluación de la presión meseta (Pm) se requiere una pausa al final de la inspiración (flujo 0, equilibrio de presiones en la vía aérea), usualmente de 0.2 a 2 s, lo que ocasiona que el volumen de aire entregado se mantenga y distribuya homogéneamente en relación con las fuerzas viscoelásticas del pulmón. Esto origina un descenso en la presión de la vía aérea que crea una meseta (Pm) antes de caer a la presión basal. Para ello, el paciente debe estar bien adaptado al ventilador y sin un esfuerzo ventilatorio significativo (fig. 5).
Se debe considerar que la Pm está influenciada por el Vc, la Csr, y el PEEP total, y representa la presión de retracción elástica del sistema respiratorio (pulmón y pared del tórax) al final del ciclo inspiratorio. Permite el cálculo de la Csr estática y se debe evaluar reiteradamente durante las primeras horas de conexión a VM. Su valor se localiza por debajo de la PIM y debe ser menor a 30 cmH2O43; valores superiores sugieren un deterioro en la Csr que amerita evaluación.
Como se ha señalado, la Csr se calcula fácilmente como la razón entre el Vc/(Pm-PEEP). Una disminución de esta (alta elastancia), como la que se observa en el SDRA, representa un escaso tejido pulmonar disponible para la ventilación, reflejando la dependencia Vc-Csr44. Entonces, ante una baja Csr, se apreciará una elevación de la Pm o del PEEP [limitación del flujo o hiperinsuflación dinámica (HID)].
7.3Presión de distensiónLa presión de distensión o gradiente de presión (ΔP) es la diferencia entre la presión alveolar al final de la inspiración (Pm) y el PEEP (ΔP=Pm-PEEP). Esta definición es independiente de la modalidad ventilatoria.
Durante la ventilación controlada por volumen, el valor de la ΔP dependerá del Vc y de la elastancia de la pared torácica. La ΔP se acerca bastante a la presión transpulmonar (Ptp); sin embargo, en ausencia de actividad ventilatoria, la presión transpulmonar siempre es inferior a la ΔP. Así, la ΔP tiene relación directa con el Vc y la Ptp; por tanto, su importancia radica en que es una medida de control (o límite) de las presiones aplicadas sobre la vía aérea para prevenir el daño asociado con la ventilación.
Mientras no se logre definir en forma más individualizada la terapia ventilatoria, es muy importante que la presión de distensión o diferencial sea, en lo posible, menor de 15 cmH2O.
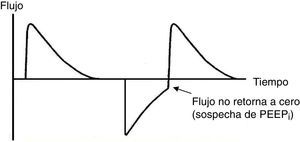
7.4Curvas presión-tiempo y flujo-tiempoSe recomienda la monitorización de las curvas presión-tiempo (fig. 5) y flujo-tiempo (fig. 6) para detectar la limitación del flujo espiratorio o asincronía paciente-ventilador, y manejar la precisión de los tiempos respiratorios18.
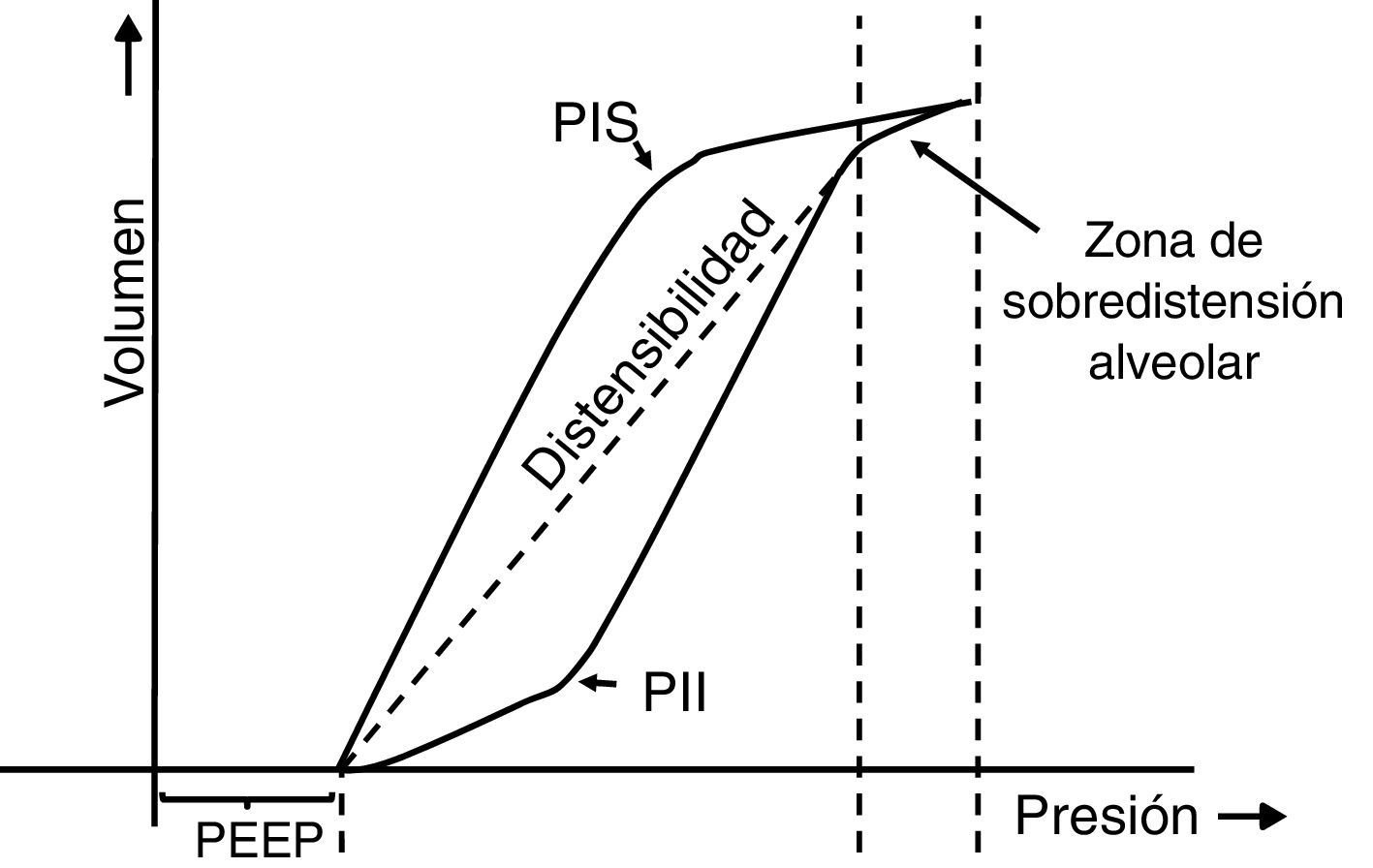
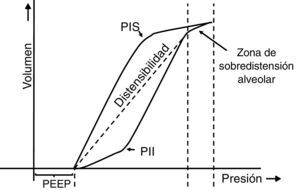
7.5Lazo presión-volumenEl lazo estático presión-volumen (P/V) entrega información completa de las propiedades mecánicas del sistema respiratorio. Se obtiene mediante la representación gráfica del volumen pulmonar para una presión determinada en ausencia de flujo en la vía aérea; es decir, prescindiendo del componente resistivo. De esta forma, la presión medida es la verdadera presión de retroceso elástico del parénquima pulmonar, lo que permite guiar la terapia ventilatoria (estimación de la Csr y ajuste de la PEEP). En la figura 7 se muestran los componentes del lazo P/V: histéresis, puntos de inflexión superior (PIS) e inferior (PII)44–46 y distensibilidad47. Cabe señalar que el reclutamiento alveolar se produce en un tramo de este lazo48,49, que el reclutamiento y desreclutamiento ocurren simultáneamente y que, además, la PEEP óptima debe evaluarse en la rama espiratoria.
Lazo estático presión-volumen (P/V). Se representa el lazo estático P/V en pacientes con SDRA. Se puede observar la histéresis del sistema respiratorio, la que genera que el recorrido de la curva sea diferente en la inspiración y la espiración. Es decir, “la presión de la vía aérea necesaria para abrir los alvéolos es mayor que la necesaria para mantenerlos abiertos una vez que han sido reclutados”. Además, se pueden observar los puntos de inflexión superior (PIS) e inferior (PII), los cuales permitirían estimar la presión positiva al final de la espiración (PEEP) y el volumen corriente (Vc) óptimos.
Finalmente, en el paciente con SDRA existe escasa evidencia concluyente referente al cambio de pronóstico con el uso del lazo P/V50–52, puesto que no es fácil de medir en clínica y su interpretación clásica ha sido cuestionada en diversos modelos matemáticos.
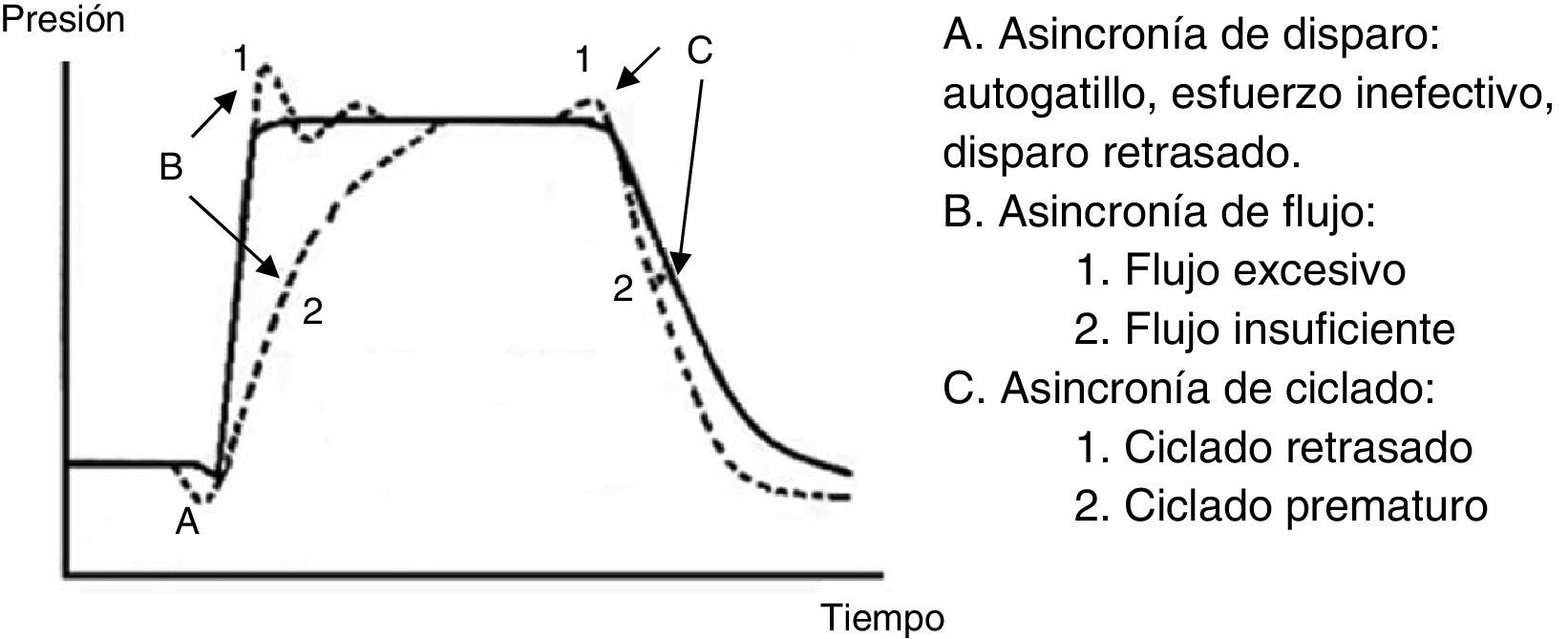
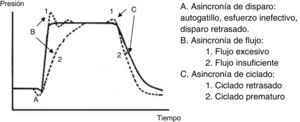
7.6Asincronía paciente-ventiladorLa asincronía o disincronía se puede observar en un paciente con alta demanda ventilatoria (SDRA grave), o también en aquel sin gran patología pulmonar pero con una complicación aguda, como en la obstrucción del TET. Esta se clasifica según la fase en la que ocurre: al inicio (disparo), en la fase inspiratoria (generación de flujo), en el punto de ciclado o al final de la espiración.
- 1.
En la asincronía de inicio o disparo se puede encontrar lo siguiente:
- •
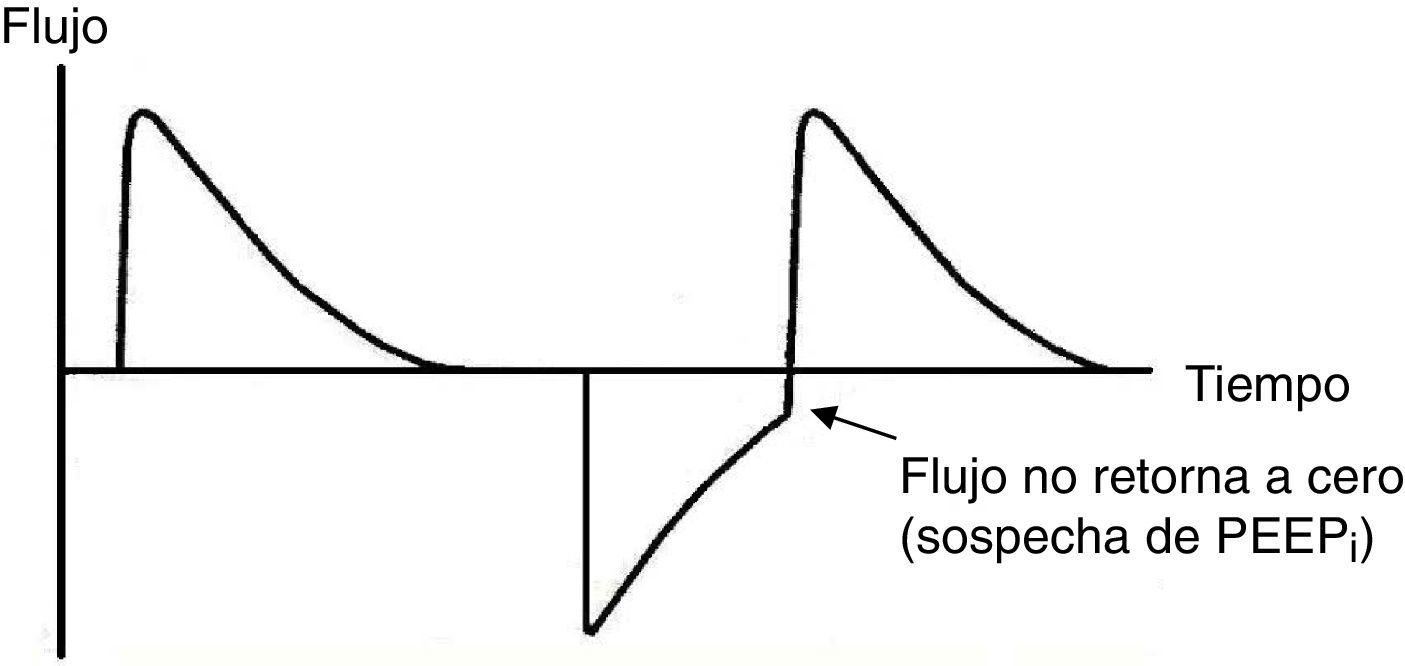
Disparo inefectivo. Se encuentra relacionado con un aumento en el tiempo de la VM y con una menor probabilidad de éxito en el destete. En este caso, el paciente intentará gatillar pero no será capaz de llegar al umbral programado, generando de esta forma un aumento en el trabajo respiratorio. Una causa común por lo que surge la asincronía es un inicio inefectivo resultante de la presencia de PEEPi. El análisis de la curva de flujo mostrará un elevado flujo inicial, y luego la interrupción del mismo que no alcanza el eje de las abscisas, revelando así la presencia de volumen aéreo atrapado (fig. 6).
- •
Doble disparo. De esta forma se recibe el doble del Vc. Esto puede originarse por una alta demanda ventilatoria por parte del paciente, o un Ti inapropiado.
- •
Autodisparo. El ventilador inicia una respiración no gatillada por el paciente. El origen de esto puede ser agua en el circuito, nebulizaciones o bajo disparo, entre otras causas.
- •
- 2.
La asincronía de flujo se produce cuando el ventilador entrega un flujo insuficiente para la demanda del paciente. En el caso de un flujo demasiado bajo para el paciente, se puede observar una caída durante la inspiración en la curva de presión. En situaciones en que el flujo se encuentre muy alto, en la curva de presión se observará un pico al inicio53,54.
- 3.
En la asincronía en el ciclado se pueden encontrar dos causas; una es un ciclo prematuro, el cual se produce cuando el Ti programado es demasiado corto para el paciente, por lo tanto el esfuerzo inspiratorio puede estar aún presente cuando ha terminado el Ti. En estos casos, el paciente puede generar presión negativa y activar el disparo generando un doble inicio.
La segunda causa es un ciclo retrasado: el Ti programado es demasiado largo para el paciente, por tanto, acaba la inspiración antes que el ventilador cicle, o se produce activación de los músculos espiratorios cuando el respirador todavía está entregando el volumen inspiratorio.
- 4.
La asincronía al final de la fase espiratoria puede ocurrir en condiciones en las que se produce un retraso en la relajación muscular espiratoria antes de la siguiente inspiración, o una superposición entre la actividad muscular inspiratoria y espiratoria. Estas condiciones son verificadas con mediciones neuronales, por lo que no se pueden evaluar a partir de la gráfica ventilatoria.
De lo anterior se desprende que el reconocimiento de la asincronía paciente-ventilador es trascendente, y abarca tanto la observación del paciente (ansiedad, diaforesis, etcétera) como las curvas del ventilador, ya que puede ocasionar HID y retardo del destete ventilatorio, entre otras complicaciones55.
En la figura 8 se grafica curva presión-tiempo con los tipos de asincronía paciente-ventilador y en la tabla 7 principales complicaciones derivadas de esta misma.
Principales complicaciones derivadas de la asincronía paciente-ventilador
| • Aumento del trabajo respiratorio • Lucha del paciente con el ventilador • Incomodidad del paciente • Aumento de los requerimientos de sedación y bloqueo neuromuscular • Disfunción de la musculatura respiratoria: “daño muscular” • Ventilación inefectiva, hipoxemia, hipercapnia • Sobredistensión pulmonar e hiperinsuflación dinámica • Ansiedad para los padres o familiares • Retardo del destete • Prolongación de la VM • Prolongación de la estancia en UCIP (aumento de riesgos infecciosos y costos) • Complicaciones neuromusculares secundario a la inmovilidad prolongada |
VM: ventilación mecánica; UCIP: unidad de cuidados intensivos pediátricos
La presión intraabdominal (PIA) corresponde a la presión dentro de la cavidad abdominal, y está determinada por tres factores: el índice de masa corporal, la posición del paciente y la resistencia ejercida por la pared abdominal (que varía según los movimientos respiratorios).
Se debe considerar que durante la respiración espontánea la PIA es subatmosférica; en cambio, cuando el paciente se encuentra ventilado, esta es levemente positiva.
Estudios han señalado que al estimar la hipertensión intraabdominal mediante la palpación existe una sensibilidad de solo el 40%. En el trabajo de Van Mieghem y colaboradores56 se encontró una pobre correlación entre la PIA y el perímetro abdominal; por tanto, frente a un leve aumento de esta presión, se podría estar en ausencia de signos clínicos para poder diagnosticarla57.
Es importante considerar que frente a un aumento de la PIA se generarán, en forma pasiva, fenómenos tales como desplazamiento del diafragma (transmitiendo dicha presión hacia los lóbulos pulmonares inferiores, modificando la mecánica toracopulmonar y originando una disminución en la Csr); reducción en el impacto de la Ptp, como fuerza de apertura alveolar y prevención de cierre por transmisión de la presión abdominal a la cavidad pleural; y por último se observará una reducción de la CRF, alteraciones de la V/Q y aumento de la fracción del corto circuito pulmonar58. A lo anterior se suma la activación de neutrófilos pulmonares, generando infiltrado inflamatorio y edema alveolar asociado con atelectasias por compresión, resultando en una VM prolongada y un destete ventilatorio difícil. En general, estas alteraciones ocurren con PIA ≥ 15mmHg59.
Se recomienda monitorizar la PIA en todo paciente en quien se sospeche hipertensión intraabdominal, especialmente en aquel que ha recibido una agresiva reanimación con fluidos60.
7.8Presión transpulmonar y presión esofágicaLa Ptp se define como la diferencia entre la Palv y la presión pleural (Ppl), (Ptp = Palv-Ppl), y es la fuerza que distiende al pulmón (equivalente al estrés); por tanto, es la principal determinante de la magnitud de deformación del parénquima pulmonar (estiramiento). Teóricamente, por medio de su medición, se puede otorgar un soporte ventilatorio más racional y limitar el daño pulmonar inducido por la VM61.
Una estimación de la Ptp puede ser posible en la clínica, reemplazando la Palv y la Ppl por la medición de la Pva y la presión esofágica (Pes).
En posición vertical, la Pes es comparable con la Ppl, aunque existe cuestionamiento si efectivamente puede aproximarse en un paciente en posición supina o prona. Además, en su medición no se considera la elastancia propia del esófago.
Estudios experimentales en modelos caninos de SDRA han demostrado una buena correlación entre los cambios de la Ppl (valores relativos) y la Pes para diversas regiones del pulmón58. Los autores sugieren monitorizar la Ptp con el uso de la Pes solamente en determinadas situaciones clínicas (paciente obeso o con hipertensión abdominal, con SDRA grave y Pm >30 cmH2O). Actualmente, solamente existen escasas publicaciones que evalúan su empleo habitual en el paciente ventilado62,63.
8Volúmenes pulmonares8.1Volumen corrienteLa limitación del Vc y del volumen minuto (Vc x frecuencia respiratoria) ha sido objeto de discusión e investigación en la última década debido a su relación con la generación de daño inducido por VM. La recomendación para pacientes adultos, basada en múltiples estudios, es limitar el Vc de 6 a 8ml/kg de peso corporal ideal, independientemente de la patología. En pediatría no existe evidencia en relación con esto; sin embargo, se sugiere imitar esta conducta, con el objetivo de disminuir el reclutamiento-desreclutamiento asociado con el uso de volúmenes altos, y la consecuente liberación de mediadores proinflamatorios.
8.2Volumen pulmonar de fin de espiraciónEl volumen pulmonar de fin de espiración (end-expiratory lung volume, EELV) corresponde a la CRF en presencia de PEEP. Se evalúa en la fisiología clásica con la dilución de helio, técnica que es su estándar de oro; sin embargo, es compleja y no está ampliamente disponible. La tomografía computarizada de tórax es probablemente el estándar para medirlo en el paciente en VM. Otro método alternativo es el lavado de nitrógeno “modificado”64.
Sus aplicaciones clínicas potenciales están en la evaluación del reclutamiento alveolar65 y el uso de una ventilación protectora66,67.
Es importante recordar que la PEEP promueve el reclutamiento del tejido pulmonar no aireado, y por tanto incrementa el EELV, pero esto debe diferenciarse de la distensión de unidades alveolares ya ventiladas. Por consiguiente, en un pulmón con un bajo potencial de reclutamiento, el incremento del PEEP producirá sobredistensión del tejido alveolar. En cambio, en un paciente con un alto potencial de reclutamiento frente a un incremento del EELV, el Vc se distribuirá de forma más homogénea en el tejido alveolar con la consiguiente limitación del estiramiento (ventilación protectora). Así, un método para evaluar la cantidad de pulmón reclutado podría mejorar el manejo ventilatorio del paciente, adaptando el PEEP a sus necesidades individuales.
Debido a razones principalmente técnicas, la medición de EELV no se monitoriza rutinariamente en la práctica clínica.
8.3Agua extravascular pulmonarEl edema pulmonar puede ser cuantificado mediante la medición del agua extravascular pulmonar (extravascular lung water, EVLW). El líquido extravascular puede estar presente en el intersticio y el compartimiento alveolar.
Se debe considerar que la sobrecarga de fluidos es un factor de riesgo de mortalidad en el niño críticamente enfermo68; por tanto, el uso de una herramienta que permita detectar y cuantificar la existencia de edema pulmonar puede ser ventajoso.
El EVLW puede medirse y monitorizarse al lado de la cama del paciente por medio de la técnica de termodilución transpulmonar, la cual está incorporada en el sistema gasto cardíaco por análisis del contorno de la onda de pulso (PiCCO, pulse index contour cardiac output). Este sistema tiene la capacidad de medir pequeños incrementos (10-20%) del EVLW demostrando una alta exactitud, lo que permite detectar un edema pulmonar incipiente. El valor obtenido en el sistema PiCCO se indexa en relación con el peso corporal [EVLWI, extravascular lung water index (ml/kg)]. Su uso, en combinación con otros parámetros cardiovasculares y pulmonares, permite diferenciar entre un edema hidrostático y de permeabilidad.
Aún no se ha demostrado una correlación del EVLWI con hallazgos radiológicos de edema pulmonar, PaO2/FiO2 o DA-aO2.
En conclusión, la monitorización del EVLW tiene gran utilidad clínica en pacientes pediátricos que se benefician de terapias depletivas, como en el caso de SDRA69,70.
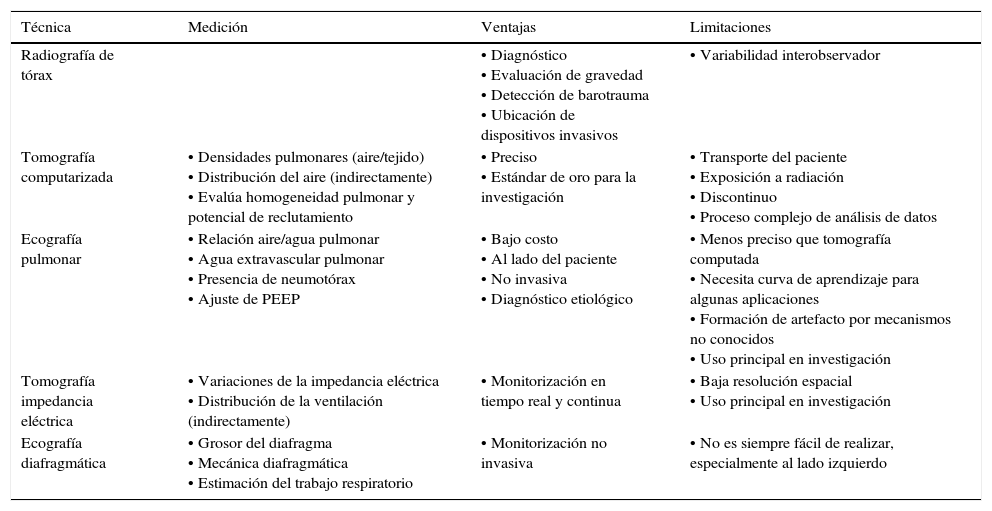
9Estudios de imagenEn la actualidad se cuenta con diversos estudios de imagen que facilitan el quehacer diario del equipo de intensivo. A continuación se describen aquellos más relevantes (tabla 8).
Fundamentos, ventajas y limitaciones de los estudios de imagen más relevantes a considerar en el paciente con ventilación mecánica
| Técnica | Medición | Ventajas | Limitaciones |
|---|---|---|---|
| Radiografía de tórax | • Diagnóstico • Evaluación de gravedad • Detección de barotrauma • Ubicación de dispositivos invasivos | • Variabilidad interobservador | |
| Tomografía computarizada | • Densidades pulmonares (aire/tejido) • Distribución del aire (indirectamente) • Evalúa homogeneidad pulmonar y potencial de reclutamiento | • Preciso • Estándar de oro para la investigación | • Transporte del paciente • Exposición a radiación • Discontinuo • Proceso complejo de análisis de datos |
| Ecografía pulmonar | • Relación aire/agua pulmonar • Agua extravascular pulmonar • Presencia de neumotórax • Ajuste de PEEP | • Bajo costo • Al lado del paciente • No invasiva • Diagnóstico etiológico | • Menos preciso que tomografía computada • Necesita curva de aprendizaje para algunas aplicaciones • Formación de artefacto por mecanismos no conocidos • Uso principal en investigación |
| Tomografía impedancia eléctrica | • Variaciones de la impedancia eléctrica • Distribución de la ventilación (indirectamente) | • Monitorización en tiempo real y continua | • Baja resolución espacial • Uso principal en investigación |
| Ecografía diafragmática | • Grosor del diafragma • Mecánica diafragmática • Estimación del trabajo respiratorio | • Monitorización no invasiva | • No es siempre fácil de realizar, especialmente al lado izquierdo |
PEEP: presión positiva al final de la espiración.
Se recomienda el uso de esta técnica para apoyar el diagnóstico, evaluar la progresión clínica y detectar situaciones adversas como desplazamiento del TET y verificación de la posición de vías centrales, sondas de alimentación, entre otros18.
9.2Ecografía pulmonarEl ultrasonido es una herramienta no invasiva, no ionizante, útil para la evaluación de la patología pulmonar en tiempo real al lado de la cama del paciente71–73.
Recientemente, se ha incrementado su uso en niños para el estudio de patologías del pulmón, pleura y diafragma. La ventaja en este grupo de pacientes se origina en la falta de osificación, tanto de cartílagos costales y esternón, y en la menor capa de tejido adiposo subcutáneo, proporcionando de esta manera una ventana acústica ideal72–74.
Destaca frente a la radiografía básicamente por la ausencia de radiaciones ionizantes, la accesibilidad de los equipos y la valoración en tiempo real. En cuanto a la clínica, se ha descrito su superioridad sobre la radiografía para el diagnóstico75 y cuantificación76 de neumotórax.
En pacientes con SDRA, adultos y pediátricos, se ha utilizado para evaluar reclutamiento pulmonar77,78; sin embargo, una limitación relevante es que no permite reconocer la hiperinsuflación pulmonar, por lo cual no debe ser empleada como un método exclusivo para la titulación del PEEP77.
9.3Tomografía computarizadaSu utilidad clínica consiste en guiar una estrategia protectora para la VM en pacientes con falla respiratoria grave, permitiendo evaluar la magnitud de la superficie disponible para el intercambio gaseoso79 y el potencial de reclutamiento alveolar.
Según los expertos, la TAC aún debe considerarse el estándar de oro para la investigación pero no para el uso clínico rutinario, dadas las limitaciones prácticas que implica80, como el alto costo, la falta de disponibilidad, la mayor radiación y la dificultad para el transporte del paciente fuera de la unidad81.
9.4Tomografía de impedancia eléctricaLa tomografía de impedancia eléctrica (TIE) es una herramienta que permite una monitorización no invasiva y en tiempo real mediante el uso de imágenes que representan cambios de impedancia (ΔZ) regional pulmonar, que están directamente correlacionadas con cambios regionales de volumen (ΔZ≈Vc)82. Los datos son obtenidos desde un cinturón con electrodos instalado a nivel torácico, produciendo una imagen que representa las áreas en las cuales ocurrió un cambio de impedancia. Así, mediante criterios topográficos, el clínico puede diferenciar entre regiones no aireadas e hiperinsufladas, lo que permite evaluar tanto la efectividad de una maniobra de reclutamiento alveolar83,84 como la ventilación protectora (evidenciado en modelos animales con SDRA) y monitorizar la redistribución del Vc85, logrando así un ajuste dinámico de la terapia ventilatoria.
En la actualidad persisten problemas derivados de la variabilidad anatómica de la caja torácica, su baja resolución espacial, el hecho de evaluar solo un nivel del tórax y cómo transformar la impedancia en una señal de volumen. No obstante, se espera que, en un futuro, su uso en la clínica permita emplearla como una herramienta tanto cualitativa (visualizar la ventilación regional) como cuantitativa (estimar el impacto terapéutico) en el paciente pediátrico mecánicamente ventilado.
10BiomarcadoresSi bien es conocido el uso de la broncoscopia con lavado broncoalveolar (LBA) para propósitos de estudio y rescate bacteriológico en el paciente con SDRA86, la evaluación citológica y de biomarcadores de inflamación, coagulación y fibrinólisis está generalmente reservada para investigación clínica87–89. No siempre es posible efectuar un LBA, pues se requiere entrenamiento y se puede asociar con el desarrollo de hipoxemia o inestabilidad hemodinámica.
Se han sugerido diversas proteínas como marcadores en pacientes con SDRA87,90,91, empleando niveles sistémicos de proteínas pulmonares como marcadores de inflamación alveolar, y describiendo su correlación con el pronóstico92 y daño inducido por VM93. Asimismo, ciertos mediadores de activación endotelial como la angiopoyetina-2 (Ang-2) y el factor von Willembrand (FvW) se han descrito como marcadores de susceptibilidad y gravedad94. Por último, cabe mencionar que los niveles de fibrocitos en el LBA se han correlacionado con el pronóstico del paciente95.
En la actualidad, el uso de biomarcadores que entreguen información confiable para estratificar riesgo, ayudar al diagnóstico, entregar información pronóstica y guiar el manejo clínico se encuentra en plena etapa de investigación96.
Con base en lo anterior, se pueden concretar las siguientes conclusiones:
- •
Cada paciente ingresado a una unidad de cuidados intensivos requiere de monitorización respiratoria. El tipo a emplear dependerá de la patología y fisiopatología que lo caracterice.
- •
El médico debe conocer el potencial y la limitación de cada técnica y maniobra de monitorización, con el objetivo de elegir la más adecuada para cada paciente.
- •
En el caso de necesitar soporte ventilatorio, una oportuna y adecuada monitorización debe considerarse como la forma de lograr individualizar la prescripción, y debe ser de carácter multimodal dada la superposición de fenómenos fisiológicos.
- •
Se recomienda la utilización de la relación PaO2/FiO2 para diagnosticar SDRA pediátrico en pacientes conectados a VMNI. Si no se encuentra disponible, se sugiere el uso de la SatO2/FiO2. En el caso de pacientes en VM invasiva, se recomienda el empleo del IO por sobre la PaO2/FiO2 como métrica primaria de gravedad para definir el SDRA pediátrico. Si este no está disponible, se aconseja el uso del ISO para estratificar el riesgo.
- •
Se recomienda la monitorización continua del Vc exhalado y de la presión inspiratoria (PIM en modos presométricos y Pm en volumen control) durante la VM invasiva en niños con SDRA, para prevenir la ventilación nociva. Esta última debe interpretarse con cautela en pacientes con sospecha de distensibilidad torácica anormal o ventilación espontánea.
- •
Se sugiere la monitorización continua del Vc exhalado y de la presión inspiratoria, además de la entrega de oxígeno, Csr y hemodinamia a medida que se incrementan los niveles de PEEP. Asimismo, se debe considerar la ΔP, ya que tiene relación directa con el daño inducido por VM.
- •
Finalmente, no existe ninguna modalidad de monitorización que mejore por sí sola el pronóstico del paciente, pues este dependerá de un adecuado tratamiento basado, a su vez, en la correcta utilización de la información recibida.
Los autores declaran no tener ningún conflicto de intereses.