El síndrome de cascanueces causado por la compresión de la vena renal izquierda entre la aorta y la arteria mesentérica superior es una causa no glomerular de sangrado renal y varicocele izquierdos. También ha sido reconocido como una causa importante de proteinuria ortostática.
Caso clínicoAdolescente masculino de 17 años de edad con un cuadro de hematuria recurrente. En el examen físico se observó varicocele izquierdo. Índice de masa corporal de 16.3 kg/m2. El examen de orina mostró hematuria y proteinuria masiva. La biopsia renal evidenció proliferación mesangial glomerular leve. El estudio de cistoscopia mostró el origen de la hematuria en el uréter izquierdo. La ultrasonografía Doppler y la angiotomografía de contraste revelaron velocidad pico de la vena renal izquierda de 20cm/s, relación del índice de flujos de la vena renal izquierda de su porción aortomesentérica e hiliar de 7.7 y agrandamiento de la vena renal izquierda en la porción hiliar. Con el diagnóstico de síndrome de cascanueces se decidió proporcionar tratamiento conservador. En los meses siguientes mostró disminución importante de los episodios de hematuria recurrente, y se observó remisión de las manifestaciones clínicas y de las alteraciones en el examen de orina. A los 13 meses de evolución el índice de masa corporal fue de 19 kg/m2.
ConclusionesEste caso clínico muestra la relación entre el incremento en la masa corporal y la remisión del síndrome de cascanueces manifestado como presencia de varicocele izquierdo, hematuria y proteinuria graves. Los síntomas desaparecieron al incrementar el índice de masa corporal, probablemente debido a un aumento en la grasa retroperitoneal que mejoró el ángulo aortomesentérico de la vena renal izquierda.
Nutcracker syndrome caused by compression of the left renal vein between the aorta and superior mesenteric artery is a non-glomerular cause of left renal bleeding and left varicocele. It has also been recognized to be an important cause of orthostatic proteinuria.
Case reportA 17-year-old male was evaluated due to recurrent macroscopic hematuria. Physical examination showed left varicocele. Body mass index 16.3 kg/m2. Urinalysis demonstrated hematuria and massive proteinuria. Renal biopsy showed mild mesangial glomerular proliferation. Cystoscopy showed hematuria originating from the left ureter. Doppler ultrasonography and contrast-enhanced computed angiotomography revealed a peak velocity of the left renal vein of 20cm/s, ratio of peak velocity of aortomesenteric and hilar portions of left renal vein of 7.7 and enlargement of the left renal vein in the hilar portion. With a diagnosis of nutcracker syndrome, the patient received conservative treatment. During follow-up, progressive remission of the recurrent episodes of hematuria and proteinuria was observed. The patient had no clinical symptoms or abnormal urinalysis. At 13 months of follow-up the body mass index was 19 kg/m2.
ConclusionsThis case shows the relationship between the increase in body mass index and remission of nutcracker syndrome, manifested as left varicocele, hematuria and massive proteinuria. All symptoms disappeared with the increase of body mass index, probably due to increase in retroperitoneal fat with improvement of the aortomesenteric angle of the left renal vein.
El síndrome de cascanueces se caracteriza por la compresión extrínseca de la vena renal izquierda, lo que impide su drenaje sanguíneo normal en la vena cava inferior. En la mayoría de los pacientes se produce por la compresión de la vena renal izquierda, entre la arteria aorta y la arteria mesentérica superior. Esta variante se ha denominado síndrome de cascanueces anterior. Con menor frecuencia la vena renal izquierda se encuentra en posición retroaórtica, por lo que ocurre la compresión entre la aorta y el cuerpo de la vértebra; esta variante recibe el nombre de síndrome de cascanueces posterior1–3.
La manifestación clínica característica es la hematuria, que puede ser microscópica o, más frecuentemente, macroscópica, sobre todo después de permanecer en posición de pie o después de realizar ejercicio. Otras manifestaciones incluyen proteinuria ortostática, la combinación de hematuria y proteinuria, dolor en región pélvica y varicocele izquierdo4–7.
En este trabajo se presenta el caso de un adolescente con síndrome de cascanueces manifestado, principalmente, como episodios de hematuria y proteinuria recurrente.
2Caso clínicoPaciente masculino de 17 años de edad con hematuria y proteinuria. Fue referido para descartar enfermedad glomerular.
Presentó episodios repetidos de hematuria desde 8meses antes de su ingreso, sin síntomas agregados al inicio. Cuatro meses después se añadieron sensación de fatiga y palidez cutánea grave. Fue atendido en otra institución donde se comprobó anemia grave (con valor de hemoglobina de 5.5g/dl), por lo que se indicó manejo con hierro intravenoso y transfusión sanguínea.
Durante el interrogatorio, el paciente refirió haber presentado pérdida de peso de aproximadamente 6kg durante el último año sin una razón aparente, antes del inicio de las manifestaciones clínicas; sin antecedentes familiares, patológicos o ambientales de importancia para el padecimiento actual.
A su ingreso pesó 45.7kg (percentil menor del 3%), talla 167cm (percentil 13%), índice de masa corporal (IMC) 16.3kg/m2, presión arterial 115/76mm Hg. Al examen físico se observó varicocele izquierdo.
Los resultados de los exámenes de laboratorio fueron los siguientes. En sangre: hemoglobina 14.2g/dl, hematocrito 44%, reticulocitos 4%, microcitosis (+) e hipocromía (+); tiempos de coagulación normales; creatinina 0.8mg/dl, nitrógeno ureico 15mg/dl, ácido úrico 5.2mg/dl, calcio 8.7mg/dl, fósforo 4.4mg/dl, magnesio 1.9mg/dl, sodio 140 mmol/l, potasio 3.6 mmol/l, cloro 104mmol/l; glucosa 77mg/dl. Proteínas: totales 7.5g/dl, albúmina 4.2g/dl; colesterol 137mg/dl, triglicéridos 60mg/dl. Pruebas de función hepática normales. Los estudios inmunológicos fueron negativos e incluyeron anti-ADN, anticardiolipinas, c-ANCA, p-ANCA, factor reumatoide y Coombs directo. C3 90.4mg/dl, C4 13.7mg/dl.
Los exámenes en orina mostraron los siguientes resultados. Examen general de orina: pH de 6, densidad 1.030, albúmina (+++), hemoglobina (++++), eritrocitos incontables; relación calcio/creatinina 0.03; proteinuria en colección nocturna de 12h: 115mg/m2/h; relación proteinuria/creatinuria: 1.25.
La investigación de tuberculosis, BAAR, PPD y el cultivo de Mycobacterium tuberculosis dio resultados negativos.
El estudio de ultrasonografía renal mostró riñones de tamaño normal para la edad, sin imágenes de litos, quistes o ectasia.
Debido a la presencia de hematuria y proteinuria, se realizó biopsia renal percutánea. Esta mostró 12 glomérulos: uno de ellos con esclerosis global y los restantes con proliferación leve del mesangio glomerular, sin otras alteraciones. No se observaron lesiones tubulointersticiales ni vasculares; el estudio de inmunofluorescencia glomerular fue negativo.
Durante su internamiento, el paciente presentó hematuria macroscópica persistente, en ocasiones con expulsión de coágulos. Debido a esta evolución, se consideró que el paciente presentaba hemorragia persistente del riñón o vías urinarias, por lo que el estudio se dirigió a dilucidar la causa de la hemorragia.
Al realizar el estudio de cistoscopia, se observó que la hemorragia provenía del riñón izquierdo. El estudio de gammagrama con eritrocitos marcados mostró ligera hiperemia del riñón izquierdo en relación con el riñón derecho.
El nuevo estudio de ultrasonografía renal mostró la vena renal izquierda con un flujo de 20cm/s, en comparación con la vena renal derecha, de 25.9cm/s. Al medir el índice de flujos entre la porción aortomesentérica y la porción hiliar de la vena renal izquierda, se observó un valor de 7.7.
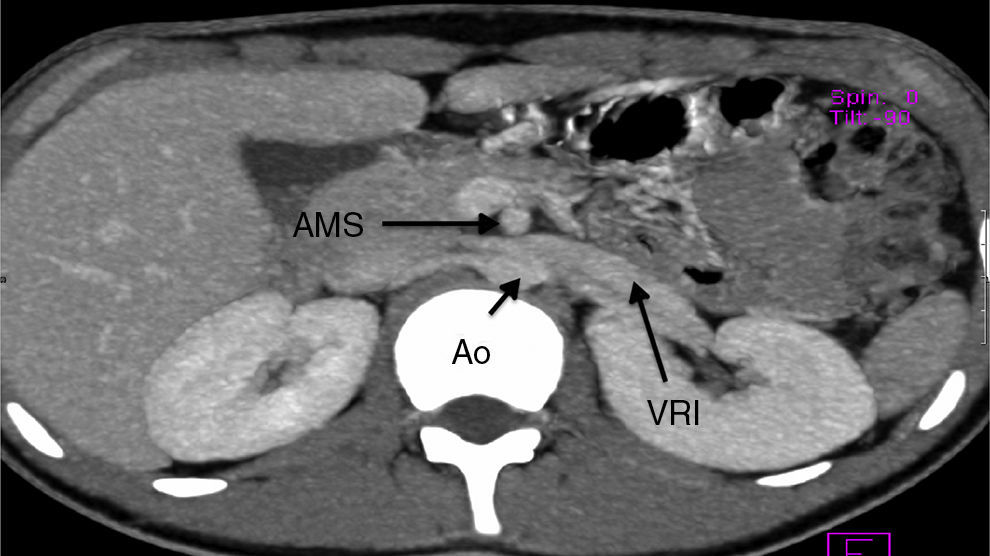
El estudio de angiotomografía del riñón y los vasos arteriales y venosos mostró un aumento en el diámetro de la vena renal izquierda en su porción distal (fig. 1). No se observaron datos indirectos de obstrucción en la segunda porción del duodeno.
Con el diagnóstico de síndrome de cascanueces y por la edad del paciente, se decidió mantener vigilancia sobre la evolución de la hematuria y proteinuria, sin realizar ninguna intervención quirúrgica. Se indicó tratamiento con ácido fólico y sulfato ferroso. Se recomendó incrementar el aporte calórico y mantener el aporte proteico adecuado con el fin de mejorar el estado nutricional.
En la visita de control, 6meses después de su internamiento, refirió espaciamiento de los episodios de hematuria macroscópica, sin dolor, presentes sobre todo después de realizar ejercicio físico. En este momento la creatinina sérica se mantenía con valores de 0.8mg/dl y el examen general de orina mostró pH de 7, densidad 1.010, albúmina (+) y hemoglobina (+++). Entonces se decidió indicar tratamiento con enalapril en dosis bajas (2.5mg/12h).
Se realizó nuevo estudio ultrasonográfico que mostró una disminución del índice de los segmentos aortomesentérico e hiliar de la vena renal izquierda de 5.1. Esto indicó aumento del flujo distal de la vena renal izquierda con respecto al valor previo. Además, el examen físico mostró aumento del IMC a 17.8kg/m2.
Tres meses después se encontró asintomático, sin evidencia de episodios de hematuria durante este periodo. El examen general de orina mostró pH de 6, densidad 1.015, sin proteinuria y sin hematuria. Se decidió suspender el enalapril, y continuar su tratamiento con sulfato ferroso.
En su último control, 4meses después (13 meses después de su internamiento), el paciente refirió no haber presentado nuevos episodios de hematuria macroscópica en los últimos 7meses. Los estudios en sangre mostraron hemoglobina 16.8g/dl, hematocrito 49.7%; volumen corpuscular medio y hemoglobina corpuscular media, normales. El examen de orina no mostró proteinuria o hematuria. Se documentó un IMC de 19kg/m2.
3DiscusiónSe ha propuesto que el síndrome de cascanueces ocurre como consecuencia del curso anómalo de la vena renal izquierda, la cual se encuentra en una porción más arriba de lo habitual, o una ramificación, también anómala, de la arteria mesentérica superior al emerger de la aorta1.
La edad de los pacientes puede variar, desde la niñez hasta la séptima década de la vida, aunque la mayoría presentan las manifestaciones clínicas en la segunda o tercera décadas de la vida, como ocurrió en el paciente aquí estudiado1.
En este paciente el diagnóstico de síndrome de cascanueces se estableció con base en las manifestaciones clínicas de un cuadro de hematuria macroscópica recurrente, e incluso persistente entre algunos episodios de la recurrencia, la demostración de la hematuria proveniente del uréter izquierdo, varicocele del lado izquierdo y los hallazgos tanto del estudio de ultrasonografía renal como de la angiotomografía.
Los episodios de hematuria correspondieron a cuadros calificados como hemorragia, ya que se acompañaban de la presencia de coágulos, y no como hematuria glomerular donde, en vez de coágulos, se observan cilindros eritrocitarios (no presentes en la orina de este paciente). Debido a la presencia de hematuria y proteinuria concomitante se decidió realizar una biopsia renal percutánea que mostró proliferación leve del mesangio glomerular y área tubulointersticial normal. Se ha considerado que en el síndrome de cascanueces, a consecuencia del aumento de la presión retrógrada en el sistema venoso renal izquierdo, se forman venas varicosas de paredes delgadas en la zona de la pelvis renal, cuya rotura produce los episodios de hemorragia característicos de esta entidad7. Además, el estudio cistoscópico mostró la salida de orina hematúrica a través del uréter del lado izquierdo.
Durante el seguimiento, el paciente refirió que los episodios de hematuria macroscópica se producían, sobre todo, después de realizar ejercicio. A este respecto se ha postulado que durante la posición de pie ocurre proptosis visceral, lo cual estrecha aún más el ángulo entre la arteria mesentérica superior y la aorta, incrementándose de esta manera la respuesta hemodinámica característica de este síndrome2.
Los episodios de hematuria se acompañaron de proteinuria en rango nefrótico (se considera proteinuria en colección nocturna de orina de 12h en rango nefrótico al valor>40mg/m2/h), pero sin hipoalbuminemia ni hiperlipidemia concomitantes. Esta última también se ha explicado por el incremento de la presión en la vena renal izquierda asociado con el aumento en la liberación de norepinefrina y angiotensina ii, inducido por modificaciones en la hemodinámica renal durante la posición de pie o con el ejercicio2,8.
Otras manifestaciones clínicas del síndrome de cascanueces incluyen dolor en el abdomen o flanco izquierdo, que ocasionalmente se irradia al muslo o región glútea y que se exacerba con la posición sentada, en la posición de pie o con el ejercicio1. Puede, además, observarse varicocele izquierdo hasta en el 5-9.5% de los pacientes varones1,9. El paciente estudiado presentó varicocele izquierdo, asintomático hasta el momento de su último control. El varicocele es causado por el aumento de la presión de la vena renal izquierda a consecuencia de la obstrucción, que condiciona un flujo retrógrado de esta vena hacia la vena espermática izquierda10.
La biopsia renal del paciente estudiado presentó proliferación mesangial glomerular leve, con examen de inmunofluorescencia negativo para todos los reactantes. Se ha postulado la probabilidad de que la proliferación mesangial sea causada por la sobrecarga macromolecular ortostática, con alteración acentuada de la microcirculación glomerular incrementada por efecto de la angiotensina ii8.
Este paciente presentó pérdida de peso en el último año, antes de la aparición de los episodios de hematuria recurrente. A este respecto, en algunos estudios se ha observado que el IMC bajo se correlaciona positivamente con el síndrome de cascanueces, y que las manifestaciones clínicas pueden presentarse después de la pérdida de peso1. En este sentido, se ha postulado que la reducción en el contenido graso retroperitoneal puede reducir aún más el ángulo aortomesentérico e inducir las manifestaciones clínicas del síndrome de cascanueces1.
Estas consideraciones podrían explicar por qué el paciente estudiado mejoró su sintomatología clínica a medida que mejoró su IMC, ya que se ha especulado que la compresión aortomesentérica de la vena renal izquierda puede mejorar con el desarrollo físico, especialmente el incremento del IMC en niños11,12.
Se ha recomendado que en todo niño con hematuria persistente o recurrente de causa desconocida se debe llevar a cabo el estudio de ultrasonografía renal con Doppler13. Con relación a los resultados de la ultrasonografía renal, Shin y colaboradores informaron del estudio de 15 niños con síndrome de cascanueces y compararon la velocidad pico por examen de ultrasonografía Doppler con 15 niños sanos; encontraron que en la porción proximal o hiliar de la vena renal izquierda en los niños con síndrome de cascanueces la velocidad pico fue en promedio de 21.99±5.47cm/s, en tanto que en el grupo control el valor promedio fue de 27.18±5.34cm/s. Asimismo, al examinar la relación entre las velocidades de flujo de la porción aortomesentérica y la porción hiliar de la vena renal izquierda, se observó en casi todos los niños con síndrome de cascanueces un valor mayor de 4.812.
Lo anterior se ha interpretado en el sentido de que la compresión de la vena renal izquierda entre la arteria mesentérica superior y la aorta causa dilatación de la vena renal izquierda en su porción distal o hiliar y reducción de la velocidad pico en esta porción venosa12. En el paciente estudiado se observó una velocidad pico de 20cm/s en la porción distal de la vena renal izquierda (menor a la observada en la vena renal derecha), lo cual, probablemente, se debió a la obstrucción proximal de la vena renal izquierda. Asimismo, la relación entre las velocidades de flujo de la porción aortomesentérica y la porción hiliar de la vena renal izquierda fue mayor al valor de corte señalado por Shin y colaboradores12.
Los hallazgos del estudio de angiotomografía no fueron concluyentes pues, aunque se observó aumento del diámetro de la vena renal izquierda en su porción distal, los intentos para validar el diámetro normal de la vena renal izquierda en su porción distal no han sido exitosos debido a que la dilatación de la vena renal izquierda puede ser una variante normal1.
El manejo del síndrome de cascanueces se puede dividir en tratamiento conservador, e intervencionista o quirúrgico.
Aunque no se ha definido claramente la historia natural del síndrome de cascanueces, en niños se ha descrito la resolución espontánea del mismo, algunas veces después de varios años de persistencia11,14.
En los pacientes jóvenes (menores de 18 años de edad) se recomienda el tratamiento conservador. A este respecto se ha observado que con el desarrollo físico aumenta el depósito de tejido graso y fibroso en el origen de la arteria mesentérica superior, lo cual puede atenuar la compresión de la vena renal izquierda. Por otro lado, pueden ocurrir cambios en las proporciones anatómicas vasculares asociadas con el crecimiento corporal1. Asimismo, la formación de venas colaterales puede favorecer la disminución de la presión en la vena renal izquierda2.
También se ha informado que la administración de un inhibidor de la enzima convertidora de angiotensina puede mejorar la proteinuria ortostática asociada con el síndrome de cascanueces, la cual, como se ha mencionado, probablemente depende de la acción o liberación aumentada de angiotensina ii8. El paciente aquí estudiado recibió tratamiento con enalapril, un inhibidor de la enzima convertidora de angiotensina, durante corto tiempo, por lo cual no es posible valorar su efecto benéfico en la evolución del cuadro clínico.
Por otro lado, cuando los síntomas de la hematuria y proteinuria se agravan durante el periodo de observación del manejo conservador (6-24 meses), debe considerarse la indicación de una intervención quirúrgica o intervencionista, aunque el paciente sea menor de 18 años de edad. Los métodos de tratamiento incluyen desde la colocación de un stent en la zona estrecha de la vena renal izquierda hasta procedimientos quirúrgicos para la transposición de la vena renal izquierda a una porción más distal de la vena cava inferior o la transposición de la arteria mesentérica superior, aplicación de una derivación de la vena renal izquierda y reanastomosis a la vena cava inferior y autotrasplante renal2,15–17.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.