Hace algunos años, el motivo principal para la solicitud del diagnóstico parasitológico era la sospecha de una etiología de base parasitaria. En la actualidad, el motivo de consulta y la solicitud del diagnóstico se encuentran asociados con una comorbilidad hemato-oncológica, autoinmune, inmunodeficiente o una condición postrasplante.
MétodoSe analizaron los resultados del laboratorio de parasitología clínica del Hospital Infantil de México Federico Gómez de enero de 1990 a diciembre del 2010, para obtener la frecuencia y distribución de parásitos y comensales por año y década.
ResultadosSe analizaron 211,600 muestras del periodo estudiado, con una media anual de 10,100 y desviación estándar de 3,500. El porcentaje de parásitos y comensales fue del 37.73%, y la frecuencia de positividad solo a parásitos fue del 21.4%. La diferencia de proporciones entre décadas resultó significativa, con una p<0.0001.
ConclusionesLa tendencia en el comportamiento de las parasitosis intestinales durante el periodo estudiado mostró un cambio tanto en frecuencia como en género y especie de los agentes reportados. La generación de información de carácter epidemiológico es necesaria para conocer la tendencia de las parasitosis y de sus variaciones a través del tiempo.
In recent years, the main reason for parasitological diagnosis was suspicion of a parasitic etiology. Currently, diagnosis and consultation are associated with co-morbidity with a hemato-oncological, autoimmune, immunodeficiency or post-transplant condition.
MethodsResults collected from the Parasitology Laboratory of the Hospital Infantil de Mexico Federico Gómez from January 1990 to December 2010 were analyzed to determine the frequency and distribution of parasites and commensals per year and decade.
ResultsThere were 211,600 samples analyzed with a statistical media of 10,100 and a standard deviation of 3,500 samples. Percentage of observations for parasitic structures as well as commensals was 37.73% according to Pearson Chi square with a significant difference among percentages between decades (p<0.0001).
ConclusionsBehavioral tendency of intestinal parasitosis during the last two decades shows a change in frequency and genera from the agents that were reported at this pediatric health care level. The processing of epidemiologic information is important in order to determine the response of the parasitosis and its variations over time.
En la década de los 80, las publicaciones en México informaban de la prevalencia de las protozoosis intestinales, que iban desde el 14.9% en el estado de Puebla1 hasta el 70% en una zona suburbana del Distrito Federal2. Dicha variabilidad se encontraba en función de la zona socioeconómica, el tamaño de la muestra por estudio, la población de estudio, etcétera. Del total de niños que asistieron a consulta en el Hospital Infantil de México Federico Gómez (HIMFG) entre 1990 y 1994 por sospecha de parasitosis, y a quienes se les realizaron los exámenes coproparasitoscópicos de concentración, se mantuvo una cifra del 44.2% positivos para Giardia lamblia, lo cual colocó a dicho parásito como el de mayor frecuencia entre las parasitosis intestinales en ese momento3,4. Estos datos fueron muy similares a otros contemporáneos emitidos por otros hospitales de concentración del Distrito Federal.5
La distribución por edad de los pacientes positivos a Giardia en el HIMFG en 1992 fue la siguiente: el 21.4% en lactantes, el 41.7% en preescolares, el 27.9% en escolares y el 9% entre adolescentes. Cuando se estudió por parasitosis única o múltiple, el 60.8% se presentó como parasitosis única; en el 27% se asoció con otro parásito intestinal; y en el 12.2% se acompañó por comensales del tubo digestivo. Al analizar por separado un grupo de 183 niños, cuyo principal motivo de consulta fue dolor abdominal y diarrea, los resultados fueron superiores, con el 62.7% positivos para quistes de Giardia lamblia. Las frecuencias reportadas para otros parásitos intestinales a finales de los 80 y principios de los 90 en el laboratorio de parasitología del HIMFG fueron las siguientes: para Entamoeba histolytica, 6.8%; Ascaris lumbricoides, 18.1%; Strongyloides stercolaris, 2%; Hymenolepis nana, 15.9%; Trichuris trichiura, 10%; Uncinarias, 1.2%; y Enterobius vermicularis, 1.8%4. Sin embargo, Blastocystis hominis, un protozoario cuya taxonomía y patogenicidad aún generan controversia, se empezó a reportar como patógeno intestinal alrededor de 1995, y pronto desplazó del primer lugar en frecuencia a Giardia lamblia6–8. Otro grupo emergente de protozoosis fueron las coccidias intestinales encabezadas por Cryptosporidium sp., que fue reconocido como patógeno humano en 1976. A partir de entonces, se incrementó su reporte, particularmente en individuos inmunocomprometidos y brotes epidémicos por ingesta de agua contaminada. El VIH impactó su diagnóstico mostrando un aumento considerable9,10. Sin embargo, en el HIMFG, su reporte y asociación con cuadros diarreicos se incrementó hasta finales de los 9011,12.
Actualmente, el reporte de helmintiosis no ha desaparecido pero es eventual, con casos aislados de hymenolepiosis y ascariosis en el último año. El planteamiento anterior lleva a las siguientes preguntas: ¿existe una transición en el tipo y frecuencia de parasitosis? y ¿cuáles son los géneros que actualmente inciden en la población pediátrica del tercer nivel de atención a la salud?
El objetivo de este trabajo fue conocer la frecuencia de parásitos y comensales por año, así como documentar la existencia de una transición entre la incidencia de parásitos intestinales en un hospital pediátrico de tercer nivel de atención durante el periodo 1990-2010.
2Métodos2.1Universo de estudioEl universo de estudio se limitó al periodo comprendido entre el mes de enero de 1990 y diciembre del 2010, utilizando las bitácoras de trabajo y reporte del laboratorio de parasitología clínica del HIMFG. Se consideraron todos los resultados de las pruebas parasitológicas: técnica de microscopía directa, concentración por flotación de Ferreira 1:10, concentración por sedimentación de Ritchie, tinción de Kinyoun, Graham, amiba en fresco y Kato-Katz. Se consideró el reporte del género y especie del parásito, comensal o las asociaciones entre estos reportadas al momento del diagnóstico.
2.2Recolección y análisis de datosEl registro de resultados por paciente y por técnica de laboratorio se encuentra resguardado en bitácoras de reporte diario de pruebas que se conservan en el laboratorio de parasitología del HIMFG. Los datos se recabaron mediante el conteo y registro correspondiente para cada año. Los resultados de los parásitos reportados por año se capturaron y procesaron en una base de datos construida en Excel 2010 (Microsoft corp.) Entre los hallazgos del diagnóstico coproparasitoscópico siempre existe la posibilidad de encontrar organismos comensales, mismos que también fueron reportados en su momento al emitir el informe de diagnóstico por el laboratorio y que también se consideran y discuten en este trabajo. La estadística descriptiva se hizo con base en distribuciones de frecuencias del reporte de parásitos y comensales por año.
2.3Plan de análisisPara estimar la diferencia de proporciones entre las décadas estudiadas, se empleó el estadístico χ2 de Pearson, con un intervalo de confianza del 95% (IC 95%). Para comparar la diferencia de proporciones, se empleó el contraste de hipótesis, donde Ho fue por la igualdad de proporciones entre las décadas estudiadas y Ha a favor de su diferencia.
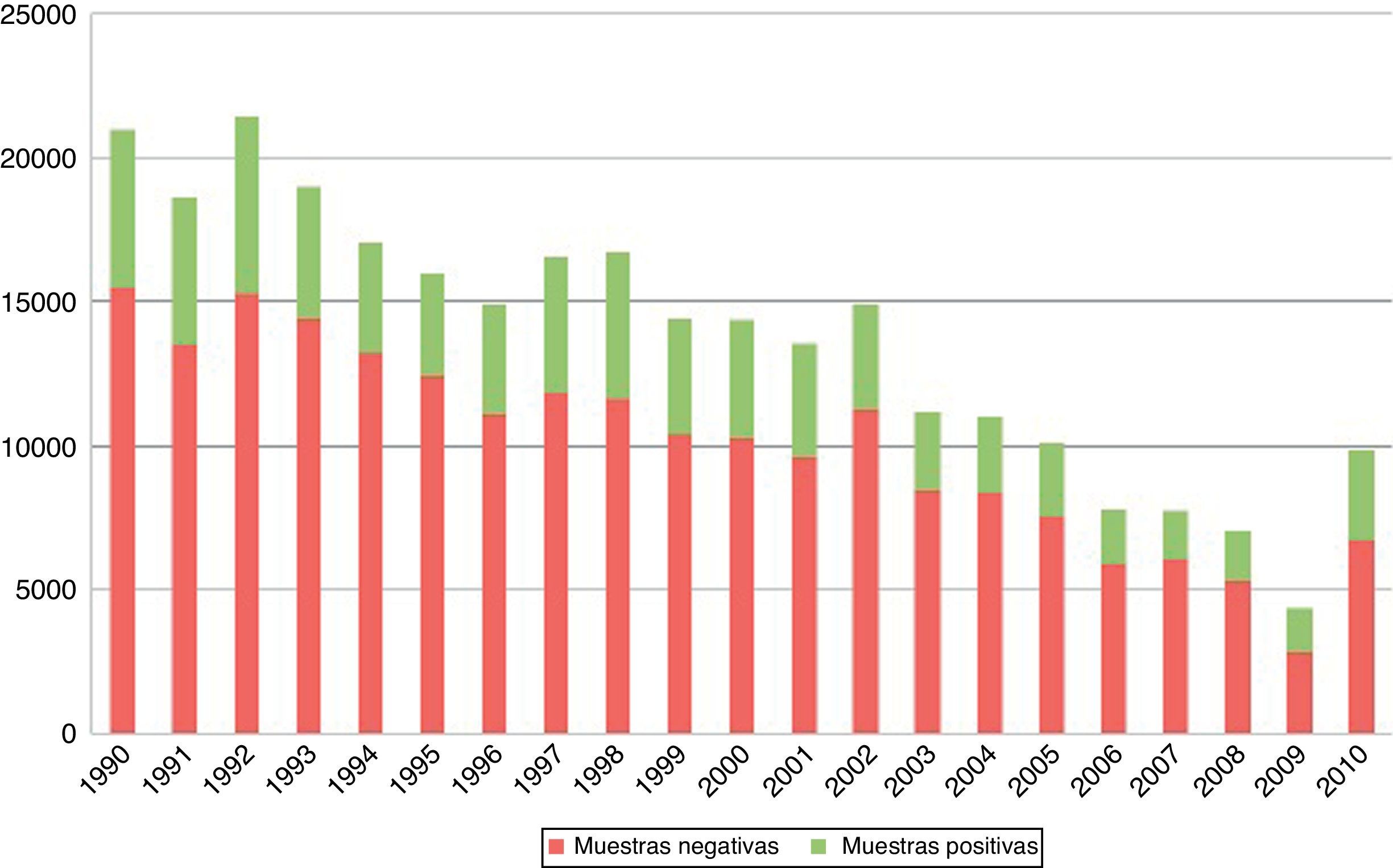
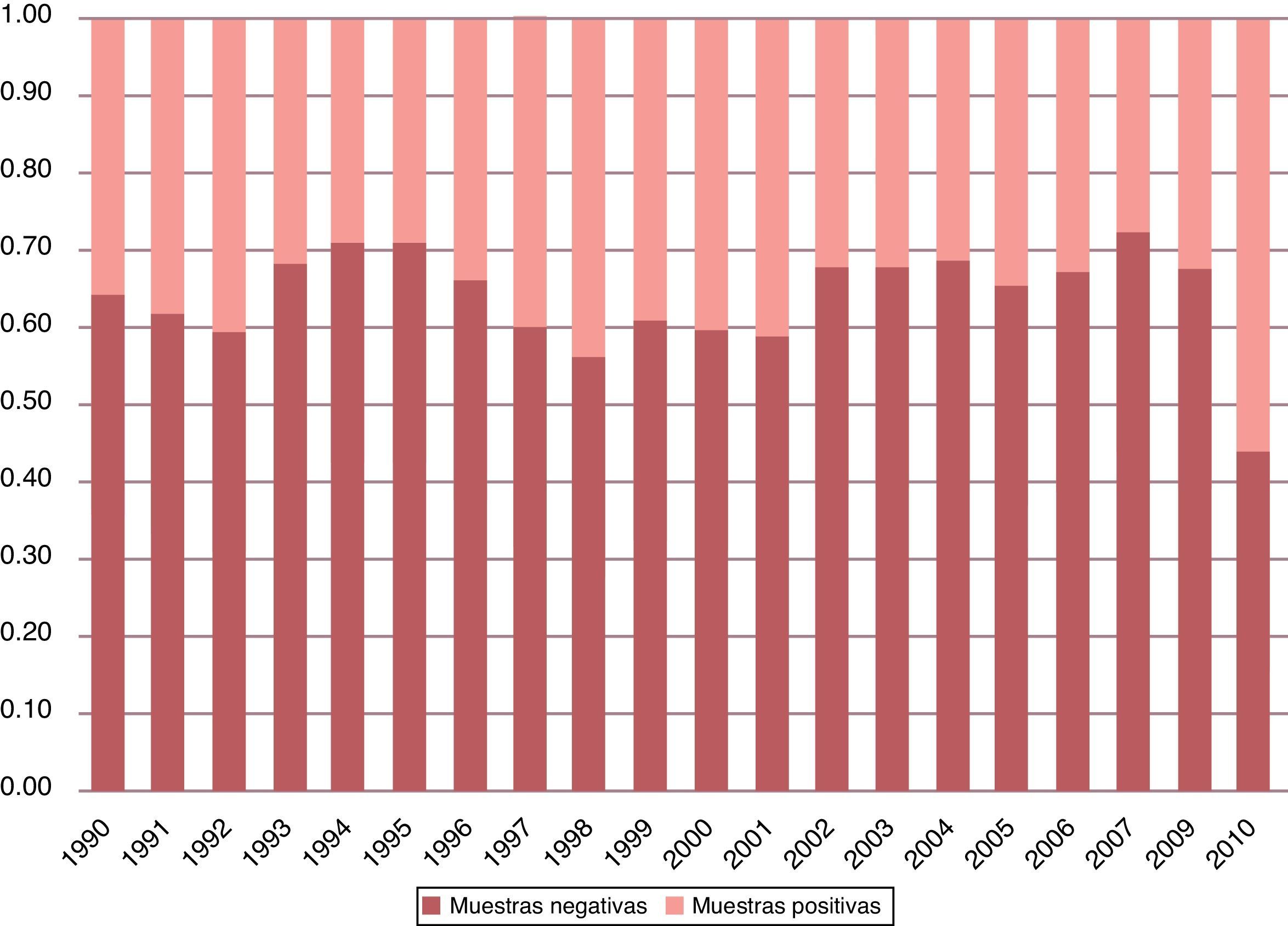
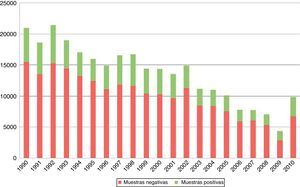
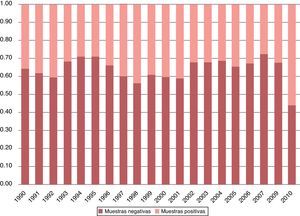
3Resultados3.1Diagnóstico parasitoscópicoConsiderando las dos décadas estudiadas, el total de muestras fue de 211,600. El promedio de muestras procesadas por año fue de 10,100, con una desviación estándar cercana a 3,500 (fig. 1). El porcentaje de observación de estructuras tanto parasitarias como comensales fue del 37.73% del total de muestras. El porcentaje de observación de solamente parásitos fue del 21.4% en las dos décadas (fig. 2).
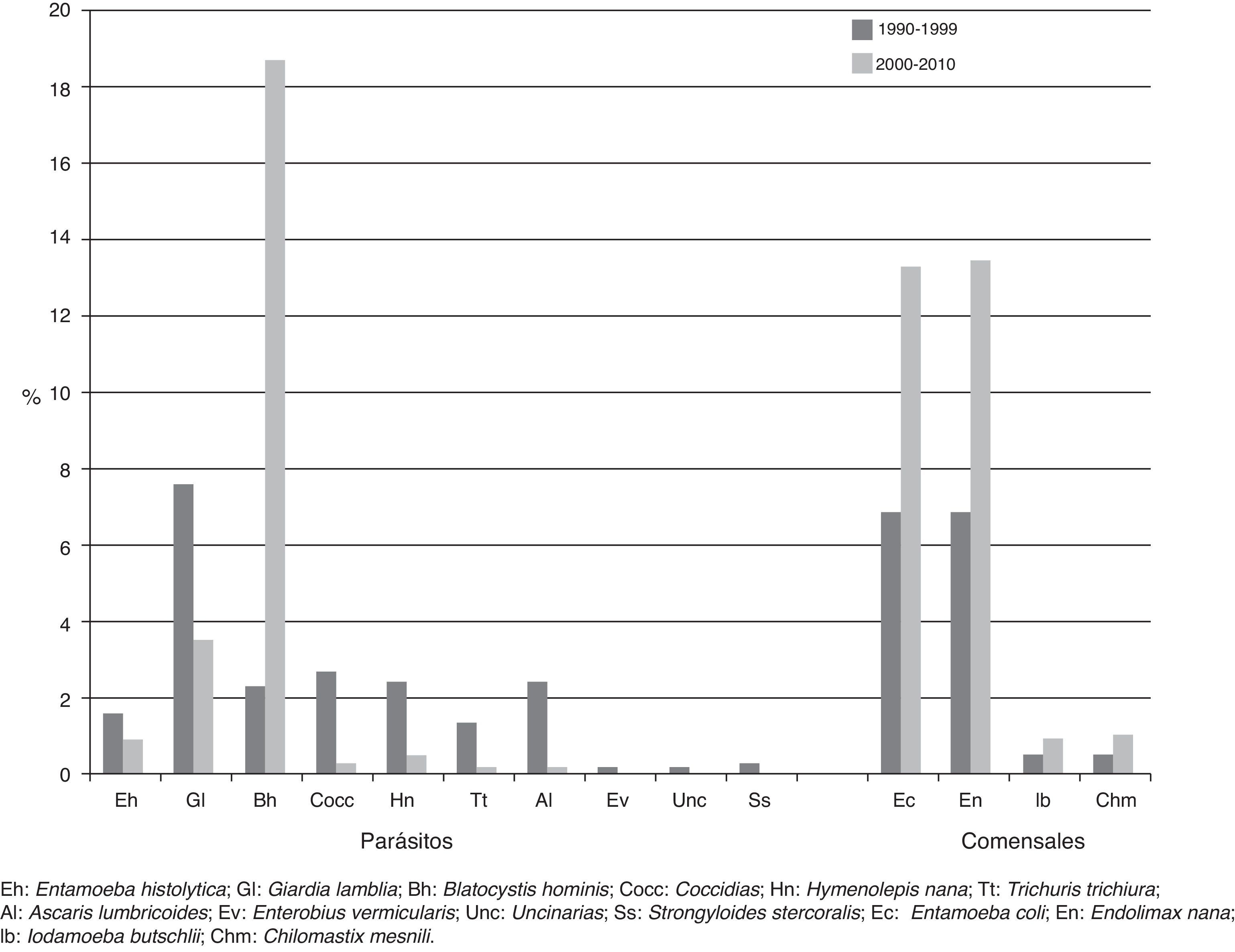
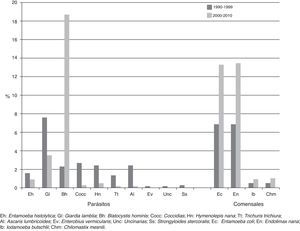
El protozoario parásito con mayor frecuencia fue Blastocystis hominis (21.8%), seguido por Giardia lamblia (17.3%), Cryptosporidium (5.4%), y por último Entamoeba histolytica (3.9%). Cabe señalar que el 73.7% del total de positividad a Cryptosporidium sp. se reportó entre 1996 y 1999. Hasta antes de 1998 no existían registros de Blastocystis hominis, pero la positividad ha presentado un incremento sostenido. Tanto así, que desplazó del primer lugar entre las protozoosis a Giardia lamblia a partir de 1999. Los comensales con mayor frecuencia fueron Endolimax nana (18.6%), Entamoeba coli (16.4%), Chilomastix mesnili (1.3%) y Iodamoeba buschtlii (1.09%) (fig. 3).
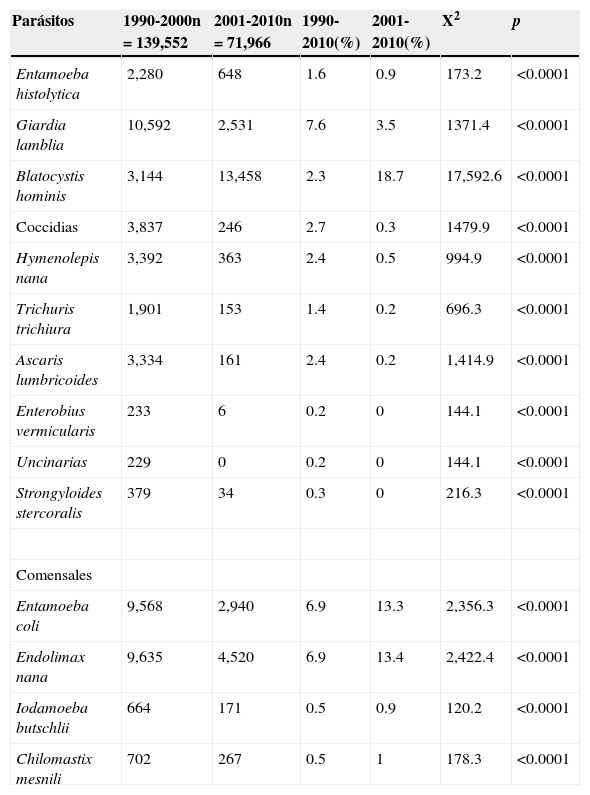
En cuanto a presentación de parasitosis única, se identificó en el 65% de los casos; el 13% estuvo asociado con otros parásitos y el 22% asociado con comensales. En cuanto a la distribución de parasitosis por sexo se encontró el 53% correspondiente al masculino. La positividad para platelmintos fue del 1.8%, y para los nematodos fue del 2.9%. Cabe señalar que el 99.4% de las cestodiosis se atribuyó al hallazgo de Hymenolepis nana, mientras que el 54.3% de las nematodiosis fue debida a Ascaris lumbricoides, seguido de Trichuris trichiura (32%). La mayor frecuencia para helmintos correspondió a Hymenolepis nana (4.9%), seguido de Ascaris lumbricoides (4.6%), Trichuris trichiura (2.7%), Strongyloides stercolaris (0.5%), Enterobius vermicularis (0.3%), Uncinarias (0.3%) y, en último lugar, Fasciola hepática (0.03%). Se debe resaltar que el 92.3% de positividad a helmintiosis lo aportó su recuento hasta el año 1999, para posteriormente mostrar un notable decremento. En la tabla 1 se muestra la estadística descriptiva por década, tipo de parasito o comensal.
Estadística descriptiva por década, tipo de parasito o comensal
| Parásitos | 1990-2000n=139,552 | 2001-2010n=71,966 | 1990-2010(%) | 2001-2010(%) | X2 | p |
|---|---|---|---|---|---|---|
| Entamoeba histolytica | 2,280 | 648 | 1.6 | 0.9 | 173.2 | <0.0001 |
| Giardia lamblia | 10,592 | 2,531 | 7.6 | 3.5 | 1371.4 | <0.0001 |
| Blatocystis hominis | 3,144 | 13,458 | 2.3 | 18.7 | 17,592.6 | <0.0001 |
| Coccidias | 3,837 | 246 | 2.7 | 0.3 | 1479.9 | <0.0001 |
| Hymenolepis nana | 3,392 | 363 | 2.4 | 0.5 | 994.9 | <0.0001 |
| Trichuris trichiura | 1,901 | 153 | 1.4 | 0.2 | 696.3 | <0.0001 |
| Ascaris lumbricoides | 3,334 | 161 | 2.4 | 0.2 | 1,414.9 | <0.0001 |
| Enterobius vermicularis | 233 | 6 | 0.2 | 0 | 144.1 | <0.0001 |
| Uncinarias | 229 | 0 | 0.2 | 0 | 144.1 | <0.0001 |
| Strongyloides stercoralis | 379 | 34 | 0.3 | 0 | 216.3 | <0.0001 |
| Comensales | ||||||
| Entamoeba coli | 9,568 | 2,940 | 6.9 | 13.3 | 2,356.3 | <0.0001 |
| Endolimax nana | 9,635 | 4,520 | 6.9 | 13.4 | 2,422.4 | <0.0001 |
| Iodamoeba butschlii | 664 | 171 | 0.5 | 0.9 | 120.2 | <0.0001 |
| Chilomastix mesnili | 702 | 267 | 0.5 | 1 | 178.3 | <0.0001 |
La tendencia en el comportamiento de las parasitosis intestinales a lo largo de las dos décadas estudiadas mostró cambios, tanto en la frecuencia como en los géneros y especies de los agentes, que se reportaron en este nivel de atención a la salud pediátrica. Estos cambios se pueden observar claramente en los gráficos de distribución de frecuencias. El cambio de parasitosis es evidente, tanto para protozoarios como para helmintos; en el caso de las protozoosis se observó un franco desplazamiento entre géneros y especies. Giardia lamblia —de ser el protozoario de mayor frecuencia reportada— pasó al segundo lugar cuando Blastocystis hominis fue reconocido como patógeno intestinal y se implementó su búsqueda intencionada a partir de la segunda mitad de los 9013–16. En el caso de Entamoeba histolytica, a pesar de que nunca mostró un número significativamente elevado, también ha registrado un decremento en su diagnóstico con la consideración actual, y en apego al criterio de la Organización Mundial de la Salud (OMS), de su reporte como Entamoeba histolytica/dispar y no solo como Entamoeba histolytica (como se hacía hasta principios de la década pasada)17–19. Este hecho evidencia que cada vez se puede establecer un mejor diagnóstico parasitario. Por ejemplo, para casos donde es deseable llegar hasta el nivel de especie y la morfometría no lo permite, se pueden utilizar técnicas actuales —con fundamento inmunológico o molecular— que permitirán la correcta identificación del parásito, para dar paso al adecuado tratamiento y control.
Las helmintiosis revelan que, incluso desde la década de los 90, ya no se encontraban entre las parasitosis más frecuentes. Mediante comunicación personal se sabe que en décadas previas ocupaban un lugar preponderante en el reporte del diagnóstico de este servicio, y en general en el país20–22. Desafortunadamente no se cuenta con esta evidencia documentada. En este estudio, el reporte de helmintos se reduce básicamente a casos aislados de ascariosis intestinal e hymenolepiosis, y la tendencia a la disminución de estos casos ha sido consistente hasta este momento.
Dicha transición parasitaria puede apoyarse en, al menos, tres hechos que se han ido sumando a lo largo de los años. Los dos primeros son atribuibles a políticas de salud desde que se consideraba a las parasitosis intestinales típicas (giardiosis, entamoebosis o helmintiosis) como problemas prioritarios de salud pública, y se implementaron estrategias en salud pública para abatirlas. Históricamente, el primer hecho que impactó operativamente en la población abierta fueron las campañas de desparasitación masiva a partir de la década de los 90,23–25 cuando se comenzó a ofrecer una sola dosis de antiparasitario a cada niño que se vacunaba durante las semanas nacionales de salud. Dicha acción ha tenido varias aristas, tanto a favor como en contra26,27. Con el tiempo, se ha podido demostrar que si bien las poblaciones de parásitos intestinales se abatieron, nunca se han eliminado del todo, y las poblaciones sobrevivientes, aunque disminuidas en cantidad, conservan su potencial reproductivo y han sido suficientes para mantenerse de forma endémica28. La siguiente política de salud de impacto en el control de las enteroparasitosis fue promovida a nivel mundial por la OMS a principios del 200029. La estrategia fue brindar educación para la salud de forma conjunta con la introducción de infraestructura sanitaria a zonas vulnerables, y por tanto endémicas para dichas parasitosis. En nuestro país, el programa de piso firme en contra de las geohelmintiosis ha tenido gran impacto en la incidencia y prevalencia de estas parasitosis30,31. El tercer argumento que podría justificar la transición parasitaria lo constituye el hecho de que este estudio se desarrolló en una institución de tercer nivel de atención. En este hospital, los pacientes referidos fueron depurados en los niveles de atención previos. En estos, las parasitosis intestinales típicas se filtran desde su diagnóstico hasta su tratamiento, de tal suerte que al llegar al tercer nivel en general se trata de hallazgos concomitantes al seguimiento de otras enfermedades de etiología diversa (que casi siempre salen del terreno de las enfermedades transmisibles para ocupar el de las crónico-degenerativas, oncológicas, genéticas o autoinmunes)32.
En otro orden de ideas, está documentado el incremento en la frecuencia de enfermedades no transmisibles en la población pediátrica, población blanco de la atención en este hospital, hecho que favorece las condiciones para el desarrollo de microorganismos oportunistas entre los cuales se encuentran algunos protozoarios, como las coccidias intestinales y las microsporidias33–35. Estos protozoarios tuvieron un auge en su frecuencia y reporte pero, al momento de este estudio, incluso mostraron una tendencia a la baja. Lo anterior se encuentra asociado con diversos factores, como la respuesta inmune celular de los pacientes que ha mejorado en función de la experiencia adquirida por los médicos en cuanto al manejo de fármacos antirretrovirales (caso particular del VIH), por lo que estas parasitosis son cada vez menos frecuentes36.
A pesar de que el diagnóstico parasitológico se debe realizar de manera rutinaria en las instituciones de nivel básico de atención, no deben descartarse las parasitosis en un tercer nivel. En este informe se demuestra que se identificaron estructuras tanto parasitarias como comensales en el 37.73% del total de muestras analizadas. El reporte de comensales en esta población no es menos importante ya que indica contaminación fecal en el entorno del paciente, por lo que deben emitirse recomendaciones para la vigilancia de las condiciones higiénico-dietéticas.
Es de suma importancia el conocimiento de la frecuencia y distribución de las parasitosis en la población pediátrica. Considerando que el HIMFG es un referente en la atención médica, se hace imperativo conocer el comportamiento de las enfermedades parasitarias asociadas con enfermedades complejas atendidas en un tercer nivel.
La generación de información de carácter epidemiológico es necesaria para entender el comportamiento de las parasitosis y de sus variaciones a través del tiempo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Fuente de financiamientoNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.