Las celdas de combustible de óxido sólido (SOFC) son complejos dispositivos que ofrecen grandes ventajas sobre la manera convencional en la que se produce la energía eléctrica. Muchas de estas ventajas giran alrededor del impacto medioambiental y en particular de la eficiencia energética. Sin embargo, el progreso en el campo de estos dispositivos que funcionan a temperaturas elevadas requiere la continua búsqueda de nuevos materiales con avanzadas propiedades, optimización en su fabricación, tecnologías de vanguardia para el procesamiento de sus principales componentes (ánodo-electrólito-cátodo-sellos) y bajos costos de fabricación. En este sentido, el material de estructura perovskita LaxSr1-xCryMn1-yO3-δ (LSCM) es eficiente, estable en ambientes redox, tiene bajo costo de fabricación y es óptimo para aplicaciones en celdas SOFC. Sus propiedades se comparan favorablemente con el compuesto Ni/YSZ al utilizar hidrógeno como combustible, y cuando se utiliza metano, se requiere de solo el 3% de humedad para prevenir la formación de carbón, que es mucho menor en comparación a cuando se utiliza en Ni/YSZ (50% de humedad). El material LSCM permite que una celda SOFC funcione a temperaturas intermedias alrededor de 700°C. En este artículo se hace una breve revisión sobre las excelentes propiedades y potencial que presenta esta perovskita.
Solid oxide fuel cells (SOFC) are complex devices that offer great advantages over conventional manner in which electrical energy is produced. Many of these advantages revolve around the environmental impact and particularly energy efficiency. However, progress in the field of these devices operating at high temperatures require the continuous search for new materials with advanced properties, optimization in manufacturing, cutting edge technologies for the processing of its main components (anode-electrolyte-cathode-seal) and low manufacturing costs. Here, the perovskite structure material LaxSr1-xCryMn1-yO3-δ (LSCM) is efficient, stable redox environments, has low manufacturing cost and is optimized for SOFC applications. Its properties compare favorably with the compound Ni/YSZ using hydrogen as a fuel; and when methane is used, it requires only 3% moisture to prevent carbon formation, which is much lower compared to when used Ni/YSZ (50% moisture). The LSCM material allows a SOFC cell operate at intermediate temperatures around 700°C. This article provides a brief review of the excellent properties and potential presented by this perovskite.
Hoy en día, entre las celdas de combustible que están disponibles en el mercado, las de óxidos sólidos representan una de las tecnologías más prometedoras para la producción de energía limpia a partir de hidrógeno, biomasa y/o biorrefinerías [1]. Los avances en el desarrollo de las celdas de combustible de óxido sólido (SOFC) dependen principalmente del tipo y de la estructura de los materiales que la conforman: ánodo (oxidación del combustible), electrólito (conducción iónica), cátodo (reducción de oxígeno), interconectores y sellos.
El níquel, que es un excelente catalizador en la oxidación de hidrógeno y en el reformado de metano con vapor durante el funcionamiento de una celda SOFC, se ha utilizado por mucho tiempo junto a cermets como la zirconia estabilizada con itrio (YSZ) (30%Ni-YSZ) [2]. Su mayor desventaja es que provoca el cracking (desintegración) catalítico del hidrocarburo, promoviendo la formación de carbono [3] (deshidrogenación) a partir de hidrocarburos en condiciones de reducción. Este mecanismo involucra quimisorción de carbón sobre la superficie del níquel, disolución del carbón en el bulk de níquel, así como grafito de carbono proveniente de alguna partícula de níquel sobresaturada de carbón [4]. Considerando lo anterior, y a menos de que exista una cantidad suficiente de vapor de agua presente para eliminar el carbón formado en la superficie del níquel a una velocidad lo suficientemente rápida, el ánodo puede ser destruido en su totalidad, y a pesar de que frecuentemente se utilizan diversos cálculos termogravimétricos con software avanzado para predecir las condiciones en las que se tendría la formación de carbón, este se puede formar aun cuando no ha sido predicho termodinámicamente [5].
A fin de superar los problemas y limitaciones del ánodo más común (Ni-YSZ), la mayoría de las investigaciones actuales se han enfocado en desarrollar materiales que sean catalíticamente activos para la oxidación de metano u otro tipo de hidrocarburo, así como permanecer lo más inactivo posible en las reacciones del cracking que pueden propiciar depósitos de carbón. Tal desarrollo se rige por varios factores, destacando el mejorar el rendimiento de la celda para reducir la resistencia del electrodo y el aumentar el tiempo de vida de los ánodos a temperatura intermedia entre 600-800°C [6]. Un aspecto importante a considerar en el rendimiento de una celda SOFC es el envenenamiento del ánodo por azufre, que es uno de los motivos principales para incursionar en el desarrollo de nuevos materiales. En la actualidad se han realizado varios intentos para mejorar el rendimiento, centrando su desarrollo en varias clases de materiales que incluyen espinelas [7,8], perovskitas [9–12], bronces de tungsteno [13] y fluoritas [14,15].
Las perovskitas (ABX3) son uno de los mejores materiales para optimizar tanto el transporte iónico-electrónico como las propiedades catalíticas del ánodo en una celda SOFC. Presentan una amplia gama de propiedades: aceptable compatibilidad química y térmica con los componentes adyacentes a la celda, son excelentes catalizadores [16], son materiales magnéticos y eléctricos [17,18] y tienen buena estabilidad estructural y dimensional en ciclos redox. Debido a su alto potencial en la disposición de oxígeno, presentan baja actividad al cracking de hidrocarburos, así como mayor resistencia a las impurezas (azufre) presentes en el combustible. A pesar de que la conductividad electrónica de estos óxidos es menor que la del cermet Ni-YSZ, es plausible su uso como colector de corriente (capa delgada) debido a que requiere un valor mínimo de conductividad (1S·cm−1), además de mantener al mínimo las pérdidas eléctricas por debajo de 0,1Ω·cm2.
Recientemente se ha reportado un enfoque particularmente exitoso con 2 ocupaciones en el sitioB de la estructura perovskita basado en manganitas de cromo-lantano [19]. Su éxito proviene de las excelentes propiedades de la manganita de lantano en la catálisis de la oxidación junto con la estabilidad y la conductividad de la cromita. Dentro de las perovskitas con mayor potencial anódico y que han sido objeto de estudio de diversos investigadores en los últimos años está el material LaxSr1-xCryMn1-yO3-δ (LSCM), que debido a la introducción de elementos de transición como el manganeso (Mn) en el sitioB presenta baja resistencia de polarización y alta estabilidad en contacto con hidrocarburos [20], por ejemplo en el reformado de metano, mejorando así las propiedades catalíticas del sistema [3]. La perovskita LSCM es relativamente estable bajo condiciones redox, condiciones cíclicas con pequeños cambios de volumen, física y químicamente compatible con materiales interconectores como el compuesto LaCrO3[21]. En este sentido, el presente estudio mostrará las características y las propiedades de la perovskita LaxSr1-xCryMn1-yO3-δ.
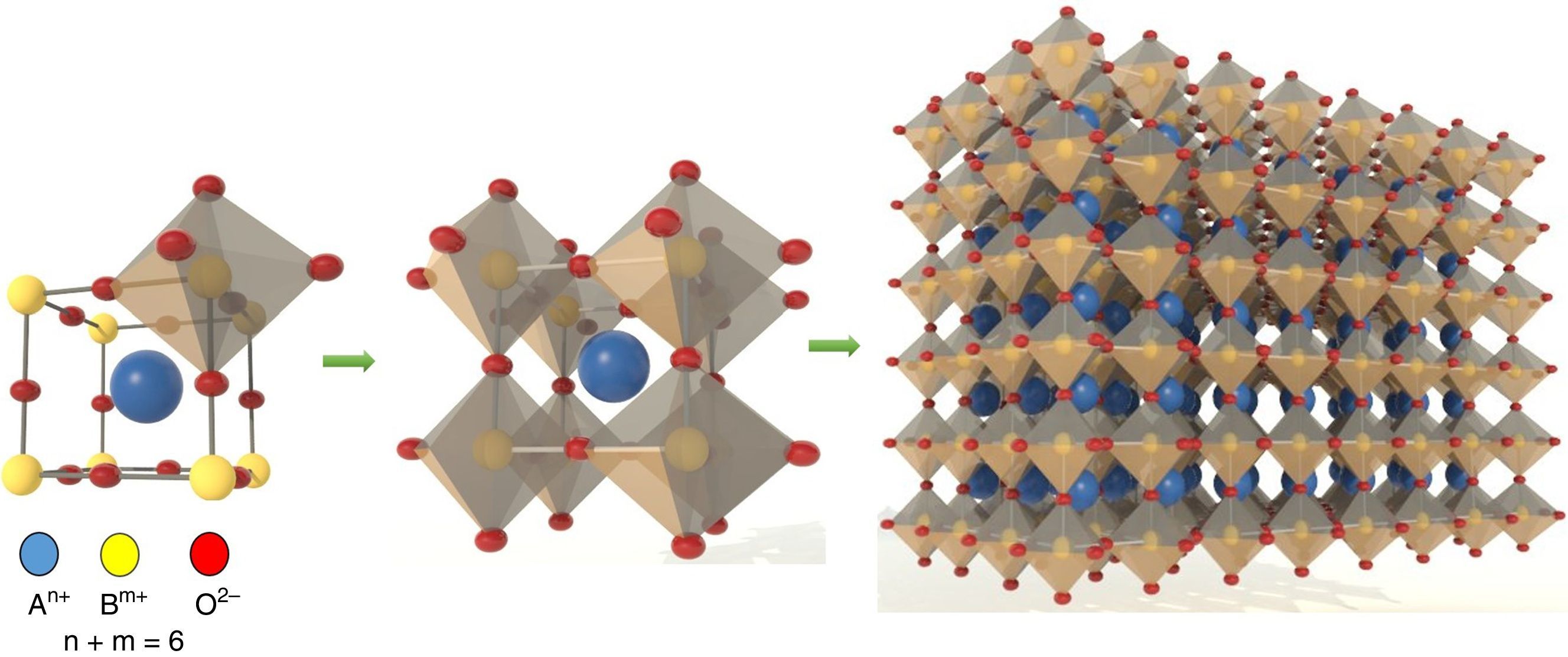
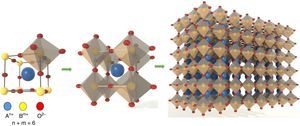
Generalidades de la estructura perovskitaEl mineral perovskita fue descubierto en 1839 en los montes Urales de Rusia por el mineralogista y químico alemán Gustav Rose. Fue nombrado en honor al dignatario, mineralogista y oficial militar ruso Lev Alexeievich Perovski. En la naturaleza existen solo unos pocos compuestos perovskita [22] (tabla 2). En la ciencia de los materiales avanzados, la estructura perovskita es una de las mejores que existen; sin embargo, también presentan algunas desventajas (tabla 3). La estructura de la perovskita (fig. 1) puede ser muy complicada debido a la inclinación que presentan los octaedros y el ordenamiento de los elementos de los sitiosA y B [23,24]. Cristalográficamente pertenece a la familia ternaria y su fórmula general es ABX3[25,26]. Está constituida a partir de un denso empaquetamiento de anionesX (preferencialmente oxígeno) con 2 tipos de sitios: uno con coordinación 6 y otro con coordinación 8 o 12. Los sitios hexagonales pueden albergar pequeños cationes de uno, 2, 3, 4, 5 o 6 estados de oxidación, mientras que en los sitios con la coordinación 6 o 12 se pueden localizar cationes de mayor tamaño de una, 2 o 3 valencias. Los compuestos resultantes de estructura perovskita poseen elevada estabilidad (factor de Goldschmidt [27] =0,77≤t≥1,00 [28]), manteniendo sin cambios la estructura básica; además, las valencias, la estequiometría y las vacancias pueden variar ampliamente (fig. 2). Tienen una amplia gama de fórmulas químicas, propiedades y aplicaciones (tabla 1). En la coordinación octaédrica cúbica cada catiónA está rodeado de 12 anionesX, y cada catiónB está rodeado por 6 anionesX (fig. 1) [29]. Cada aniónX está rodeado por 2 cationes del sitioB y 4 del sitioA. Los cationes más grandes A y los oxígenos forman una red cúbica de cara centrada (FCC). Los cationes más chicos, B, ocupan los sitios octaédricos en la red FCC y solo están rodeados por ionesX. Los cationesB ocupan las esquinas que se comparten con los octaedros y están compartidos con las caras de los dodecaedros que rodean los cationesA. Los cationesA yB están separados uno del otro por ionesX. Debido a su capacidad para acomodar una gran cantidad estequiométrica de vacancias de oxígeno [3], a su estabilidad y a su carácter mixto iónico-electrónico (cromitas, manganitas y titanatos) [30–33] permiten el dopado de varios iones con diferentes estados de oxidación, mejorando su conductividad y su actividad catalítica, y en este sentido es que han adquirido gran importancia para utilizarse en tecnologías de celdas SOFC [34,35].
Compuestos tipo perovskita en la naturaleza
| Tipo | Fórmula general | Lugar de origen |
|---|---|---|
| Latrapita | Ca(Fe,Nb)O3 | Oka, Quebec, Canadá |
| Loparita | (Na,Ce)TiO3 | Khibiny, Península de Kola, Rusia |
| Luesita | NaNbO3 | Lueshe, República Democrática del Congo |
| Macedonita | PbTiO3 | Crni Kamen, Macedonia |
| Perovskita | CaTiO3 | Distrito Zlatoust, Montes Urales, Rusia |
| Tausonita | SrTiO3 | Complejo de Murun, Yakutia, Rusia |
Ventajas y desventajas de varios óxidos de estructura perovskita
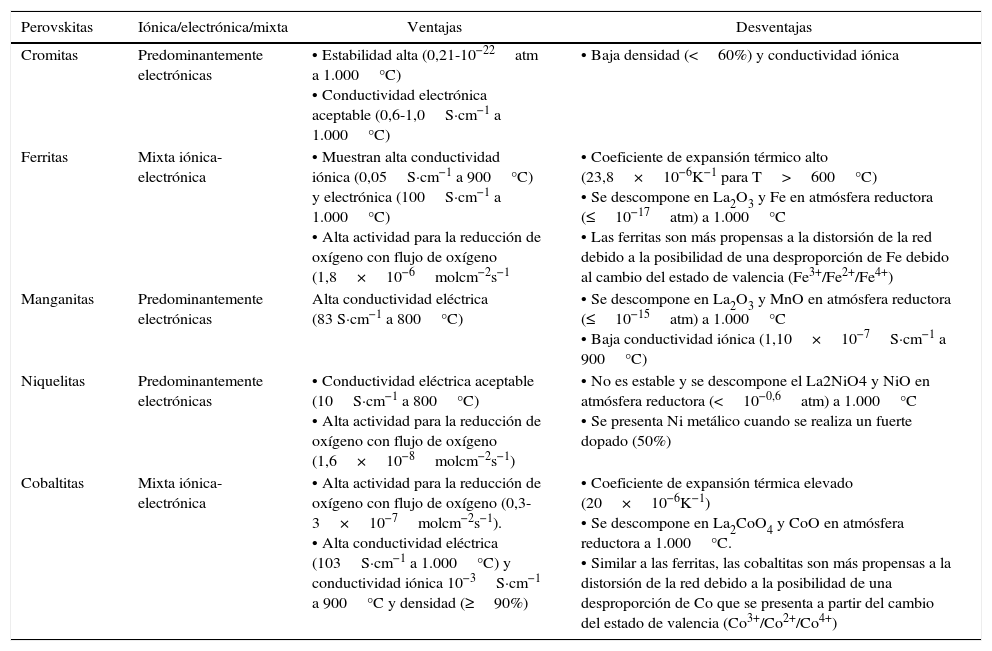
| Perovskitas | Iónica/electrónica/mixta | Ventajas | Desventajas |
|---|---|---|---|
| Cromitas | Predominantemente electrónicas | • Estabilidad alta (0,21-10−22atm a 1.000°C) • Conductividad electrónica aceptable (0,6-1,0S·cm−1 a 1.000°C) | • Baja densidad (<60%) y conductividad iónica |
| Ferritas | Mixta iónica-electrónica | • Muestran alta conductividad iónica (0,05S·cm−1 a 900°C) y electrónica (100S·cm−1 a 1.000°C) • Alta actividad para la reducción de oxígeno con flujo de oxígeno (1,8×10−6molcm−2s−1 | • Coeficiente de expansión térmico alto (23,8×10−6K−1 para T>600°C) • Se descompone en La2O3 y Fe en atmósfera reductora (≤10−17atm) a 1.000°C • Las ferritas son más propensas a la distorsión de la red debido a la posibilidad de una desproporción de Fe debido al cambio del estado de valencia (Fe3+/Fe2+/Fe4+) |
| Manganitas | Predominantemente electrónicas | Alta conductividad eléctrica (83 S·cm−1 a 800°C) | • Se descompone en La2O3 y MnO en atmósfera reductora (≤10−15atm) a 1.000°C • Baja conductividad iónica (1,10×10−7S·cm−1 a 900°C) |
| Niquelitas | Predominantemente electrónicas | • Conductividad eléctrica aceptable (10S·cm−1 a 800°C) • Alta actividad para la reducción de oxígeno con flujo de oxígeno (1,6×10−8molcm−2s−1) | • No es estable y se descompone el La2NiO4 y NiO en atmósfera reductora (<10−0,6atm) a 1.000°C • Se presenta Ni metálico cuando se realiza un fuerte dopado (50%) |
| Cobaltitas | Mixta iónica-electrónica | • Alta actividad para la reducción de oxígeno con flujo de oxígeno (0,3-3×10−7molcm−2s−1). • Alta conductividad eléctrica (103S·cm−1 a 1.000°C) y conductividad iónica 10−3S·cm−1 a 900°C y densidad (≥90%) | • Coeficiente de expansión térmica elevado (20×10−6K−1) • Se descompone en La2CoO4 y CoO en atmósfera reductora a 1.000°C. • Similar a las ferritas, las cobaltitas son más propensas a la distorsión de la red debido a la posibilidad de una desproporción de Co que se presenta a partir del cambio del estado de valencia (Co3+/Co2+/Co4+) |
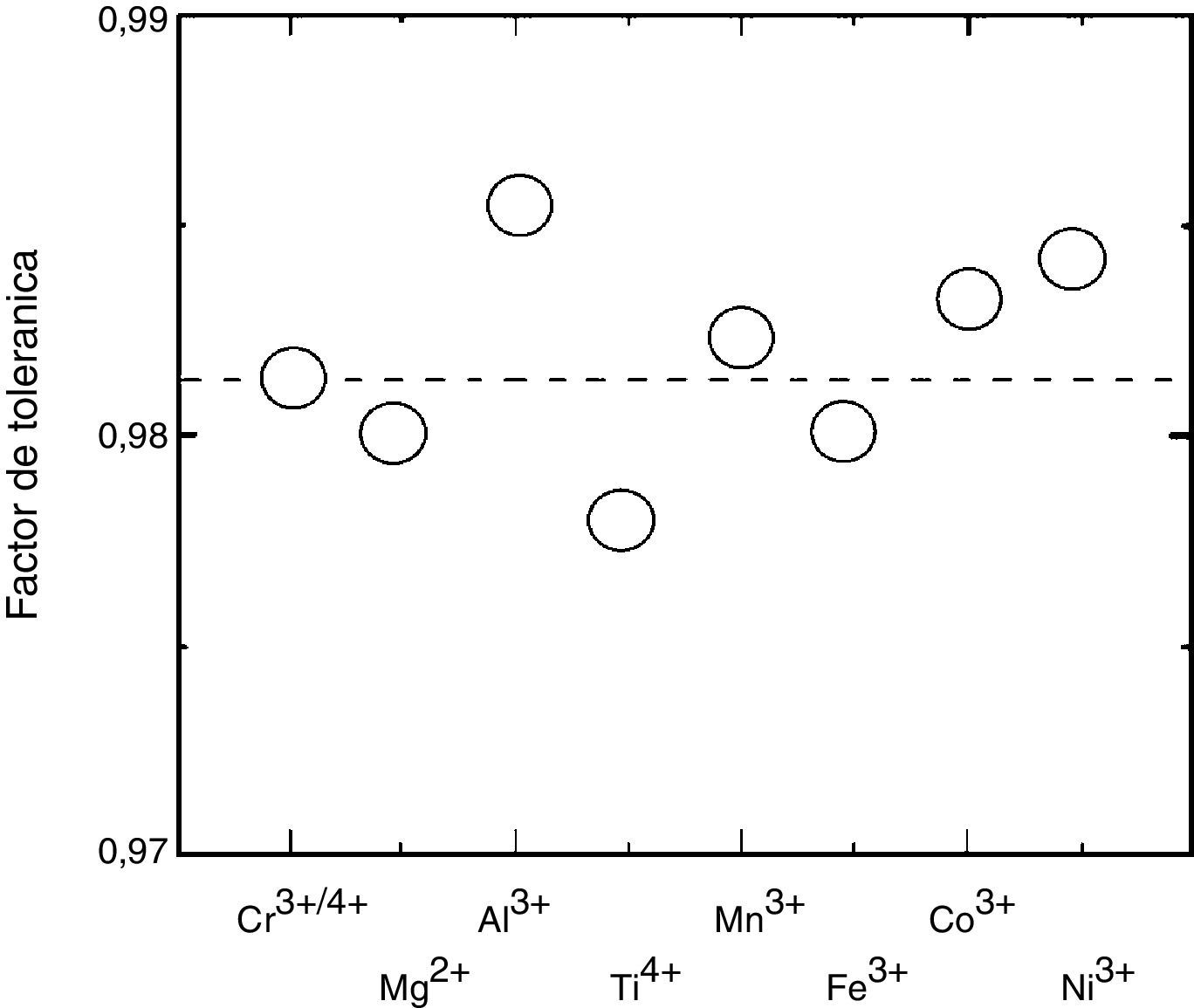
Factor de tolerancia de la perovskita La0.9Sr0.1Cr0.9M0.1O3 vs dopantes en el sitio B (M=Mg, AI, Ti, Cr, Mn, Fe, Co, Ni) [80].
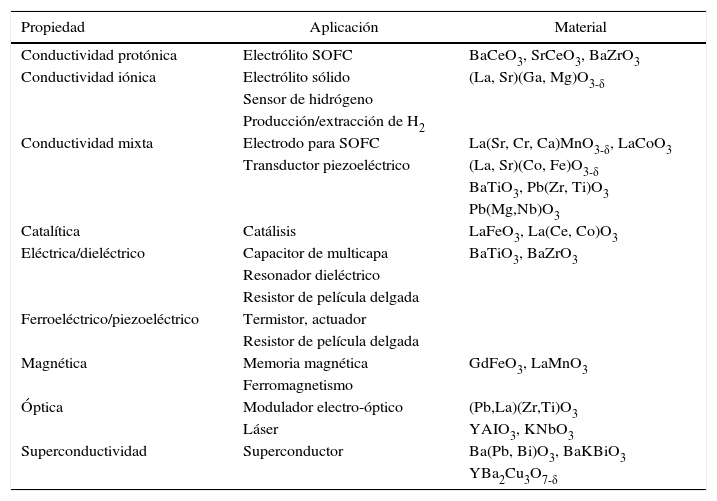
Propiedades y aplicaciones de perovskitas
| Propiedad | Aplicación | Material |
|---|---|---|
| Conductividad protónica | Electrólito SOFC | BaCeO3, SrCeO3, BaZrO3 |
| Conductividad iónica | Electrólito sólido | (La, Sr)(Ga, Mg)O3-δ |
| Sensor de hidrógeno | ||
| Producción/extracción de H2 | ||
| Conductividad mixta | Electrodo para SOFC | La(Sr, Cr, Ca)MnO3-δ, LaCoO3 |
| Transductor piezoeléctrico | (La, Sr)(Co, Fe)O3-δ | |
| BaTiO3, Pb(Zr, Ti)O3 | ||
| Pb(Mg,Nb)O3 | ||
| Catalítica | Catálisis | LaFeO3, La(Ce, Co)O3 |
| Eléctrica/dieléctrico | Capacitor de multicapa | BaTiO3, BaZrO3 |
| Resonador dieléctrico | ||
| Resistor de película delgada | ||
| Ferroeléctrico/piezoeléctrico | Termistor, actuador | |
| Resistor de película delgada | ||
| Magnética | Memoria magnética | GdFeO3, LaMnO3 |
| Ferromagnetismo | ||
| Óptica | Modulador electro-óptico | (Pb,La)(Zr,Ti)O3 |
| Láser | YAIO3, KNbO3 | |
| Superconductividad | Superconductor | Ba(Pb, Bi)O3, BaKBiO3 |
| YBa2Cu3O7-δ |
El óptimo desarrollo de materiales de estructura perovskita [36,37] con potencial aplicación en celdas SOFC ha llevado a una intensa investigación de nuevos materiales conductores libres de níquel o en cantidades muy reducidas y que, además, sean resistentes al azufre. En este sentido se destacan los compuestos: Sr1-xLaxTiO3 (LST; x=0,3-0,4) [38,39], itria dopada con SrTiO3[40], La1-XSrxVO3 (LSV: x=0,5) [41,42], Ce0.9Sr0.1Vox (x=3, 4) y sus variaciones en el dopaje [43,44], pirocloros Gd2Ti2-xMoxO7 (x=0,6) [45], estructuras tipo LaxSr1-xCryMn1-yO3 (LSCM; x=0,25, y=0,5) [19], e incluso materiales con estructura de doble perovskita como Sr2Mg2-xMoO6 (SMMO; x=1) [46,47] y Sr2Fe4/3Mo2/3O6[48].
De los materiales antes mencionados, el compuesto LaxSr1-xCryMn1-yO3 (LSCM), con sus diversas variaciones en el dopaje (x, y), ha demostrado un importante avance en investigación y desarrollo de perovskitas basadas en manganitas, por ejemplo, donde el Mn en la manganita de lantano se reemplaza por Cr [49]. A baja presión parcial de oxígeno, la reducción del Mn produce vacancias, generando conductividad iónica. Y dado que el Cr presenta una coordinación hexagonal con deficiencia de oxígeno [50], la introducción de cationes con bajo número de coordinación como el Mn puede mejorar la actividad catalítica aumentando la conductividad iónica [3]. Además, la adición de estroncio mejora la estabilidad en ambientes reductores y disminuye la resistencia de polarización [51]. Por ejemplo, el óxido La0.75Sr0.25Cr0.5Mn0.5O3-δ es un material anódico eficiente y estable en ambientes redox, óptimo para aplicaciones en celdas SOFC, y además muestra un rendimiento electroquímico comparable al compuesto Ni-YSZ [19,49,50,52–54]. Es importante mencionar que, al aumentar el contenido de Sr en la perovskita LSCM, la conductividad eléctrica también lo hace debido a la formación de portadores de carga y a la conversión Mn3+→Mn4+[20]. Sin embargo, el aumento del Sr también incrementa la reactividad química cuando se utiliza esta perovskita con electrólitos base zirconia, y en algunos casos puede resultar la formación de fases resistivas, por ejemplo, el compuesto SrZrO3, que se produce debido a la reacción química con el electrólito en alta temperatura (T>1.200°C) [55].
La perovskita LSCM es estable en diferentes atmósferas (combustible-aire); sin embargo, puede presentarse un cambio de volumen alrededor del 1%, y en una atmósfera altamente reductora su conductividad electrónica se reduce bastante (∼1S·cm−1). De acuerdo a estudios de catálisis, se ha demostrado que el material LSCM presenta buen rendimiento electroquímico en metano (CH4) humidificado, sin necesidad de utilizar exceso de vapor [56]. Cuando se utiliza CH4, se requiere solo el 3% de humedad para prevenir la formación de carbón, que es mucho menos comparado con el material Ni/YSZ, que requiere cerca del 50% de humedad [52].
Debido a su estabilidad en contacto con aire y/o combustible, la perovskita LSCM se ha empleado como electrodo en celdas SOFC de diseño simétrico, abriendo la posibilidad de desarrollar una celda de combustible reversible [57]. Para compensar la falta de actividad catalítica de este material puede emplearse la adición de un conductor iónico como YSZ, GDC o YSZ/CGO en la conformación del ánodo. Esta alternativa mejora enormemente la unión del material LSCM con el electrólito, reduciendo al mismo tiempo la resistencia a la polarización del electrodo y mejorando la actividad catalítica para la oxidación del combustible [58]. La sustitución con cerio (Ce) es otra alternativa que se ha utilizado para mejorar su conductividad. Tal es el caso del cermet CexLa0.75-xSr0.25Cr0.25Mn0.5O3-δ (CeLSCM, x=0, 0,10, 0,25, 0,375) [59], donde se observó que para un valor de x=0 e y=0,375 se tiene un aumento de conductividad de 18,3 a 35,4S·cm, respectivamente, a 900°C. Cabe destacar que ambos compuestos LSCM y CeLSCM fueron estables en condición de operación como ánodos en una SOFC y demostraron un comportamiento de conductividad tipo p (semiconductor) en una atmósfera de argón e hidrógeno. Esta conductividad fue disminuyendo con la presión parcial de oxígeno. En atmósfera de argón, el material aumenta su conductividad eléctrica proporcionalmente con el contenido de Ce hasta un valor de 35S·cm−1 a 900°C. Sin embargo, en hidrógeno se obtuvo solo 1S·cm−1 a 900°C independientemente de la cantidad de cerio incluida. Cabe señalar que cuanto más alto fue el contenido de cerio, menor fue la resistencia a la polarización y mayor la densidad de corriente anódica.
Recientemente se han realizado otros intentos para mejorar la conductividad eléctrica de la perovskita LSCM a partir de la adición de una fase eléctricamente conductora, por ejemplo, de CuNi, solo Cu o solo Ni. Tal es el caso del material La0.7Sr0.3Cr0.4Mn0.6O3-δ-XCu0.75Ni0.25 (LSCM+XCuNi) [60], donde se reportó una alta estabilidad en condiciones reductoras para la perovskita LSCM, independientemente de la cantidad de Cu-Ni. Sin embargo, y de acuerdo a las pruebas de conductividad eléctrica, el material LSCM+XCuNi presentó comportamiento metálico para las muestras de 45-75% de XCuNi, y solo los ánodos con 25 y 35% fueron aceptables para utilizarse en una celda SOFC debido a su comportamiento de semiconductor. Respecto a las adiciones con níquel solamente, se investigaron una serie de ánodos tipo La0.7Sr0.3Cr0.4Mn0.6O3-δ-25-75%Ni [61]. En este caso, todas las muestras mostraron un comportamiento semiconductor; sin embargo, al incrementar la temperatura de operación hasta 1.050°C en atmósfera de hidrógeno, el material presentó una rotura simétrica originando otra fase no deseada, y solo la muestra con 25% de Ni mostró un comportamiento semiconductor. Se determinó que, de acuerdo a la compatibilidad con materiales para una celda SOFC y su comportamiento a 800°C, solo las muestras con 35 y 45% de Ni serían las más aceptables. Recientemente se han realizado otros esfuerzos para mejorar la conductividad de este material, realizando experimentos a través de la variación en el dopaje para x=0,8, y=0,5 en la perovskita LaxSr1-xCryMn1-yO3 adicionando una fase de cobre de 25-45% en peso (La0.8Sr0.2Cr0.5Mn0.5O3-δ+25-45%Cu) [62]. De acuerdo a los resultados, se concluyó que las muestras con 25 y 35% de cobre fueron los mejores ánodos para ser utilizados en una celda SOFC a 800°C.
La perovskita de composición La0.8Sr0.2Cr0.8Mn0.2O3-δ, similar a los interconectores de una SOFC, se ha utilizado debido a su estabilidad y conductividad electrónica en altas temperaturas, así como en un amplio rango de composiciones de gas. Los autores indican que el estroncio (Sr) se combinó con la cromita de lantano (LaCrO3) para asegurar la compatibilidad del coeficiente de expansión térmica e incrementar la conductividad electrónica [63]. El Mn se agregó para mejorar la sinterización. Es bien conocido el uso del material LaCrO3 como ánodo en una celda SOFC; sin embargo, se presentan elevadas resistencias de polarización y, por lo tanto, densidades de potencia relativamente bajas debido a su capacidad de catálisis en las reacciones electroquímicas del ánodo. Para superar este gran inconveniente, los investigadores han realizado algunas modificaciones, por ejemplo, combinar la perovskita La0.8Sr0.2Cr0.8Mn0.2O3-δ con una fase conductora iónica tipo Ce0.9Gd0.1O1.95 (GDC), lo cual puede mejorar la adherencia con electrólitos GDC, y sobre todo aumenta el rendimiento electroquímico debido al aumento de la densidad en la triple frontera de fase. Adicionalmente también se ha incluido una pequeña cantidad de níquel de aproximadamente 5% en peso para obtener el compuesto LSCM-GDC-Ni, demostrándose buena estabilidad, pero una conductividad relativamente baja de ∼1S·cm.
Otros elementos que los investigadores han considerado para ánodos en celdas SOFC en adición a la perovskita LaxSr1-xCryMn1-yO3 alterna al Mn y al Ni son el hierro (Fe) y el cobalto (Co). Estas perovskitas se han sintetizado a partir del método sol-gel de acuerdo a la conformación La0.75Sr0.25Cr0.9M0.1O3 (M=Mn, Fe, Co, Ni) [64] con el fin de utilizarse como ánodos en un sistema SOFC y en atmósfera de CO/CO2:O2. La comparación de todas las perovskitas se realizó a 900 y 1.000°C. En ambas temperaturas la variación del rendimiento se registró de acuerdo a la siguiente secuencia y en base a la sustitución del catión del sitioB: Fe>Ni>Co>Mn. Estos resultados indicaron que la perovskita La0.75Sr0.25Cr0.9Mn0.1O3 mostró una densidad de corriente de 8,4 y 16mAcm−2 así como una densidad de potencia de 1,4 a 2,4 mW·cm−2 a 900 y 1.000°C, respectivamente, que puede considerarse aceptable para utilizarse en una SOFC. Sin embargo, los resultados indicaron valores más altos en densidad de corriente y de potencia para al material La0.75Sr0.25Cr0.9Fe0.1O3 de 14 y 24mA·cm−2 así como de 2,6 y 4mW·cm−2, respectivamente, en ambas temperaturas. Claramente se observa que la actividad catalítica de las perovskitas aumenta cuando la conductividad del ion involucrado es mayor [65]. Cabe resaltar que el dopado del sitioB de las cromitas de lantano-estroncio con metales de transición origina vacancias de oxígeno y por lo tanto mejora la actividad electrocatalítica del monóxido de carbono (CO) utilizado, y como se comentó anteriormente se tiene un efecto benéfico adicional al realizar tal sustitución en la perovskita para el reformado con metano, así como para la oxidación de CO.
En este contexto se ha sintetizado la perovskita La1-xSrxCr0.5Mn0.5O3 (LSCM; x=0,25) como posible ánodo en celdas SOFC, demostrado ser estable en atmósferas reductoras, además de mostrar baja resistencia de polarización [48,50]. Cabe recordar que las cromitas-manganitas de lantano dopadas con estroncio no catalizan la deposición de carbón y permiten el reformado de metano sin exceso de vapor [66]. Actualmente se han reportado varios estudios relacionados al rendimiento de estos materiales en celdas SOFC y la influencia que representan el Cr y el Mn en la composición [19,58].
Sin embargo, los estudios referidos a la influencia del contenido de Sr [20], deterioro térmico y optimización microestructural de la perovskita pueden contribuir fuertemente al conocimiento de esta perovskita para aplicaciones en celdas SOFC. En este sentido, se han realizado investigaciones evaluando el comportamiento del material La1-xSrxCr0.5Mn0.5O3 de acuerdo al contenido de Sr en el rango de 0,3≤x≤0,5 [55] en conjunto con electrólitos base zirconia, analizando su estabilidad durante diferentes ciclos redox, obteniendo su resistividad eléctrica en diferentes atmósferas. Los principales resultados mostraron que en la composición con x=0,5 (La0.5Sr0.5Cr0.5Mn0.5O3) fue donde se observó la mayor conductividad eléctrica sin tener la presencia de alguna reacción con el material YSZ. Además, esta composición exhibe un comportamiento estable durante ciclos de oxidación y reducción entre la temperatura ambiente y la temperatura de operación de la SOFC. De acuerdo al análisis de difracción de rayosX (XRD), se observó un aumento directamente proporcional respecto al parámetro de red a de la estructura cristalina de la perovskita con la concentración de Sr, mientras que el parámetro c no tuvo cambios significativos. Lo anterior puede asociarse al tamaño del radio iónico de ciertos cationes como el Mn4+ (0,53Å) que son más pequeños comparados con Mn3+ (0,645Å), así como con el enlace Mn-O, lo cual compensa la sustitución de los cationes de Sr2+ (1,44Å) por los cationes de La3+ (1,36Å). Los resultados del análisis de conductividad eléctrica revelaron un comportamiento de activación térmica al aumentar el contenido de estroncio debido a la formación de los portadores de carga, lo cual está relacionado a la oxidación de Mn3+ a Mn4+[20]. Sin embargo, y de acuerdo al análisis de XRD, cuando aumenta el Sr, también la reactividad química con el electrólito base zirconia. De manera similar a los cátodos tipo LSM, una sustitución de Sr en la perovskita La1-xSrxCr0.5Mn0.5O3 mayor a x=0,3 puede resultar en una fase altamente resistiva tipo SrZrO3. En este mismo análisis y con un valor de x=0,3, luego de una reducción a 1.000°C en H2 por 5h, los autores reportaron fases que correspondían a los compuestos (La,Sr)2MnO4 como resultado de la sustitución de estroncio en la perovskita LaMnO3. De acuerdo a estos resultados, y a pesar de las buenas propiedades eléctricas que trae consigo hacer el dopaje con estroncio en la perovskita La1-xSrxCr0.5Mn0.5O3, puede observarse que es necesario optimizar la microestructura de la perovskita con el fin de mejorar sus propiedades y poder ser utilizada en una celda SOFC.
Un aspecto interesante en los materiales de óxidos mixtos de estructura perovskita es su capacidad a tolerar el envenenamiento por azufre en ciertas concentraciones. Se ha reportado que la estructura perovskita ABO3 es menos reactiva en ácido sulfhídrico (H2S) que los ánodos base níquel [38]. Debido a su estequiometría y a la capacidad de la perovskita para generar vacancias, se logra el dopado de varios iones con diferentes estados de oxidación, ya sea para mejorar la conductividad y la actividad catalítica de compuestos cerámicos resistentes al azufre o aumentar la estabilidad del sistema, logrando un prometedor rendimiento electroquímico. Como ejemplo de ello, se puede mencionar la perovskita La0.75Sr0.25Cr1-yMnyO3 (LSCM, y=0,4, 0,5, 0,6) como ánodo para celdas SOFC en contacto con atmósfera de hidrógeno puro y H2S [19]. Se observó que, luego de exponer el material LSCM en una solución de (10%) H2S-H2, algunas fases secundarias (impuras) se presentaron. La cantidad de estas fases tipo MnS, La2O2S y α-MnOS, disminuyeron con el contenido de Cr. Sin embargo, los resultados también indican que la tolerancia al azufre se reduce al aumentar que contenido de Mn. De acuerdo a los autores, un 20% de Mn aumentó al doble la pérdida de tensión en el ánodo en H2 con 1.000ppm de H2S. De esta perovskita también se reportó que la composición La0.75Sr0.25Cr0.5Mn0.5O3 se degradó rápidamente después de ser expuesta en circuito abierto por 16h debido a las fases secundarias mencionadas. Aunque estas pruebas se han realizado en condiciones severas, otros autores han comentado que incluso con 100ppm de H2S se tiene baja tolerancia al azufre cuando los niveles de dopaje respecto al Mn son bajos [38]. Se considera que esta baja tolerancia al azufre puede ser debida a la falta de estabilidad de la manganita de lantano dopada con estroncio (LSM) en un ambiente reductor. Otros estudios han tratado de explicar el papel que tiene la red de oxígeno en la desactivación de la catálisis del ánodo tipo La0.75Sr0.25Cr0.5Mn0.5O3 y el ácido sulfhídrico (H2S) [67], mostrando nuevamente la generación de las fases La2O2S y MnOS después del tratamiento en H2S. En base al análisis para la región de oxígeno (O1s), se propone que la red de oxígeno no solo contribuye a la completa oxidación en la superficie, sino también en el cuerpo (bulk) de la perovskita. También se menciona que la pre-reducción del ánodo La0.75Sr0.25Cr0.5Mn0.5O3 en H2 puede reducir el envenenamiento por azufre, debido a que el hidrógeno consume previamente parte de la cantidad de oxígeno en la red; sin embargo, puede afectarse el rendimiento eléctrico del ánodo. Por lo tanto, y como se ha mencionado anteriormente, es necesaria la optimización en la microestructura de ánodos tolerantes al azufre que puedan tener alto rendimiento electroquímico en una celda SOFC. A la fecha, se han examinado diversas perovskitas para aplicarse como ánodos resistentes al azufre [47,68–70]. Sin embargo, se han reportado muy pocas perovskitas que muestren tanto tolerancia al azufre como actividad catalítica en la oxidación de H2, equivalente a materiales de cerio dopados con níquel, o YSZ/Ni. Algo muy importante de mencionar es que existe limitada investigación acerca de los mecanismos respecto a la resistencia de los materiales en contacto con azufre para celdas SOFC.
Transformaciones de fase perovskita LaxSr1-xCryMn1-yO3-δPara permitir un óptimo desempeño en la interface electrólito/ánodo es muy importante conocer las posibles transformaciones y/o transiciones de fase en la perovskita LaxSr1-xCryMn1-yO3-δ (LSCM) a elevadas temperaturas. Tales transiciones pueden ser de primer y segundo orden. La transición de fase de primer orden mediante un abrupto cambio de volumen puede causar la deslaminación en la interface ánodo/electrólito. En este sentido, y a partir de diversos análisis por XRD, se ha determinado que la perovskita LSCM presenta una estructura romboedral a temperatura ambiente. Sin embargo, después de que se reduce en 5% H2/Ar a 900°C por 120h, se transforma a una estructura cúbica [53]. Cabe mencionar que, debido a la elevada cantidad de vacancias de oxígeno, la estructura perovskita (LSCM) en su forma La0.25Sr0.75Cr0.5Mn0.5O3-δ se descompone en las fases (LaSr)2MnO4 y MnO en atmósfera reductora (10−20atm) a 900°C [71].
Se han realizado grandes aportaciones de estudios realizados en perovskitas con deficiencia en los sitiosA yB. Por ejemplo, la perovskita con deficiencia en el sitioA (La0.85Sr0.15)0.9MnO3) puede reducir la resistencia de la interface y las pérdidas del sobrepotencial de una SOFC, en comparación al material estequiométrico (La0.85Sr0.15)1.0MnO3[72]. Se piensa que el bajo rendimiento de este último se debe a la formación de compuestos resistivos como La2Zr2O7/SrZrO3 entre las fases LSM y YSZ en el electrodo y en la interface electrodo/electrólito [72,73]. Frecuentemente se utiliza la deficiencia en el sitioA para aumentar el rango de estabilidad en la perovskita reduciendo la temperatura de sinterizado permitiendo así el co-sinterizado [74]. En general, diversos experimentos han demostrado que la estructura perovskita puede experimentar varias transiciones de fase en altas temperaturas, tal como se ha observado en los compuestos BaCeO3[75], Pr1-xSrxMnO3[76] y Sr2MWO6 (M=Ni, Zn, Co, Cu) [77].
De acuerdo a lo anterior y con el objetivo de mejorar la estabilidad frente a la reacción de la interface, se ha investigado in situ la estructura y evolución de fase en la perovskita de composición nominal (La0.75Sr0.25)0.95Cr0.5Mn0.5O3 (LSCM), con deficiencia en el sitioA en alta temperatura mediante un estudio de difracción de neutrones [78]. En este estudio, a partir de un análisis Rietveld se observó que a 1.000°C se forma hasta en un 85,5% la fase cúbica. La transición romboedral a cúbica (R3¯c→Pm3¯m) se completó aproximadamente a 1.100°C. A la fecha, la razón para tal transformación de fase no es muy conocida aún, pero puede explicarse usando el factor de tolerancia (fig. 2). Un ejemplo de ello es el análisis del ánodo La0.9Sr0.1Cr0.9M0.1O3 (M=Mn, Ni, Al) [79]. Sin embargo, también puede ser debido a los diferentes estados de valencia del Mn (+2, +3 y +4). Esto permitiría formar vacancias de oxígeno para compensar la carga y puede resultar en una menor distorsión de la red en alta temperatura. Los autores observaron una relación casi lineal entre la temperatura y la fracción cúbica formada, lo cual indica que muy probablemente se logró el equilibrio termodinámico para la transición de fase, dado que es poco probable que sea lineal si se encuentra bajo control cinético. Lo anterior se confirmó mediante XRD a 800°C por periodos de 5h sin observar un cambio en las posiciones e intensidades de los picos. Se observó que la fase cúbica fue dominante tanto en aire como en atmósfera reductora a 900°C en 5%H2/Ar, lo cual es benéfico para minimizar el efecto de las tensiones en ambientes redox. Se atribuye al cambio de fase un cambio significativo de conductividad en aire e hidrógeno, lo cual fue consistente con la prueba de dilatometría. Un detalle interesante es, de acuerdo al refinamiento cristalino realizado, que las 2 fases (romboédrica y cúbica) coexisten en un rango entre 500 y 1.100°C. Cabe resaltar que a diferencia de esta perovskita (LSCM) que puede coexistir en un rango de 600°C, algunas transformaciones no son tan fáciles de detectar, como la perovskita Pr1-xSrxMnO3, donde la transición de fase R3¯→Pm3¯m es directa en alta temperatura [76].
Expansión térmica de la perovskita LaxSr1-xCryMn1-yO3-δGeneralmente, los materiales de estructura perovskita LaxSr1-xCryMn1-yO3-δ aplicados en una celda SOFC están en contacto con diversos materiales como YSZ, ScSZ o GDC en forma de capas de estructura fluorita adyacentes a los componentes [80]. La falta de compatibilidad con el valor en expansión térmica o coeficiente de expansión térmico (TEC) en estas estructuras puede conducir a estrés térmico [81], pudiéndose desarrollar grietas y deformaciones en las intercapas de los materiales y componentes adyacentes, lo que puede conducir a una fuga de gas y fallo mecánico, así como cambios de temperatura al inicio y al final del funcionamiento.
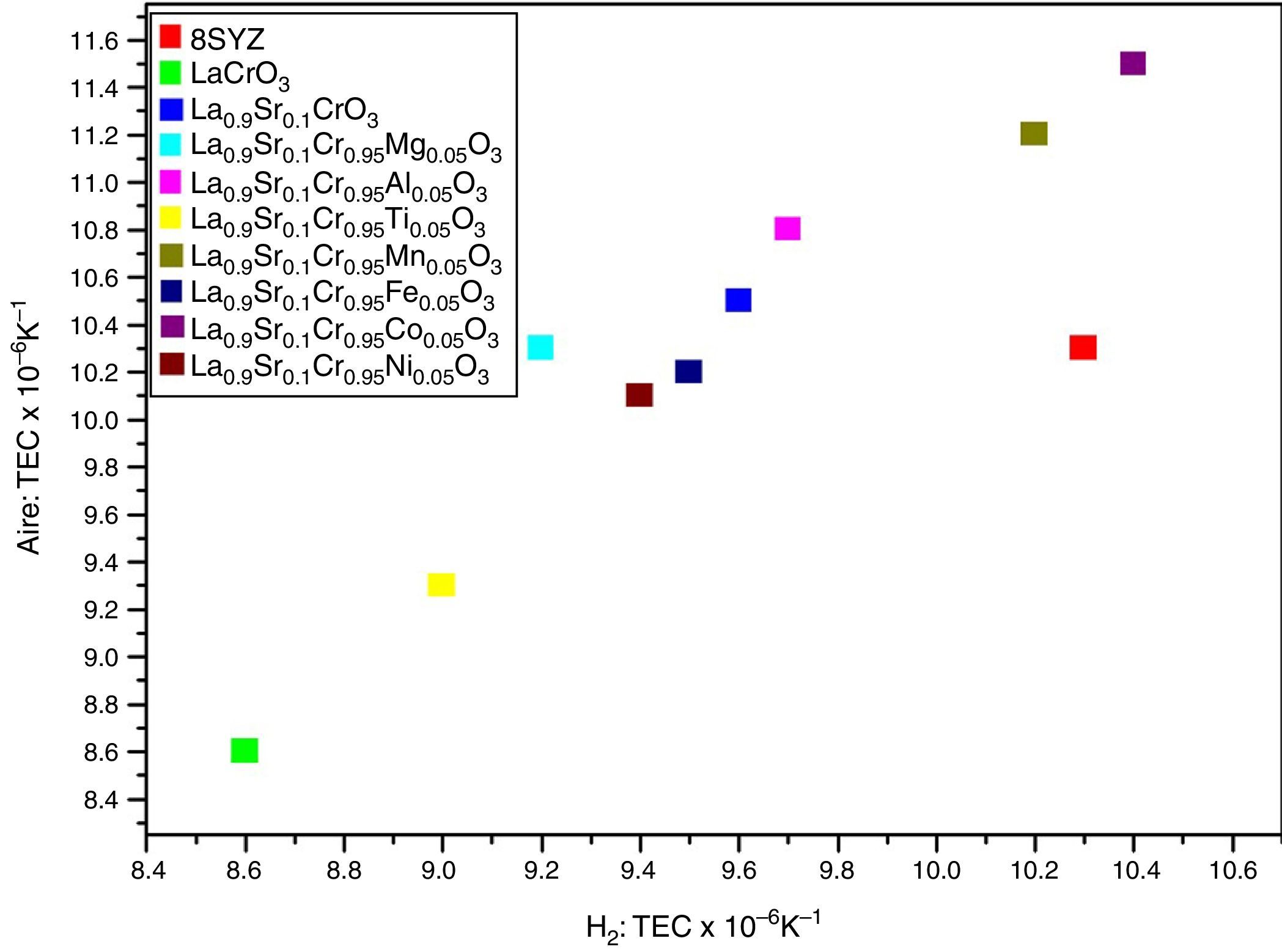
En ciertas perovskitas es posible la presencia de un alto valor del TEC, el cual está relacionado al cambio en el estado de valencia del dopante en el sitioB, radio iónico y/o spin [82]. Además, la conductividad iónica y el TEC aumentan al reducir las diferencias iónicas entre los enlaces A-O y B-O [83,84]. Por ejemplo, el alto valor del TEC en el material La0.9Sr0.1Cr1-xMnxO3-δ se debe al cambio en los estados de valencia entre Mn4+ (0,067nm), Mn3+ (0,078nm, spin elevado) e y iones de Mn2+ (spin bajo, 0,081nm), lo cual conduce al aumento en el promedio del radio iónico del catión en el sitioB en alta temperatura [82]. Como ejemplo de la variación del TEC, la figura 3 muestra la perovskita La0.9Sr0.1Cr1-xMxO3 (0≤x≤0,1; M=Mg, Al, Ti, Mn, Fe, Co, Ni) en contacto con el material 8YSZ en aire e hidrógeno (H2) [82,85]. Se ha reportado que el promedio del TEC de la perovskita (La0.75Sr0.25)0.95Cr0.5Mn0.5O3-δ es de 9,3×10−6°C−1 en aire, que es cercano al compuesto YSZ (10,3×10−6°C−1) en un rango de temperatura de 60-950°C [50]. Otro estudio sobre el material (La0.75Sr0.25)0.95Cr0.5Mn0.5O3-δ mostró un TEC lineal de 12,7×10−6°C−1 y de 11,7×10−6°C−1 en atmósfera oxidativa (PO2=0,21atm) y reductora (PO2=5×10−21–3×10−14 atm), respectivamente, en un rango de temperatura de 650-950°C [21]. El promedio del TEC en la perovskita La0.75Sr0.25Cr0.5Mn0.5O3 es de 11,4×10−6°C−1 en aire entre 30-900°C [58], que es más elevado que el reportado anteriormente (9,3×10−6°C−1). Considerando la fase LSCM (50%)/YSZ (50%), el TEC de La0.75Sr0.25Cr0.5Mn0.5O3 se reduce a 10,3×10−6°C−1, dando como resultado mayor compatibilidad con la fase YSZ [58].
Valores del TEC de las perovskitas La0.9Sr0.1Cr1-xMxO3 (M=Mg, AI, Ti, Mn, Fe, Co, Ni; 0=x=0.1 de 150 a 1000°C en atmósfera de aire e hidrógeno [86].
Se ha presentado una breve revisión sobre la estructura perovskita LaxSr1-xCryMn1-yO3-δ (LSCM) como ánodo para celdas SOFC. Esta perovskita ha demostrado un gran potencial en una amplia gama de aplicaciones. Su versatilidad con respecto a su simetría cristalina y su capacidad para incorporar diversos cationes dan lugar a una serie de nuevas propiedades, facilidad de adaptar la composición, propiedades y configuración (bulk, películas gruesas-delgadas, nanopartículas), y permite pensar que su futuro será tan importante como su espléndido pasado. Los grandes avances en nanotecnologías aplicados con el material LaxSr1-xCryMn1-yO3-δ han abierto un horizonte muy prometedor en el campo de la ciencia de materiales. Sin embargo, para explotar plenamente su potencial es necesaria una mayor investigación respecto a la actividad electroquímica y sobre todo en el comportamiento del transporte de oxígeno, su difusividad (conductividad iónica) e intercambio superficial. Por ejemplo, es importante establecer si la conducción de iones oxígeno en la perovskita juega un papel importante en el electrodo, o si la difusión superficial de especies adsorbidas del combustible será lo que controle la velocidad. Por último, la mayoría de los resultados publicados muestran defectos en la estructura de las perovskitas, estequiometría de oxígeno, propiedades de transporte y su actividad electrocatalítica respecto a la reducción de oxígeno [86–88]. Sin embargo, la gran cantidad de publicaciones que describen la estabilidad termoquímica en condiciones reductoras es bastante limitada y rara vez demuestran el mecanismo, la cinética de reducción, así como la transformación de fase y/o estructura de las perovskitas a temperatura alta e intermedia [16,56]. Además, deben realizarse más experimentos a largo plazo y en condiciones reales de funcionamiento de una SOFC que puedan mejorar esta tecnología llevando un paso más adelante su comercialización.
El autor agradece la participación de Mario Francisco Alvarado Flores por su valiosa aportación técnica en este estudio, mediante el uso de software para el diseño gráfico y modelado en 3D.






![Factor de tolerancia de la perovskita La0.9Sr0.1Cr0.9M0.1O3 vs dopantes en el sitio B (M=Mg, AI, Ti, Cr, Mn, Fe, Co, Ni) [80]. Factor de tolerancia de la perovskita La0.9Sr0.1Cr0.9M0.1O3 vs dopantes en el sitio B (M=Mg, AI, Ti, Cr, Mn, Fe, Co, Ni) [80].](https://static.elsevier.es/multimedia/03663175/0000005600000002/v1_201704290021/S0366317516300826/v1_201704290021/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Valores del TEC de las perovskitas La0.9Sr0.1Cr1-xMxO3 (M=Mg, AI, Ti, Mn, Fe, Co, Ni; 0=x=0.1 de 150 a 1000°C en atmósfera de aire e hidrógeno [86]. Valores del TEC de las perovskitas La0.9Sr0.1Cr1-xMxO3 (M=Mg, AI, Ti, Mn, Fe, Co, Ni; 0=x=0.1 de 150 a 1000°C en atmósfera de aire e hidrógeno [86].](https://static.elsevier.es/multimedia/03663175/0000005600000002/v1_201704290021/S0366317516300826/v1_201704290021/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)

