La exenteración pélvica es uno de los procedimientos quirúrgicos más mutilantes, con elevada morbilidad postoperatoria. La técnica laparoscópica tiene la finalidad de reducir las complicaciones perioperatorias y reducir la recuperación posquirúrgica.
ObjetivoPresentar el primer caso de una exenteración anterior laparoscópica, por melanoma localmente avanzado, realizada en el Instituto Nacional de Cancerología y publicado en México.
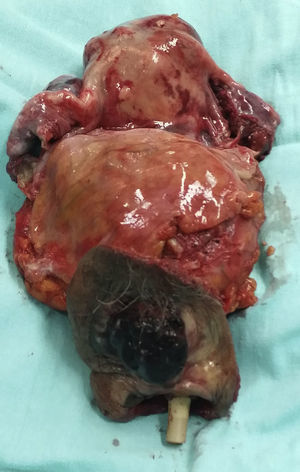
Descripción del casoPaciente de 60años de edad con diagnóstico de melanoma vulvar invasivo con extensión vesical. Se realizó exenteración pélvica anterior por laparoscopia con reconstrucción urinaria externa. El tiempo operatorio fue de 505min, y la pérdida de sangre estimada fue de 400ml. No se presentaron complicaciones durante o en el postoperatorio inmediato. El estudio histopatológico final reportó: lesión nodular que sustituye completamente el clítoris y se extiende hacia el labio mayor izquierdo; mide 3×2.5×2cm y se localiza respecto a los márgenes libres con invasión al espacio perineural y diseminación intraepitelial en uretra y trígono vesical.
ConclusionesLa exenteración pélvica anterior laparoscópica en una alternativa segura en pacientes bien seleccionadas, con tiempo operatorio, complicaciones operatorias y tiempo de recuperación aceptables.
Pelvic exenteration is one of the most mutilating surgical procedures with high post-operative morbidity. The laparoscopic technique aims to reduce perioperative complications and reduce post-surgical recovery.
ObjectiveWe present the first case of laparoscopic anterior exenteration for locally advanced melanoma, held at the National Cancer Institute and published in Mexico.
Case reportPatient 60 years of age diagnosed with invasive vulvar melanoma with bladder extension upon whom laparoscopic anterior pelvic exenteration with external urinary reconstruction was performed. Time in surgery was 505minutes and estimated blood loss was 400ml. No complications occurred during or immediately after surgery. The final histopathological study reported: nodular lesion that completely replaces the clitoris and spreads to the left labia majora, measures 3×2.5×2cm and is located relative to the free margins with perineural invasion intraepithelial spread in space and urethra and bladder trigone.
ConclusionsThe laparoscopic anterior pelvic exenteration is a safe alternative in well-selected patients, with acceptable time in surgery, surgical complications and recovery time.
El melanoma de la vulva es una neoplasia rara que representa el 1-3% de todos los melanomas diagnosticados en la mujer; sin embargo, es la segunda neoplasia más común de la vulva1. Debido a la rareza de la neoplasia no se han podido establecer guías de manejo y su abordaje terapéutico se transpola del manejo del melanoma cutáneo. La supervivencia a 5años reportada se encuentra entre el 8 y el 55%2. La cirugía sigue siendo el tratamiento de elección, y aunque durante la última década se ha abogado por una cirugía conservadora que proporciona similar control locorregional, la extensión de la enfermedad determinará la radicalidad del tratamiento3. La exenteración pélvica inicialmente descrita por Brunschwig en 1948, cuya indicación actual más común es el cáncer cervical central recurrente después del tratamiento primario con quimioterapia y radioterapia, también está indicada como tratamiento del cáncer de vulva y vagina localmente avanzados o recurrentes4. Continúa siendo uno de los procedimientos quirúrgicos más mutilantes, con elevada morbilidad postoperatoria, por lo que se han investigado nuevos abordajes mínimamente invasivos con el fin de reducir las complicaciones perioperatorias y una recuperación posquirúrgica en menor tiempo5. La exenteración pélvica anterior es un procedimiento que ha demostrado ser factible, seguro y con ciertas ventajas sobre su abordaje clásico, que es la exenteración pélvica total4. En este reporte nosotros mostramos la factibilidad de la exenteración anterior con abordaje laparoscópico abdominal.
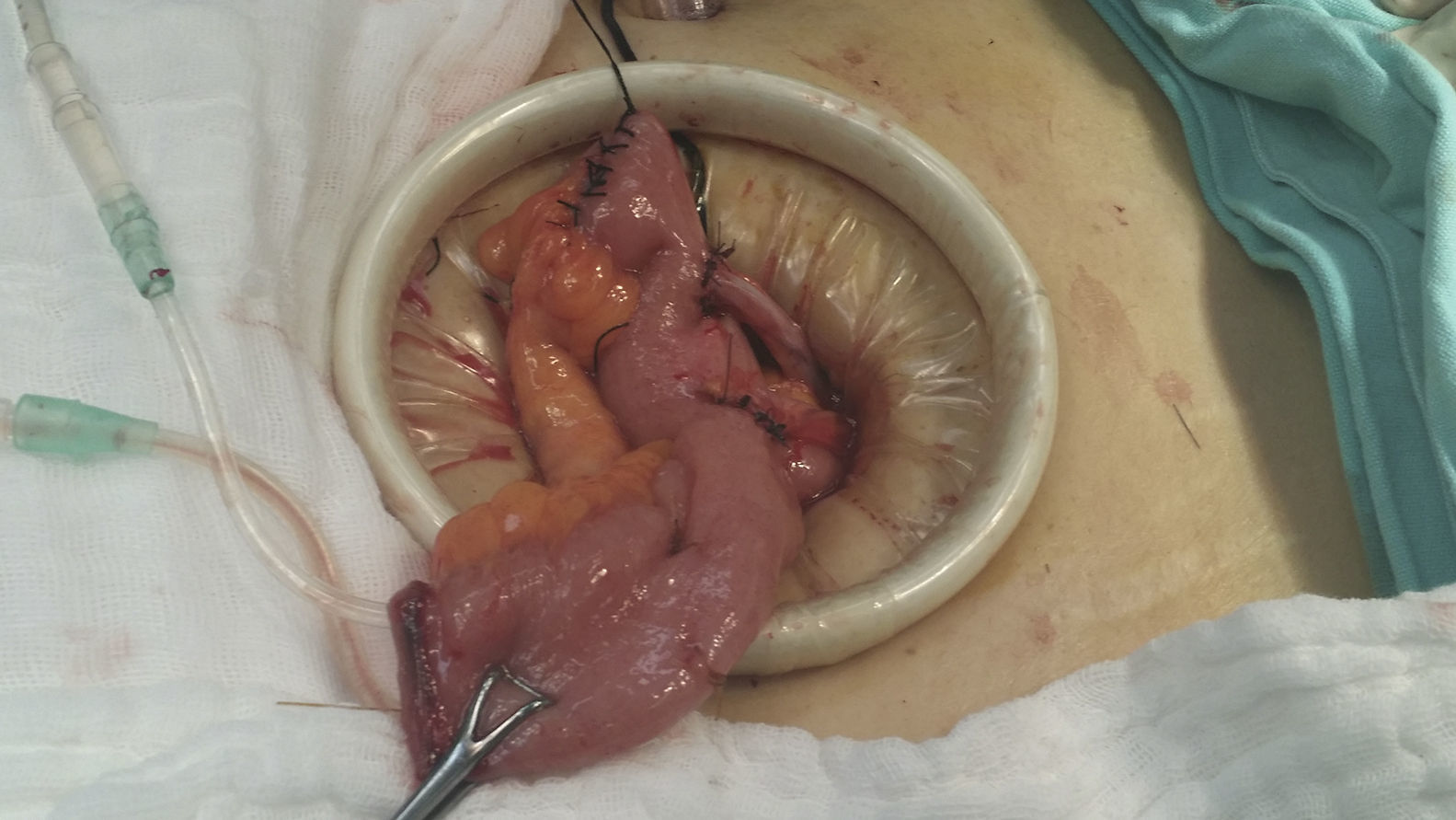
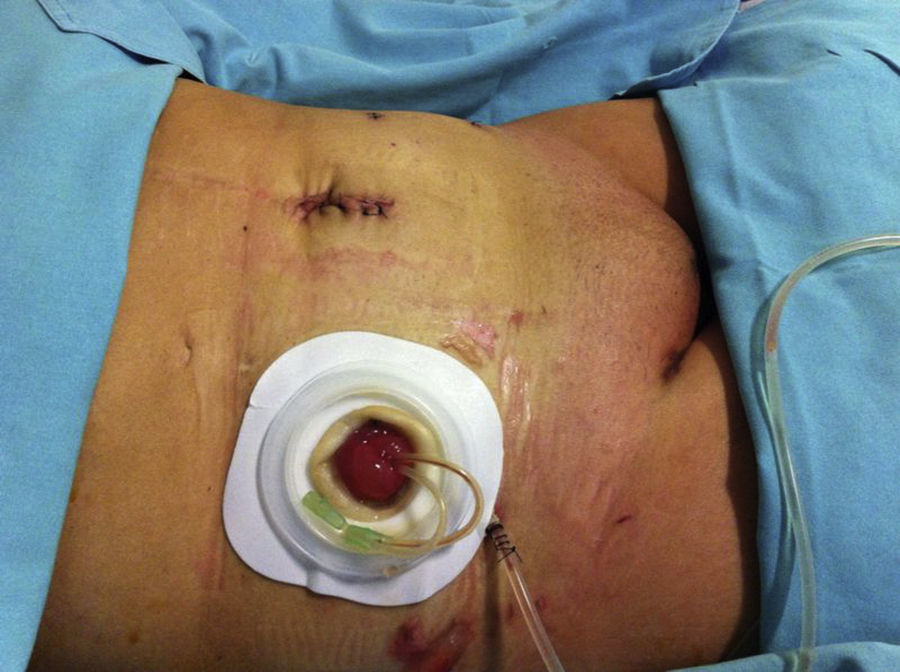
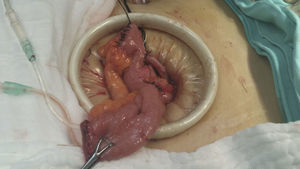
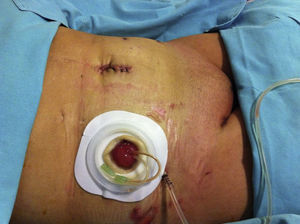
Reporte de casoMujer de 60 años que acudió al Instituto Nacional de Cancerología en mayo de 2014 con IMC de 22.8kg/m2. Durante la exploración física se identificó una lesión hiperpigmentada en vulva de 4×4cm que afectaba el clítoris y los labios menor y mayor derechos. La biopsia de la lesión de vulva reportó melanoma invasivo Breslow de 3mm. En radiografía de tórax y tomografía de abdomen y pelvis no se evidenció enfermedad metastásica a distancia; cistoscopia con lesión hiperpigmentada del trígono vesical con biopsia reportada con extensión intraepitelial por melanoma. Previo a la exenteración se realizó a la paciente biopsia de ganglio centinela con 99mTc y azul patente aplicados peritumoral y buscando ganglios inguinales, que fueron negativos a metástasis. En un segundo tiempo quirúrgico se planteó la exenteración pélvica anterior laparoscópica con derivación urinaria tipo Bricker como el tratamiento de elección para esta patología, la cual se realizó con la paciente en posición de Trendelenburg. El procedimiento se inició con la colocación de un VCare® Uterine Manipulator/Elevator (ConMed Endosurgery, Utica, NY) en el útero, posteriormente una incisión supraumbilical de 30mm, hasta la cavidad abdominal; se colocó un Alexis GelPort laparoscopic system (Applied), se insufló con CO2 a una presión de 15mmHg. Se utilizaron 4 trócares (Ethicon); 2 trócares de 5mm cada uno fueron colocados a la derecha y la izquierda de los cuadrantes inferiores, respectivamente, y 2 trócares de 10mm cada uno se colocaron a la derecha y la izquierda de los flancos a nivel de la cicatriz umbilical, respectivamente. Se introdujo en el GelPort un lente de 10mm de 30grados, se exploró la cavidad abdominal y, posteriormente a realizar apertura del ligamento ancho, a nivel del ligamento redondo, desplazando el corte paralelo al ligamento infundibulopélvico, que se logra colocando el útero en contra-tracción al corte; se disecan espacios retroperitoneales paravesicales y pararrectales, posteriormente el espacio rectovaginal y el de Retzius, y se seccionaron los ligamentos infundibulopélvicos. Se exploraron los ganglios pélvicos, sin evidencia de ser metastásicos, por lo que se procedió a identificar las arterias uterinas, vesicales superiores y umbilicales obliteradas, las cuales se coagularon y se cortaron a nivel de la emergencia de la arteria hipogástrica con un coagulador bipolar LigaSure™ laparoscópico (5mm blunt tip, Medtronic); se seccionaron los parametrios hasta la pared pélvica y se disecó la vejiga, continuando la disección por el espacio de Retzius, coagulando y seccionando el uraco y disecando lateralmente hasta unirlos con los espacios paravesicales, hasta el piso pélvico; los uréteres fueron liberados de los tejidos adyacentes hasta su inserción con la vejiga, donde fueron seccionados. En el mismo tiempo quirúrgico se realizó la resección perineal y vulvectomía anterior y lateral, con margen tridimensional de 2cm del tumor (melanoma), hasta obtener comunicación con la cavidad pélvica, preservando y verificando la integridad de la pared anterior del recto (se realizó una sutura de capa muscular rectal a 5cm de margen anal en la cara anterior por lesión inadvertida por quemadura de 5mm); toda la disección fue realizada con un coagulador bipolar LigaSure™ laparoscópico (5mm blunt tip, Covidien). Posteriormente a nivel abdominal se extrajo por el puerto de Alexis hacia fuera de la pared abdominal el íleon, y a 30cm de la válvula ileocecal se seccionó una porción de íleon de 20cm aproximadamente, con un pedículo de mesenterio con sus vasos ileales; se realizó un conducto bricker anastomosando los uréteres con puntos de sutura simples con Monocryl 3-0, cerrando el extremo distal en 2 planos (fig. 1); exteriorizando el estoma ileal por el sitio del puerto lateral derecho superior (fig. 2) se colocó drenaje cerrado a pelvis, exteriorizado en el sitio de la herida inferior derecha.
El tiempo operatorio fue de 505min, y la pérdida de sangre fue de 400ml (incluyendo la pieza quirúrgica). No hubo complicaciones transoperatorias o postoperatorias inmediatas. La paciente fue dada de alta a los 8días de la cirugía, y reingresó a los 30días del postoperatorio con fistula de recto a periné a 5cm en la cara anterior rectal, lo que se resolvió con colostomía en asa de sigmoides. A 14meses de cirugía se encuentra sin evidencia de actividad tumoral y sin complicaciones actuales derivadas de la cirugía.
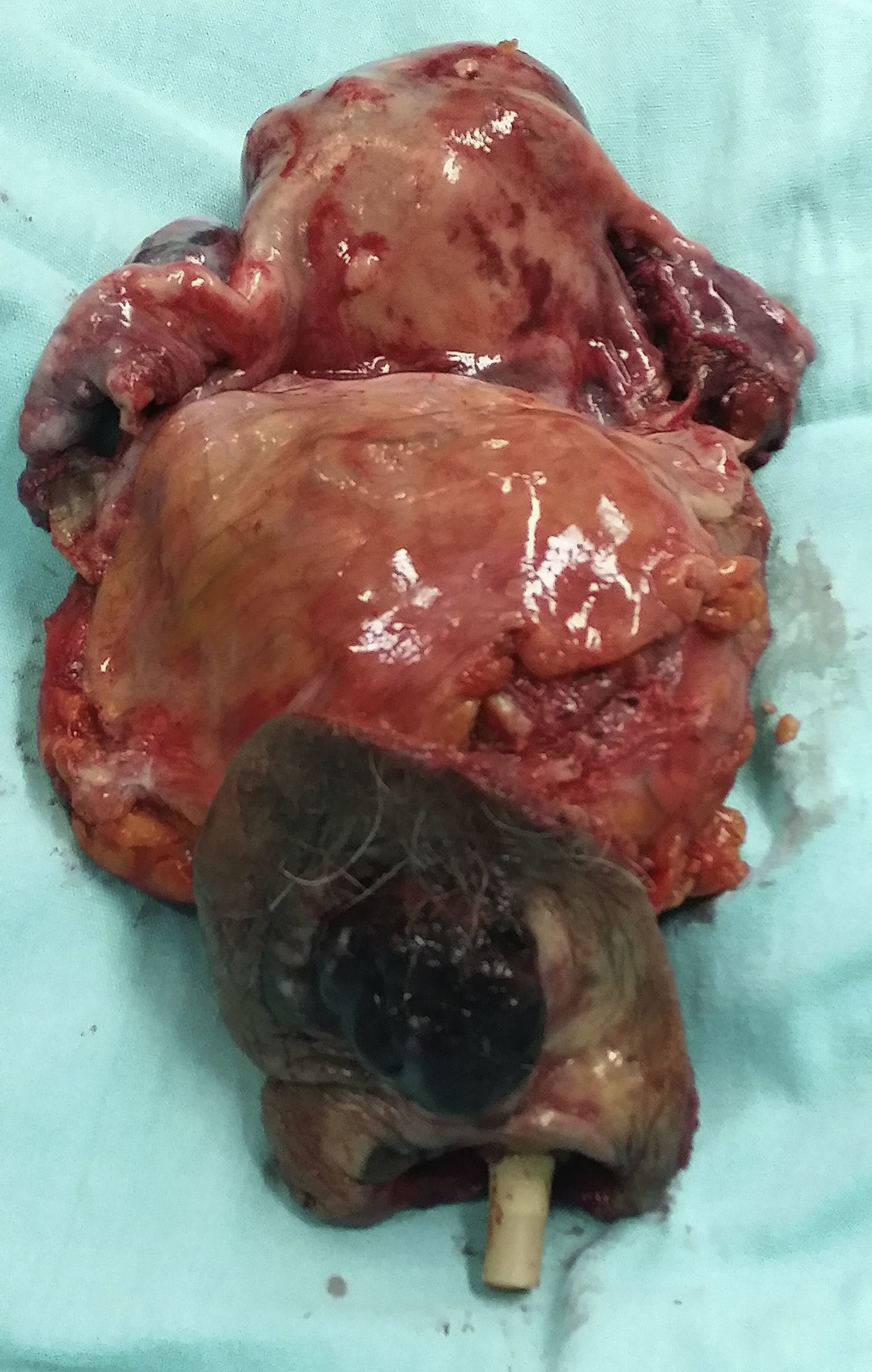
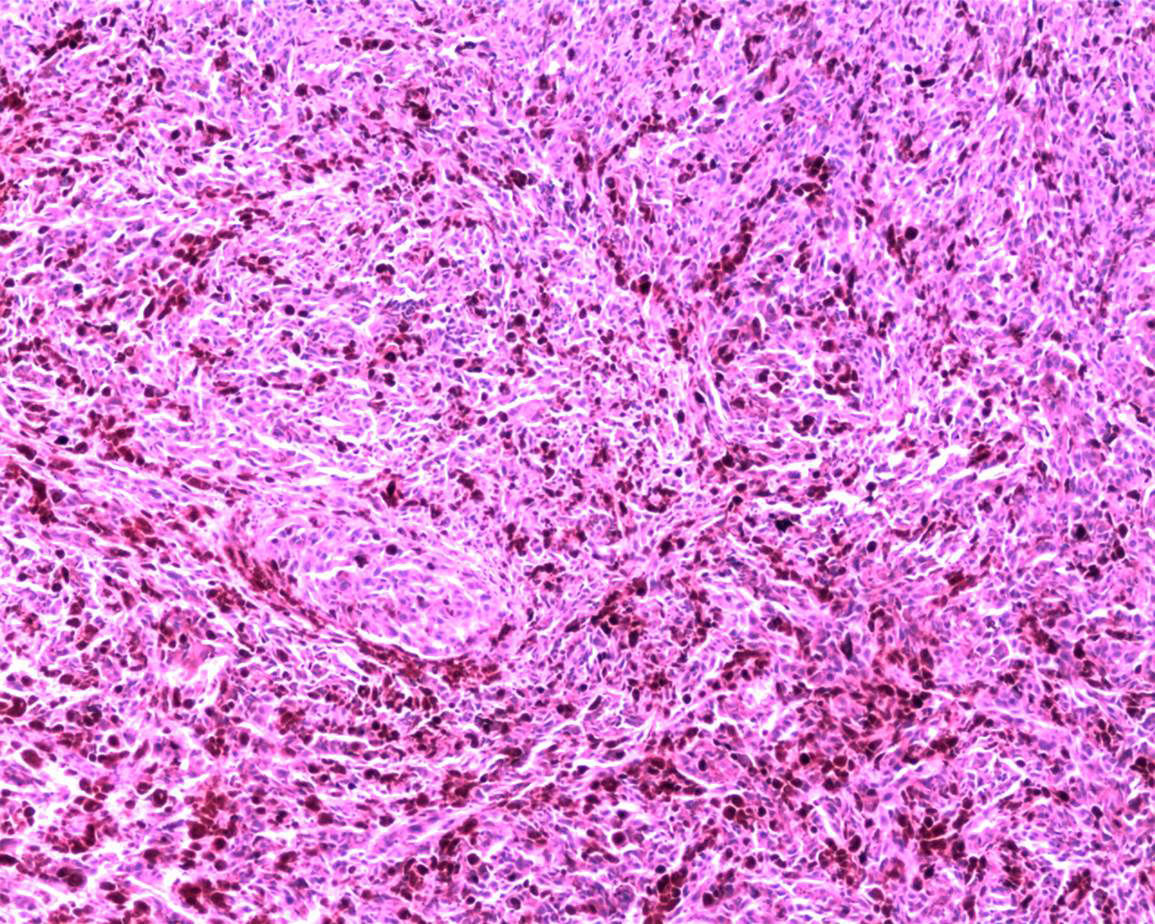
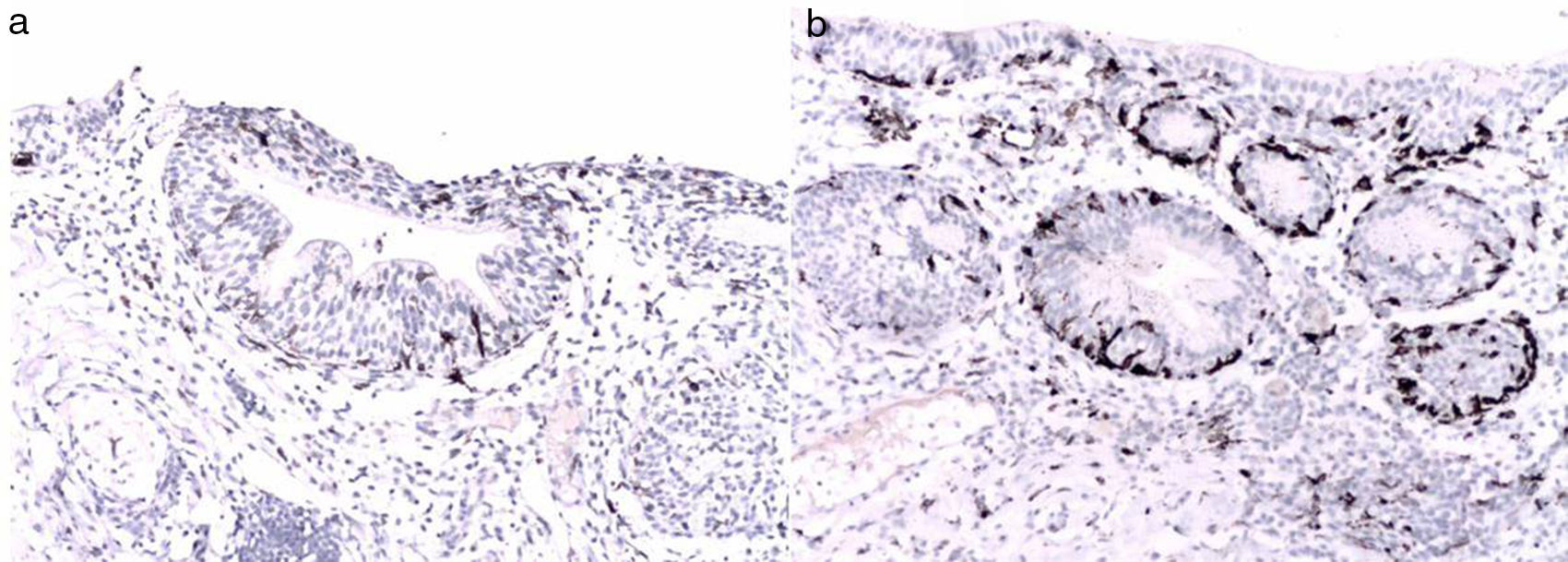
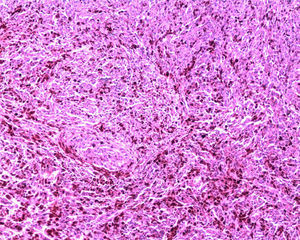
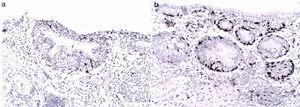
Reporte final de patologíaMelanoma de vulva en fase de crecimiento vertical, ulcerado, Breslow de 13mm, 9 mitosis/mm2, con invasión al espacio perineural y diseminación intraepitelial en uretra y trígono vesical (figs. 3-6). Sin células neoplásicas en el lecho y en los bordes quirúrgicos. Cérvix y endometrio sin alteraciones. Leiomioma uterino intramural, ovarios derecho e izquierdo con cuerpos blancos, salpinges izquierda y derecha congestivas.
El melanoma de vulva ocurre en aproximadamente el 9% de todas las neoplasias primarias de la vulva. Su pico de incidencia se sitúa entre la sexta y la séptima décadas de la vida3. Es un melanoma vulvar raro, pero representa el segunda neoplasia maligna más común de la vulva. Clínicamente suele presentarse como una lesión pigmentada elevada y puede estar ulcerada. El sitio con mayor afectación es el labio mayor y el clítoris, presentación semejante a nuestro caso6. Se han utilizado múltiples sistemas de estadificación para este tipo de melanomas (Clark, Breslow o localización anatómica), pero se ha demostrado que el espesor del tumor es el factor predictivo de supervivencia más importante, por lo que se estadifica basándose en el American Joint Committee on Cancer7. El comportamiento biológico del melanoma de la vulva ha mostrado ser pobre, comparado con los casos de melanoma cutáneo, con una alta tendencia hacia la recurrencia local y a distancia. Seifried et al.1 reportaron en su estudio que predictores de pobre supervivencia libre de enfermedad eran tener un Breslow y patrón mitótico elevado así como la ulceración. De ellos, nuestra paciente presenta los 3 factores8.
Es difícil desarrollar guías de manejo de esta neoplasia debido a su rareza y a la imposibilidad de realizar estudios aleatorizados. Sin embargo, la cirugía es el tratamiento inicial de elección para el melanoma de vulva, y al cabo de los últimos años la extensión de la cirugía ha cambiado hacia procedimientos más conservadores debido a que no se han visto diferencias en la supervivencia en pacientes sometidos a escisiones amplias vs vulvectomías radicales9,10, mientras se consigan márgenes negativos, así como la estatificación ganglionar por medio del ganglio centinela11. En un melanoma de gran tamaño, con proximidad o involucro de la uretra, vejiga, ano y recto, debe considerarse la exenteración4.
Desde la primera descripción de la exenteración pélvica por Brunschwig12 en 1948, con intento paliativo en pacientes con cáncer pélvico avanzado, se asoció con tasas inaceptables de morbimortalidad postoperatoria. Con el tiempo, este procedimiento se convirtió en la piedra angular en el tratamiento de tumores malignos de la pelvis avanzada13, y ha habido un desarrollo de la exenteración durante las últimas décadas, siendo indicada actualmente como manejo del cáncer de cérvix, vagina, vulva, urológicos e intestinales localmente avanzadas o recurrentes, con intento curativo14-16. Pero a pesar de los avances quirúrgicos y anestésicos, la morbilidad transoperatoria y postoperatoria sigue siendo alta, por lo que se han reportado reducciones en la extensión de la resección durante la exenteración, realizándose actualmente exenteraciones anteriores o posteriores según los órganos involucrados por la neoplasia4. En nuestra paciente, desde la evaluación preoperatoria ya se había confirmado involucro vesical y uretral, por lo que se decidió realizar la exenteración anterior dado que era improbable conseguir márgenes negativos si se intentaba una resección menos radical.
El abordaje laparoscópico, que en un inicio se utilizó para evaluar pacientes candidatas a exenteración, ha emergido como una opción para el tratamiento de neoplasias que ameritan una exenteración pélvica, con el fin de disminuir la morbilidad intraoperatoria y postoperatoria (pérdida sanguínea, estancia intrahospitalaria, menores complicaciones postoperatorias) en comparación con el abordaje abierto convencional5. Además, se ha reportado que este abordaje permite los diferentes tipos de reconstrucción urinaria (conducto ileal tipo Bricker, reservorio Miami) con adecuada seguridad17.
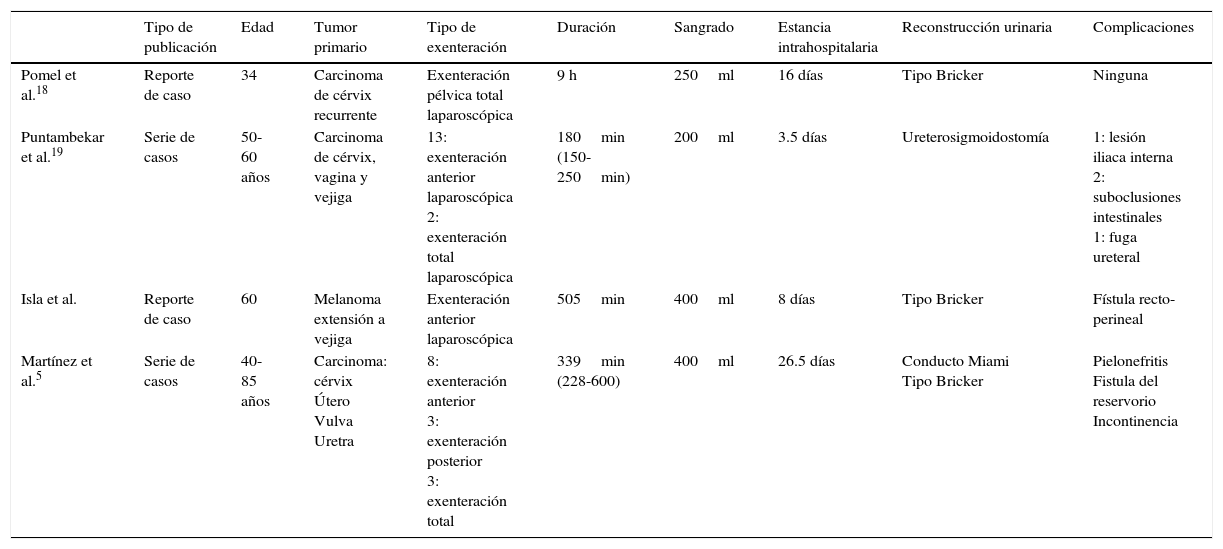
Existen en la literatura reportes de casos y series con un número pequeño de pacientes, que se describen en la tabla 1.
Resultados quirúrgicos de reportes de exenteración pélvica laparoscópica
| Tipo de publicación | Edad | Tumor primario | Tipo de exenteración | Duración | Sangrado | Estancia intrahospitalaria | Reconstrucción urinaria | Complicaciones | |
|---|---|---|---|---|---|---|---|---|---|
| Pomel et al.18 | Reporte de caso | 34 | Carcinoma de cérvix recurrente | Exenteración pélvica total laparoscópica | 9 h | 250ml | 16 días | Tipo Bricker | Ninguna |
| Puntambekar et al.19 | Serie de casos | 50-60 años | Carcinoma de cérvix, vagina y vejiga | 13: exenteración anterior laparoscópica 2: exenteración total laparoscópica | 180min (150-250min) | 200ml | 3.5 días | Ureterosigmoidostomía | 1: lesión iliaca interna 2: suboclusiones intestinales 1: fuga ureteral |
| Isla et al. | Reporte de caso | 60 | Melanoma extensión a vejiga | Exenteración anterior laparoscópica | 505min | 400ml | 8 días | Tipo Bricker | Fístula recto-perineal |
| Martínez et al.5 | Serie de casos | 40-85 años | Carcinoma: cérvix Útero Vulva Uretra | 8: exenteración anterior 3: exenteración posterior 3: exenteración total | 339min (228-600) | 400ml | 26.5 días | Conducto Miami Tipo Bricker | Pielonefritis Fistula del reservorio Incontinencia |
Pomel et al.18 reportaron en 2003 un caso de exenteración pélvica total con abordaje laparoscópico abdominal, con un tiempo operatorio de 9h y un sangrado de 250ml. Realizaron una reconstrucción urinaria tipo Bricker y la paciente tuvo una estancia intrahospitalaria de 16 días sin complicaciones postoperatorias, mostrando ser factible este procedimiento18.
Puntambekar et al.19 publicaron en 2006 una revisión de 16 casos. Las histologías de las pacientes fueron carcinoma de cérvix primario y recurrente y carcinoma de vagina y vejiga primarios. Se realizó en 13 pacientes exenteración anterior con ureterosigmoidostomía, y en 2 pacientes, exenteración pélvica total. El tiempo promedio quirúrgico fue de 180min, con una pérdida sanguínea de 200ml. Las complicaciones transoperatorias ocurrieron en una sola paciente (lesión de la arterial iliaca interna) y 3 pacientes presentaron complicaciones postoperatorias (2 suboclusiones y una fuga ureteral). La estancia intrahospitalaria fue corta y no hubo conversión a cirugía abierta o mortalidad reportada en esta serie con un seguimiento de 15meses, en donde no se había reportado recurrencia de ninguna de las pacientes. Este autor concluye que la exenteración pélvica laparoscópica (anterior o total) es posible, segura, con una baja morbilidad y que se sigue manteniendo los beneficios de la cirugía laparoscópica a pesar de ser un procedimiento radical, como son disminución del sangrado transoperatorio, estancia intrahospitalaria corta y recuperación más rápida19. En nuestra paciente también se pudieron evidenciar estos beneficios de la cirugía laparoscópica: el sangrado reportado fue de 400ml, la estancia intrahospitalaria fue corta (8días) y no se reportaron complicaciones transoperatorias o postoperatorias inmediatas, solo una complicación al día 30 del postoperatorio (fístula rectoperineal), corregida con colostomía en asa de sigmoides.
El tipo de derivación urinaria que se realizó en nuestra paciente fue a elección del cirujano de acuerdo a las características de la neoplasia y a los aspectos socioculturales y constitucionales de la paciente, y aunque se sabe que el tipo de derivación influirá en la calidad de vida de la paciente, consideramos que nuestra paciente se encontraba adecuadamente adaptada al conducto ileal durante su evaluación ambulatoria. Pero como Martínez et al.5 reportaron en 2010, el conducto Miami, en pacientes adecuadamente seleccionadas, es la derivación urinaria de elección (ventajas en calidad de vida), además de que puede ser realizado por abordaje laparoscópico con un porcentaje de complicaciones semejante al abordaje abierto5.
Tomando en cuenta que los márgenes negativos constituyen uno de los principales factores pronósticos en este tipo de procedimiento, independientemente del tipo histológico, se ha reportado la obtención de los mismos en las series ya descritas5,19. En nuestra paciente los márgenes fueron negativos, pero como se describió anteriormente, tiene múltiples factores de pronóstico positivo para la recurrencia tanto local como a distancia.
Como se comentó anteriormente, el manejo actual del melanoma de vulva ha migrado hacia procedimientos más conservadores y hay pocos reportes actuales sobre el uso de la exenteración como parte del tratamiento primario, ya que la radicalidad será establecida por la extensión de la enfermedad9.
Es necesario continuar realizando este tipo de procedimientos mediante abordaje laparoscópico con el fin de tener datos más contundentes que permitan la realización sistémica de este tipo de abordaje. Además, es necesario que el cirujano desarrolle las habilidades necesarias para su realización.
ConclusiónLa exenteración pélvica anterior por laparoscopia en una alternativa segura en pacientes bien seleccionadas. Sobre todo, debe individualizarse de acuerdo a las características físicas de la paciente, así como considerar la extensión y la naturaleza de la neoplasia a tratar, con tiempo operatorio, complicaciones operatorias aceptables y con los beneficios que tiene la laparoscopia, menor sangrado, menor estancia hospitalaria y mejor recuperación postoperatoria en comparación con la cirugía abierta.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.