La enfermedad peritoneal diseminada debe considerarse como un estadio locorregional de la enfermedad, y por tanto, candidata a una opción terapéutica con intención curativa mediante cirugía citorreductora y quimioterapia intraperitoneal hipertérmica perioperatoria.
ObjetivoComprobar si la esponja de colágeno con fibrinógeno 5.5mg y trombina 2UI, aplicada como sellante tisular, contribuye a la reducción del número de dehiscencia anastomóticas.
Material y métodosEstudio cuasi-experimental, comparativo, prospectivo, caso y controles en pacientes con carcinomatosis peritoneal de origen colorrectal, intervenidos en nuestra Unidad de Cirugía Oncológica Peritoneal desde 2011 hasta abril de 2014. Nuestra serie consta de 73 pacientes, 43 (59%) hombres y 30 (41%) mujeres, diagnosticados de cáncer de origen colorrectal y candidatos a cirugía citorreductora y quimioterapia intraperitoneal hipertérmica perioperatoria. En 49 pacientes (67%) se realizaron anastomosis digestivas; dichos pacientes se aleatorizaron en 2 grupos: A control (27), y B hipótesis (22) con sutura reforzada con esponja.
ResultadosEl número total de anastomosis fueron 49 (x˙: 1.9), 27 en el grupo A (x˙: 1.88) y 22 en B (x˙: 2.16). Las citorreducciones alcanzadas fueron: citorreducción completa 0: 38 (77.5%), citorreducción completa 1: 7 (14.8%), y en 4 (8.1%) no se realizó quimioterapia intraperitoneal hipertérmica perioperatoria por citorreducción completa>2. Fístula intestinal: 3 casos (6.1%) en el grupo A (sin esponja medicamentosa) frente a 0 en el grupo B.
ConclusiónEl empleo en nuestra serie de la esponja de fibrinógeno y trombina ha contribuido a una reducción significativa del riesgo de fístulas digestivas, en pacientes oncológicos de alto riesgo.
Peritoneal disseminated disease, regardless of its origin, should currently be considered a locoregional disease stage, and thus a candidate for an intention to treat therapeutic option with debulking surgery and hyperthermic intraperitoneal chemotherapy.
ObjectiveTo determine whether or not the collagen sponge with fibrinogen 5.5mg and thrombin 2IU, applied as a tissue sealant and gastrointestinal reinforcement sutures, contributes to the reduction of anastomotic leak.
Material and methodsQuasi-experimental, comparative, prospective, case/control study conducted on patients with peritoneal carcinomatosis of colorectal origin, operated on in our Peritoneal Cancer Surgery Unit from 2011 to April 2014. The study included 73 patients, 43 (59%) men and 30 (41%) women with peritoneal carcinomatosis of colorectal origin, candidates for debulking surgery and hyperthermic intraperitoneal chemotherapy. Gastrointestinal anastomoses were performed on 49 (67%) patients. These patients were randomised into 2 groups: A control (27) and B hypothesis (22) reinforced with sponge suture.
ResultsThe total number of anastomoses performed was 49 (mean: 1.9), with 27 in the control group A (mean: 1.88) and 22 in B (mean: 2.16). The debulkings achieved were: complete debulking 0.38 (77.5%), complete debulking 1: 7 (14.8%), and 4 (8.1%) did not undergo hyperthermic intraperitoneal chemotherapy due to complete debulking>2. Intestinal fistula: 3 cases (6.1%) in A group vs 0 in B.
ConclusionsIn our series, the use of a fibrinogen and thrombin sponge has contributed to a significant reduction in the risk of gastrointestinal fistulas in high risk oncology patients.
Actualmente, la enfermedad peritoneal diseminada o carcinomatosis peritoneal debe considerarse como un estadio locorregional de la enfermedad independientemente de su origen. En base a este planteamiento presenta una opción terapéutica con intención curativa: la cirugía citorreductora y quimioterapia hipertérmica intraperitoneal perioperatoria.
La alta morbilidad de esta técnica (30-65%) puede reducirse de forma significativa extremando la selección de candidatos a cirugía, derivando a unidades especializadas con equipos multidisciplinares cohesionados y mediante la práctica de una técnica quirúrgica depurada, que contribuya a reducir el número de complicaciones como las fístulas intestinales, entre otras1. La dehiscencia anastomótica tras cirugía citorreductora y quimioterapia hipertérmica intraperitoneal perioperatoria oscila entre el 5 y 12%. Son muchos los procedimientos que han sido desarrollados para reducir el riesgo de fuga anastomótica, incluyendo el uso de materiales para reforzar las líneas de suturas2.
La esponja medicamentosa contiene (por cm2) fibrinógeno humano 5.5mg y trombina humana 2UI, y está indicada en adultos como tratamiento de apoyo en diversas cirugías para mejorar la hemostasia, favorecer el sellado tisular y como refuerzo de suturas en cirugía vascular.
El objetivo del estudio es comprobar si la esponja de colágeno con fibrinógeno 5.5mg y trombina 2 aplicada como sellante tisular y como refuerzo de suturas digestivas contribuye o no a la reducción del número de dehiscencias anastomóticas. Este compuesto ha demostrado ser eficaz en la disminución de la tasa de fuga anastomótica digestiva en modelos animales. La presencia de fibrinógeno y trombina alrededor de la sutura favorece la estanqueidad de la sutura, y establece puentes biológicos que favorecen la cicatrización. La desaparición del material por las rutas metabólicas endógenas de la fibrina impide la aparición de complicaciones relacionadas con otros materiales protésicos de protección no degradables.
Material y métodosHemos diseñado el presente estudio cuasi-experimental, comparativo, prospectivo, tipo casos y controles en pacientes con carcinomatosis peritoneal de origen gastrointestinal (carcinoma colorrectal), intervenidos en nuestra Unidad de Cirugía Oncológica Peritoneal; entre el 1 de enero del 2011 y el 1 de enero del 2014 en el que aplicamos la esponja medicamentosa en pacientes con anastomosis digestivas. Nuestra serie consta de 73 pacientes, 43 (59%) hombres y 30 mujeres (41%), todos ellos diagnosticados de carcinomatosis peritoneal y candidatos a tratamiento quirúrgico potencialmente curativo con técnicas de cirugía citorreductora y quimioterapia hipertérmica intraperitoneal perioperatoria. En 49 (67%) de estos pacientes, 28 hombres y 21 mujeres, con carcinomatosis peritoneal de origen colorrectal se realizaron anastomosis digestivas. Dichos pacientes se dividieron aleatoriamente en 2 grupos: Grupo A/control (n=27): edad media 61.5años (rango: 39-72). No se empleó esponja medicamentosa.
Grupo B/casos (n=22): edad media 56.2años (rango: 35-69), línea de anastomosis reforzada con esponja medicamentosa.
Los procedimientos utilizados en los pacientes (casos) y en los controles han sido realizados tras la obtención del consentimiento informado y se han seguido los protocolos establecidos en nuestro centro.
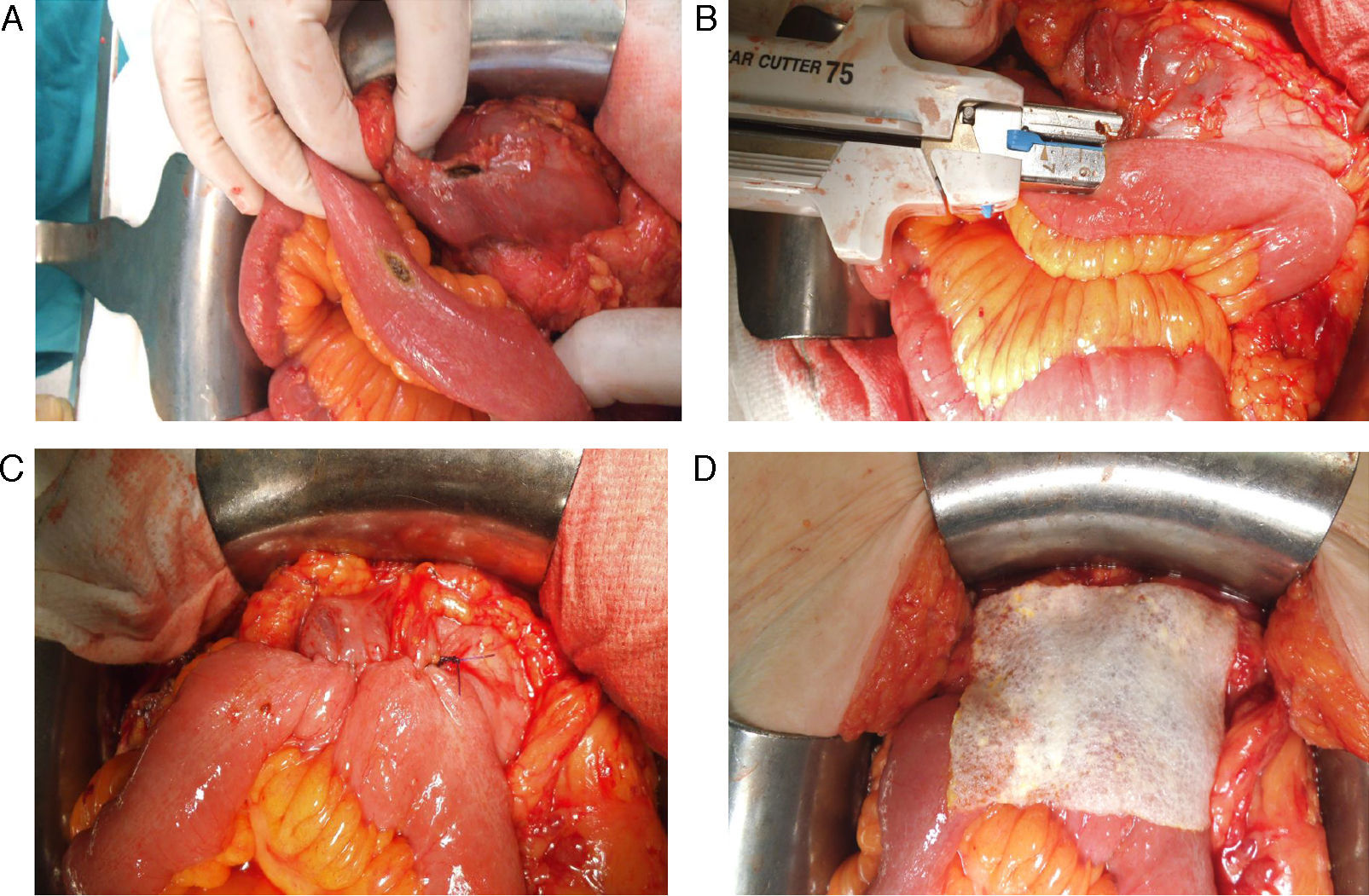
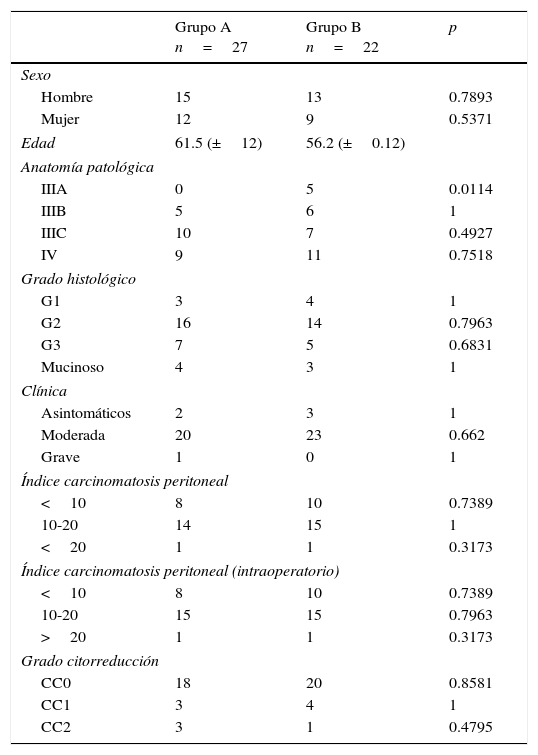
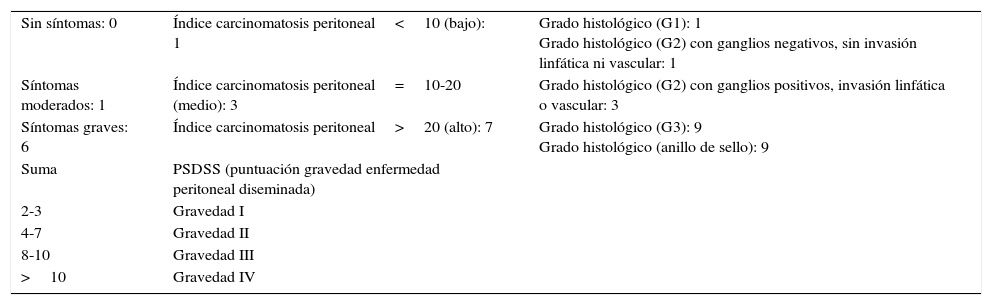
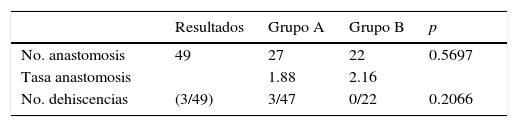
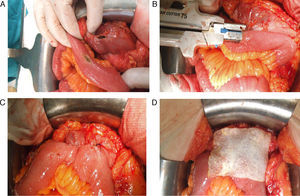
Todas las suturas fueron mecánicas y realizadas siempre por los 2 mismos cirujanos. La esponja fue colocada cubriendo toda la anastomosis, sobrepasando al menos 0.5-1cm a cada lado de la línea de sutura y ejerciendo una leve presión sobre la misma (fig. 1). El tamaño de la esponja empleada fue de 9.5×4.8cm.
Reforzamiento de la anastomosis mediante esponja medicamentosa. Anastomosis yeyuno-cólica latero-lateral mecánica tras hemicolectomía derecha en paciente con carcinomatosis peritoneal de origen colorrectal. A. Preparación de anastomosis: incisión con electrobisturí de yeyuno y colon transverso. B. Introducción de GIA 75mm a través de ambas incisiones para anastomosis. C. Resultado final de anastomosis intestinal yeyuno-cólica latero-lateral mecánica. D. Colocación de esponja medicamentosa sobre anastomosis intestinal.
La mayoría de las anastomosis fueron cubiertas con una sola lámina, en caso de requerir 2 o más, se registró en la historia clínica. Ambos grupos no presentaban diferencias poblacionales significativas (tabla 1).
Características de los pacientes
| Grupo A n=27 | Grupo B n=22 | p | |
|---|---|---|---|
| Sexo | |||
| Hombre | 15 | 13 | 0.7893 |
| Mujer | 12 | 9 | 0.5371 |
| Edad | 61.5 (±12) | 56.2 (±0.12) | |
| Anatomía patológica | |||
| IIIA | 0 | 5 | 0.0114 |
| IIIB | 5 | 6 | 1 |
| IIIC | 10 | 7 | 0.4927 |
| IV | 9 | 11 | 0.7518 |
| Grado histológico | |||
| G1 | 3 | 4 | 1 |
| G2 | 16 | 14 | 0.7963 |
| G3 | 7 | 5 | 0.6831 |
| Mucinoso | 4 | 3 | 1 |
| Clínica | |||
| Asintomáticos | 2 | 3 | 1 |
| Moderada | 20 | 23 | 0.662 |
| Grave | 1 | 0 | 1 |
| Índice carcinomatosis peritoneal | |||
| <10 | 8 | 10 | 0.7389 |
| 10-20 | 14 | 15 | 1 |
| <20 | 1 | 1 | 0.3173 |
| Índice carcinomatosis peritoneal (intraoperatorio) | |||
| <10 | 8 | 10 | 0.7389 |
| 10-20 | 15 | 15 | 0.7963 |
| >20 | 1 | 1 | 0.3173 |
| Grado citorreducción | |||
| CC0 | 18 | 20 | 0.8581 |
| CC1 | 3 | 4 | 1 |
| CC2 | 3 | 1 | 0.4795 |
Criterios de inclusión: pacientes diagnosticados de carcinomatosis peritoneal de origen colorrectal y candidatos a tratamiento quirúrgico potencialmente curativo con técnicas de cirugía citorreductora y quimioterapia hipertérmica intraperitoneal perioperatoria.
Criterios de exclusión: pacientes diagnosticados de carcinomatosis peritoneal de origen no colorrectal. Pacientes sometidos a otra intervención (quimioterapia peritoneal normotérmica). No hay pérdida de pacientes durante todo el seguimiento.
Las variables a estudio son: sexo, edad, anatomía patológica, grado histológico, datos clínicos, índice carcinomatosis peritoneal, índice carcinomatosis peritoneal (intraoperatorio) y grado citorreducción.
Todos los pacientes incluidos en este estudio cumplían con estrictos criterios de inclusión para tratamiento quirúrgico mediante cirugía citorreductora y quimioterapia hipertérmica intraperitoneal perioperatoria y fueron informados, de forma oral y escrita, de su participación en este estudio, siendo necesario la firma del paciente y la de un familiar allegado para su inclusión. En todos los casos nos ajustamos a la legislación vigente, incluida la actual Ley sobre Protección de Datos.
Según la anatomía patológica de la pieza quirúrgica, los tumores se estadificaron como: IIIA (uno), IIIB (11), IIIC (17) y IVB (20). G1: 7 (14%), G2: 30 (61%) y G3:12 (24%). Mucinosos 7 (15%). Según la clínica presentada: 5 (10%) asintomáticos, 43 (88%) con clínica moderada y uno (2%) con importante sintomatología. El índice de carcinomatosis peritoneal radiológico fue≤10: 18 casos (36%), entre 10-20: 29 (59%) y 2 con índice de carcinomatosis peritoneal≥20. Recibieron quimioterapia adyuvante 37 pacientes (75.5%) estadios IIIC y IVB.
Tras la realización de las diversas técnicas de peritonectomías, electrofulguraciones y resecciones viscerales, solo aquellos pacientes en los que se alcanza CC0-CC1 fueron sometidos a quimioterapia hipertérmica intraperitoneal perioperatoria mediante protocolo Sugarbaker con mitomicina+doxorrubicina a 42°C durante 90min. El índice de carcinomatosis peritoneal fue≤10 en 15 casos (30%), entre 10 y 20 en 32 (65%) y ≥20 en 2 (5%). Todos se estratificaron en el preoperatorio según el indicador Peritoneal Surface Disease Severity Score (tabla 2).
Peritoneal Surface Disease Severity Score (PSDSS)
| Sin síntomas: 0 | Índice carcinomatosis peritoneal<10 (bajo): 1 | Grado histológico (G1): 1 Grado histológico (G2) con ganglios negativos, sin invasión linfática ni vascular: 1 |
| Síntomas moderados: 1 | Índice carcinomatosis peritoneal=10-20 (medio): 3 | Grado histológico (G2) con ganglios positivos, invasión linfática o vascular: 3 |
| Síntomas graves: 6 | Índice carcinomatosis peritoneal>20 (alto): 7 | Grado histológico (G3): 9 Grado histológico (anillo de sello): 9 |
| Suma | PSDSS (puntuación gravedad enfermedad peritoneal diseminada) | |
| 2-3 | Gravedad I | |
| 4-7 | Gravedad II | |
| 8-10 | Gravedad III | |
| >10 | Gravedad IV |
Tras un periodo de seguimiento medio de 24meses, los pacientes fueron clasificados según su situación clínica en: libres de enfermedad, vivos con enfermedad, fallecimientos por y sin enfermedad. En ambos grupos, la reconstrucción del tránsito intestinal se realizó tras la administración de la quimioterapia intraperitoneal intraoperatoria hipertérmica. Todas las suturas fueron mecánicas y realizadas siempre por los 2 mismos cirujanos. En el grupo A (control) las anastomosis no fueron reforzadas con esponja medicamentosa; mientras que en los pacientes del grupo B sí lo fueron, siguiendo las normas del fabricante.
Estudio estadísticoPara las comparaciones basales de las características de los pacientes se calculó la prueba Chi cuadrado de Pearson o el estadístico de Fisher según correspondiera. Se midieron las diferencias de incidencia de fístulas anastomóticas mediante la prueba exacta bilateral de Fisher. Para todos los análisis el nivel de significación estadística se fija en el 5%, valor α=0.05.
ResultadosEl número total de anastomosis fueron 49 (x˙: 1.9), 27 en el grupo A (49.4%, x˙: 1.88) y 22 en el B (54.7%, x˙: 2.16). Las citorreducciones alcanzadas fueron: CC0 en 38 pacientes (77.5%), CC1 en 7 (14.8%), y en 4 (8.1%) no se realizó quimioterapia hipertérmica intraperitoneal perioperatoria por CC2-CC3. Dehiscencia de anastomosis y fístula intestinal en 3 casos (6.1%); 2 de ellas en el grupo CC0-CC1 y una en el grupo CC2-CC3. Las 3 en el grupo A/control (sin esponja medicamentosa) frente a ninguna en el grupo B/hipótesis. Dos de ellas requirieron reintervención (estomas) con un incremento significativo en el tiempo de estancia postoperatorio. El tiempo medio de ingreso en nuestra serie en pacientes no complicados fue de 14 días frente a una media de 26 días en los 3 casos complicados con fístula intestinal. Dos pacientes (4.1%) presentaron hemoperitoneo, uno por cada grupo y ambos fueron reintervenidos. La tasa de morbilidad global: 31.7%, grado I-II (21.5%), grado III-IV (10.2%) (tabla 3).
DiscusiónLa esponja medicamentosa contiene, por cm2, fibrinógeno humano 5.5mg y trombina humana 2UI en forma de capa seca en la superficie de una matriz de colágeno. En contacto con los fluidos fisiológicos (por ejemplo, sangre, linfa o una solución salina fisiológica), los componentes de dicha capa se disuelven y se esparcen parcialmente por la superficie de la herida. A continuación se produce una reacción del fibrinógeno y la trombina que inicia la última fase de la coagulación fisiológica de la sangre. El fibrinógeno se convierte en monómeros de fibrina que se polimerizan de manera espontánea para formar un coágulo de fibrina, que mantiene la matriz de colágeno fuertemente adherida a la superficie de la herida. La fibrina queda unida en enlaces cruzados por el factor endógeno XIII, creándose una red firme y mecánicamente estable con buenas propiedades adhesivas, por lo que al mismo tiempo sirve como sellante.
La esponja medicamentosa está indicada solo para uso epilesional. La administración por vía intravascular está contraindicada. Como consecuencia de esto, no se han realizado estudios farmacocinéticos en el hombre. Los selladores de fibrina/hemostáticos se metabolizan de la misma manera que la fibrina endógena por fibrinólisis y fagocitosis. En estudios con animales, la esponja medicamentosa se biodegrada después de la administración en la superficie de la herida, quedando pocos restos después de 13 semanas. Se observó degradación completa de la esponja medicamentosa en algunos animales 12 meses después de su administración sobre una herida en hígado, mientras que en otros se vieron aún pequeños restos. La degradación se asoció con la infiltración de granulocitos y la formación de tejido de granulación reabsorbible que encapsulaba los restos de la degradación progresiva de la esponja medicamentosa. En los estudios con animales no se han observado evidencias de intolerancia local. De la experiencia recogida en humanos, se han encontrado casos aislados, donde los restos observados de forma incidental no ocasionaron daño funcional.
La morbilidad del tratamiento multidisciplinar en la carcinomatosis peritoneal es importante1–3. La morbilidad quirúrgica específica es del 30% y corresponde fundamentalmente a dehiscencias de suturas digestivas, perforaciones y fístulas intestinales, colecciones o abscesos intrabdominales y sangrados posquirúrgicos, responsables de que el 10% de los pacientes requieran una o varias reintervenciones quirúrgicas4.
La incidencia de dehiscencia o fuga anastomótica como complicación postoperatoria de la cirugía colónica se estima en torno al 2 y 5%, asociándose con un incremento de la morbimortalidad. Determinar la causa exacta de la fístula es difícil, estando implicados diversos factores como: malnutrición, hipoproteinemia, inadecuada técnica quirúrgica (pobre vascularización de los cabos intestinales, anastomosis a tensión), entre otros. Hoy en día se sigue discutiendo el papel de la preparación o no del colon previa a la cirugía. Las mayores complicaciones de las fugas anastomóticas son la sepsis por abscesos intraperitoneales (50%), la peritonitis fecaloidea (25%), los abscesos de pared y la infección de herida (25%), con importantes repercusiones en la estancia hospitalaria1,3–8.
Son muchas las técnicas quirúrgicas y los procedimientos que han sido desarrollados para reducir el riesgo de fuga anastomótica, incluyendo el uso de materiales para reforzar las líneas de suturas. Estos incluyen cola de fibrina, politetrafluoroetileno expandido, parches de pericardio bovino, parches de poliglicol y de celulosa oxidada, entre otros muchos. No obstante, son necesarios estudios prospectivos aleatorizados controlados para obtener una evidencia de su eficacia2.
Está indicada en adultos como tratamiento de apoyo en diversas cirugías para mejorar la hemostasia, favorecer el sellado tisular y como refuerzo de suturas en cirugía vascular cuando las técnicas estándar demuestran ser insuficientes. Su eficacia y seguridad han sido demostradas en diversos tipos de cirugía, como por ejemplo tras resecciones hepáticas9,10, reduciendo el drenaje biliar, el débito hemático del lecho hepático, y por consiguiente, una reducción en la estancia postoperatoria. Chirletti et al.11 han demostrado su eficacia en la prevención de la fuga anastomótica pancreaticoyeyunal tras duodenopancreatectomía cefálica. Rickenbacher et al.2 y Toro et al.12 han publicado sendas revisiones acerca del empleo del sellante tisular en cirugía abdominal, no comunicándose complicaciones relacionadas con inmunogenicidad ni tampoco de seguridad. Se ha demostrado su eficacia en reducir el número de fugas anastomóticas esofagogástricas e intestinales en diversos modelos experimentales13. Sin embargo, el número de publicaciones referentes a su uso en la prevención de la dehiscencia anastomótica en cirugía colorrectal es muy limitado. Parker et al.14 han observado un menor número de fugas en 26 pacientes sometidos a resecciones anteriores colorrectales en el grupo de pacientes con anastomosis reforzadas por la esponja medicamentosa. Resultados muy similares a los obtenidos por de Stefano et al.15 en 63 pacientes, con una reducción significativa en el número de fugas anastomóticas colorrectales en el grupo tratado con dicho compuesto. Recientemente Sabino et al.16 comunicaron, en un modelo experimental con ratas, el efecto que tiene la quimioterapia intraperitoneal postoperatoria inmediata en los procesos de cicatrización que tienen lugar en anastomosis colocólicas manuales en hemicolectomías izquierdas. Se observa cómo el 5-fluouracilo dificulta dichos mecanismos, favoreciendo la dehiscencia anastomótica. Por otro lado, se ve un menor número de fugas anastomóticas en el grupo de animales cuya línea de sutura fue protegida con esponja medicamentosa.
Hasta nuestro conocimiento, no existe ningún estudio que haga referencia al papel potencialmente preventivo de la fuga anastomótica en pacientes con carcinomatosis peritoneal, sometidos a técnicas de citorreducción completa y quimioterapia intraperitoneal intraoperatoria hipertérmica (tratamiento multimodal). Con relación a las tasas de dehiscencias anastomóticas, la mayoría de los autores1,3,5–8 han comunicado valores del 6.5% asociados a la duración de la cirugía y la extensión de la implantación. Sugarbaker1,17 destaca que la duración de la cirugía, el número de procedimientos de peritonectomías y el número de suturas son factores independientes de riesgo de dehiscencias anastomóticas. Glockzin et al.4 comunicaron una fuerte relación entre extensión de la citorreducción y el desarrollo de complicaciones postoperatorias con una tasa de fugas anastomóticas del 8.9% y del 11.3% de infecciones intraabdominales. Baratti et al.6 describen un 6.9% de dehiscencia anastomótica. En su estudio, la regresión logística multivariable señala que la duración de la cirugía (>540min) y el índice de carcinomatosis peritoneal (>19) son factores predictivos independientes. Por su parte, Bartlett et al.18 sobre 795 pacientes intervenidos por carcinomatosis peritoneal gastrointestinal y ginecológica mediante técnicas de citorreducción completa y quimioterapia intraperitoneal intraoperatoria hipertérmica observan, en el análisis multivariable que la edad superior a 60 años, los valores de albúmina inferiores a 3g/dl, el tiempo operatorio (>500min) y los requerimientos de transfusiones están relacionados con el incremento en la morbimortalidad. Como es lógico, el número de anastomosis realizadas tienen un papel importante en el porcentaje de complicaciones postoperatorias. No hay evidencia de que las diversas técnicas de perfusión ni la propia quimioterapia intraperitoneal hipertérmica influyan sobre las complicaciones postoperatorias1,5–8. Es evidente que el desarrollo de complicaciones operatorias tiene un impacto negativo en la evolución oncológica del paciente.
En nuestra serie, la tasa de fugas anastomóticas fue de 3 casos, todas en el grupo de pacientes en los que no se aplicó la esponja de colágeno con fibrina-trombina. Todos los pacientes incluidos lo eran por presentar implantación peritoneal de origen colorrectal: una fístula anastomótica tras hemicolectomía derecha, una tras sigmoidectomía y peritonectomía pélvica tras quimioterapia sistémica neoadyuvante por carcinomatosis peritoneal colorrectal sincrónica, y una tercera fuga de una anastomosis yeyuno-yeyunal latero-lateral mecánica en un paciente con implantes de un tumor de colon izquierdo (carcinomatosis peritoneal sincrónica) y con varios implantes en yeyuno medio que infiltraban la capa muscular y que requirieron resecciones de segmentos de intestino delgado. Las 2 primeras ocurrieron tras la quimioterapia intraperitoneal intraoperatoria hipertérmica, mientras otra tuvo lugar en un paciente con CC2-CC3 (citorreducción incompleta), y por tanto, no candidatos a quimioterapia intraoperatoria. La mortalidad descrita oscila entre el 0 y el 14%, si bien cifras del 2-6% aparecen como las más frecuentes en la mayoría de los estudios. En nuestra serie global es del 3%. La mortalidad está relacionada con el origen de la carcinomatosis peritoneal (mayores en seudomixoma peritoneal en relación con un alto índice de carcinomatosis peritoneal). Además, también se ha relacionado con la intensidad de la agresión quirúrgica, que se refleja en el número de procedimientos de peritonectomías realizados y el índice de carcinomatosis peritoneal (más de 5 regiones anatómicas afectadas), el número de anastomosis digestivas y el volumen de sangre transfundida preoperatoriamente. Aunque la mortalidad media descrita en este complejo tratamiento no es superior a la referenciada en la cirugía mayor digestiva, el porcentaje y la importancia de la morbilidad y de las complicaciones quirúrgicas, que obligan a reintervenciones en pacientes muy frágiles, hacen necesaria una selección muy adecuada de los pacientes. La morbimortalidad se relaciona directamente con la experiencia del equipo quirúrgico1–3.
Si bien somos conscientes de que nuestro estudio consta de un número de casos reducido (n=49) para poder extraer conclusiones concretas y significativas, sí puede servir para iniciar, para incentivar al diseño de futuros estudios prospectivos aleatorizados con un mayor reclutamiento de pacientes, que aclaren el papel del empleo de la esponja medicamentosa en la prevención de la fuga anastomótica intestinal.
En conclusión, en un grupo seleccionado de pacientes, consideramos la carcinomatosis peritoneal de origen gastrointestinal y ginecológica como potencialmente curable. La mejor opción terapéutica es la cirugía citorreductora completa y la aplicación de quimioterapia intraperitoneal intraoperatoria hipertérmica. Debemos procurar que estos pacientes sean valorados en unidades especializadas dotadas de equipos multidisciplinares. En nuestra serie, el empleo de la esponja medicamentosa para el refuerzo de las anastomosis intestinales ha sido seguro y eficaz, contribuyendo a una reducción del riesgo de fístula digestiva en pacientes con alto riesgo de dehiscencia por tratarse de pacientes oncológicos, sometidos a extensas y prolongadas cirugías, casi todos previamente tratados con quimioterapia sistémica y generalmente desnutridos. Tras realizar una exhaustiva búsqueda bibliográfica en las principales bases bibliográficas, este trabajo es el primero en demostrar el papel preventivo, en el desarrollo de dehiscencias anastomóticas, de la aplicación de la esponja medicamentosa en pacientes con implantación peritoneal tratados quirúrgicamente con intención curativa mediantes técnicas de cirugía citorreductora completa y la aplicación de quimioterapia intraperitoneal intraoperatoria hipertérmica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.