La mucormicosis es una infección micótica rara de la orden de los mucorales, la cual afecta en su mayoría a pacientes inmunocomprometidos. La asociación con gastritis enfisematosa es muy poco frecuente y, a menudo, es fatal producida por bacterias formadoras de gas. Presentamos el caso de un paciente politraumatizado con diabetes mellitus tipo 1 y cetoacidosis diabética que se complicó con mucormicosis gástrica asociada a gastritis enfisematosa.
Caso clínicoPaciente varón, de 32 años de edad, que sufre un accidente automovilístico, ocasionando traumatismo craneoencefálico. Ingresa a la Unidad de Cuidados Intensivos presentando cetoacidosis diabética y, posteriormente, sangrado de tubo digestivo alto. Se realiza una endoscopia, encontrándose esofagitis erosiva clase C, isquemia y necrosis gástrica. Una tomografía axial computada mostró gastritis enfisematosa y necrosis gástrica. Se sometió a gastrectomía total, reportándose en el estudio histopatológico mucormicosis gástrica. Posterior al evento quirúrgico, con desenlace fatal secundario a sepsis por mucormicosis pulmonar.
DiscusiónLa mucormicosis es una enfermedad fúngica rara, que afecta con poca frecuencia al tubo digestivo, siendo el estómago el sitio de mayor afectación. Su mortalidad es elevada si no se realiza su diagnóstico y se da tratamiento oportuno.
ConclusiónEs necesario sospechar su existencia en pacientes con estado de inmunodepresión para diagnosticarlo y dar el tratamiento oportunamente para incrementar la sobrevida, ya que cursa con elevada mortalidad.
Mucormycosis is a rare fungal infection of the mucosa, which mainly affects immunocompromised patients. The association with emphysematous gastritis, produced by gas -forming bacteria, is rare and often fatal. The case is presented of a trauma patient with type 1 diabetes mellitus, and diabetic ketoacidosis complicated with gastric mucormycosis associated with emphysematous gastritis.
Clinical caseA male aged 32, who was involved in a car accident, and suffered head trauma, is admitted to the Intensive Care Unit, presenting with diabetic ketoacidosis and upper gastrointestinal bleeding. An endoscopy was performed, finding an erosive esophagitis Class C, ischaemia and gastric necrosis. Computed tomography scan showed emphysematous gastritis and gastric necrosis. He underwent total gastrectomy with a histopathology report of gastric mucormycosis. After the surgical procedure the patient died due to sepsis secondary to pulmonary mucormycosis
DiscussionMucormycosis is a rare fungal disease which infrequently affects the gastrointestinal tract, with the stomach being the most affected site. The mortality is high if the diagnosis is not made promptly and appropriate treatment is given.
ConclusionSuspecting its existence is necessary in patients with immunocompromised status to diagnose it and provide timely treatment to increase survival, due to its high mortality.
La zigomicosis es una infección causada por hongos de la clase de zigomicetos, compuesta por el orden de mucorales y entomoforales. La mucormicosis es una infección micótica oportunista causada por un agente de la clase glomeromicota del orden mucorales, que afectan a huéspedes inmunocomprometidos en zonas industrializadas o en desarrollo1. De acuerdo con Jung et al.2, fue descrita por primera vez a nivel pulmonar en 1876 por Furbringer y la forma diseminada en 1885 por Paltauf. Especies de Rhizopus son los patógenos humanos predominantes, que comúnmente habitan en el suelo, las heces de animales y en materia vegetal en descomposición. Cualquier sistema de órganos puede verse afectado, las infecciones rino-orbital-cerebral y pulmonares son las más frecuentes3. Es una patología angioinvasiva1,4. Su vía de transmisión más frecuente es la inhalación de esporas, seguida de la implantación traumática de elementos fúngicos en quemaduras y lesiones cutáneas; la transmisión directa más rara es la vía intravenosa5. Enfermedades subyacentes causan un estado de inmunocompromiso, especialmente disfunción leucocitaria de neutrófilos o macrófagos considerados como factores predisponentes6. Los fagocitos mononucleares y polimorfonucleares en huéspedes sin alteraciones eliminan a los hongos mucorales por la generación de metabolitos oxidativos y defensinas catiónicas, siendo el mayor mecanismo de defensa contra la mucormicosis. La hiperglucemia y la acidosis son conocidas por afectar a la quimiotaxis de neutrófilos1,5. Son conocidos otros estados patológicos, los cuales promueven la infección, tal es el caso del uso de fármacos como la deferoxamina, los corticoides, pacientes trasplantados, desnutrición severa o con algún otro inmunocompromiso. Sin embargo, se ha descrito en pacientes sin los factores antes descritos7. La presentación clínica menos frecuente es la gastrointestinal, siendo particularmente rara en naciones industrializadas, esta representa entre el 4 y el 7% de las presentaciones; de estas, únicamente el 57.7% afecta al estómago, seguida de la afección colónica e ileal. Se diagnostica ante mortem en el 25% de los casos, alcanzando una mortalidad con cifras del 85 al 95% en afección diseminada7.
La gastritis enfisematosa es caracterizada por gas en la pared del estómago debido a la invasión de microorganismos formadores de gas. Los microorganismos más comunes son los estreptococos. Escherichia coli (E. coli), Pseudomonas aeruginosa, Clostridium perfrigens (C. perfrigens) y Staphylococcus aureus (S. aureus). Los factores predisponentes incluyen la ingestión de corrosivos, el abuso de alcohol, la cirugía abdominal reciente, la diabetes y las condiciones de inmunocompromiso8. El aislamiento de hongos de casos con gastritis enfisematosa ha sido raro. Hasta ahora, se encuentran escasos reportes de gastritis enfisematosa secundaria a mucormicosis, siendo sus resultados fatales9.
Presentamos el caso de un paciente politraumatizado con diabetes mellitus tipo 1 y cetoacidosis diabética, que se complicó con mucormicosis gástrica asociada a gastritis enfisematosa, y se hace una revisión de la literatura médica.
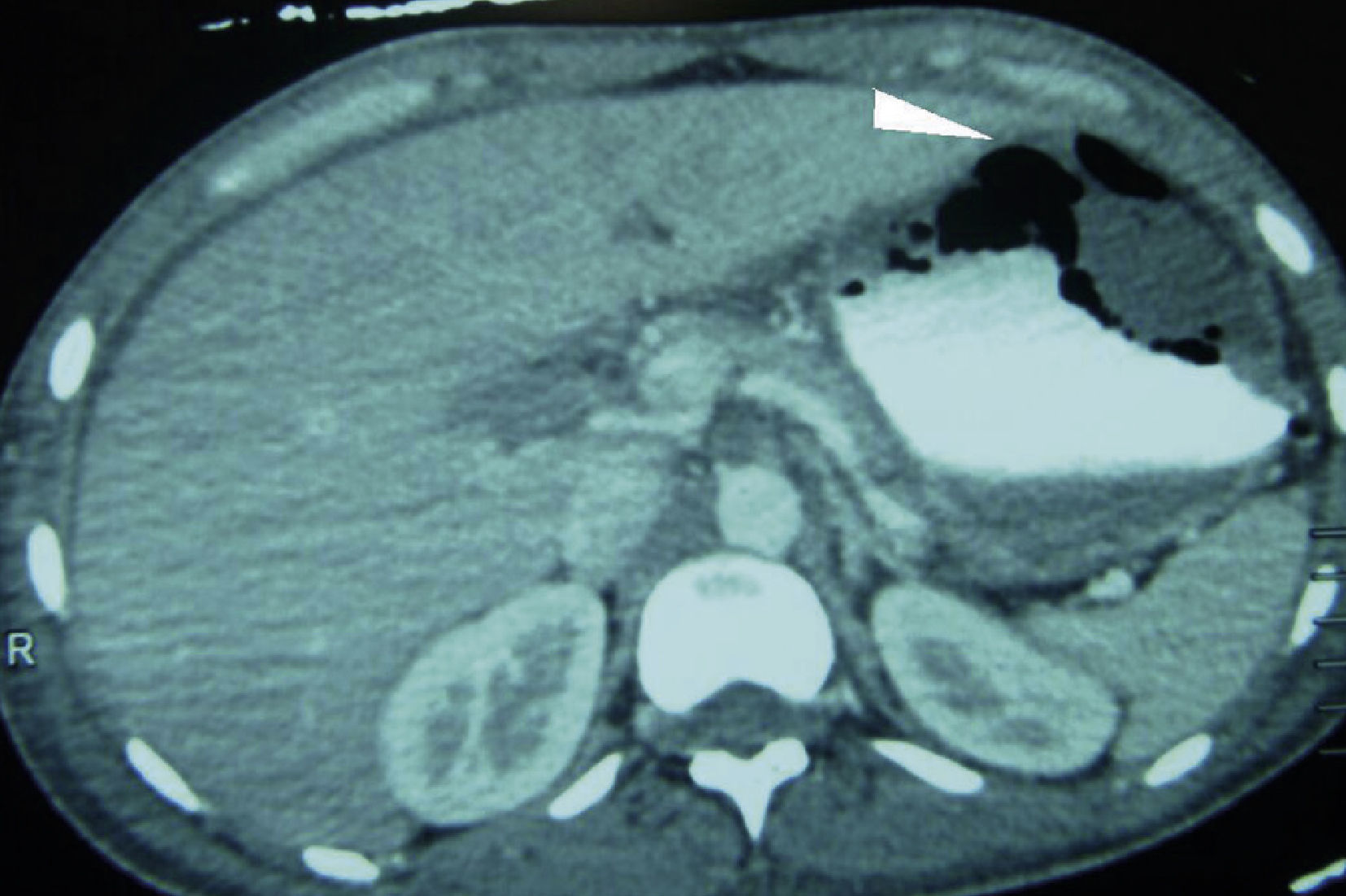
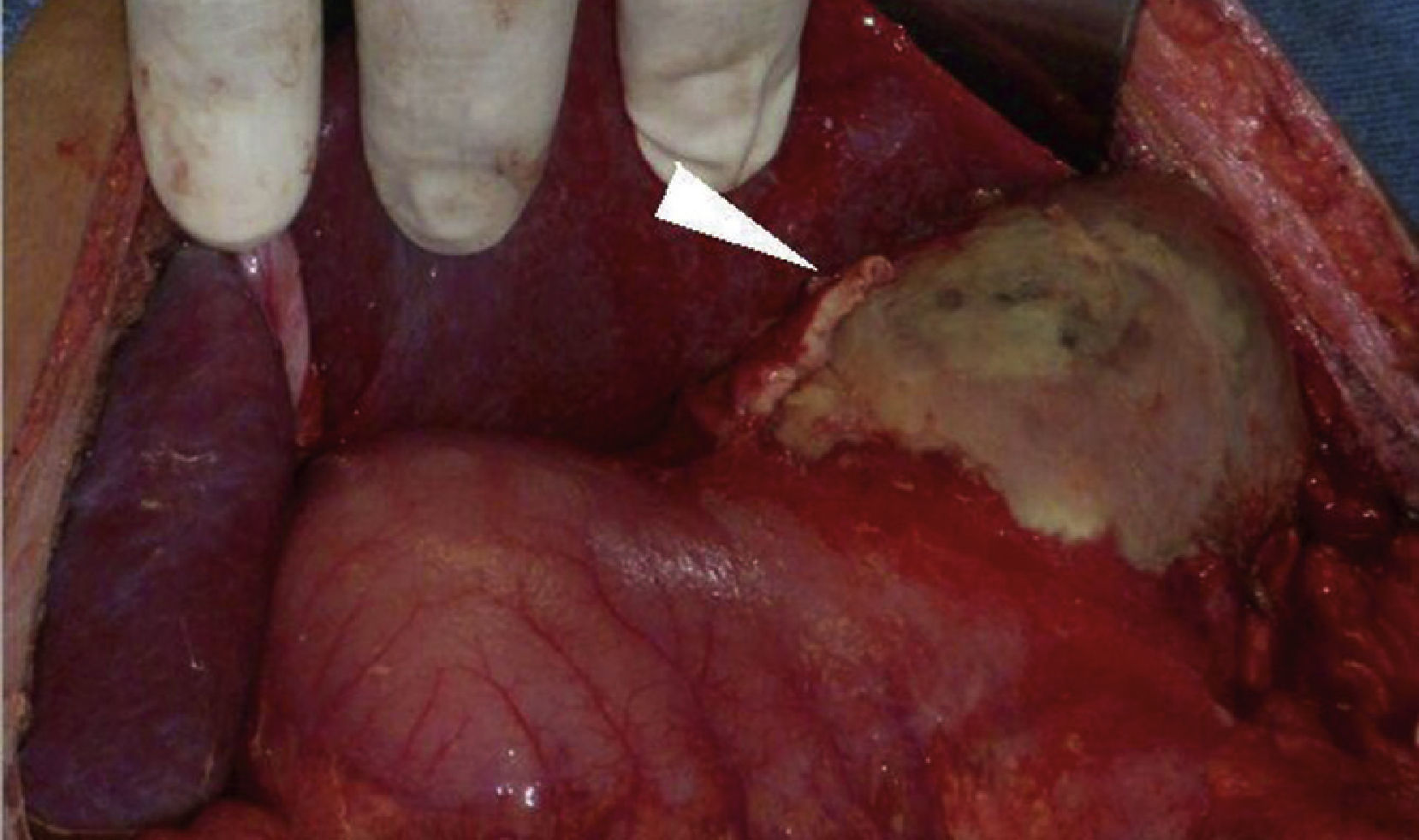
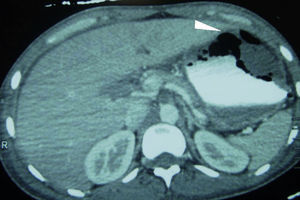
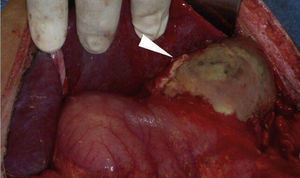
Caso clínicoPaciente masculino de 32 años de edad, con diabetes mellitus tipo 1 de 7 años de evolución, manejada con insulina NPH; tiene un politraumatismo por vehículo automotor, presentando traumatismo craneoencefálico, que amerita drenaje del hematoma subdural y politransfusiones, así como fracturas de tibia y peroné izquierdos, y de tobillo derecho. Ingresa a Terapia Intensiva con cetoacidosis diabética. Presenta sangrado de tubo digestivo alto en forma de hematemesis. En la exploración física, con leve palidez de tegumentos, campos pulmonares con crepitantes subescapulares, abdomen depresible, peristalsis presente, dolor leve a nivel del epigastrio, sin irritación peritoneal. Presenta leucocitosis (133/μl), neutrofilia (94%) y alcalosis respiratoria (pH 7.54, PCO2 30mmHg, HCO3 25 mEq/l). Radiografía de abdomen con radioopacidad en la topografía de cámara gástrica, con aumento de volumen. La endoscopia reporta esófago con lesiones lineales desde el tercio medio, cubiertas de fibrina de color blanquecino; estómago con mucosa de fundus y cuerpo gástrico con necrosis, fibrina grisáceo-verdosa con pérdida de pliegues, mucosa antral respetada. Se realiza una tomografía abdominal, encontrando derrame pleural bilateral, neumatosis gástrica en fondo y cuerpo, edema perigástrico, en relación con gastritis enfisematosa (fig. 1). Es intervenido quirúrgicamente, efectuándose gastrectromía total con cierre esofágico distal, exclusión duodenal, yeyunostomía, esofagostomía y drenaje con sondas endopleurales, por el hallazgo de necrosis gástrica que abarca fondo, cuerpo y curvatura mayor, con úlcera gástrica posterior que involucra cuerpo y fondo gástrico, de aproximadamente 10 × 10cm, con absceso contenido por los segmentos hepáticos I y II, polo superior del bazo, presencia de líquido de reacción inflamatoria en cavidad, fétido (fig. 2). Ingresa a la Unidad de Cuidados Intensivos con apoyo aminérgico, ventilatorio, antibioticoterapia (cefepime, levofloxacino) y antifúngico (fluconazol), con APACHE II de 30 puntos para una mortalidad mayor del 80%.
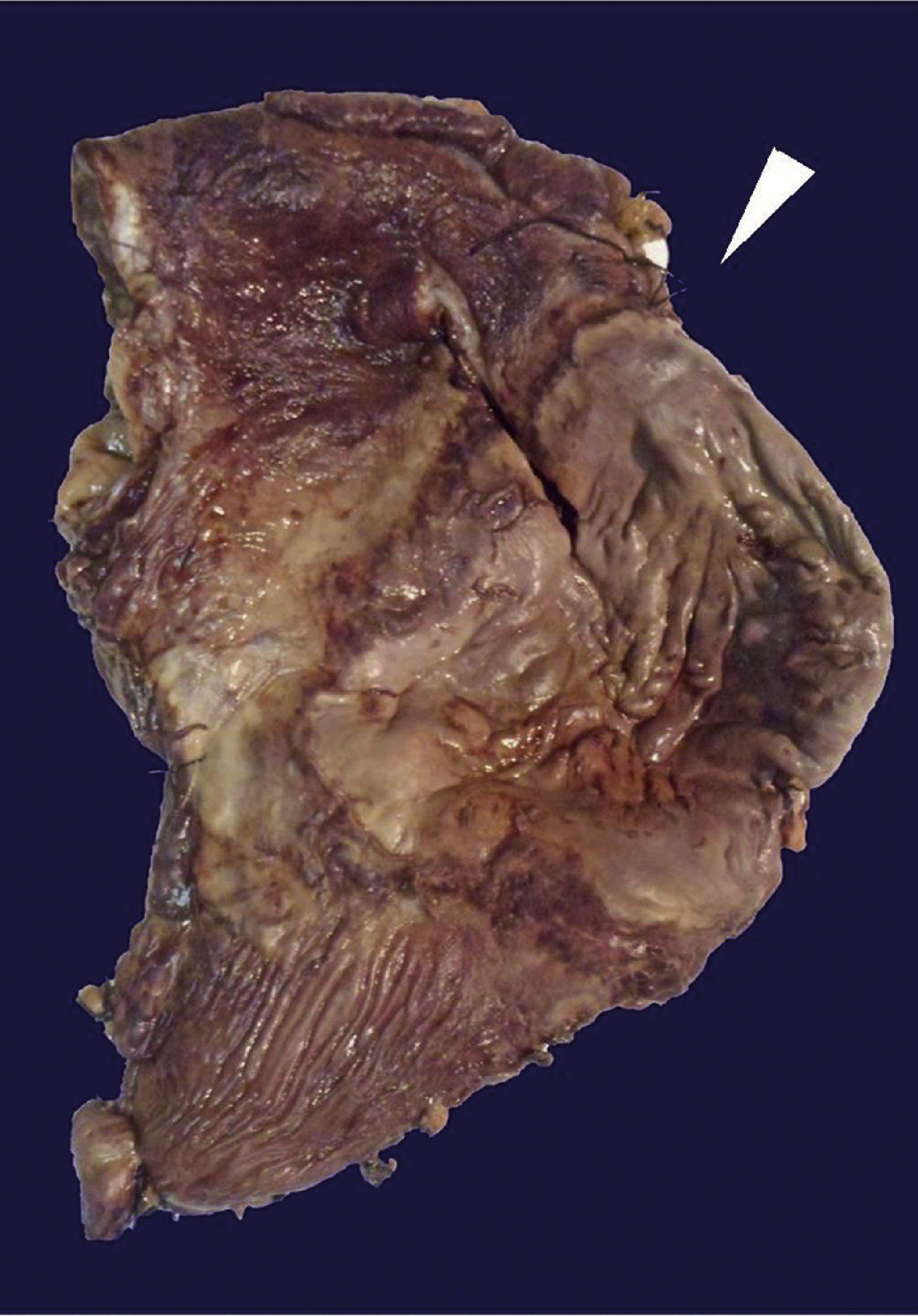
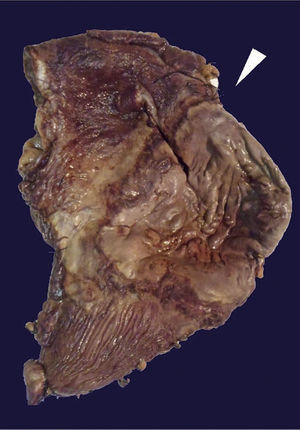
El estudio histopatológico de la pieza quirúrgica revela una úlcera gástrica anterior de 10 × 9cm a nivel de curvatura mayor y otra úlcera en la cara posterior de 16 × 7cm de color café-verdosa; el resto de la cámara gástrica muestra una pared engrosada, aproximadamente 1cm de espesor (fig. 3).
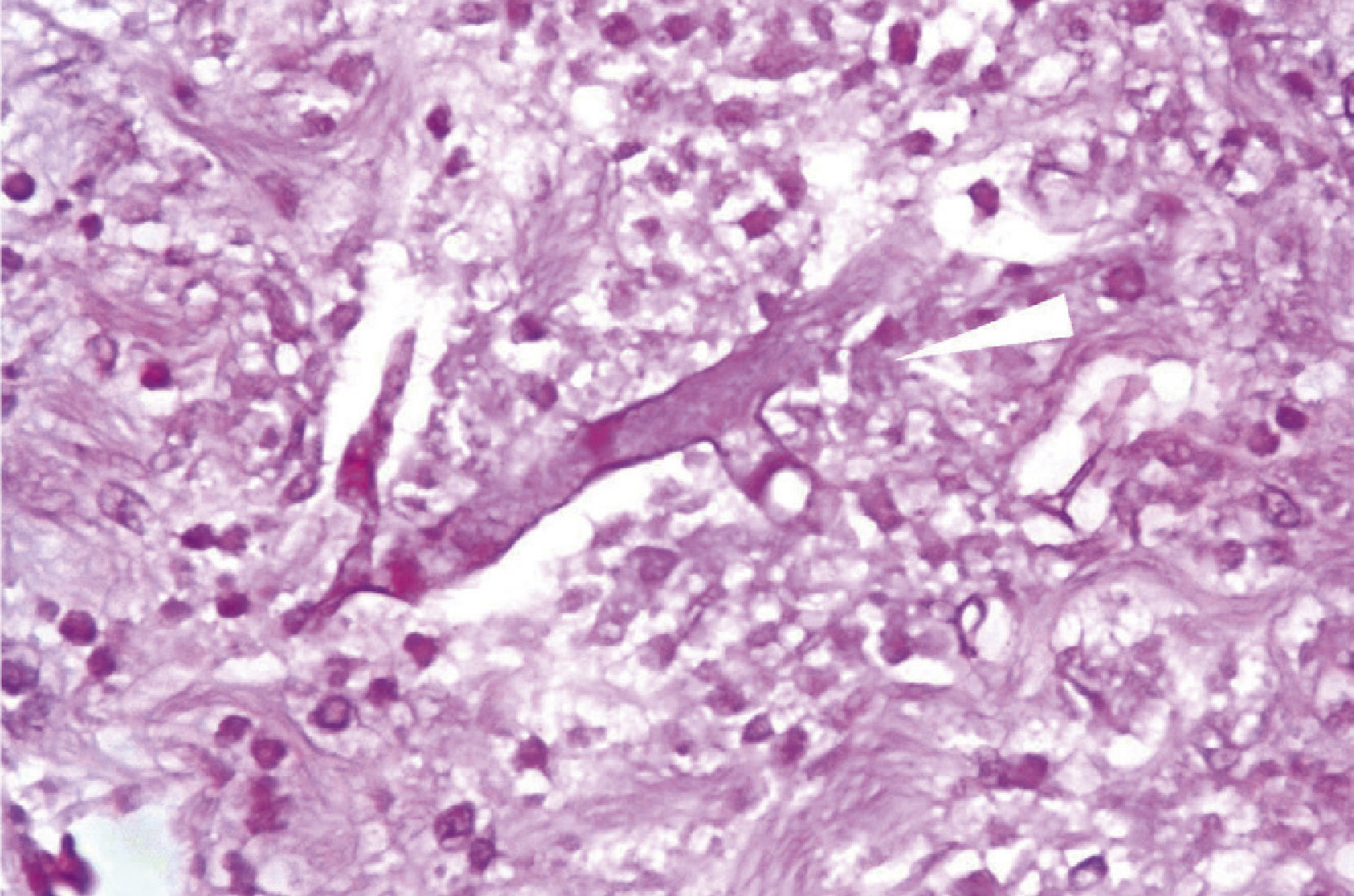
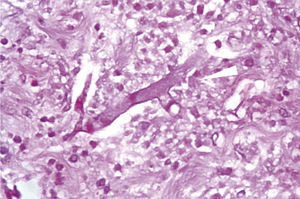
Microscópicamente, presencia de hifas ramificadas no septadas en ángulo recto, secundarias a infección micótica por mucormicosis, con límites quirúrgicos libres de lesión (fig. 4).
Tratamiento inicial con anfotericina B al cuarto día de estancia en Unidad de Cuidados Intensivos, manteniéndose con normovolemia, sin evidencia de sangrado, estabilidad hemodinámica, presentando reducción en apoyo aminérgico, con mejoría bioquímica, y egresando de la Unidad de Cuidados Intensivos al día 18 posquirúrgico. Posteriormente, el paciente presenta condensación pulmonar y neumonía, confirmándose mucormicosis pulmonar por aspirado bronquial, falleciendo por complicaciones de foco neumónico a los 27 días de su ingreso.
DiscusiónLa mucormicosis es la menos común de las infecciones por hongos oportunistas, como las causadas por Candida y Aspergillus spp. Se estima una incidencia de 1.7 por millón por año, lo cual se traduce en aproximadamente 500 casos por año en los Estados Unidos. En una serie de autopsias, la prevalencia de mucormicosis va en un rango de 1 a 5 casos por 10,000 autopsias, haciendo la infección 10 a 50 veces menos común que la infección por Candida o Aspergillus1.
Se caracteriza por la presencia de angioinvasión y trombosis, y las consecuentes isquemia y necrosis del tejido, y se encuentra en forma patognomónica la presencia de hifas ramificadas no septadas en ángulo recto en los tejidos de biopsias o durante autopsias en series de casos. Las formas de presentación clínica son la rino-orbito-cerebral (66%), pulmonar (16%), cutánea (10%), y gastrointestinal (7%), afectando al estómago (57.7%), colon (32.5%) e íleon (6.9%)10. La mucormicosis gastrointestinal es una infección poco frecuente y potencialmente mortal; puede ser más frecuente en la población pediátrica y todo el aparato digestivo puede verse afectado3. Se ha descrito en pacientes extremadamente desnutridos (especialmente en niños) y se piensa que surge de la ingestión del hongo. Se ha visto en neonatos prematuros en asociación a enfermedad generalizada diseminada. El estómago, el colon y el íleon son los lugares más comúnmente involucrados1,3. En el reporte realizado por Martinello et al.7 se describe la presencia de mucormicosis a nivel de yeyuno en un paciente con antecedente de desnutrición relacionado con el abuso de alcohol y enteritis reciente por Salmonella typhimurium, con presencia de abdomen agudo, que fue manejado con tratamiento quirúrgico y médico sobre la base de anfotericina B y posaconazole, reportándose exitoso3.
La acidosis interrumpe las uniones de hierro de la transferrina, incrementando el hierro libre, lo cual quizá promueve el crecimiento de los hongos. En un estudio realizado por Turunc et al.4, ninguno de sus pacientes diabéticos presentaba cetoacidosis, con una elevada mortalidad en la serie de 11 pacientes con tan solo la presencia de diabetes mellitus e insuficiencia renal crónica, a las cuales atribuyen la alta mortalidad. Se conoce también que la hiperglucemia y la acidosis afectan a la quimiotaxis de neutrófilos, los cuales son responsables, al igual que los fagocitos, de la eliminación de hongos mucorales en pacientes sin alteración en las defensas. Son varios factores encontrados en nuestro paciente, lo cual puede promover la colonización por hongos del orden mucorales, los cuales encontraron el medio propicio para su progresión (cetoacidosis, hiperglucemia).
Los síntomas de mucormicosis gastrointestinal son variados y dependen del sitio afectado. El dolor abdominal inespecífico y la distensión asociados a náuseas y vómitos son síntomas comunes; la fiebre y la hematoquecia también pueden ocurrir7,10. A menudo se inicia con un diagnóstico de absceso intraabdominal. El diagnóstico se puede realizar mediante una biopsia del área sospechosa durante la cirugía o la endoscopia7.
De acuerdo con Jung et al.2, la gastritis enfisematosa descrita por Frankel en 1889 es causada por ingesta crónica de alcohol, álcalis o ácidos, cirugía gástrica, agentes bacterianos (E. coli, Clostridium welchi, C. perfringens y S. aureus) y micóticos (Pseudomonas, Aspergillus y mucormicosis), por lo cual las manifestaciones clínicas son inespecíficas y el diagnóstico definitivo depende del examen histológico, demostrando hifas septadas, infarto y angioinvasión.
Su tratamiento es antifúngico y el desbridamiento quirúrgico, así como soporte médico agresivo de las comorbilidades. Se sabe que debido a la necrosis presente en los tejidos infectados por mucormicosis, los agentes antifúngicos tienen una pobre penetración a los mismos, por lo cual es necesario el tratamiento combinado10.
El retraso en el tratamiento con el régimen basado en la anfotericina B (> 6 días después del diagnóstico) se ha reportado estar asociado con el doble de mortalidad a las 12 semanas. En pacientes con diabetes con o sin cetoacidosis, los esfuerzos deben hacerse para restaurar la euglucemia y el estado ácido-base normal9.
En el caso de nuestro paciente, se desconoce la fuente de infección por el agente fúngico; sin embargo, se han reportado casos, como en la serie realizada por Maraví-Poma et al.11, quienes reportan mucormicosis gastrointestinal transmitida por el uso de abatelenguas contaminadas con angioesporas en la Unidad de Cuidados Intensivos. Nuestro paciente fue trasladado de la Unidad de Cuidados Intensivos del Hospital de Traumatología y Ortopedia; aunado a sus comorbilidades (diabetes mellitus tipo 1, traumatismo), cursó con cuadro de cetoacidosis y factores conocidos como inmunosupresores. En su artículo, Jung et al.2 describen que la coexistencia de mucormicosis con gastritis enfisematosa es debida a quizá a la presencia de necrosis de la pared gástrica causada por la infección bacterial o, alternativamente es posible la invasión de la mucormicosis, con la consecuente necrosis de la pared gástrica que permita una invasión bacteriana secundaria y la producción de gas intramural. En un reporte se refiere que la condición más comúnmente asociada es la presencia de una úlcera gástrica preexistente, siendo posible que la base de la úlcera gástrica denudada en un huésped comprometido permita a las bacterias y hongos invadir profundamente, conduciendo a la necrosis de la pared gástrica y la producción de gas intramural8. Martinello et al.7 describen una serie de 66 casos de mucormicosis gastrointestinal con diseminación a órganos no contiguos en el 38%, y mortalidad elevada relacionada con la perforación intestinal y el sangrado del tubo digestivo alto. En nuestro caso, se piensa y agrega que el sitio primario de infección fue el tubo digestivo, con la consecuente diseminación a otros órganos, y que al ser un paciente que permaneció en la Unidad de Cuidados Intensivos con manejo invasivo, la contaminación hacia otros órganos pudo ser la causa de inoculación en otros sitios, dado su inmunocompromiso. A su ingreso en nuestra unidad, el paciente presenta datos de neumonía, agregada al sangrado del tubo digestivo, por lo cual no se puede asegurar que sea secundario a la inoculación por broncoaspiración o bien debido a la instrumentación a la que son expuestos este tipo de pacientes. El paciente no fue sometido a necropsia debido a que no fue autorizada por los familiares, por lo cual no se puede asegurar la infección en otros sitios intraabdominales y/o extraabdominales.
ConclusiónPresentamos el caso de un paciente masculino de 32 años con mucormicosis gástrica, diagnosticado ante mortem y que, pese al tratamiento combinado médico-quirúrgico, presentó septicemia fúngica, alcanzando diseminación pulmonar con desenlace fatal.
El diagnóstico de una infección por mucorales requiere un alto índice de sospecha y en la literatura mundial existen pocos casos reportados, por lo cual no nos encontramos familiarizados con dicha patología, siendo un hallazgo incidental ante el protocolo de sangrado de tubo digestivo y la indicación de intervención quirúrgica ante el deterioro del paciente. El éxito del tratamiento depende del diagnóstico temprano, el control de los factores de riesgo, la reducción de la inmunosupresión, la pronta terapia antimicótica sobre la base de polienos, como la anfotericina B y la anfotericina liposomal, así como el pronto desbridamiento quirúrgico, requiriéndose un alto índice de sospecha debido a su alta mortalidad por la rápida progresión de la enfermedad ante un paciente con alteración en su sistema inmunitario, lo cual cada vez es más común en nuestra sociedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.