No hay apenas información nacional sobre los resultados oncológicos de la cirugía del cáncer gástrico, por lo que se utilizan cifras foráneas, que pueden ser absolutamente distintas de las locales. El objetivo de nuestro trabajo es analizar estos resultados en los pacientes intervenidos en nuestro centro.
MétodosSe analizan los resultados de supervivencia de 134 pacientes intervenidos por cáncer gástrico con intención curativa desde 2004 hasta junio de 2016.
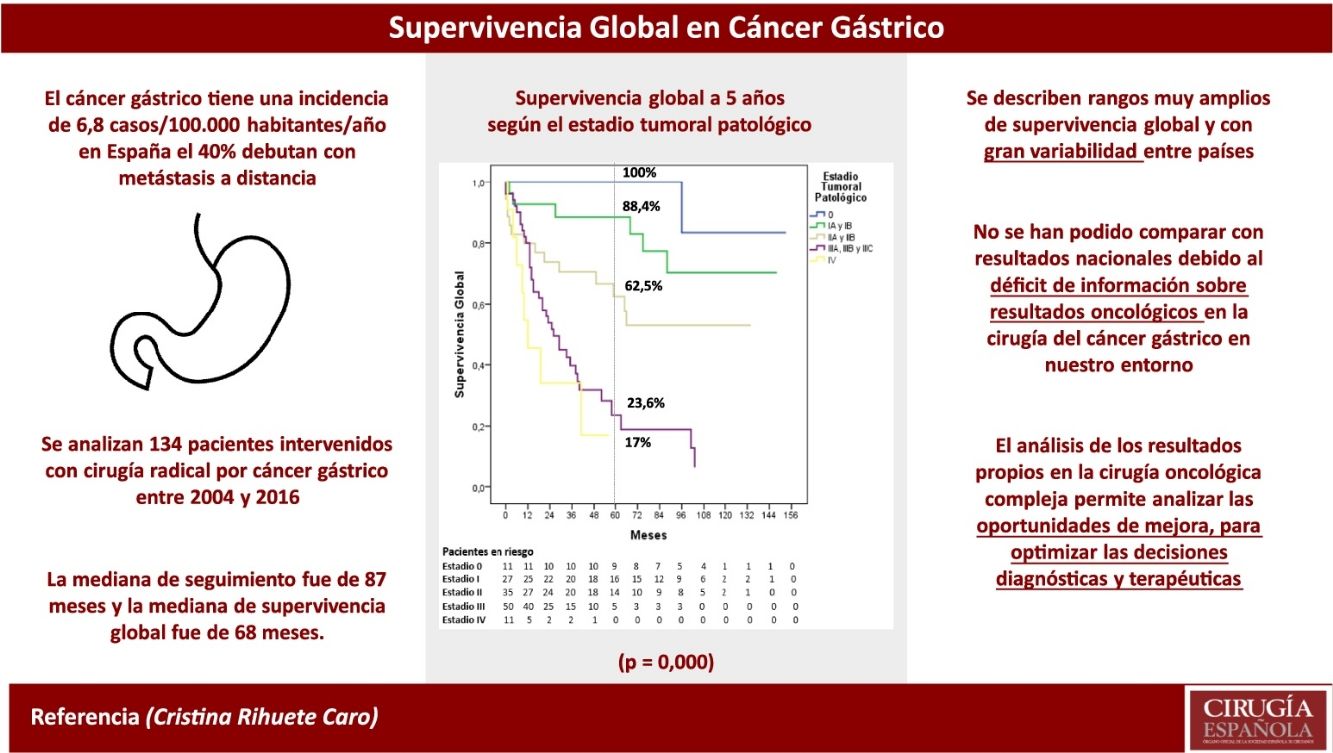
ResultadosEl 76,8% de los pacientes (103/134) tenían estadios clínicos avanzados (≥ii), se realizó laparoscopia de estadificación en el 67% de los mismos (69/103), linfadenectomía extensa (≥LD1+) en el 89,3% (92/103), y recibieron QT perioperatoria el 76,7% (79/103). La distribución final por estadios patológicos 0, i, ii, iii y iv fue del 8,2; 20,2; 26,1; 37,3 y 8,2%, respectivamente. La mediana de seguimiento fue de 87 meses. La mediana de SG fue de 68 meses y la SG a uno, 3 y 5 años fue del 81,2, 62 y 53,8%, respectivamente. La SG a 5 años según el estadio patológico fue del 100% para el estadio 0, del 88,4% para el estadio i, del 62,5% para el estadio ii, del 23,6% para el estadio iii y del 17% para el estadio iv.
ConclusionesNuestras tasas de supervivencia se encuentran en los rangos altos de la literatura occidental. No se han podido comparar con resultados nacionales debido al déficit de información sobre resultados oncológicos en la cirugía del cáncer gástrico en nuestro entorno más cercano.
National information on the oncological results of gastric cancer surgery is scarce, so foreign figures are used, which may completely differ from local ones. The aim of our study is to analyse these results in the patients operated on in our centre.
MethodsSurvival results of 134 patients that underwent gastric cancer surgery with curative intent from 2004 to June 2016 were analysed.
ResultsA percentage of 76.8 of the patients (103/134) presented in advanced clinical stages (≥ii). Staging laparoscopy was performed in 67% of them (69/103), an extensive lymphadenectomy (≥LD1+) was carried out in 89.3% of patients (92/103), and 76.7% (79/103) received perioperative chemotherapy. The distribution by pathological stage 0, i, ii, iii and iv was 8.2, 20.2, 26.1, 37.3, and 8.2%, respectively. Median follow-up was 87 months. Median OS was 68 months and one-, 3- and 5-year OS were 81.2, 62, and 53.8%, respectively. The 5-year OS according to pathological staging was 100% for stage 0, 88.4% for stage i, 62.5% for stage ii, 23.6% for stage iii and 17% for stage iv.
ConclusionsOur survival rates are in the high ranges of western literature. These results could not be compared with national ones due to the lack of information regarding oncological outcomes in gastric cancer surgery in our closest environment.
Un objetivo primordial de cualquier sistema sanitario debería ser garantizar la calidad de la atención de los procesos oncoquirúrgicos, siendo la supervivencia (SV) del cáncer una medida clave para conocer la efectividad del sistema de salud1. El estudio EUROCARE-52, observacional y retrospectivo, incluyó datos de 107 registros con más de 10 millones de pacientes entre los años 1999 y 2007, y mostró que sigue habiendo diferencias importantes en la SV del cáncer entre los distintos países europeos. El proyecto European Registry of Cancer Care (EURECCA) se creó para evaluar dichas diferencias e intentar establecer normas destinadas a mejorar la calidad y los resultados3.
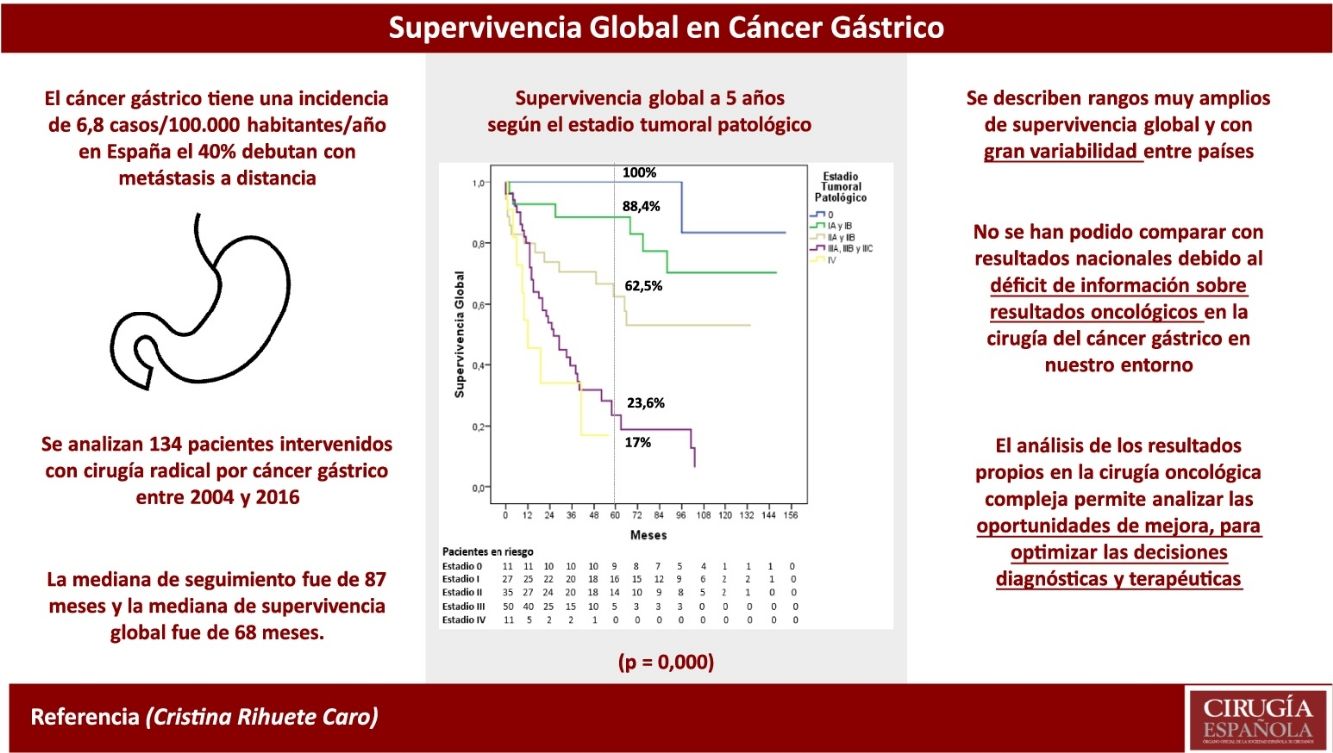
El cáncer gástrico (CG) es un tumor relativamente infrecuente (6,8 casos/100.000 habitantes-año en España) y altamente letal (el 40% se manifiestan con metástasis a distancia), en el que la atención multidisciplinar para la estadificación clínica y la toma de decisiones terapéuticas cobran la mayor importancia. El proyecto EURECCA de cáncer gastroesofágico inicialmente seleccionó 7 países europeos con registros nacionales (Dinamarca, Francia, Irlanda, Holanda, Polonia, Suecia y Reino Unido) y determinó los datos relevantes y comunes para poder comparar resultados entre países4. Posteriormente, se realizó un estudio observacional y prospectivo en el que participaron 5 países (Reino Unido, Holanda, Francia, España e Irlanda), incluyendo un total de 4.668 pacientes con diagnóstico de carcinoma escamoso o adenocarcinoma gastroesofágico tratados quirúrgicamente con intención curativa durante un periodo de 12 meses5, demostrando que es factible implementar un registro uniforme de resultados en el tratamiento del cáncer gastroesofágico. Sin embargo, no se publicaron datos de SV a largo plazo.
Tras una revisión exhaustiva de la literatura solo hemos podido encontrar un mínimo número de series nacionales, fundamentalmente el registro de tumores esófago-gástricos de la Comunidad Valenciana publicado en 20176, y la publicación del grupo español EURECCA para cáncer esofagogástrico de 20197, que no incluyen datos de SV por estadios. Por tanto, no hay resultados oncológicos de referencia nacional y normalmente se utilizan datos foráneos que pueden no concordar con la realidad local. Dado que en nuestro país no existe una iniciativa global para conocer la SV del cáncer, el objetivo de este estudio retrospectivo es analizar la SV de los pacientes intervenidos quirúrgicamente de CG en nuestro centro, que podría servir como referente para comparar resultados, en ausencia de registros multicéntricos nacionales.
MétodosSe ha realizado un estudio retrospectivo sobre una base de datos prospectiva de todos los pacientes intervenidos quirúrgicamente por CG desde 2004 hasta junio de 2016, con un seguimiento mínimo posterior de un año, analizando los datos demográficos, diagnósticos, quirúrgicos y postoperatorios, anatomopatológicos, de tratamiento complementario perioperatorio y de seguimiento. El estudio fue aprobado por el Comité de Ética e Investigación Clínica de nuestro centro, que es un hospital de 450 camas que atiende a una población aproximada de 300.000 habitantes, con la máxima infraestructura para la atención oncológica.
Realizamos el diagnóstico y la estadificación mediante endoscopia digestiva alta con biopsia y TC toracoabdominopélvica. La RMN y la PET solo se realizaron si existían dudas de enfermedad a distancia. Indicamos laparoscopia de estadificación en tumores c≥T3 y/o N+. Se utilizó la 7.a edición (2009) de la clasificación TNM, reclasificando con ella a los pacientes intervenidos en el periodo anterior a 2009. A pesar de que dicha clasificación considera los tumores Siewert II como esofágicos, algunos de estos casos se han tratado como tumores gástricos, atendiendo a la controversia permanente, que se mantiene incluso en la 8.a edición (2018) de la TNM. Indicamos neoadyuvancia cuando la estadificación clínica es≥T3 y/o N+, y tratamiento postoperatorio exclusivo cuando la indicación se establece tras el estudio anatomopatológico. Durante el periodo de estudio se utilizó fundamentalmente el esquema ECF. De elección se realizó gastrectomía subtotal en tumores distales y total en el resto, con linfadenectomía (LD) extendida D1+/D2. La no inclusión del grupo 10 dependió del cirujano. En la última edición de la clasificación japonesa ya no se incluye el grupo 10 en la LD2 en la gastrectomía total. En pacientes con CG precoz en la estadificación clínica, elevada morbilidad o cirugía urgente se realizaron LD más limitadas. Las complicaciones postoperatorias se registraron a 90 días según la clasificación de Dindo-Clavien.
Se intervinieron 150 pacientes por CG durante el periodo de estudio. La intervención se realizó de forma programada en 126, de los que 118 fueron resecciones macroscópicamente radicales, por lo que la tasa de resección con intención curativa en cirugía electiva fue del 93,7%. En 16 de los 24 pacientes operados de urgencia por complicación del tumor primario también se consiguió una cirugía radical, siendo el total de pacientes con cirugía radical de 134. Todos los pacientes se presentaron en el Comité Multidisciplinar de Tumores, ya fuera preoperatoriamente (cirugía programada) o tras la cirugía (todos). El análisis de SV se ha realizado sobre los 134 casos intervenidos con resección macroscópicamente radical.
Análisis estadísticosPara el cálculo de la SV y del impacto sobre la misma de cada una de las variables, se empleó el método de Kaplan-Meier, y para comparar las curvas de SV, se empleó el método Log-Rank. Para el cálculo de la supervivencia global (SG), se definió el periodo de seguimiento como el comprendido desde la fecha de inicio del tratamiento, bien fuera la fecha de la cirugía, bien la fecha del comienzo de la quimioterapia (QT) neoadyuvante, hasta la fecha de fallecimiento del paciente o de la última revisión en consulta antes del cierre del estudio. La estimación de la mediana de seguimiento se realizó mediante Kaplan-Meier inverso, que se recomienda para calcular el tiempo de seguimiento en ensayos clínicos de oncología debido a la alta mortalidad de estos pacientes8. Se realizó un modelo de regresión múltiple de Cox para estimar la posible relación de la SG con diferentes variables registradas calculando las razones de riesgo (hazard ratio) para las variables relevantes según criterio clínico.
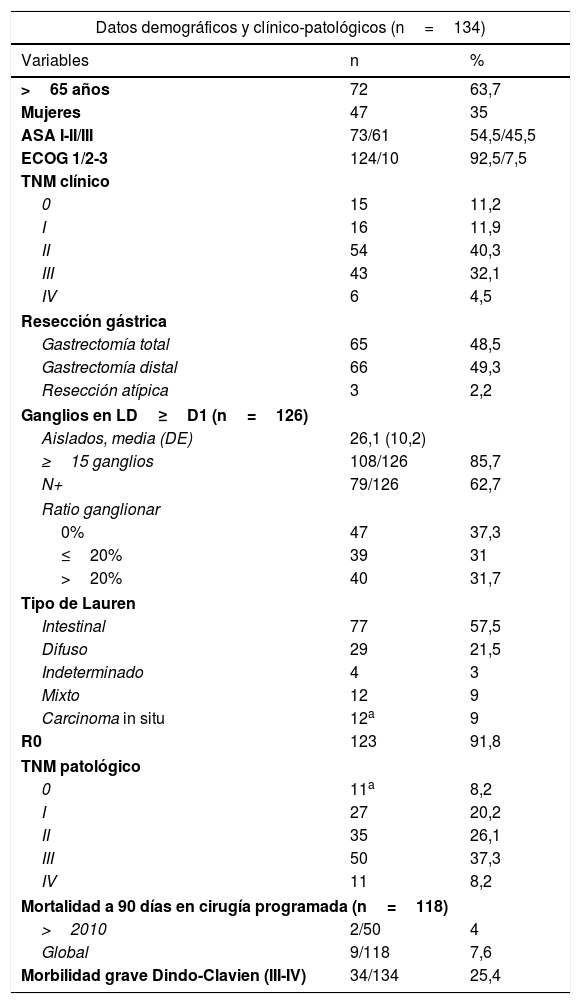
ResultadosLas características demográficas y clínico-patológicas de los 134 pacientes se muestran en la tabla 1. Hay 20 casos cuya estadificación clínica fue de CG precoz (estadios 0-IA), que fueron intervenidos al ser desestimada su resección endoscópica. El 76,9% de los pacientes (103/134) se diagnosticaron en estadios clínicos avanzados (≥II), realizando laparoscopia de estadificación en el 67% de los mismos (69/103), LD extensa (≥LD1+) en el 89,3% (92/103), y recibiendo QT perioperatoria (pre y/o postoperatoria) el 76,7% (79/103), con ECF en la mayoría (68,4%) y esquemas similares en el resto. Los 6 casos con enfermedad metastásica conocida preoperatoriamente fueron 4 pacientes con adenopatías paraaórticas y 2 pacientes con metástasis hepática única con respuesta al tratamiento neoadyuvante. Además, hubo otros 5 pacientes pM1 tras el análisis histológico (uno por citología positiva y 4 con focos microscópicos en epiplón o vesícula). La cirugía se realizó de forma electiva en el 88% de los pacientes (118/134) y el abordaje fue mayoritariamente abierto (86,6%). La mediana [RIC] de duración de la intervención fue de 215 [28] min, y un 35% de los procedimientos se prologaron más de 4h. La mortalidad a 90 días se redujo al 4% a partir de 2010, momento en el que se consolidó la Unidad de Cirugía Esófago-Gástrica. No presentaron complicaciones a 90 días 47 pacientes (35%), mientras que fueron leves (grados i-ii) en 40 (29,9%; i 0,8% y ii 29,1%) y graves (grados iii-v) en 34 (35,1%; iiia 6,7%; iiib 4,5%; iva 7,5%; ivb 6,7% y v 9,7%). La estancia hospitalaria superó las 2 semanas en el 46,3% de los casos y la tasa de reingresos fue del 8,2%. La localización anatómica más frecuente fue la antral (46,3%) y la serie incluye 19 tumores de la UEG (5 Siewert II y 14 Siewert III) tratados como CG.
Características demográficas y clínico-patológicas de los pacientes con cáncer gástrico intervenidos con intención radical
| Datos demográficos y clínico-patológicos (n=134) | ||
|---|---|---|
| Variables | n | % |
| >65 años | 72 | 63,7 |
| Mujeres | 47 | 35 |
| ASA I-II/III | 73/61 | 54,5/45,5 |
| ECOG 1/2-3 | 124/10 | 92,5/7,5 |
| TNM clínico | ||
| 0 | 15 | 11,2 |
| I | 16 | 11,9 |
| II | 54 | 40,3 |
| III | 43 | 32,1 |
| IV | 6 | 4,5 |
| Resección gástrica | ||
| Gastrectomía total | 65 | 48,5 |
| Gastrectomía distal | 66 | 49,3 |
| Resección atípica | 3 | 2,2 |
| Ganglios en LD≥D1 (n=126) | ||
| Aislados, media (DE) | 26,1 (10,2) | |
| ≥15 ganglios | 108/126 | 85,7 |
| N+ | 79/126 | 62,7 |
| Ratio ganglionar | ||
| 0% | 47 | 37,3 |
| ≤20% | 39 | 31 |
| >20% | 40 | 31,7 |
| Tipo de Lauren | ||
| Intestinal | 77 | 57,5 |
| Difuso | 29 | 21,5 |
| Indeterminado | 4 | 3 |
| Mixto | 12 | 9 |
| Carcinoma in situ | 12a | 9 |
| R0 | 123 | 91,8 |
| TNM patológico | ||
| 0 | 11a | 8,2 |
| I | 27 | 20,2 |
| II | 35 | 26,1 |
| III | 50 | 37,3 |
| IV | 11 | 8,2 |
| Mortalidad a 90 días en cirugía programada (n=118) | ||
| >2010 | 2/50 | 4 |
| Global | 9/118 | 7,6 |
| Morbilidad grave Dindo-Clavien (III-IV) | 34/134 | 25,4 |
ASA: American Society of Anesthesiologists; DE: desviación estándar; ECOG: Eastern Cooperative Oncology Group; IMC: índice de masa corporal; LD: linfadenectomía.
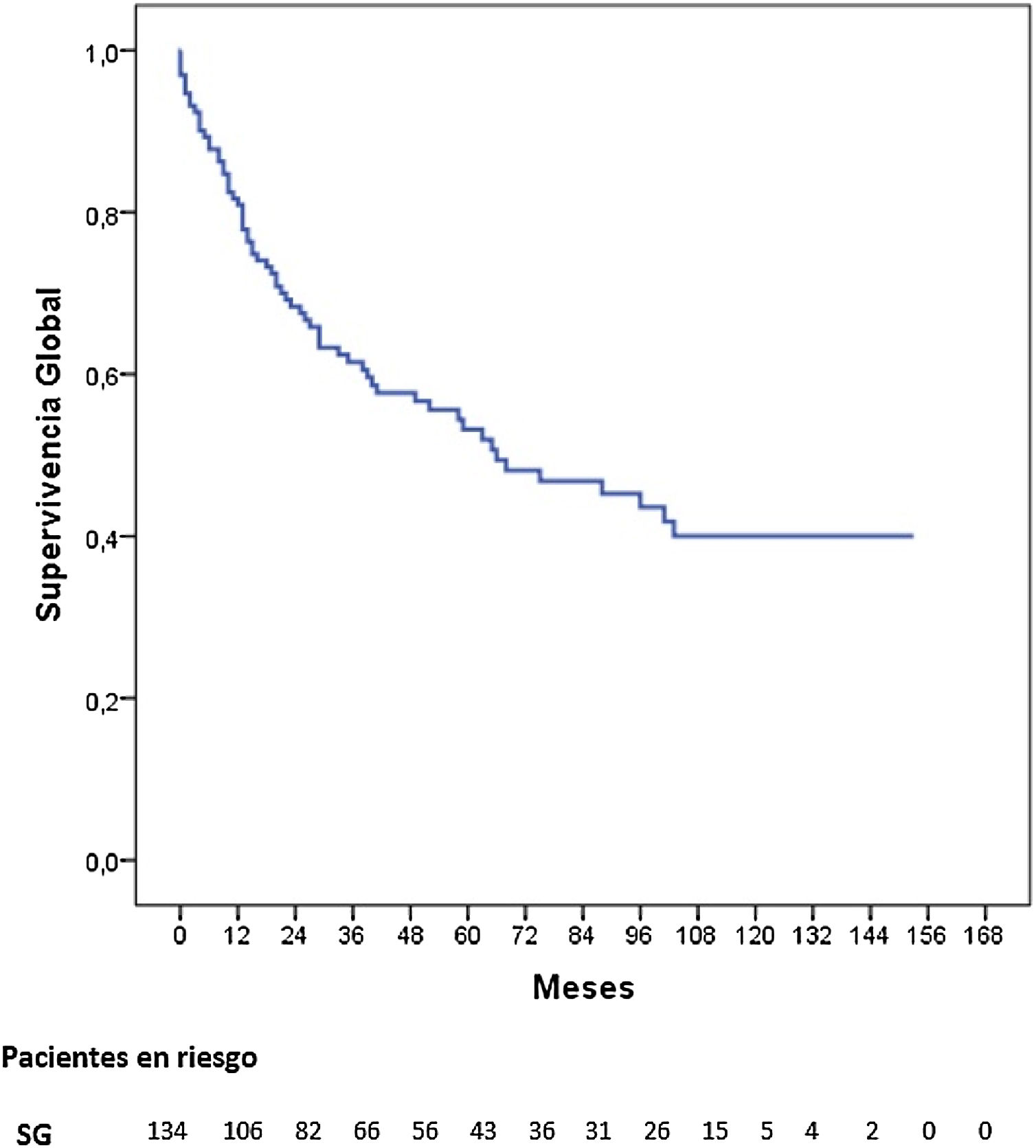
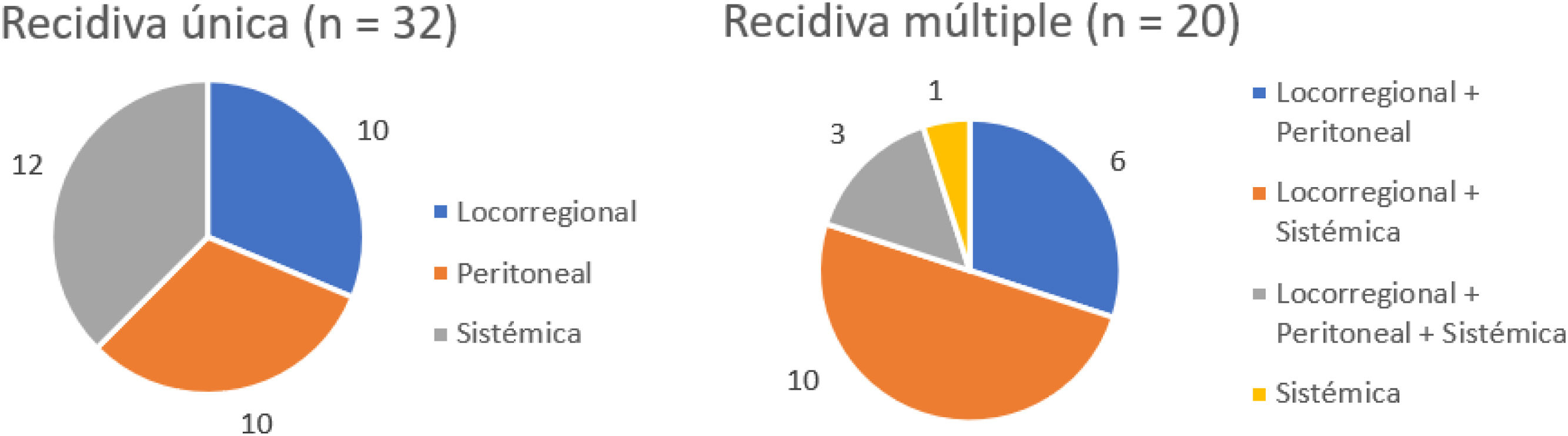
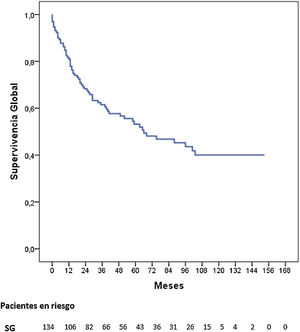
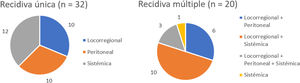
Tres pacientes se perdieron en el seguimiento (2,2%). La mediana de seguimiento fue de 87 meses (Kaplan-Meier inverso) y la mediana de SG fue de 68 meses. La SG a uno, 3 y 5 años fue del 81,2, 62 y 53,8%, respectivamente (fig. 1). La mediana de SV libre de enfermedad fue de 62 meses, siendo a 5 años del 50,3%. La tasa de recidiva a uno, 3 y 5 años fue del 28,9, 40,4 y 42,7%, respectivamente, y los patrones de recidiva se muestran en la figura 2.
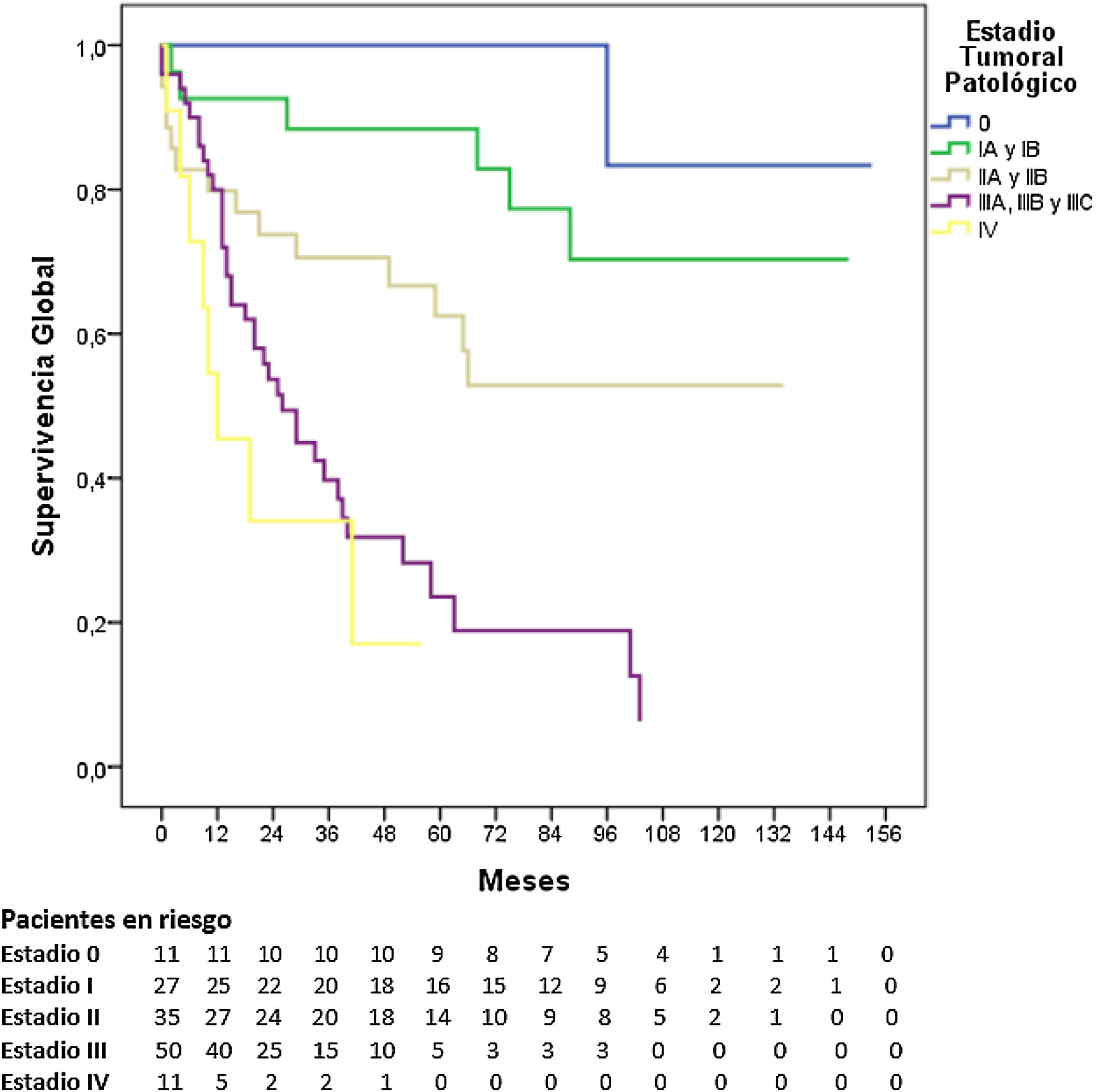
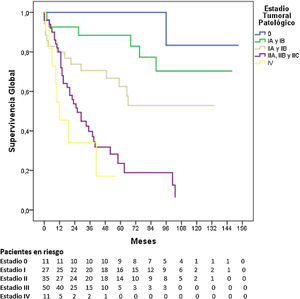
La SG a 5 años según el estadio tumoral patológico fue del 100% para el estadio 0, del 88,4% para el estadio i, del 62,5% para el estadio ii, del 23,6% para el estadio iii y del 17% para el estadio iv (p=0,000). La mediana de SG no se alcanzó en los estadios 0, i y ii, siendo de 26 y 12 meses para los estadios iii y iv, respectivamente (fig. 3).
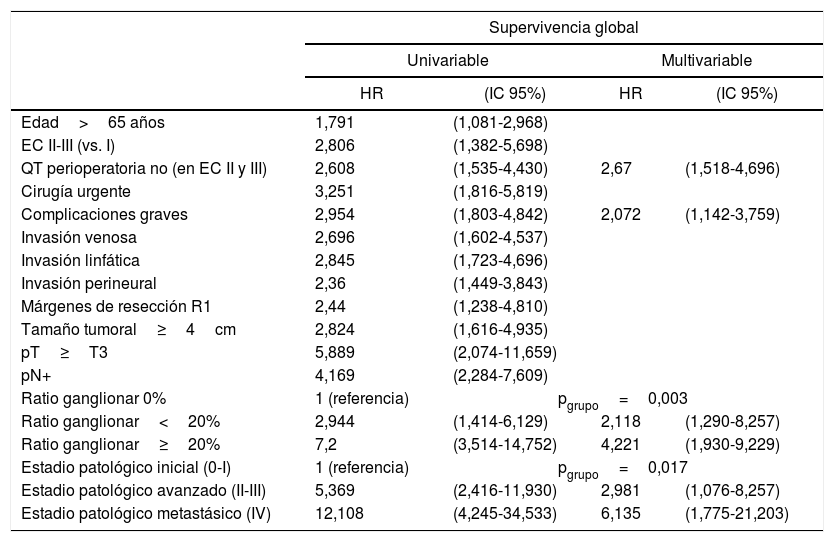
Las variables que mostraron ser factores de mal pronóstico independientes para la SG en el modelo de regresión de Cox se muestran en la tabla 2.
Influencia de las variables clínicas y patológicas en la supervivencia global en cáncer gástrico intervenido con intención radical
| Supervivencia global | ||||
|---|---|---|---|---|
| Univariable | Multivariable | |||
| HR | (IC 95%) | HR | (IC 95%) | |
| Edad>65 años | 1,791 | (1,081-2,968) | ||
| EC II-III (vs. I) | 2,806 | (1,382-5,698) | ||
| QT perioperatoria no (en EC II y III) | 2,608 | (1,535-4,430) | 2,67 | (1,518-4,696) |
| Cirugía urgente | 3,251 | (1,816-5,819) | ||
| Complicaciones graves | 2,954 | (1,803-4,842) | 2,072 | (1,142-3,759) |
| Invasión venosa | 2,696 | (1,602-4,537) | ||
| Invasión linfática | 2,845 | (1,723-4,696) | ||
| Invasión perineural | 2,36 | (1,449-3,843) | ||
| Márgenes de resección R1 | 2,44 | (1,238-4,810) | ||
| Tamaño tumoral≥4cm | 2,824 | (1,616-4,935) | ||
| pT≥T3 | 5,889 | (2,074-11,659) | ||
| pN+ | 4,169 | (2,284-7,609) | ||
| Ratio ganglionar 0% | 1 (referencia) | pgrupo=0,003 | ||
| Ratio ganglionar<20% | 2,944 | (1,414-6,129) | 2,118 | (1,290-8,257) |
| Ratio ganglionar≥20% | 7,2 | (3,514-14,752) | 4,221 | (1,930-9,229) |
| Estadio patológico inicial (0-I) | 1 (referencia) | pgrupo=0,017 | ||
| Estadio patológico avanzado (II-III) | 5,369 | (2,416-11,930) | 2,981 | (1,076-8,257) |
| Estadio patológico metastásico (IV) | 12,108 | (4,245-34,533) | 6,135 | (1,775-21,203) |
EC: estadio clínico; HR: hazard ratio; IC 95%: intervalo de confianza al 95%; QT: quimioterapia; pN afectación ganglionar patológica; pT: infiltración tumoral patológica.
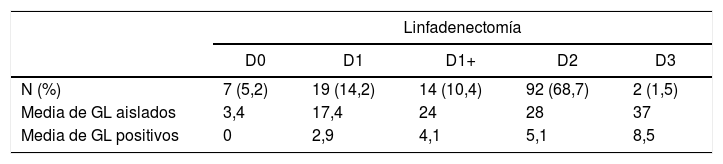
En la tabla 3 se muestran los tipos de LD, con el número de ganglios linfáticos (GL) aislados y positivos según la LD realizada. La diferencia en la SG a 5 años en los estadios patológicos ii y iii según el tipo de LD realizada fue clínicamente relevante (17% en LD<D1+ vs. 43,3% en LD≥D1+), aun sin haber alcanzado la significación estadística (p=0,4).
Afectación ganglionar en función de la linfadenectomía en cáncer gástrico intervenido con intención radical
| Linfadenectomía | |||||
|---|---|---|---|---|---|
| D0 | D1 | D1+ | D2 | D3 | |
| N (%) | 7 (5,2) | 19 (14,2) | 14 (10,4) | 92 (68,7) | 2 (1,5) |
| Media de GL aislados | 3,4 | 17,4 | 24 | 28 | 37 |
| Media de GL positivos | 0 | 2,9 | 4,1 | 5,1 | 8,5 |
GL: ganglios linfáticos.
Es llamativa la relativamente escasa información en el mundo occidental, y especialmente a nivel nacional, sobre índices de calidad asistencial en la cirugía del CG tan básicos e importantes como la morbimortalidad o la SV. A pesar de ser un tumor de incidencia relativamente baja en España (6,8 casos/100.000 habitantes-año)9, de presentarse con metástasis a distancia en aproximadamente un 40% de los casos10–12, de tener una pobre SV (SG a 5 años del 25,1% en Europa para todos los CG diagnosticados según el estudio EUROCARE-5)2 y de requerir tratamientos complejos y multidisciplinares, todos ellos factores que reclamarían una atención especial, hay un gran vacío de información sobre los resultados del tratamiento quirúrgico de estos pacientes en nuestro país, lo que podría conllevar una idea equivocada sobre su pronóstico, asumiendo que nuestros resultados son iguales a los mejores publicados, generalmente de series orientales.
A pesar de los avances en las últimas décadas en la precisión diagnóstica, los cuidados postoperatorios y los tratamientos complementarios perioperatorios, el pronóstico del CG sigue siendo sombrío, situándose en la tercera causa de mortalidad por cáncer a nivel mundial9. La tasa de SG a 5 años tras resección gástrica en Estados Unidos, según un estudio multiinstitucional publicado en 2015 que incluía 807 pacientes intervenidos entre los años 2000 y 201213, es del 30%, con un 4,7% de CG metastásico. Sin embargo, en Japón, la tasa de SG a 5 años para todos los pacientes intervenidos (7.935 pacientes) según el registro de 1991 en 113 hospitales, que incluía también pacientes metastásicos (15,1%), fue del 68,2%14, fundamentalmente por la tasa netamente superior de CG precoz (48,8%) debido a los programas de cribado, aunque también es superior cuando se compara por estadios. Esta tasa de SG a 5 años se ha mantenido invariable en un estudio reciente que incluye 118.367 pacientes intervenidos entre 2001 y 200715. En Europa, de acuerdo con el registro nacional belga, publicado en 2015 para identificar los indicadores de calidad en la cirugía esofagogástrica de pacientes (n=4.847) intervenidos entre 2004 y 200816, la tasa de SG a 5 años observada fue del 19,4% al comienzo del estudio y del 27,4% al final del mismo.
La SG a 5 años de nuestra serie (53,8%) fue muy superior a la publicada por Estados Unidos (30%), a pesar de incluir más pacientes en estadio iv (8,2 vs. 4,7%), y a la del registro belga (27,4% al final del estudio), e inferior a la registrada por el registro japonés (68,2%), que incluye un 15,1% de pacientes intervenidos con estadio iv. En un registro multicéntrico europeo publicado en 201317, que incluyó pacientes intervenidos de los registros nacionales de Holanda, Suecia, Dinamarca e Inglaterra (estadio iv 7,6-17,1%), las tasas de SG a 2 años fueron del 51,9; 51,7; 53,7 y 56,3%, respectivamente, siendo la SG a 2 años de nuestra serie próxima al 70% (estadio iv 8,2%). Estas comparaciones globales solo pueden ser orientativas, dados los sesgos que surgen en las comparaciones cruzadas entre estudios, máxime cuando la distribución por estadios no es exactamente igual en todas las series, y en la mayoría no se especifican las tasas de cirugía curativa/paliativa.
Sin embargo, la comparación de la SV por estadios puede ser más clarificadora. En el estudio multiinstitucional estadounidense de 201513, la SG a 5 años fue del 62% para el estadio i (27,9% de los pacientes), del 43% para el estadio ii (24,9%), del 21% para el estadio iii (42,5%) y del 4% para el estadio iv (4,7%). En el análisis por estadios del registro belga16, la SG a 5 años para hombres/mujeres fue del 57,9/58,3% para el estadio i, del 40,7/36,5% para el estadio ii, del 17,6/17,1% para el estadio iii y del 3,7/2,8% para el estadio iv. En los resultados publicados por la JGCA15, la SG a 5 años fue del 91,5% para el estadio IA (43,7% pacientes), del 83,3% para el estadio IB (15,5%), del 68,9% para el estadio II (13,1%), del 49,6% para el estadio IIIA (8,6%), del 32,3% para el estadio IIIB (3,4%) y del 17% para el estadio iv (14,2%).
En nuestra serie, la SG a 5 años fue del 100% para el estadio 0 (8,2% de los pacientes), del 88,1% para el estadio i (20,2%), del 62,2% para el estadio ii (26,1%), del 21,1% para el estadio iii (37,3%) y del 17% para el estadio iv (8,2%). Estas tasas fueron superiores a las publicadas por los registros nacionales de Estados Unidos13 y Bélgica16, y alcanzaron cifras similares respecto a las registradas por Japón15 para los estadios i, ii y iv, pero muy inferiores para el estadio iii.
El grupo EURECCA español de cáncer esofagogástrico7 publicó en 2019 una media de SG de 39,5 meses, sin incluir pacientes en estadio iv y sin especificar las tasas de SG a 5 años ni por estadios. El estudio basado en el registro de la Comunidad Valenciana para CG6 tampoco incluyó resultados de SG con los que podernos comparar. Aunque podría parecer indiscutible la necesidad de conocer y auditar los resultados propios en la cirugía oncológica compleja, la realidad en nuestro entorno es muy distinta debido a la sobrecarga asistencial, a la falta de cultura de medición de resultados y, sobre todo, a la ausencia de la infraestructura administrativa esencial para la recogida de datos (que solo depende de la iniciativa y el sobreesfuerzo personal). La información que se transmite a los pacientes sobre estos procedimientos quirúrgicos habitualmente se sustenta en datos de la literatura y no propios, por lo que puede estar completamente sesgada y, además, inducir una falsa seguridad (tanto a médicos como a pacientes) al asumir que nuestros resultados son iguales a los mejores publicados. El registro y análisis de la actividad propia es fundamental para conocer los resultados locales y promover acciones de mejora con el fin de optimizar la atención oncoquirúrgica.
Los factores de mal pronóstico independientes para la SG que hemos obtenido (ausencia de QT perioperatoria en estadios ii y iii, complicaciones graves y ratio ganglionar) son similares a los de otras series. En la tabla 2 solo se consignan los factores que tuvieron significación estadística, al menos en el análisis univariable. Otras variables tradicionalmente relacionadas con la SG a 5 años no han sido significativas en nuestra serie y por ello no se muestran en dicha tabla. Entre ellas cabe destacar la localización proximal, el tipo difuso de Lauren, el grado de diferenciación, el tipo de gastrectomía, la extensión de la LD o el aislamiento de menos de 15 GL, si bien el número de GL aislados y de GL positivos aumentó en función del tipo de LD realizada (tabla 3), siendo la ratio ganglionar un factor pronóstico independiente de la SG (tabla 2).
Los resultados favorables de SV de nuestra serie se deben probablemente a una conjunción de medidas, entre las que cabe destacar la toma de todas las decisiones de tratamiento de forma colegiada en un Comité Multidisciplinar de Tumores, la estadificación óptima realizando laparoscopia en un alto porcentaje, la coordinación oncoquirúrgica, que permite que reciban QT perioperatoria la mayoría de los pacientes en los que está indicada, y el alto número de LD extensas.
Concluimos, por tanto, que nuestras tasas de SG y las obtenidas por estadio se encuentran entre las mejores publicadas en la literatura occidental, aunque se describen rangos muy amplios y con gran variabilidad entre países. Los resultados se aproximan a los obtenidos en el registro japonés en los estadios i, ii y iv, pero son llamativamente inferiores en el estadio iii, motivo por el que probablemente haya diferencia en la SG bruta. No se han podido comparar con resultados nacionales debido al déficit de información sobre resultados oncológicos en la cirugía del CG en nuestro entorno más cercano. El análisis de los resultados propios en la cirugía oncológica compleja permite analizar las oportunidades de mejora, para optimizar las decisiones diagnósticas y terapéuticas en estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.