Analizar el impacto de la cirugía de second look (CSL) combinada con quimioterapia intraperitoneal hipertérmica (HIPEC) realizada un año después de la cirugía del tumor primario en pacientes asintomáticos con alto riesgo de desarrollar carcinomatosis peritoneal (CP) tras resección de cáncer colorrectal.
MétodosEntre febrero 2012 y febrero 2016, 33 pacientes con alto riesgo de recidiva peritoneal, sin signos de recurrencia en pruebas de imagen fueron prospectivamente incluidos en el estudio y sometidos a CSL con el objetivo de tratar posibles recidivas peritoneales precozmente. Los pacientes fueron seleccionados por 5 criterios: pT4 (n = 15), citología peritoneal positiva por cáncer (n = 2), tumor perforado (n = 4), enfermedad peritoneal sincrónica resecada (n = 10), metástasis ováricas sincrónicas resecadas (n = 2).
ResultadosSe detectó carcinomatosis peritoneal (CP) en 10 de los 33 pacientes (30,3%) (CP+), en los cuales se realizó citorreducción completa más HIPEC. En el subgrupo de los pacientes pT4 (n = 15) se detectó CP solo en 2 casos (13,3%). El resto de los pacientes (CP-) fueron sometidos a HIPEC profiláctica. La mediana de seguimiento después de CSL ha sido de 14,5 meses. La tasa de morbilidad postoperatoria grave (Clavien-Dindo III-V) fue del 15,2% (5/33) y la mortalidad del 3,0% (1 paciente al 55.° día postoperatorio). La supervivencia global a 3 años fue del 93% y la supervivencia libre de enfermedad del 33%. Tras CSL + HIPEC, 4/33 pacientes (12,1%) recidivaron en el peritoneo, 2 CP + (20%) y 2 CP - (8,7%) (p = 0,04).
ConclusionesLa realización de CSL + HIPEC en nuestra serie de pacientes con alto riesgo de desarrollar CP permite su detección temprana y su tratamiento en el 30,3% de los casos, con una tasa muy baja de recurrencia peritoneal posterior. Es importante continuar evaluando los resultados para aumentar la precisión de los criterios de inclusión, especialmente del criterio pT4, que en esta serie tiene un bajo poder predictivo para la aparición de CP.
To analyze the impact of systematic second-look surgery plus hyperthermic intraperitoneal chemotherapy (HIPEC) performed 1 year after resection of the primary tumor, in asymptomatic patients at high risk of developing peritoneal carcinomatosis (PC).
MethodsBetween 2012-2016, 33 patients without any sign of peritoneal recurrence on imaging studies were prospectively included in the study and underwent second-look surgery aimed at treating limited PC earlier and were prospectively recorded. They were selected based on 5 primary tumor-associated criteria: resected minimal synchronous macroscopic PC (n = 10), synchronous ovarian metastases (n = 2), positive peritoneal cytology (n = 2), pT4 primary tumors (n = 15) and perforation (n = 4).
ResultsPC was found and treated by cytoreduction plus HIPEC in 10 of the 33 (30.3%) patients, although it was detected in only 2/15 patients of the pT4 subgroup (13.3%). The patients without PC underwent complete abdominal exploration plus HIPEC. Median follow-up was 14.5 months. One patient died postoperatively at day 55. Severe morbidity rate (Clavien-Dindo III-V) was low (15.2%). The 3-year overall survival rate was 93% and the 3-year disease-free survival rate was 33%. Peritoneal recurrences occurred in 4 patients (12.1%), 2 of whom had macroscopic PC discovered at the second-look (20%), while the other 2 patients had no macroscopic PC (8.7%) (P = .04).
ConclusionsThe second look + HIPEC strategy in our series of patients at high risk of developing PC, allows its early detection and its treatment in 30.3% of cases, with a very low rate of peritoneal recurrence. It is important to continue evaluating the results to increase the accuracy of the inclusion criteria, especially the pT4 criterion that in this series has a low predictive power for the occurrence of PC.
En el cáncer colorrectal (CCR), la carcinomatosis peritoneal (CP) se detecta al diagnóstico del tumor primario en el 10% de los pacientes, y el 40-70% de los pacientes tratados presentan recidiva, localizándose exclusivamente en el peritoneo en el 10-35%1–5. Estos pacientes con CP se han considerado clásicamente como incurables; aunque la mediana de supervivencia se ha incrementado considerablemente con la quimioterapia (QT) contemporánea (basada en oxaliplatino o irinotecan) llegando a 12,7 meses6, la supervivencia prolongada es anecdótica7–10. Pero el pronóstico ha mejorado con el empleo de cirugía de citorreducción (CR) combinada con quimioterapia intraperitoneal hipertérmica (Hyperthermic IntraPEritoneal Chemotherapy [HIPEC]). La supervivencia en pacientes con CP es del 30% a 5 años y podría exceder del 40% en pacientes seleccionados11,12. Los mejores resultados se obtienen en pacientes con baja carga tumoral (índice de carcinomatosis peritoneal [Peritoneal Cancer Index –PCI–]). El PCI es el factor pronóstico más importante8,13,14, con una supervivencia a 5 años del 49% en pacientes con PCI < 7 en comparación con supervivencias < 10% con PCI ≥ 2013. Los pacientes con mucha afectación peritoneal (PCI > 21) no se benefician de esta técnica.
Todos nuestros esfuerzos deberían ir dirigidos a identificar pacientes con carcinomatosis peritoneal en el estadio más precoz posible. El diagnóstico precoz de la CP es difícil, por la ausencia de síntomas en fases tempranas y la pobre sensibilidad de las pruebas de imagen actuales para detectar la enfermedad peritoneal de bajo volumen15. El grupo de Elias ha propuesto la realización sistemática de cirugía de second look (CSL) + HIPEC en pacientes intervenidos de CCR con intención curativa sin evidencia de enfermedad peritoneal en el seguimiento pero con factores que aumentan el riesgo de recidiva a dicho nivel, detectando CP en un 56% de los casos intervenidos con esta estrategia16. Los criterios de selección del grupo francés incluyen a los pacientes que con perforación tumoral al diagnóstico o aquellos en los que se resecó CP limitada o metástasis ováricas de forma simultánea y radical con el tumor primario. Sin embargo, hay otros factores que claramente se relacionan con un mayor riesgo de recidiva peritoneal, fundamentalmente que el tumor primario sea pT417–20 o la existencia de citología positiva en la cirugía del primario21,22.
El objetivo de nuestro estudio es analizar el impacto de la CSL + HIPEC en un grupo de pacientes intervenidos previamente de CCR sin evidencia de recidiva peritoneal en el seguimiento, pero con diversos criterios de alto riesgo para desarrollarla, en un intento de diagnosticar y tratar la CP en un estadio precoz.
MétodosEstudio prospectivo, aprobado por el Comité Ético, en el que todos los pacientes fueron informados del objetivo del mismo y firmaron consentimiento específico para ser incluidos en el mismo.
Se aplicaron los siguientes criterios de inclusión:
- 1.
Pacientes con CCR intervenido con intención curativa y alto riesgo de desarrollar CP (pT4, citología positiva, perforación del tumor primario, enfermedad peritoneal sincrónica resecada con el tumor primario [EPSR] o metástasis ováricas sincrónicas resecadas [MOSR]).
- 2.
Ausencia de signos de recurrencia radiológica (TC tórax-abdomen-pelvis siempre, PET-TC selectivamente en caso de duda), clínica ni analítica (marcadores tumorales) alrededor de 4-6 meses del fin de la QT adyuvante, con la única excepción de la existencia de metástasis hepáticas limitadas y resecables en el mismo procedimiento.
- 3.
Pacientes con buen estado general (WHO performance status < 2).
El estudio se llevó a cabo desde febrero de 2012 hasta febrero de 2016, seleccionando aquellos pacientes que cumplían los criterios de inclusión desde el Comité de Tumores, cuando no existían signos de recurrencia peritoneal en la revisión realizada alrededor de 4-6 meses tras finalizar la QT adyuvante (según protocolo, 12 ciclos de FOLFOX, 6 meses). Los pacientes fueron sometidos a CSL por laparotomía o laparoscopia cuando se consideró factible. En los pacientes con CP se realizó CR + HIPEC. En los que no presentaban CP solo se realizó HIPEC. Además realizamos omentectomía, apendicectomía y anexectomía (posmenopáusicas) si no se habían llevado a cabo durante la cirugía del tumor primario, además de la resección de las metástasis hepáticas limitadas en los pocos pacientes que las presentaban.
Se calculó el PCI, aunque solo se consideró positivo tras la confirmación histológica definitiva (gold standard). Se realizó HIPEC con oxaliplatino a dosis de 460mg/ m2, temperatura media de 42° C (41-43° C) durante 30 min, tras 5-fluoracilo (400mg/ m2) y leucovorin (20mg/ m2) en perfusión intravenosa 30 min antes23–25.
Se registraron las complicaciones mayores (III-V según la clasificación de Dindo-Clavien)26,27 y la estancia postoperatoria. Se siguió a los pacientes según el protocolo oncológico del Hospital Universitario de Fuenlabrada: TC toracoabdominopélvico y determinación de marcadores tumorales cada 3 meses durante los siguientes 2 años y cada 6 meses en los 3 años posteriores. Los pacientes con CP+ y aquellos con resección simultánea de metástasis hepáticas recibieron QT complementaria.
Análisis estadísticosLos datos se analizaron en febrero de 2016. Las variables cualitativas fueron descritas con sus frecuencias de distribución y comparadas con el test χ2 de Pearson o el test exacto de Fisher. Las variables cuantitativas se expresaron con la media (desviación estándar [DE]) o mediana (rango intercuartílico) si no tenían distribución normal, y se compararon usando el test de t de Student o el test de U Mann-Whitney. Para el análisis de supervivencias se usó el método de Kaplan-Meier y se compararon usando el test log-rank. Las variables clínica o estadísticamente significativas fueron ajustadas mediante un modelo de regresión multivariable de Cox. Todos los análisis estadísticos se realizaron utilizando SPSS v19.0. Se consideró significativa una p < 0,05.
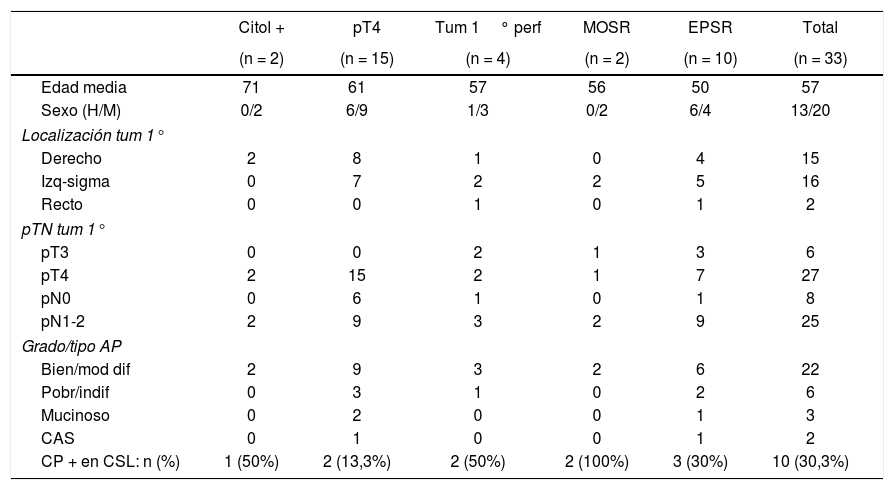
ResultadosSe realizó CSL + HIPEC en 33 pacientes. Se descubrió CP macroscópica (CP+) en 10 de los 33 pacientes (30,3%). La incidencia de CP total y por subgrupos (según cada factor de riesgo de CP analizado) se muestran en la tabla 1. En tres pacientes se realizaron además resecciones menores hepáticas por la coexistencia de metástasis.
Características de los pacientes e incidencia de CP por subgrupos (criterio de inclusión)
| Citol + | pT4 | Tum 1° perf | MOSR | EPSR | Total | |
|---|---|---|---|---|---|---|
| (n = 2) | (n = 15) | (n = 4) | (n = 2) | (n = 10) | (n = 33) | |
| Edad media | 71 | 61 | 57 | 56 | 50 | 57 |
| Sexo (H/M) | 0/2 | 6/9 | 1/3 | 0/2 | 6/4 | 13/20 |
| Localización tum 1° | ||||||
| Derecho | 2 | 8 | 1 | 0 | 4 | 15 |
| Izq-sigma | 0 | 7 | 2 | 2 | 5 | 16 |
| Recto | 0 | 0 | 1 | 0 | 1 | 2 |
| pTN tum 1° | ||||||
| pT3 | 0 | 0 | 2 | 1 | 3 | 6 |
| pT4 | 2 | 15 | 2 | 1 | 7 | 27 |
| pN0 | 0 | 6 | 1 | 0 | 1 | 8 |
| pN1-2 | 2 | 9 | 3 | 2 | 9 | 25 |
| Grado/tipo AP | ||||||
| Bien/mod dif | 2 | 9 | 3 | 2 | 6 | 22 |
| Pobr/indif | 0 | 3 | 1 | 0 | 2 | 6 |
| Mucinoso | 0 | 2 | 0 | 0 | 1 | 3 |
| CAS | 0 | 1 | 0 | 0 | 1 | 2 |
| CP + en CSL: n (%) | 1 (50%) | 2 (13,3%) | 2 (50%) | 2 (100%) | 3 (30%) | 10 (30,3%) |
CAS: células en anillo de sello; Citol +: citología positiva; CP: carcinomatosis peritoneal; CSL: cirugía de second look; EPSR: enfermedad peritoneal sincrónica resecada; MOSR: metástasis ováricas sincrónicas resecadas; Tum 1° perf: tumor primario perforado.
La media de tiempo transcurrido entre la cirugía del tumor primario y la CSL fue de 10,8 meses; rango 8-18. En el grupo CP+ la media (DE) fue de 11,9 (8,2) meses. En el grupo sin hallazgos (CP-) el intervalo fue de 10,3 (3,8) meses (p > 0,05).
El abordaje fue por laparotomía en 25 pacientes, y por laparoscopia en 8 (2 conversiones). Todas las laparoscopias se realizaron por criterio pT4 (se había realizado la cirugía del primario por laparoscopia). Solo se descubrió CP+ mínima (PCI 3) en uno de los 6 abordajes laparoscópicos puros, y es el único de ellos que ha presentado recidiva.
Solo uno de los tres pacientes en los que se realizó resección simultánea de metástasis hepáticas presentaba CP+.
La media (DE) de PCI en los casos CP+ fue de 4,3 (2,9). El PCI por subgrupos de los casos con CP+ se especifica en la tabla 2.
PCI por subgrupos (criterio de inclusión)
| Factor de riesgo | Media PCI |
|---|---|
| Citología + (n = 2) | 9 |
| pT4 (n = 15) | 5 |
| Tum 1° perf (n = 4) | 2 |
| MOSR (n = 2) | 4,5 |
| EPSR (n = 10) | 3,67 |
| Total | 4,3 |
EPSR: enfermedad peritoneal sincrónica resecada; MOSR: metástasis ováricas sincrónicas resecadas; PCI: peritoneal cancer index; Tum 1° perf: tumor primario perforado.
En el análisis univariable, ninguno de los factores (sexo, localización, subgrupos de riesgo, estadios T-N del tumor primario) fue predictor de CP macroscópica.
Al finalizar la cirugía se realizó HIPEC en todos los pacientes, CP+ (n = 10) y CP- (n = 23). La duración media (DE) de la cirugía fue mayor en pacientes con CP+ (349 [101] min) que en el grupo CP- (276 [82] min) (p < 0,05).
Morbimortalidad: el postoperatorio cursó sin complicaciones mayores en 28 de los 33 pacientes (84,9%). La morbilidad severa (complicaciones grados 3-5 según la escala de Dindo-Clavien) fue del 15,2% (5/33), incluyendo un fallecimiento postoperatorio. En los 23 pacientes CP- la tasa de complicaciones mayores fue del 4,3% (1/23), mientras que en los 10 pacientes CP+ fue del 40% (4/10) (p = 0,03). Un paciente (subgrupo EPSR) (3,0%) falleció por fallo multiorgánico postoperatorio. El PCI estimado durante la CSL de este paciente fue de 2, resecando las lesiones, reconstruyendo el tránsito intestinal con cierre de una ileostomía de protección realizada en la primera intervención (hemicolectomía derecha y resección rectosigmoidea) y aplicando HIPEC. El paciente fue reintervenido en 2 ocasiones: hemoperitoneo y dehiscencia de la anastomosis ileal y peritonitis biliar secundaria a perforación yeyunal. Tras múltiples complicaciones (neumonía, TVP, shock séptico), éxitus por fallo multiorgánico a los 55 días de estancia en Unidad de Cuidados Intensivos.
La mediana de estancia hospitalaria fue 8 (15) días; en CP+ fue de 12 (38) días y en CP–, 7 (11) días (p = 0,12).
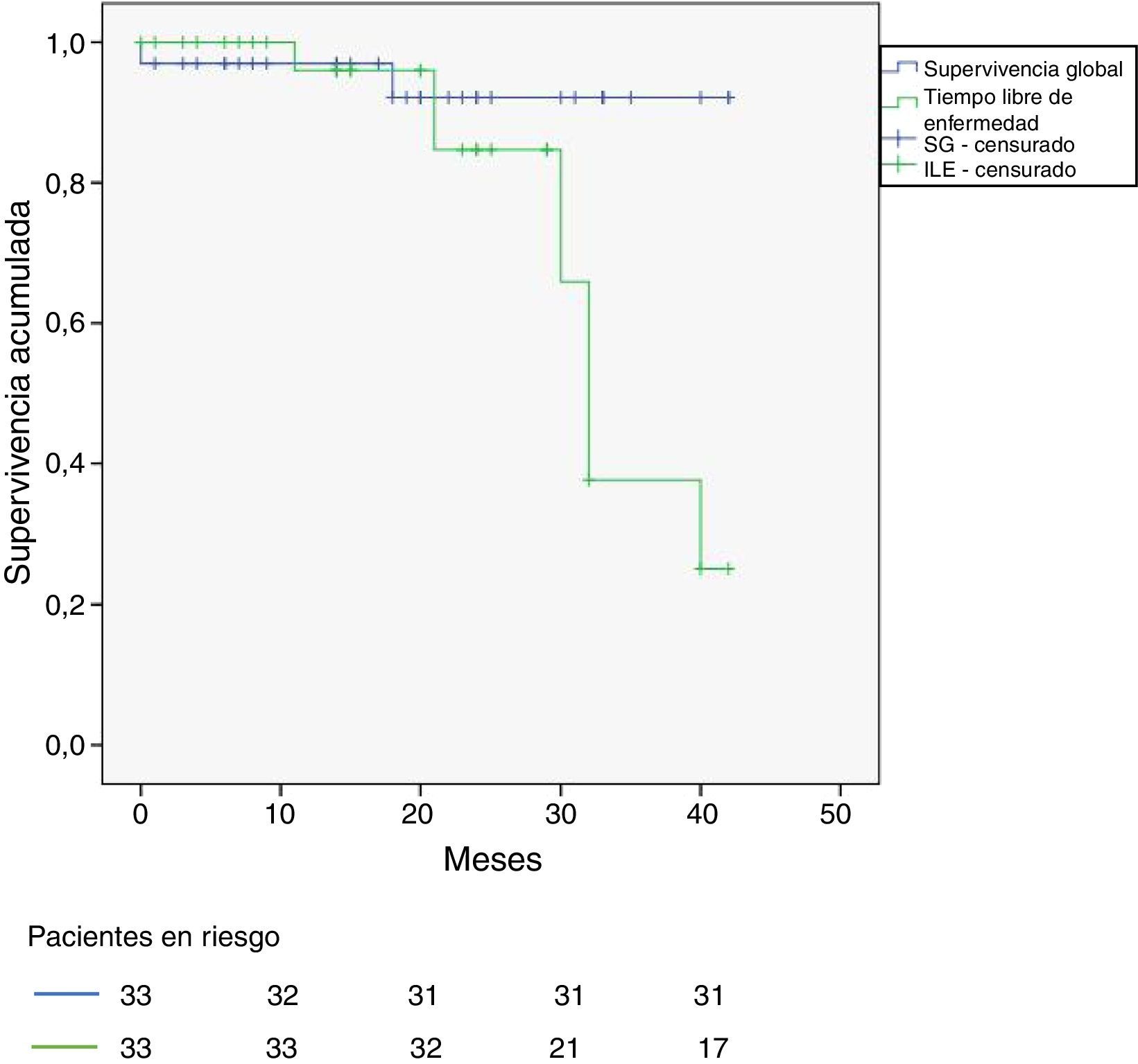
Seguimiento y supervivencia: la mediana de seguimiento después de la CSL es de 14,5 meses. No hay pacientes perdidos en el seguimiento.
La mediana de supervivencia todavía no ha sido alcanzada.
Las tasas de supervivencia global (SG) y libre de enfermedad (SLE) de los 33 pacientes aparecen en la figura 1. SG a 3 años: 93% y SLE a 3 años: 33%.
Hay 6 recaídas hasta el momento de revisión (febrero de 2016), 4 de ellos en torno a los 30 meses de seguimiento. De los 6 casos por laparoscopia solo uno ha presentado recidiva (el único que tenía CP+), peritoneal. Ninguno de los tres pacientes con resección simultánea de metástasis hepáticas ha presentado recidiva peritoneal ni hepática. El criterio pT4 resultó estadísticamente significativo (p = 0,037) como predictor de recidiva pos-CSL en el estudio univariable, pero en el análisis multivariable por regresión de Cox perdió la significación (p = 0,068).
En el grupo CP+, 4 pacientes (40%) recayeron y uno de ellos falleció a causa de la enfermedad. La recurrencia fue en peritoneo (2), locorregional/anastomosis (1) e hígado (1).
De los CP-, 2 pacientes (8,7%) recayeron y ninguno falleció en el seguimiento. La recurrencia fue: peritoneo y locorregional/anastomosis (1) y peritoneo y útero (1).
En definitiva, 4 pacientes (12,1%) recidivaron en el peritoneo, 2 en el grupo CP+ (20%) y 2 en el de CP- (8,7%) (p = 0,04).
DiscusiónLa CSL en nuestra serie diagnostica CP en el 30,3% de los pacientes con CCR con alto riesgo sin hallazgos clínico-radiológicos previos. El grupo de Elias12 constata hallazgos de CP hasta el 56% de pacientes con criterios de selección más restrictivos, al considerar que no hay suficiente información para incluir los pT4 o con citología positiva. Se han descrito otros factores de riesgo28,29 para carcinomatosis. Hay información relevante sobre el riesgo aumentado de recidiva peritoneal en los tumores con citología positiva21,22 y en los pT417–20, por lo que se han incluido en nuestro estudio. Hay diversos ensayos en marcha que exploran la posibilidad de administrar HIPEC de entrada en los tumores estadificados preoperatoriamente como cT4.
Según nuestros resultados, los criterios de inclusión han sido seleccionados con éxito, ya que más del 30% de pacientes han presentado CP en el momento de la CSL. Pero solo se ha detectado CP en un 13,3% de los pT4; si los excluyésemos16, el grupo de CP+ pasaría a ser del 44,4%. La consideración de los pT4 debe ponerse todavía en cuarentena.
En nuestro estudio, los pacientes con EPSR tienen tasa de CP+ del 30% (60% en el artículo de Elias16). Consideramos que este criterio sí debería incluirse como criterio de inclusión para CSL. La resección previa de metástasis ováricas, que hemos considerado por separado pero podría considerarse junto con el subgrupo de EPSR, resultó ser el criterio más fiable (los dos pacientes tenían recaída peritoneal indetectada). Estos dos últimos subgrupos serían candidatos a HIPEC simultánea en la primera cirugía, siempre que la enfermedad peritoneal se hubiera diagnosticado preoperatoriamente y en el contexto de un centro con la infraestructura adecuada (con programa HIPEC).
Dos de los cuatro pacientes con tumor perforado tuvieron CP en la CSL. La perforación en ambos casos fue iatrogénica a nivel del tumor por la colocación de un stent, no por distensión colónica a distancia del tumor primario. Estos últimos no deben incluirse para CSL.
En cuanto a la citología positiva, uno de nuestros dos pacientes tenía CP. La citología se realiza de forma muy infrecuente, pero es una maniobra sencilla y barata que debería generalizarse.
Aunque nuestra intención era realizar la CSL + HIPEC alrededor de 4-6 meses tras el final de la QT adyuvante en caso de no existir evidencia de recurrencia, los pacientes se seleccionan cuando son presentados en Comité. La media de tiempo transcurrido entre la cirugía del tumor primario y la CSL en nuestra serie es de 10,82 meses, pero algunos pacientes fueron intervenidos un poco después (rango de 8-18), siempre que siguieran cumpliendo los criterios de inclusión.
El abordaje fue laparotomía en 25 pacientes y laparoscopia en 8 (la cirugía del tumor primario había sido también laparoscópica y la exploración peritoneal durante la CSL fue satisfactoria en 6 de ellos, optándose por conversión en los otros dos). Está aceptado que la CR + HIPEC por laparoscopia es posible y segura en pacientes estrictamente seleccionados con enfermedad peritoneal limitada, pudiendo reducir las complicaciones postoperatorias. Aunque la laparoscopia puede infraestimar el volumen de enfermedad peritoneal, esto es menos preocupante en un abdomen sin cirugía abierta previa, siendo esta nuestra filosofía al seleccionar pacientes para laparoscopia y convirtiendo a la mínima duda.
La morbimortalidad después de CRS + HIPEC está correlacionada con la extensión de la CP, con la extensión y complejidad de la cirugía. La CSL se realiza en pacientes sin evidencia de CP en las pruebas preoperatorias y por tanto normalmente, en caso de encontrar CP, esta es muy limitada (media PCI 4,3 en nuestra serie), y precisa resecciones limitadas de poca morbilidad. Pero muchos pacientes precisan adhesiólisis extensa y cierre de posibles estomas que aumentan el riesgo quirúrgico. En ningún caso hemos encontrado enfermedad extensa. Nuestra tasa de complicaciones mayores en pacientes CP- fue muy baja (4,3%), mientras en pacientes CP+ fue similar a la de los pacientes intervenidos por CP (40%). Consideramos asumibles ambas tasas, si bien la existencia de mortalidad nos obliga a intentar afinar al máximo las indicaciones.
Respaldados por el trabajo de Elias30, en el que los pacientes con CP- que no recibieron HIPEC tuvieron una recurrencia peritoneal del 42%, realizamos HIPEC sistemática en todos los pacientes. A pesar de que el tiempo de seguimiento es corto (mediana de 14,5 meses) obtenemos tasas de recurrencia peritoneal del 8,69% en el grupo CP- y del 12,12% en el total de la serie (datos comparables con la serie de Elias, 6% y 17% respectivamente)16. Y aunque la SG a 3 años del 93% es prometedora, nuestro estudio aporta una probabilidad relativamente baja de SLE a 3 años (33%). Solo han recaído 6 pacientes en la serie global, pero 4 de ellos lo han hecho en torno a los 3 años, lo que hace que la SLE caiga a partir de ese momento. La serie de Elias16 presenta una tasa alta de recurrencia extraperitoneal, con una SLE a 5 años del 44%. Nuestras recaídas fueron en su mayor parte intraabdominales (peritoneales, locorregionales).
Para asegurar el beneficio de esta estrategia es imprescindible la realización de estudios comparándola con la estrategia estándar (cirugía del primario + QT adyuvante + seguimiento), esperando con gran interés los resultados del estudio multicéntrico francés Prophylochip, en la actualidad está reclutando pacientes.
En conclusión, la CSL + HIPEC en nuestra serie de pacientes permite una detección temprana de CP y su tratamiento en el 30,3% de los casos, con una tasa muy baja de recurrencia peritoneal. No obstante, este procedimiento devenga una tasa de morbilidad no despreciable, e incluso mortalidad. Es importante continuar evaluando los resultados para aumentar la precisión de los criterios de inclusión, especialmente del criterio pT4 que en esta serie tiene un bajo poder predictivo para la aparición de CP. Esto solo debería realizarse en el seno de estudios clínicos perfectamente controlados en Unidades de Carcinomatosis Peritoneal de alto volumen, para evitar los estragos de la curva de aprendizaje, especialmente en estas indicaciones todavía no establecidas.
Autoría/colaboradoresÁngel Serrano del Moral: diseño, análisis e interpretación y redacción. Revisión crítica.
Estibalitz Pérez Viejo: recogida de datos, diseño.
Israel Manzanedo Romero: recogida de datos, diseño.
Gil Rodríguez Caravaca: interpretación de resultados, revisión crítica.
Fernando Pereira Pérez: interpretación de resultados, revisión crítica, aprobación de la versión final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Parte de la información del manuscrito fue presentada en European Society of Coloproctology, Milán septiembre de 2016 y en CNC Madrid, noviembre de 2016.