El cáncer colorrectal (CCR) constituye un problema sanitario relevante, asociado a una morbimortalidad significativa. A lo largo de las últimas décadas se ha estudiado en profundidad el vínculo que existe entre el cáncer y el estado nutricional e inflamatorio de los pacientes oncológicos, y se han desarrollado múltiples escalas inmunonutricionales, relacionadas principalmente con el pronóstico oncológico de varios tipos de cáncer.
Al generarse una interacción entre el tumor y el huésped, se desencadena una reacción inflamatoria sistémica que conduce a una serie de alteraciones neuroendocrinas. Dicha situación favorece una tendencia hacia la anorexia y el catabolismo. Nuestra hipótesis es que el estado nutricional e inflamatorio de los pacientes oncológicos se correlaciona con la morbilidad postoperatoria.
MétodosEste es un estudio observacional y prospectivo de cohortes, con pacientes tratados mediante la cirugía curativa para el CCR en nuestro centro, entre septiembre del 2015 y marzo del 2017. El estado nutricional e inflamatorio de los pacientes fue establecido mediante el uso del Prognostic Nutritional Index (PNI). Las complicaciones (globales, graves, infecciosas y fuga anastomótica) fueron cuidadosamente observadas y registradas durante los 30 primeros días del período postoperatorio.
ResultadosTras llevar a cabo el análisis multivariante, el PNI resultó ser un gran factor predictivo de complicaciones globales (RR: 0,279; IC 95%: 0,141-0,552), complicaciones graves (RR: 0,355; IC 95%: 0,130-0,965), complicaciones infecciosas (RR: 0,220; IC 95%: 0,099-0,489) y fuga anastomótica (RR: 0,151; IC 95%: 0,036-0,640).
ConclusionesNuestro trabajo refleja que el INP es un factor predictivo independiente para el desarrollo de complicaciones tras la cirugía curativa del CCR.
Colorectal cancer (CRC) is a major health concern and it is associated with significant morbidity and mortality. Over the last decades, the relationship between cancer and nutritional and inflammatory status in oncologic patients was studied thoroughly and multiple immunonutritional scores were developed. These scores have been mainly related to the prognosis of several cancers.
An interaction between the tumour and the host is generated, triggering a systemic inflammatory reaction leading to several neuroendocrine changes. This situation favours a tendency towards anorexia and catabolism. Our hypothesis is that nutritional and inflammatory status of oncologic patients is correlated to postoperative morbidity.
MethodsThis is a prospective observational cohort study with those patients undergoing curative surgery for CRC at our institution between September 2015 and March 2017. Nutritional and inflammatory status was established using Onodera's Prognostic Nutritional Index (PNI). Complications (overall, severe, infectious and anastomotic leakage) were carefully collected during the first 30 days of the postoperative period.
ResultsAfter carrying out the multivariate analysis, PNI turned out to be a great predictive and protective factor for overall complications (RR: 0.279; 95% CI: 0.141-0.552), severe complications (RR: 0.355; 95% CI: 0.130-0.965), infectious complications (RR: 0.220; 95% CI: 0.099-0.489) and anastomotic leakage (RR: 0.151; 95% CI: 0.036-0.640).
ConclusionOur work reports that PNI is an independent predictive factor for the development of postoperative complications following curative surgery for CRC.
El cáncer colorrectal (CCR) es un problema de salud importante ya que representa el 10% de todos los cánceres en general. A pesar del gran avance en el diagnóstico y el tratamiento oncológico, el CCR se asocia a altas tasas de morbimortalidad1 y la cirugía es considerada la principal opción de tratamiento curativo2,3.
La tasa de complicaciones postoperatorias es aproximadamente del 29,7% para el cáncer de colon y del 40% para el cáncer de recto4-6. Las complicaciones médicas más relevantes son: el edema agudo de pulmón (2,9%), la neumonía (2,4-6,2%), la insuficiencia renal aguda (0,6-2%), la cardiopatía isquémica (0,5%) y los accidentes cerebrovasculares agudos (0,4%)7-9. Entre las complicaciones quirúrgicas más importantes encontramos: el íleo paralítico (7,5%), la infección del sitio quirúrgico (3,8-14%) y la fístula anastomótica (8,5% en el colon y hasta 15% de recto)10,11. La tasa de mortalidad durante los primeros 30 días del período postoperatorio es del 6,7%12-14.
En los últimos años, se ha observado que la aparición de complicaciones durante el período postoperatorio de la cirugía curativa del CCR no solo afecta la calidad de vida del paciente y la tasa de mortalidad a corto plazo, sino que también tiene una relevante influencia a largo plazo en el pronóstico del cáncer. Las complicaciones se relacionan con una mayor tasa de recidiva local y distante, así como con una peor supervivencia general y supervivencia sin enfermedad15-20. De ahí, la gran importancia en identificar preoperatoriamente a los pacientes que tienen un alto riesgo de desarrollar complicaciones.
En las últimas décadas se ha estudiado a fondo la estrecha relación entre el estado nutricional, el estado inflamatorio y el cáncer. La interacción entre el tumor y el propio huésped desencadena una reacción inflamatoria sistémica, en la que se liberan varias citocinas. Además, hay varios cambios neuroendocrinos que provocan desequilibrios hormonales, lo que genera una tendencia hacia la anorexia y el catabolismo (aumento de la proteólisis y la lipólisis)21,22. En consecuencia, con el objetivo de analizar esta situación en pacientes oncológicos, se han desarrollado varias escalas o scores, calculados principalmente a partir de los marcadores obtenidos en el análisis preoperatorio de sangre periférica. Uno de ellos es el Prognostic Nutritional Index (PNI), diseñado en 1984, por Onodera. El PNI es un índice que permite evaluar el estado nutricional e inflamatorio del paciente y se calcula mediante una fórmula matemática simple: PNI=(10×albúmina sérica [g/dL])+(0,005×linfocitos/μL)23. Los valores más altos indican la mejor situación del paciente.
Insistimos en la hipótesis de que el estado nutricional e inflamatorio de los pacientes con cáncer está relacionado con la morbimortalidad postoperatoria. Por ello, hemos diseñado un estudio prospectivo de cohortes que evalúa la capacidad del PNI para predecir la aparición de complicaciones después de la cirugía curativa del CCR.
MétodosEste es un estudio prospectivo y observacional de cohortes realizado en pacientes intervenidos con cirugía curativa para el CCR en nuestra institución, entre septiembre del 2015 y marzo del 2017. Los pacientes en quienes se realizaron cirugías urgentes o no curativas fueron excluidos del estudio, así como aquellos que obtuvieron diagnósticos patológicos distintos del CCR. Este estudio es parte de un proyecto de investigación pública y ha sido aprobado por el Comité de Ética de Investigación Clínica de nuestra institución. Se han seguido todos los principios éticos y las pautas de protección de datos para recopilar toda la información de los pacientes incluidos en él.
Hemos recopilado variables preoperatorias que pueden influir en el desarrollo de complicaciones postoperatorias: sexo, edad, índice de masa corporal, factores de riesgo cardiovascular (hipertensión arterial, diabetes mellitus, dislipidemia y tabaquismo), tratamiento neoadyuvante con quimioterapia o radioterapia, riesgo anestésico de acuerdo con la clasificación de la American Society of Anaesthesiology (ASA), colocación de stents antes de la cirugía (en aquellos casos que presentaban una neoplasia obstructiva y que no eran operados de urgencia), ubicación del tumor (colon o recto), momento de la cirugía y transfusión intraoperatoria de concentrados de glóbulos rojos. Además, resaltamos que solo consideramos procedimientos curativos aquellos en los que se podría lograr una resección R0.
Todas nuestras variables fueron dicotómicas, excepto 3variables cuantitativas (edad, índice de masa corporal y tiempo quirúrgico). El riesgo anestésico se recodificó en una nueva variable dicotómica, por lo que los pacientes se clasificaron como de alto riesgo (ASA III-IV) o de bajo riesgo (ASA I-II).
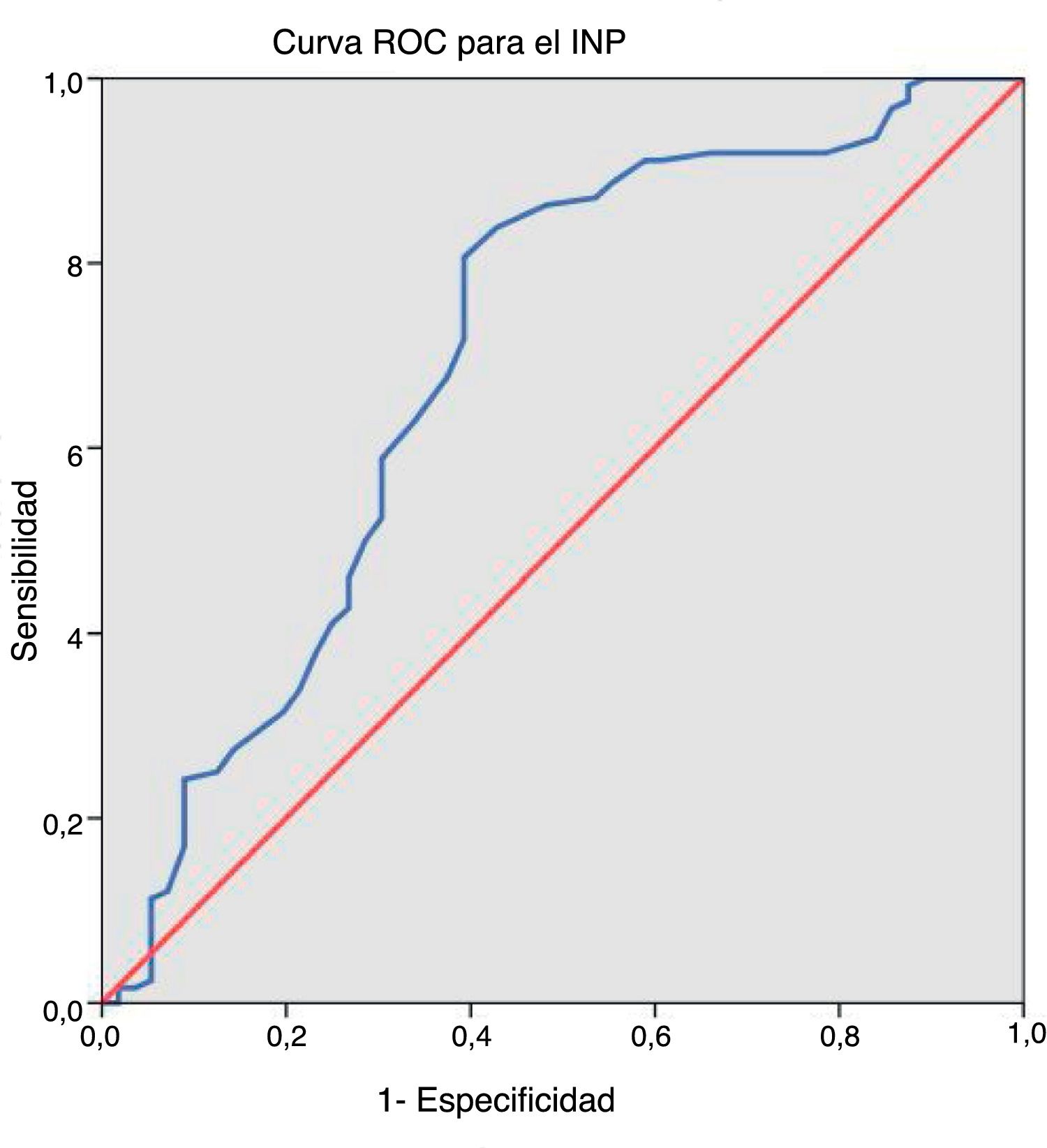
Se realizó una prueba en sangre periférica el día antes de la cirugía para establecer los niveles de albúmina y linfocitos y así calcular la PNI (10×albúmina sérica [g/dL])+(0,005×linfocitos/μL). El punto óptimo de corte para este puntaje se calculó usando la curva de características operativas del receptor (COR), mientras que la variable del punto final para este análisis fueron las complicaciones globales. Usamos este valor para crear 2grupos de riesgo, lo que facilita la interpretación de nuestros resultados.
Las complicaciones fueron cuidadosamente registradas durante los primeros 30 días del período postoperatorio, o hasta el alta, en caso de prolongarse la estancia hospitalaria. Establecimos 4variables para definir nuestra morbilidad: complicaciones generales, complicaciones graves (grados III, IV y V de la clasificación de Clavien-Dindo), complicaciones infecciosas y fuga anastomótica. Esta última fue considerada como una complicación infecciosa y se analizó exclusivamente entre los pacientes con anastomosis y sin estoma protector24. La fuga anastomótica se definió como la presencia de contenido intestinal dentro del drenaje o a través de la herida, la salida del contraste oral en la tomografía computarizada o la visualización directa durante la endoscopia o la cirugía.
Evaluamos la influencia de las variables PNI, preoperatorias e intraoperatorias en la aparición de estas 4complicaciones.
El análisis estadístico se realizó usando el programa SPSS (versión 18.0, IBM Corporation). Para llevar a cabo el análisis univariado, se utilizaron la prueba chi cuadrado para las variables cualitativas y la prueba t de Student para las variables cuantitativas. Se utilizó como punto de corte una p<0,15 para el registro de variables en el estudio multivariado. Se aplicó la regresión logística en el análisis multivariado (AMV), usando una p<0,05 para establecer la significación estadística.
ResultadosTras aplicar los criterios de inclusión y exclusión, 180 pacientes fueron finalmente analizados. De ellos, 118 (65,6%) eran hombres y 62 (34,4%) eran mujeres. La distribución según la clasificación ASA fue la siguiente: 8 (4,4%) pacientes resultaron ser de grado I, 109 (60,6%) de grado II, 61 (33,9%) de grado III y 2 (1,1%) de grado IV.
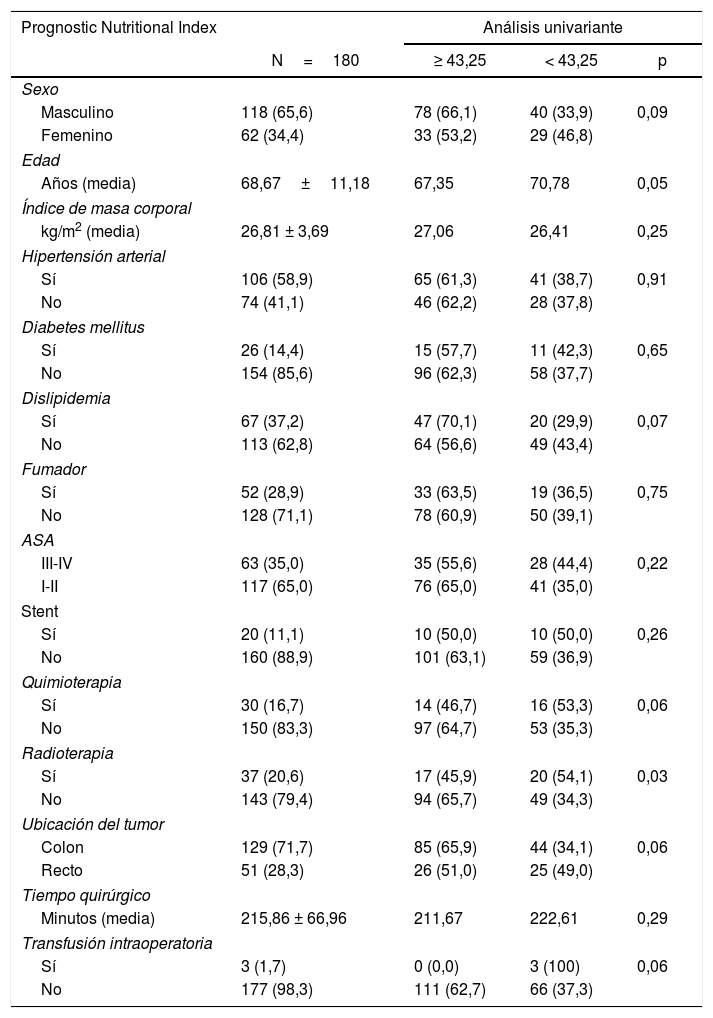
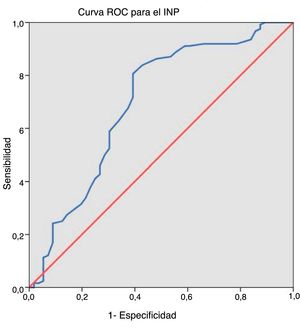
Teniendo en cuenta nuestra agrupación dicotómica, 63 (35,0%) pacientes tenían alto riesgo anestésico (ASA III-IV) y 117 (65,0%) presentaban bajo riesgo anestésico (ASA I-II). En cuanto al tratamiento neoadyuvante, 30 (16,7%) pacientes recibieron quimioterapia y 37 (20,6%) recibieron radioterapia. El tumor se localizó en el colon en 129 casos (71,7%) y en el recto en 51 casos (28,3%). El tiempo quirúrgico promedio fue de 215,86±66,96 min (rango 80-450). El valor promedio de PNI fue de 45,06±6,08 (rango 22-64). Después de aplicar la curva COR (fig. 1), obtuvimos un punto de corte de 43,25, por lo que 111 pacientes (61,7%) presentaron valores iguales o superiores y los 69 restantes (38,3%), inferiores. La tabla 1 describe la distribución de los factores de riesgo en nuestra muestra de pacientes y entre ambos grupos del PNI.
Distribución de los factores de riesgo según nuestra muestra de pacientes y entre ambos grupos del PNI
| Prognostic Nutritional Index | Análisis univariante | |||
|---|---|---|---|---|
| N=180 | ≥ 43,25 | < 43,25 | p | |
| Sexo | ||||
| Masculino | 118 (65,6) | 78 (66,1) | 40 (33,9) | 0,09 |
| Femenino | 62 (34,4) | 33 (53,2) | 29 (46,8) | |
| Edad | ||||
| Años (media) | 68,67±11,18 | 67,35 | 70,78 | 0,05 |
| Índice de masa corporal | ||||
| kg/m2 (media) | 26,81 ± 3,69 | 27,06 | 26,41 | 0,25 |
| Hipertensión arterial | ||||
| Sí | 106 (58,9) | 65 (61,3) | 41 (38,7) | 0,91 |
| No | 74 (41,1) | 46 (62,2) | 28 (37,8) | |
| Diabetes mellitus | ||||
| Sí | 26 (14,4) | 15 (57,7) | 11 (42,3) | 0,65 |
| No | 154 (85,6) | 96 (62,3) | 58 (37,7) | |
| Dislipidemia | ||||
| Sí | 67 (37,2) | 47 (70,1) | 20 (29,9) | 0,07 |
| No | 113 (62,8) | 64 (56,6) | 49 (43,4) | |
| Fumador | ||||
| Sí | 52 (28,9) | 33 (63,5) | 19 (36,5) | 0,75 |
| No | 128 (71,1) | 78 (60,9) | 50 (39,1) | |
| ASA | ||||
| III-IV | 63 (35,0) | 35 (55,6) | 28 (44,4) | 0,22 |
| I-II | 117 (65,0) | 76 (65,0) | 41 (35,0) | |
| Stent | ||||
| Sí | 20 (11,1) | 10 (50,0) | 10 (50,0) | 0,26 |
| No | 160 (88,9) | 101 (63,1) | 59 (36,9) | |
| Quimioterapia | ||||
| Sí | 30 (16,7) | 14 (46,7) | 16 (53,3) | 0,06 |
| No | 150 (83,3) | 97 (64,7) | 53 (35,3) | |
| Radioterapia | ||||
| Sí | 37 (20,6) | 17 (45,9) | 20 (54,1) | 0,03 |
| No | 143 (79,4) | 94 (65,7) | 49 (34,3) | |
| Ubicación del tumor | ||||
| Colon | 129 (71,7) | 85 (65,9) | 44 (34,1) | 0,06 |
| Recto | 51 (28,3) | 26 (51,0) | 25 (49,0) | |
| Tiempo quirúrgico | ||||
| Minutos (media) | 215,86 ± 66,96 | 211,67 | 222,61 | 0,29 |
| Transfusión intraoperatoria | ||||
| Sí | 3 (1,7) | 0 (0,0) | 3 (100) | 0,06 |
| No | 177 (98,3) | 111 (62,7) | 66 (37,3) | |
Durante los primeros 30 días postoperatorios, 56 pacientes (31,1%) presentaron algún tipo de complicación. La distribución según los niveles de severidad de la clasificación de Clavien-Dindo se describe en la tabla 2. Se detectaron complicaciones graves (clasificación Clavien-Dindo III-V) en 18 pacientes (10,0%) e infecciosas en 34 (18,9%). Se comprobó fuga anastomótica específicamente en 11 pacientes (6,5%), de los 159 con anastomosis y sin un estoma protector.
Distribución de complicaciones según los niveles de gravedad de acuerdo a la clasificación de Clavien-Dindo
| Complicaciones | N = 180 | |
|---|---|---|
| No | 124 (68,9) | 162 (90,0) |
| Nivel de gravedad según la clasificación de Clavien-Dindo | ||
| I-II | ||
| I | 20 (11,1) | |
| II | 18 (10,0) | |
| III-V | 18 (10,0) | |
| IIIa | 3 (1,7) | |
| IIIb | 5 (2,8) | |
| IVa | 4 (2,2) | |
| IVb | 3 (1,7) | |
| V | 3 (1,7) | |
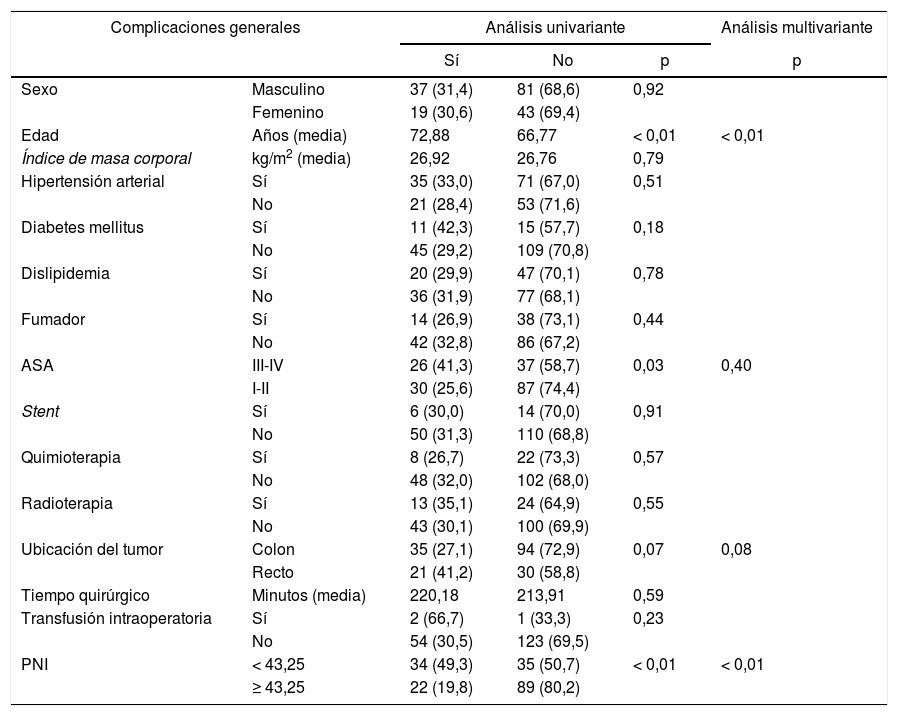
En cuanto a las complicaciones generales, las siguientes 4variables tuvieron significación estadística: la edad, el ASA III-IV, la ubicación del tumor y el PNI. Después del AMV, la edad y el cálculo del PNI, se obtuvo una p<0,05. El PNI se manifestó como un factor de protección significativo, con un RR de 0,279 (IC 95%: 0,141-0,552) (tabla 3).
Distribución de las complicaciones generales según los factores de riesgo y estado nutricional e inflamatorio
| Complicaciones generales | Análisis univariante | Análisis multivariante | |||
|---|---|---|---|---|---|
| Sí | No | p | p | ||
| Sexo | Masculino | 37 (31,4) | 81 (68,6) | 0,92 | |
| Femenino | 19 (30,6) | 43 (69,4) | |||
| Edad | Años (media) | 72,88 | 66,77 | < 0,01 | < 0,01 |
| Índice de masa corporal | kg/m2 (media) | 26,92 | 26,76 | 0,79 | |
| Hipertensión arterial | Sí | 35 (33,0) | 71 (67,0) | 0,51 | |
| No | 21 (28,4) | 53 (71,6) | |||
| Diabetes mellitus | Sí | 11 (42,3) | 15 (57,7) | 0,18 | |
| No | 45 (29,2) | 109 (70,8) | |||
| Dislipidemia | Sí | 20 (29,9) | 47 (70,1) | 0,78 | |
| No | 36 (31,9) | 77 (68,1) | |||
| Fumador | Sí | 14 (26,9) | 38 (73,1) | 0,44 | |
| No | 42 (32,8) | 86 (67,2) | |||
| ASA | III-IV | 26 (41,3) | 37 (58,7) | 0,03 | 0,40 |
| I-II | 30 (25,6) | 87 (74,4) | |||
| Stent | Sí | 6 (30,0) | 14 (70,0) | 0,91 | |
| No | 50 (31,3) | 110 (68,8) | |||
| Quimioterapia | Sí | 8 (26,7) | 22 (73,3) | 0,57 | |
| No | 48 (32,0) | 102 (68,0) | |||
| Radioterapia | Sí | 13 (35,1) | 24 (64,9) | 0,55 | |
| No | 43 (30,1) | 100 (69,9) | |||
| Ubicación del tumor | Colon | 35 (27,1) | 94 (72,9) | 0,07 | 0,08 |
| Recto | 21 (41,2) | 30 (58,8) | |||
| Tiempo quirúrgico | Minutos (media) | 220,18 | 213,91 | 0,59 | |
| Transfusión intraoperatoria | Sí | 2 (66,7) | 1 (33,3) | 0,23 | |
| No | 54 (30,5) | 123 (69,5) | |||
| PNI | < 43,25 | 34 (49,3) | 35 (50,7) | < 0,01 | < 0,01 |
| ≥ 43,25 | 22 (19,8) | 89 (80,2) | |||
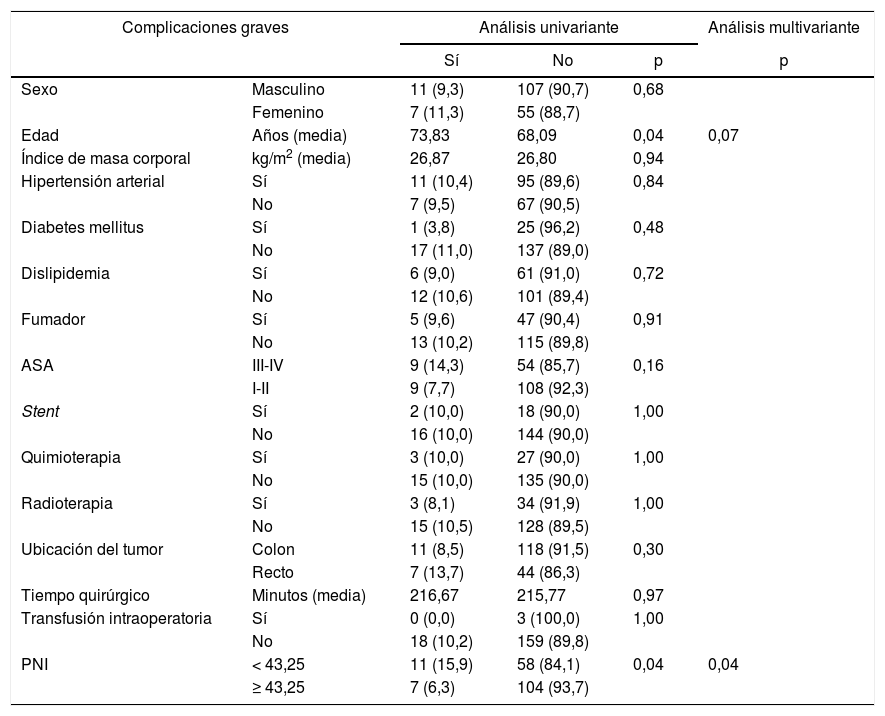
Entre las complicaciones graves, 2variables fueron relevantes: la edad y el PNI. Después del AMV, solo el PNI alcanzó significación estadística. En este caso, el PNI también fue un factor protector importante, con un RR de 0,355 (IC 95%: 0,130-0,965) (tabla 4).
Distribución de complicaciones graves (Clavien-Dindo ≥ III) según factores de riesgo y estado nutricional e inflamatorio
| Complicaciones graves | Análisis univariante | Análisis multivariante | |||
|---|---|---|---|---|---|
| Sí | No | p | p | ||
| Sexo | Masculino | 11 (9,3) | 107 (90,7) | 0,68 | |
| Femenino | 7 (11,3) | 55 (88,7) | |||
| Edad | Años (media) | 73,83 | 68,09 | 0,04 | 0,07 |
| Índice de masa corporal | kg/m2 (media) | 26,87 | 26,80 | 0,94 | |
| Hipertensión arterial | Sí | 11 (10,4) | 95 (89,6) | 0,84 | |
| No | 7 (9,5) | 67 (90,5) | |||
| Diabetes mellitus | Sí | 1 (3,8) | 25 (96,2) | 0,48 | |
| No | 17 (11,0) | 137 (89,0) | |||
| Dislipidemia | Sí | 6 (9,0) | 61 (91,0) | 0,72 | |
| No | 12 (10,6) | 101 (89,4) | |||
| Fumador | Sí | 5 (9,6) | 47 (90,4) | 0,91 | |
| No | 13 (10,2) | 115 (89,8) | |||
| ASA | III-IV | 9 (14,3) | 54 (85,7) | 0,16 | |
| I-II | 9 (7,7) | 108 (92,3) | |||
| Stent | Sí | 2 (10,0) | 18 (90,0) | 1,00 | |
| No | 16 (10,0) | 144 (90,0) | |||
| Quimioterapia | Sí | 3 (10,0) | 27 (90,0) | 1,00 | |
| No | 15 (10,0) | 135 (90,0) | |||
| Radioterapia | Sí | 3 (8,1) | 34 (91,9) | 1,00 | |
| No | 15 (10,5) | 128 (89,5) | |||
| Ubicación del tumor | Colon | 11 (8,5) | 118 (91,5) | 0,30 | |
| Recto | 7 (13,7) | 44 (86,3) | |||
| Tiempo quirúrgico | Minutos (media) | 216,67 | 215,77 | 0,97 | |
| Transfusión intraoperatoria | Sí | 0 (0,0) | 3 (100,0) | 1,00 | |
| No | 18 (10,2) | 159 (89,8) | |||
| PNI | < 43,25 | 11 (15,9) | 58 (84,1) | 0,04 | 0,04 |
| ≥ 43,25 | 7 (6,3) | 104 (93,7) | |||
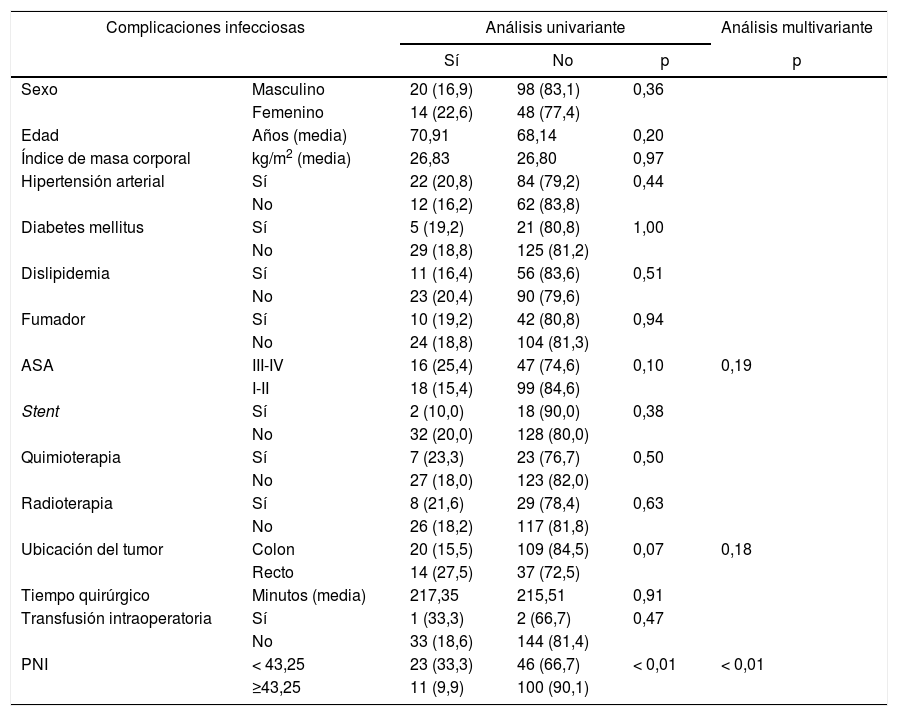
Dentro de las complicaciones infecciosas, 3variables alcanzaron valores significativos: el ASA III-IV, ubicación del tumor y el PNI. Una vez que se realizó el AMV, solo el PNI logró significación estadística: se comportó, nuevamente, como un factor de protección relevante, con un RR de 0,220 (IC 95%: de 0,099-0,489) (tabla 5).
Distribución de complicaciones infecciosas según factores de riesgo y estado nutricional e inflamatorio
| Complicaciones infecciosas | Análisis univariante | Análisis multivariante | |||
|---|---|---|---|---|---|
| Sí | No | p | p | ||
| Sexo | Masculino | 20 (16,9) | 98 (83,1) | 0,36 | |
| Femenino | 14 (22,6) | 48 (77,4) | |||
| Edad | Años (media) | 70,91 | 68,14 | 0,20 | |
| Índice de masa corporal | kg/m2 (media) | 26,83 | 26,80 | 0,97 | |
| Hipertensión arterial | Sí | 22 (20,8) | 84 (79,2) | 0,44 | |
| No | 12 (16,2) | 62 (83,8) | |||
| Diabetes mellitus | Sí | 5 (19,2) | 21 (80,8) | 1,00 | |
| No | 29 (18,8) | 125 (81,2) | |||
| Dislipidemia | Sí | 11 (16,4) | 56 (83,6) | 0,51 | |
| No | 23 (20,4) | 90 (79,6) | |||
| Fumador | Sí | 10 (19,2) | 42 (80,8) | 0,94 | |
| No | 24 (18,8) | 104 (81,3) | |||
| ASA | III-IV | 16 (25,4) | 47 (74,6) | 0,10 | 0,19 |
| I-II | 18 (15,4) | 99 (84,6) | |||
| Stent | Sí | 2 (10,0) | 18 (90,0) | 0,38 | |
| No | 32 (20,0) | 128 (80,0) | |||
| Quimioterapia | Sí | 7 (23,3) | 23 (76,7) | 0,50 | |
| No | 27 (18,0) | 123 (82,0) | |||
| Radioterapia | Sí | 8 (21,6) | 29 (78,4) | 0,63 | |
| No | 26 (18,2) | 117 (81,8) | |||
| Ubicación del tumor | Colon | 20 (15,5) | 109 (84,5) | 0,07 | 0,18 |
| Recto | 14 (27,5) | 37 (72,5) | |||
| Tiempo quirúrgico | Minutos (media) | 217,35 | 215,51 | 0,91 | |
| Transfusión intraoperatoria | Sí | 1 (33,3) | 2 (66,7) | 0,47 | |
| No | 33 (18,6) | 144 (81,4) | |||
| PNI | < 43,25 | 23 (33,3) | 46 (66,7) | < 0,01 | < 0,01 |
| ≥43,25 | 11 (9,9) | 100 (90,1) | |||
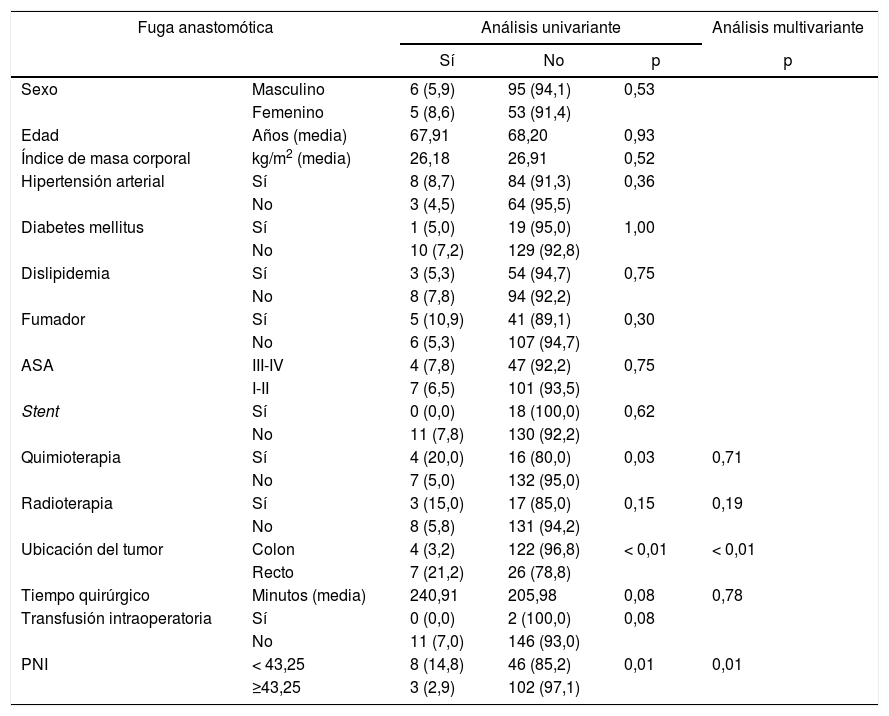
Al considerar la fuga anastomótica de manera individual, la quimioterapia preoperatoria, la ubicación del tumor y el PNI demostraron ser variables de relevancia. El AMV demostró que la ubicación del tumor y el cálculo del PNI permitieron obtener una p<0,05. Además, en esta complicación específica, el PNI se consolida como un factor de protección sobresaliente, con un RR de 0,151 (IC 95%: 0,036-0,640) (tabla 6).
Distribución de la fuga anastomótica según factores de riesgo y estado nutricional e inflamatorio
| Fuga anastomótica | Análisis univariante | Análisis multivariante | |||
|---|---|---|---|---|---|
| Sí | No | p | p | ||
| Sexo | Masculino | 6 (5,9) | 95 (94,1) | 0,53 | |
| Femenino | 5 (8,6) | 53 (91,4) | |||
| Edad | Años (media) | 67,91 | 68,20 | 0,93 | |
| Índice de masa corporal | kg/m2 (media) | 26,18 | 26,91 | 0,52 | |
| Hipertensión arterial | Sí | 8 (8,7) | 84 (91,3) | 0,36 | |
| No | 3 (4,5) | 64 (95,5) | |||
| Diabetes mellitus | Sí | 1 (5,0) | 19 (95,0) | 1,00 | |
| No | 10 (7,2) | 129 (92,8) | |||
| Dislipidemia | Sí | 3 (5,3) | 54 (94,7) | 0,75 | |
| No | 8 (7,8) | 94 (92,2) | |||
| Fumador | Sí | 5 (10,9) | 41 (89,1) | 0,30 | |
| No | 6 (5,3) | 107 (94,7) | |||
| ASA | III-IV | 4 (7,8) | 47 (92,2) | 0,75 | |
| I-II | 7 (6,5) | 101 (93,5) | |||
| Stent | Sí | 0 (0,0) | 18 (100,0) | 0,62 | |
| No | 11 (7,8) | 130 (92,2) | |||
| Quimioterapia | Sí | 4 (20,0) | 16 (80,0) | 0,03 | 0,71 |
| No | 7 (5,0) | 132 (95,0) | |||
| Radioterapia | Sí | 3 (15,0) | 17 (85,0) | 0,15 | 0,19 |
| No | 8 (5,8) | 131 (94,2) | |||
| Ubicación del tumor | Colon | 4 (3,2) | 122 (96,8) | < 0,01 | < 0,01 |
| Recto | 7 (21,2) | 26 (78,8) | |||
| Tiempo quirúrgico | Minutos (media) | 240,91 | 205,98 | 0,08 | 0,78 |
| Transfusión intraoperatoria | Sí | 0 (0,0) | 2 (100,0) | 0,08 | |
| No | 11 (7,0) | 146 (93,0) | |||
| PNI | < 43,25 | 8 (14,8) | 46 (85,2) | 0,01 | 0,01 |
| ≥43,25 | 3 (2,9) | 102 (97,1) | |||
El CCR es considerado un problema médico y social relevante por su alta incidencia en nuestra población. Su presencia en pacientes ancianos implica mayores tasas de comorbilidades, peor estado nutricional, mayor dificultad para la cicatrización del tejido, peor vascularización y mayor riesgo anestésico, lo que favorece la aparición de complicaciones25. Todo esto, combinado con el hecho de que es un área anatómica contaminada, hace que las repercusiones de posibles complicaciones postoperatorias puedan tener consecuencias muy relevantes para el bienestar y la recuperación de nuestros pacientes, al poner en riesgo incluso su vida.
Recientemente, se ha estudiado a fondo la relación entre el cáncer y el estado nutricional e inflamatorio en pacientes oncológicos. Como resultado de estos estudios, se han desarrollado escalas inmunonutricionales múltiples (PNI, escala pronóstica de Glasgow, escala pronóstica modificada de Glasgow, proporción de granulocitos/linfocitos, proporción de neutrófilos/linfocitos o proporción de plaquetas/linfocitos). Estos se han relacionado principalmente con el pronóstico de varios neoplasmas, pero su relación con la aparición de complicaciones no ha sido aún estudiada en profundidad26-29. La mayoría de estas escalas son objetivas, ya que emplean valores analíticos, lo que también las hacen asequibles y fáciles de realizar. De esta manera, podemos evitar el uso de escalas que se basan fundamentalmente en variables subjetivas.
Existen otras escalas realmente interesantes relacionadas con complicaciones postoperatorias, como la CR-POSSUM, que está constituida por variables intraoperatorias y fisiológicas30. Sin embargo, quisimos enfocarnos en una escala compuesta por variables preoperatorias objetivas, relacionadas con el estado nutricional e inflamatorio. Por lo tanto, decidimos usar el PNI, ya que constituye una herramienta sencilla y útil para definir este estado. Además, su valor puede calcularse rápidamente a partir de un análisis de sangre periférica (albúmina sérica y recuento de linfocitos). Algunos trabajos recientes también han demostrado una relación entre el estado nutricional (determinado principalmente por la proteína sérica total) y la fuga anastomótica tras la cirugía colorrectal31,32. Consideramos que la albúmina es una variable más confiable que la proteína sérica total, ya que se trata de una escala tanto del estado nutricional como del estado inflamatorio. Los valores de esta proteína disminuyen debido a una absorción directa por el tumor y debido a la extravasación inducida por el factor de necrosis tumoral α.
Al generarse una interacción entre el tumor y el huésped, se desencadena una reacción inflamatoria sistémica en la que se liberan varias citosinas, como por ejemplo las interleucinas, el factor de necrosis tumoral α o la citosina 1, inhibidora de macrófagos21. Se produce un desequilibrio neuroendocrino debido al aumento de las hormonas catabólicas (cortisol, miostatina) y una disminución de las hormonas anabólicas (insulina, hormona del crecimiento y testosterona). En segundo lugar, se liberan reactivos de fase aguda, como la proteína C reactiva y el fibrinógeno, lo que favorece una tendencia a la anorexia y al catabolismo33.
Los niveles de leptina y propiomelanocortina también aumentan, y los niveles de neuropéptido Y disminuyen, lo que provoca el estímulo anoréxico34. Se produce un aumento en el factor inductor de proteólisis y en los niveles del factor movilizador de lípidos, lo que da como resultado la proteólisis y un incremento de la lipólisis35,36. Por tanto, se han desarrollado varias escalas que permiten analizar el estado nutricional e inflamatorio de los pacientes con cáncer, la mayoría de ellas calculadas a partir de variables analíticas. Una de las escalas inmunonutricionales más importantes es el PNI, creado por Onodera et al. en 198423. Esta se ha relacionado principalmente con el pronóstico oncológico y no con las complicaciones postoperatorias. Se han utilizado varios puntos de corte en la literatura, lo que dificulta la extrapolación de resultados y conclusiones.
Por esta razón, decidimos utilizar la curva COR para establecer el valor de corte óptimo para nuestra muestra de pacientes, mientras tenemos las complicaciones globales como variable de referencia. Posiblemente serán necesarios nuevos estudios, con una población mayor, para establecer un punto de corte que sea más interpretable desde el punto de vista global.
Se ha relacionado estadísticamente con la enfermedad avanzada en términos de invasión local, presencia de linfadenopatías patológicas o metástasis a distancia37,38. Además, ha demostrado tener una influencia independiente y estadísticamente significativa en el pronóstico de varios tipos de cáncer, lo que resulta en una peor supervivencia global y una supervivencia libre de enfermedad con valores más bajos39-41.
En 2013, Mohri et al. publicaron un estudio retrospectivo con 265 pacientes en el que estudiaron la relación entre el PNI, el pronóstico del cáncer y la tasa de complicaciones después de la cirugía para el CCR42. Se demostró que esta escala está estadísticamente relacionada con una peor supervivencia y una mayor tasa de complicaciones generales y graves (definidas, como en nuestro estudio, en grados Clavien-Dindo III-V).
Un trabajo similar fue publicado por Tokunaga et al. en 201543. Este fue un estudio retrospectivo con 556 pacientes en los que el PNI se asoció con complicaciones y supervivencia general después de la cirugía para el CCR. Encontraron que el PNI se asoció a una mayor morbilidad postoperatoria y un peor pronóstico, en ambos casos con significación estadística después del AMV.
Recientemente, Cao et al. presentaron un estudio retrospectivo con 228 pacientes, en el que un PNI bajo se relacionó de manera significativa con una mayor tasa de complicaciones postoperatorias y, especialmente, con las graves44.
Este estudio adopta un enfoque similar, ya que trata de relacionar el estado nutricional e inflamatorio de los pacientes oncológicos (según lo evidenciado por el PNI) con una mayor morbilidad, tras la cirugía curativa para el CCR. En nuestra serie prospectiva, el PNI se asoció con la apariencia general, severa (aquellos que son ≥ III de la clasificación de Clavien-Dindo) y complicaciones infecciosas durante los primeros 30 días postoperatorios. Además, se ha correlacionado con la fuga anastomótica. Dichas relaciones han confirmado una significación estadística incluso después del AMV, lo que demuestra que el PNI se comporta como un factor de protección importante. Sin embargo, estos hallazgos tendrán que ser validados en estudios prospectivos con una población más grande, a fin de mejorar la interpretabilidad y la validación externa.
Los hallazgos obtenidos en este estudio demuestran que el estado nutricional e inflamatorio preoperatorio está relacionado con la morbilidad postoperatoria tras la cirugía curativa del CCR. Estamos interesados en poder predecir qué pacientes tienen un mayor riesgo de presentar complicaciones, para tratar de reducir las mismas. Sobre todo si consideramos que la aparición de complicaciones (en particular, infecciosas) durante el período postoperatorio de la cirugía del CCR se relaciona con un peor pronóstico oncológico, en términos de mayor tasa de recurrencia local y remota, y menor supervivencia general y supervivencia sin enfermedad15-20.
El PNI representa una herramienta útil adicional para estimar el estado en el que nuestros pacientes llegan a la cirugía, lo que puede ayudarnos tanto a evaluar a cada uno de manera individual como su riesgo particular de desarrollar complicaciones. En pacientes de alto riesgo, se puede tener en cuenta la posibilidad de retrasar un procedimiento —siempre que sea posible—, con el objetivo de mejorar el estado nutricional. Esto podría lograrse mediante la administración de suplementos ricos en proteínas. Además, podríamos considerar una forma más conservadora de enfrentar el período postoperatorio y la posibilidad de un estoma derivado, con el fin de proteger la anastomosis colorrectal. Sin embargo, este posible manejo clínico solo debe considerarse en caso de validarse dichos resultados en una población mucho más grande.
Nuestro trabajo tiene como limitaciones obvias el reducido número de pacientes y el hecho de que estos provengan de un solo hospital. Otra limitación es que no analizamos el factor cirujano. Decidimos descartar esta variable de nuestro análisis ya que trabajamos en equipo, aceptando indicaciones y técnicas quirúrgicas. Será necesario profundizar en el tema para evaluar adecuadamente la relación entre el estado nutricional y el estado inflamatorio y el desarrollo de complicaciones en este tipo de cirugía. Nuestros resultados deberán ser validados en nuevos estudios prospectivos y multicéntricos, con una población mayor.
Nuestro trabajo refleja que el PNI es, en nuestra muestra de pacientes, un factor predictivo y una protección independiente para el posible desarrollo de complicaciones postoperatorias, en especial para las de carácter grave o infeccioso (y, específicamente, para la fuga anastomótica), tras la cirugía curativa para el CCR. La mayoría de los artículos que analizan escalas nutricionales e inflamatorias son retrospectivos. Se centran en la relación entre dichas escalas y el pronóstico del cáncer, pero no en la aparición de complicaciones45. Este estudio es pionero en este campo, ya que tiene un diseño prospectivo y se centra en la morbilidad postoperatoria tras la cirugía curativa del CRC.
FinanciaciónHemos recibido fondos de una agencia gubernamental de salud pública (Gerencia Regional de Salud de la Junta de Castilla y León) a través de un proyecto de investigación con el título «Influencia del estado nutricional e inflamatorio preoperatorio en la morbilidad y mortalidad postoperatoria de la cirugía curativa del cáncer de colon y recto»; número de archivo GRS 1316/A/16.
Autoría/colaboración- Martín Bailón-Cuadrado, MD PhD: diseño y concepción del estudio, recolección de datos, redacción del manuscrito y aprobación de la versión final.
- Baltasar Pérez-Saborido, MD PhD: diseño y concepción del estudio, redacción del manuscrito y aprobación de la versión final.
- Javier Sánchez-González, MD PhD: diseño y concepción del estudio, recolección de datos, redacción del manuscrito y aprobación de la versión final.
- Mario Rodríguez-López, MD PhD: diseño y concepción del estudio, redacción del manuscrito y aprobación de la versión final.
- Rosalía Velasco-López, MD: recopilación de datos, redacción del manuscrito y aprobación de la versión final.
- José C. Sarmentero-Prieto, MD PhD: diseño y concepción del estudio, redacción del manuscrito y aprobación de la versión final.
- José I. Blanco-Álvarez, MD PhD: diseño y concepción del estudio, redacción del manuscrito y aprobación de la versión final.
- David Pacheco-Sánchez, MD PhD: diseño y concepción del estudio, redacción del manuscrito y aprobación de la versión final.
Conflicto de intereses- Martín Bailón-Cuadrado, MD PhD: sin conflicto de intereses.
- Baltasar Pérez-Saborido, MD PhD: sin conflicto de intereses.
- Javier Sánchez-González, MD PhD: sin conflicto de intereses.
- Mario Rodríguez-López, MD PhD: sin conflicto de intereses.
- Rosalía Velasco-López, MD: sin conflicto de intereses.
- José C. Sarmentero-Prieto, MD PhD: sin conflicto de intereses.
- José I. Blanco-Álvarez, MD PhD: sin conflicto de intereses.
- David Pacheco-Sánchez, MD PhD: sin conflicto de intereses.
AgradecimientosQueremos agradecer a todos los profesionales que han contribuido al manejo de todos estos pacientes, y especialmente a nuestras enfermeras, que los cuidan con esmero desde el primero hasta el último día.