La colitis fulminante es una entidad cuya definición no está bien establecida y que supone una complicación grave. Sus principales causas son la colitis ulcerosa y la infección por Clostridium difficile. El manejo multidisciplinar integrado por gastroenterólogos y cirujanos es fundamental, con un tratamiento médico intensivo de inicio y cirugía precoz en los pacientes que no responden. Es importante dilucidar si nos encontramos ante un brote de EII o por el contrario, se trata de una colitis infecciosa, ya que aunque las medidas terapéuticas generales a adoptar serán las mismas, exigirán medidas específicas opuestas.
Fulminant colitis is not a well-defined entity, that constitutes a severe complication. It usually occurs in the course of úlcerative colitis and Clostridium difficile colitis. A multidisciplinary management combining gastroenterologist and surgeons is crucial with intensive medical treatment and early surgery in non-responders. It is important to distinguish if we are facing a flare of IBD or, on the contrary, it is an infectious colitis, due to the fact that although general therapeutic measures to adopt will be the same, they will demand opposed specific measures.
La definición exacta de colitis fulminante (CF) no está bien establecida. La primera definición de 1950 describe una colitis aguda grave y rápidamente progresiva con desenlace fatal en el primer año1. Generalmente se acepta que este término hace referencia a una inflamación aguda grave del colon asociada a toxicidad sistémica, con o sin dilatación cólica2. No obstante, es una definición imprecisa, y en ocasiones resulta difícil situar el límite entre qué se considera una colitis grave y qué una CF, prefiriéndose en la actualidad el término de colitis aguda grave3,4. En la colitis ulcerosa (CU) según los criterios diagnósticos de Truelove y Witts5, se define la colitis grave cuando los pacientes presentan más de 6 deposiciones sanguinolentas diarias, taquicardia, hipotensión, fiebre elevada, cambios del estado mental, anemia que requiere transfusión, dolor y distensión abdominal, y alteraciones hidroelectrolíticas. En el contexto de la colitis por Clostridium difficile (CD), Dallal6 define la CF según la existencia de taquicardia, necesidad de ventilación mecánica, oliguria e hipotensión que precisa tratamiento vasopresor.
Cuando se asocia a dilatación cólica total o segmentaria mayor de 6cm en ausencia de obstrucción, se considera un megacolon tóxico, entidad que al contrario que la CF está perfectamente definida, y exige que el tiempo para decidir una aproximación quirúrgica no deba dilatarse más de 24-72 h7.
Ambas son situaciones graves que requieren de una atención hospitalaria especial con un seguimiento intensivo y conjunto por gastroenterólogos y cirujanos.
Este manuscrito se ha realizado a partir de una revisión de aquellos artículos relevantes, obtenidos a través de una búsqueda bibliográfica en la base de datos MEDLINE, entre los años 1990 y 2014 empleando como palabras clave: «fulminant colitis», «toxic megacolon», «severe colitis», «ulcerative colitis», «severe ulcerative colitis», «clostridium difficile colitis».
EtiologíaLas causas más frecuentes de CF son la CU y la colitis infecciosa, si bien se han comunicado casos producidos por enfermedad de Crohn, colitis isquémica, colitis por irradiación y colitis inducida por fármacos o por vasculitis2 (fig. 1).
Históricamente se había asociado casi exclusivamente a la enfermedad inflamatoria intestinal (EII) y concretamente a la CU. Sin embargo, en los últimos decenios ha aumentado la incidencia de la CF de causa infecciosa8–10, de la mano de la mayor incidencia de colitis por CD, a su vez más agresiva y refractaria11,12. No obstante, en nuestro medio, la infección por CD es una causa mucho menos frecuente de colitis infecciosa y de colitis grave que en Estados Unidos y, aunque su incidencia no ha sido adecuadamente evaluada, los datos existentes todavía nos muestran alejados del grave problema de los hospitales americanos, aunque asistimos también a un progresivo aumento de la misma13. El CD es un bacilo grampositivo, anaerobio, formador de esporas, que crece formando colonias, y que puede causar desde una diarrea sin colitis a una CF. Aproximadamente un 3-8% de la enfermedad por CD desarrolla CF y un número importante de estos pacientes requieren colectomía urgente14. El principal factor de riesgo para desarrollar enfermedad por CD es el uso previo de antibióticos. La clindamicina, cefalosporinas y las fluorquinolonas son los que presentan mayor riesgo. Se describen otros factores de riesgo como edad avanzada, hospitalización prolongada, inmunosupresión, EII y uso de inhibidores de la bomba de protones11,14. Otros agentes infecciosos han sido también implicados con menor frecuencia como causantes de una CF, tanto bacterianos (Salmonella15, Shigella16 y Campylobacter17), como virales (Citomegalovirus10 [CMV] y Herpes simplex18) y parasitarios (Entamoeba hystolytica19).
El posible papel de algunas infecciones como factor desencadenante de brotes en pacientes con EII no ha sido claramente probado8,9, aunque se recomienda siempre descartar una posible sobreinfección en pacientes con EII activa20. Los agentes más frecuentemente implicados son el CD y el CMV21. La incidencia aumentada de infección por CD entre pacientes con EII es bien conocida, siendo la EII un factor de riesgo independiente para la infección11,14. Los pacientes con CU en tratamiento con corticoides o inmunosupresores presentan riesgo elevado de infección por CMV10,21.
DiagnósticoEl paciente con CF plantea una serie de dilemas para el especialista que lo trata. El primero es dilucidar si se trata de un brote de EII, en cuyo caso precisará intensificar el tratamiento inmunosupresor o, por el contrario, de una colitis infecciosa en la cual esta estrategia puede empeorar la evolución del paciente. Esta duda puede presentarse tanto en el inicio como en un paciente ya diagnosticado de EII.
El primer paso debe ser realizar una correcta historia clínica, indagando sobre antecedentes conocidos personales o familiares de EII, datos epidemiológicos que susciten la sospecha de un origen infeccioso (contacto con otras personas con diarrea, viajes o uso previo de antibióticos), empleo de fármacos o drogas capaces de producir una colitis, como antiinflamatorios no esteroideos o cocaína, o enfermedades vasculares o vasculitis que hicieran sospechar un origen isquémico.
Los datos de laboratorio suelen mostrar anemia y leucocitosis con neutrofilia (en ocasiones leucopenia por el estado séptico). Es común la alteración electrolítica a causa de la deshidratación, y la hipocaliemia por el aumento de la excreción de potasio por la mucosa cólica inflamada. La hipoalbuminemia también es común especialmente en pacientes crónicos. La velocidad de sedimentación eritrocitaria y la proteína C reactiva suelen estar elevadas, ambos marcadores de inflamación sistémica.
Asimismo, deben tomarse muestras de heces para cultivo y determinación de toxina de CD. El diagnóstico de CD se establece por una combinación de hallazgos clínicos y de laboratorio. El test de laboratorio considerado gold standard es el ensayo de citotoxicidad, con muy elevada sensibilidad y especificidad, pero dada su laboriosidad y su tiempo de respuesta superior a 48 h en la práctica clínica se utiliza habitualmente el ELISA para la detección de toxinas A y B: rápido y fácilmente reproducible, aunque menos sensible. La PCR (reacción en cadena de la polimerasa) es una técnica de biología molecular sensible y específica, pero más costosa22–24.
La radiografía simple de abdomen es útil para detectar la presencia de dilatación cólica y su seguimiento, estimar la extensión del proceso inflamatorio y descartar complicaciones. La tomografía computarizada (TC) de abdomen es útil para determinar la etiología, identificar posibles complicaciones y en el diagnóstico diferencial. Los hallazgos suelen ser inespecíficos: engrosamiento parietal, dilatación cólica, signo del acordeón, signo de la diana, y ascitis, entre otros25. Su realización es esencial en los pacientes gravemente comprometidos que no presenten diarrea.
La colonoscopia completa está totalmente contraindicada; suele ser suficiente la realización de una sigmoidoscopia con toma de biopsias para estudio histológico y microbiológico, que tiene menos riesgo. No obstante, hay autores que defienden la seguridad de una colonoscopia completa en estas situaciones26. Resulta esencial para el diagnóstico etiológico, con hallazgo de patrones endoscópicos que orientan a una posible EII, una colitis pseudomembranosa o isquémica. La colitis infecciosa puede imitar los hallazgos endoscópicos propios de una EII y debe ser distinguida a partir de hallazgos clínicos, coprocultivo y hallazgos histológicos.
Tratamiento generalEn el tratamiento de la CF es fundamental la estrecha relación y colaboración médico-quirúrgica, con un seguimiento estricto por parte de ambos servicios. El paciente debe conocer las opciones, sus aspectos positivos y negativos2. El tiempo es crucial en la decisión quirúrgica: una intervención apresurada sin un tratamiento médico previo puede ser perjudicial para la futura calidad de vida del paciente, pero es menos peligrosa que una decisión quirúrgica tardía tomada después de que aparezcan complicaciones. Si el paciente requiere cirugía por la presencia de perforación, la mortalidad puede ascender al 30%27.
Los objetivos son reducir la distensión colónica para evitar la perforación, corregir las alteraciones hidroelectrolíticas y nutricionales, y tratar los factores precipitantes y la afectación sistémica.
El tratamiento comienza con una vigilancia estrecha, evaluando diariamente la situación clínica, la exploración abdominal, el nivel de consciencia y las constantes vitales. Asimismo, es preceptivo realizar controles analíticos cada 48h y radiología simple de abdomen diaria en caso de que exista dilatación cólica28.
Deben identificarse y corregirse lo antes posible las alteraciones electrolíticas mediante una adecuada reposición de fluidos y electrolitos, fundamentalmente potasio y magnesio, cuyas deficiencias pueden precipitar un megacolon tóxico29. La transfusión sanguínea debe ser muy restrictiva y reservarse para casos de anemia grave20.
El uso de antibióticos en colitis no infecciosas permanece controvertido. Aunque algunos justifican su uso por el riesgo de extensión transmural, microperforación y bacteriemia, la heterogeneidad de los estudios disponibles impiden recomendarlos de forma generalizada30,31. No obstante, en casos graves con alto riesgo de perforación y especialmente en caso de megacolon, prácticamente todos los expertos recomiendan utilizar un tratamiento antibiótico dirigido a gérmenes gramnegativos y anaerobios. En función de las tasas locales de resistencias se recomiendan cefotaxima más metronidazol, ciprofloxacino más metronidazol, imipenem, meropenem o piperacilina-tazobactam30.
El soporte nutricional es importante. La dieta absoluta no tiene ninguna efectividad terapéutica primaria y, salvo en casos de intolerancia oral absoluta, obstrucción intestinal o extrema gravedad, no debe suspenderse la alimentación oral32. En caso de no poder asegurar un aporte calórico y nutricional completo, se debe utilizar preferiblemente la nutrición enteral, como suplemento o como fuente única de alimentación. La nutrición parenteral es más cara y supone un mayor riesgo de infección y de fenómenos tromboembólicos33.
Se deben evitar los agentes antiperistálticos y los narcóticos, ya que pueden contribuir al íleo, exacerbar la colitis, y precipitar megacolon tóxico29.
La profilaxis antitrombótica con heparina de bajo peso molecular es preceptiva en todos los pacientes34.
Tratamiento específicoColitis por enfermedad inflamatoria intestinalEn el brote grave de CU el paciente debe hospitalizarse4,20. A la vez que se instauran las medidas inmediatas, hay que plantear una estrategia que incluya las opciones si aquellas fracasan, y el tratamiento posible a medio y largo plazo. Para ello es clave revisar toda la información diagnóstica y aquellos datos que puedan ser de interés en la toma de decisiones. Además, resulta práctico incluir procedimientos diagnósticos que informan sobre los riesgos de efectos adversos de infliximab, ciclosporina o azatioprina, puesto que permitirán iniciar los tratamientos con mayor seguridad, instituyendo las medidas preventivas necesarias28.
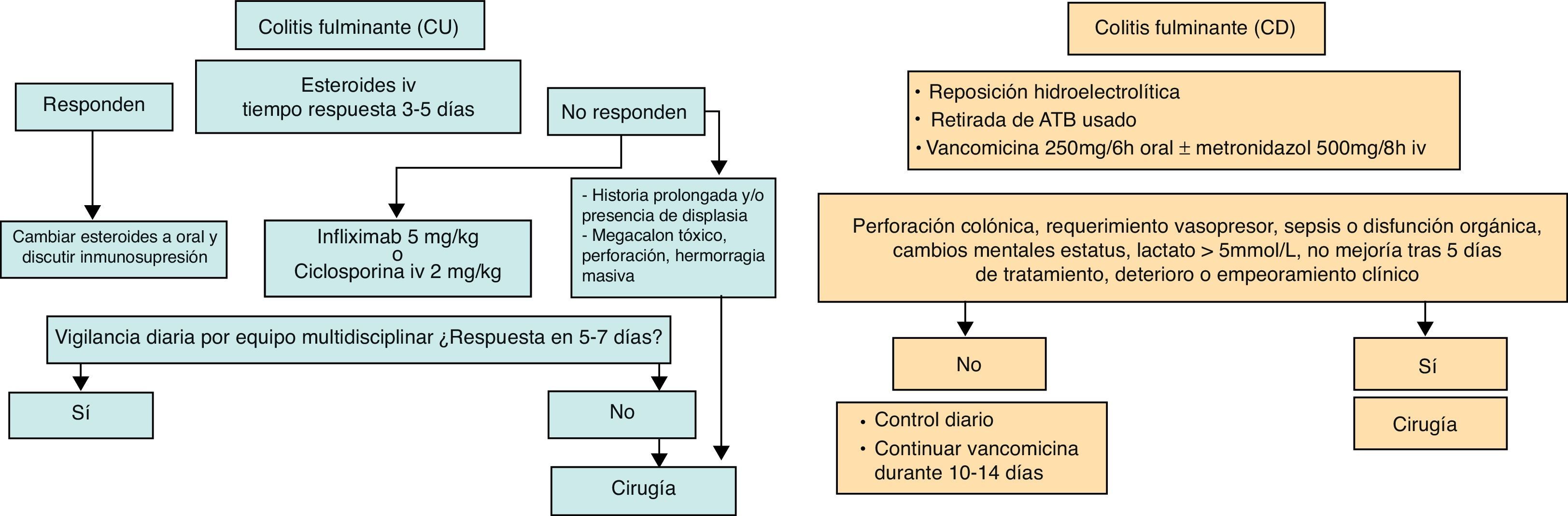
El tratamiento inicial se basará en la mayoría de los casos, salvo contraindicación absoluta por toxicidad grave previa o situación de urgencia quirúrgica, en la administración de corticoides intravenosos, a una dosis equivalente a 1mg/kg/día de prednisona35,36 (fig. 2). Se puede administrar en dosis única o fragmentada, o en perfusión continua, sin que se hayan demostrado diferencias entre ellas35. En pacientes que no pueden tratarse con esteroides, la ciclosporina (4mg/kg) se puede utilizar como primera línea con resultados similares37.
Es recomendable fijar desde el primer día un momento para evaluar la respuesta, siendo lo más adecuado entre el tercer y el quinto día tras iniciar el tratamiento, la mayoría de los autores tienden a realizar una evaluación inicial a las 72 h28. Si no se ha obtenido la remisión, disponemos de diversos índices que permiten predecir la probabilidad de respuesta si el tratamiento corticoideo se prolongase. El índice de Ho estima la probabilidad de respuesta a corticoides en función del número de deposiciones, la presencia de dilatación cólica y de hipoalbuminemia38. Otro modelo sencillo basado en 4 parámetros (rectorragia, PCR, recuento de plaquetas y número de deposiciones) evaluados al tercer día puede predecir con bastante precisión si el paciente precisa cambiar de tratamiento39. En ocasiones la situación es muy clara, y se propone un nuevo tratamiento a iniciar entre el tercer y el quinto día. En otras no es tan clara, y se prefiere hacer una reevaluación entre los días quinto y séptimo. Si en el séptimo día no se ha alcanzado la remisión, lo mejor es iniciar un tratamiento alternativo.
Llegado este punto es muy importante descartar otras causas de resistencia al tratamiento corticoideo, especialmente una infección por CMV y por CD, mediante biopsia rectal y determinación de toxina en heces, respectivamente.
Cuando fracasan los corticoides disponemos de 3 alternativas: ciclosporina, infliximab o cirugía. No existen estudios comparativos entre estas opciones para hacer recomendaciones tajantes. La decisión debe tomarse en equipo, siendo también muy importante la opinión del paciente bien asesorado. Favorecen la cirugía una historia prolongada de la enfermedad o la presencia de displasia en controles previos, así como 3 situaciones clínicas: megacolon tóxico, perforación y hemorragia masiva. En casi todos los casos, no obstante, y excluidas esas 3 situaciones, se debe intentar una opción médica, pudiendo optar por 2 posibles segundas líneas: la ciclosporina, y los fármacos biológicos anti-TNF.
La ciclosporina a dosis de 4mg/kg/día por vía intravenosa ha demostrado ser eficaz en la inducción de la remisión de la CU grave corticorresistente40. Dosis menores, 2mg/kg/día, han demostrado una eficacia similar con menos efectos secundarios41, por lo que son las actualmente recomendadas, se pueden adaptar individualmente hasta un máximo de 4mg/kg/día en función de los niveles obtenidos y la toxicidad.
De entre los anti-TNF disponibles, el infliximab es con el que se tiene mayor experiencia. Ha demostrado ser más eficaz que placebo en el brote grave de CU, concretamente en los resistentes a corticoides, con una dosis de inducción de 5mg/kg, seguida de otra dosis a las 2 semanas y una tercera dosis a las 6 semanas42. Solo disponemos de un ensayo clínico sobre adalimumab en CU, en el que aunque con pequeñas diferencias frente a placebo se mostró más eficaz para obtener la remisión clínica en el brote moderado a grave sin respuesta a corticoides ni inmunomoduladores43. Sin embargo, no disponemos de datos en el brote grave. Desde hace pocos meses disponemos de un tercer anti-TNF para el tratamiento de la colitis ulcerosa moderada-grave, el golimumab44.
La elección entre infliximab o ciclosporina no puede basarse en eficacia ya que los estudios que los comparan muestran resultados similares45. Si el paciente ha sufrido el brote grave mientras ya estaba en tratamiento con tiopurinas lo más indicado será utilizar infliximab. En el resto de casos, se podrá escoger entre cualquiera de los 2, en función de factores locales como la propia experiencia y la disponibilidad de la determinación de niveles sanguíneos de ciclosporina para su monitorización, y factores clínicos que pudieran contraindicar uno u otro tratamiento.
Independientemente de la opción médica escogida, hay que planificar un nuevo momento de evaluación, y lo más razonable es hacerlo a los 7 días de iniciado el nuevo tratamiento. En este punto, nuevamente no hay normas fijas: si hay un empeoramiento o una falta absoluta de mejoría, lo más razonable será la cirugía, y si hay una remisión pasar al esquema de mantenimiento; no obstante, es bastante frecuente que se produzcan situaciones intermedias. Así, pacientes que no han respondido a ciclosporina pueden evitar la cirugía mediante el uso de infliximab; también en menos ocasiones se ha seguido el camino contrario46.
En cuanto al uso de otros tratamientos, hacen falta más estudios para obtener conclusiones consolidadas. El tacrolimus por vía oral parece eficaz en inducir respuesta en el brote grave de CU, incluso resistente a corticoides, pero la calidad y cantidad de evidencia disponible es limitada. En un único ensayo controlado en pacientes hospitalizados con CU activa moderada-grave, corticorresistentes o corticodependientes, solo a dosis altas se mostró significativamente superior a placebo, con un efecto dosis-respuesta47. En una revisión sistemática de las series observacionales disponibles, sin definir cuántos pacientes eran graves o resistentes a corticoides, el 53% de pacientes tratados alcanzó remisión48. A pesar de que algunos autores defienden la leucocitoaféresis como un sistema inocuo y eficaz, la mayoría de los estudios realizados son de baja calidad, con medidas de respuesta muy heterogéneas, asignación no ciega a los grupos de tratamiento o tratamientos concomitantes, que hacen muy difícil su valoración. Los datos procedentes del único estudio aleatorizado ciego no confirman su eficacia49, por lo que no puede recomendarse para la inducción de la remisión, menos aún en el brote grave.
La cirugía queda reservada para pacientes que no responden al tratamiento médico, aunque esta posibilidad debe valorarse desde el primer día. El procedimiento más comúnmente realizado es la colectomía subtotal e ileostomía terminal. Una vez recuperado el paciente, se podrá completar la intervención mediante proctectomía y anastomosis ileoanal con reservorio27.
En la era prebiológicos, se estimaba que solo un 60% de los pacientes que respondían a tratamiento médico estaban libres de colectomía a los 2 años, y por ello algunos autores recomendaban realizar proctocolectomía con anastomosis ileoanal de forma electiva en pacientes con buena respuesta inicial a tratamiento conservador, cirugía con menor morbilidad y mejor calidad de vida que la realizada en condiciones de urgencia50. Sin embargo, en la época actual la difusión del tratamiento biológico ha mejorado el pronóstico de estos pacientes a corto plazo, habiéndose reducido la tasa de colectomía a los 2 años al 10-20%51, por lo que esta recomendación ha perdido vigencia. Se necesitan estudios sobre el impacto a largo plazo del tratamiento biológico en la historia natural de los pacientes con CU grave.
Colitis por Clostridium difficileMuchas colitis infecciosas son autolimitadas, pero otras pueden complicarse a CF. Además de las medidas generales previamente comentadas, una vez identificado el agente patógeno debe iniciarse tratamiento antibiótico específico.
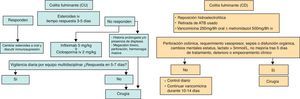
En el caso de la colitis por CD debe retirarse además, en la medida posible, el antibiótico usado previamente que ha actuado como desencadenante del cuadro52.
Los antibióticos recomendados para el tratamiento de la colitis por CD son el metronidazol y la vancomicina (fig. 2). En los casos leves o moderados ambos son igualmente efectivos, sin que se haya demostrado superioridad de ninguno de ellos, por lo que el de elección suele ser el metronidazol oral, mucho menos costoso. Sin embargo, en la colitis grave la vancomicina oral es superior al metronidazol, con una tasa de respuesta del 90-100%, y es la opción de elección53. La vancomicina intravenosa no es efectiva; en pacientes que no puedan tolerar vía oral, puede administrarse por sonda nasogástrica o incluso en enema54. En la enfermedad fulminante su efectividad puede aumentarse añadiendo metronidazol por vía intravenosa11.
El tratamiento recomendado para la CF refractaria es desconocido. Se han utilizado novedosas estrategias como nuevos antibióticos (fidaxomicina55, tigeciclina56 y rifaximina57), e inmunoglobulinas58, con diferentes resultados, aunque sin datos en casos graves. El trasplante de microbiota fecal ha mostrado resultados prometedores en el tratamiento de las recurrencias, pero igualmente no hay experiencia en colitis grave59.
En aquellos pacientes que no presentan mejoría en 24-48 h, la valoración quirúrgica es necesaria. El diagnóstico temprano y el tratamiento quirúrgico con colectomía subtotal e ileostomía terminal es importante para reducir la mortalidad60,61. Es obligado considerar el tratamiento quirúrgico en caso de perforación colónica, requerimiento vasopresor, sepsis o disfunción orgánica, cambios mentales, leucocitosis mayor de 50.000/ml, lactato >5mmol/L, ausencia de mejoría tras 5 días en terapia médica y empeoramiento del examen clínico62.
Otros autores como Neal63 proponen una alternativa laparoscópica menos invasiva, que consiste en la realización de lavados de colon con polietilenglicol a través de una ileostomía en asa y seguimiento con enemas de vancomicina y metronidazol iv, obteniendo buenos resultados (mortalidad del 19% y tan solo 3 colectomías subtotales).
Diferentes estudios han demostrado que una intervención precoz antes del desarrollo de shock y fallo orgánico puede mejorar la supervivencia en una CF por CD. Se han propuesto diferentes factores de riesgo para el desarrollo de CF en el contexto de una colitis por CD64, así como factores predictivos de mortalidad tras colectomía65. Neal et al.63 proponen un sistema de puntuación basado en 12 criterios clínicos para identificar pacientes graves en los que es necesario contemplar una colectomía: 1) inmunosupresión (1 punto); 2) dolor o distensión abdominal (1 punto); 3) hipoalbuminemia <3g/dl (1 punto); 4) fiebre (1 punto); 5) ingreso en UCI (1 punto); 6) engrosamiento mural o ascitis en TAC abdominal (2 puntos); 7) leucocitos>15.000 o <1.500 (2 puntos); 8) deterioro de función renal con aumento 1,5 veces de creatinina basal (2 puntos); 9) signos de irritación peritoneal (3 puntos); 10) necesidad de fármacos vasoactivos (5 puntos); 11) necesidad de ventilación (5 puntos) y 12) desorientación, confusión (5 puntos). Así catalogan el cuadro como leve (1-3 puntos), grave (4-6 puntos) y grave complicado (7 o más puntos) e identifican a los pacientes que se pueden beneficiar de una valoración quirúrgica precoz.
ConclusiónLa CF es una entidad grave que requiere del manejo intensivo y conjunto por un equipo multidisciplinar integrado por gastroenterólogos y cirujanos. Es obligado plantear desde el primer momento una estrategia a seguir, que incluya las opciones si las medidas inmediatas fracasan, y el tratamiento a medio y largo plazo.
En nuestro medio las etiologías más frecuentes son la CU y la colitis infecciosa, y entre estas últimas estamos asistiendo a un aumento de la incidencia y gravedad de colitis por CD.
A la hora del diagnóstico es muy importante dilucidar si nos encontramos ante un brote de EII o, por el contrario, se trata de una colitis infecciosa, ya que aunque las medidas terapéuticas generales a adoptar serán las mismas, exigirán medidas específicas diametralmente opuestas.
En la CU el tratamiento inicial se basará en la administración de corticoides intravenosos. Es muy importante evaluar la respuesta precozmente, para instaurar un tratamiento de segunda línea con ciclosporina o infliximab, salvo que exista complicación que indique un tratamiento quirúrgico, que también estará indicado ante un fracaso de estas últimas medidas.
En la colitis grave por CD el tratamiento recomendado es la vancomicina oral asociada a metronidazol intravenoso, monitorizando igualmente de forma intensiva y precoz la respuesta del paciente por si fuera necesario realizar una colectomía.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.