Los tumores del estroma gastrointestinal (GIST) son las neoplasias mesenquimales más comunes del aparato digestivo (3%). El estómago e intestino delgado son las localizaciones más frecuentes, con un 75 y 25% de los casos, respectivamente1. Su localización esofágica es rara (5%), siendo el tumor más frecuente a este nivel el leiomioma, que representa el 70% de los tumores esofágicos benignos. Dada la similitud clínica, endoscópica y radiológica entre los GIST y los leiomiomas, pueden no ser adecuadamente diferenciados hasta después de su resección. Presentamos el caso de un leiomioma esofágico, que por presentar hiperactividad metabólica en el PET/TC fue tratado como un GIST.
Mujer de 59 años, sin antecedentes de interés, que consultó por molestias epigástricas de 5 años de evolución, asociadas a sensación de plenitud posprandial precoz en los últimos meses. En la endoscopia digestiva alta (EDA), justo al entrar en cavidad gástrica, se observó una gran impronta en cara anterior-curvatura menor gástrica por lesión de morfología bilobulada y aspecto submucoso. En la ultrasonografía endoscópica (USE) se identificó una masa mediastínica de 4×7cm, bien delimitada, sugerente de benignidad, en contacto con el lóbulo hepático izquierdo, vena cava inferior y aurícula izquierda sin signos de infiltración; discretamente hipoecogénica con respecto al parénquima hepático y bien vascularizada. El resultado de la punción aspiración con aguja fina (PAAF) dirigida por la USE fue compatible con neoplasia mesenquimal de bajo grado citológico (c-kit [−], actina ML [±], CD31 [−]). Se realizó una tomografía computarizada (TC que reveló una masa hipodensa en la unión esófago-gástrica (UEG) de 9cm de longitud que producía un engrosamiento parietal circunferencial en su porción superior de hasta 3,5cm, y algo más excéntrico en su parte inferior gástrica, donde mostraba un claro componente submucoso. De densidad homogénea con ausencia o muy ligera captación de contraste intravenoso, contactaba con la pared posterior de ambas aurículas, pero con una interfase nítida. Los hallazgos eran compatibles con un tumor submucoso de la unión esofagogástrica cuyo diagnóstico diferencial incluía GIST u otro tumor mesenquimal o adenocarcinoma. Se completó el estudio con un PET/TC que demostró una masa hipermetabólica en mediastino posterior, sobre tercio distal del esófago, y que se extendía hasta cardias con un SUV máximo de 8,21 (figs. 1 y 2).
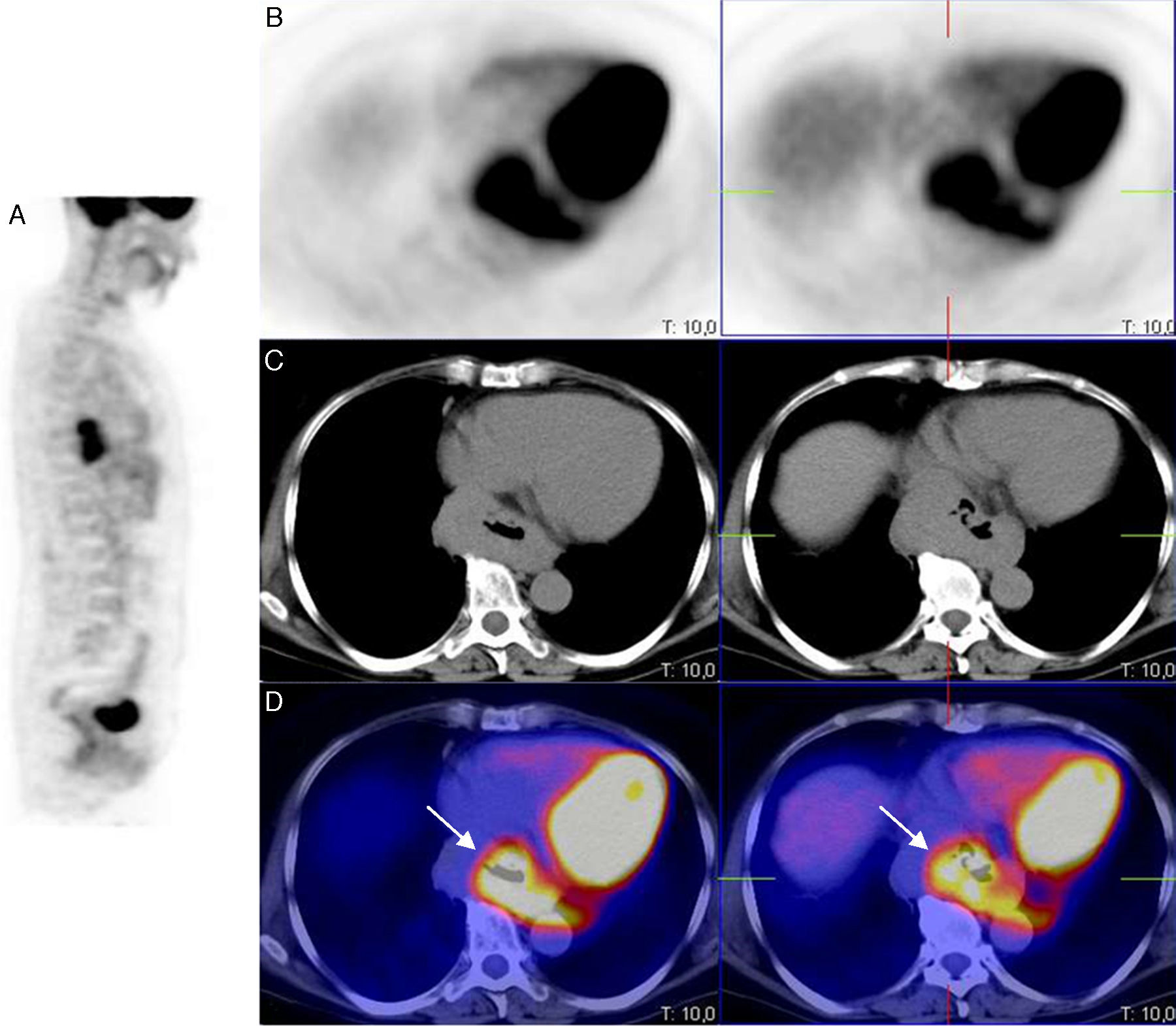
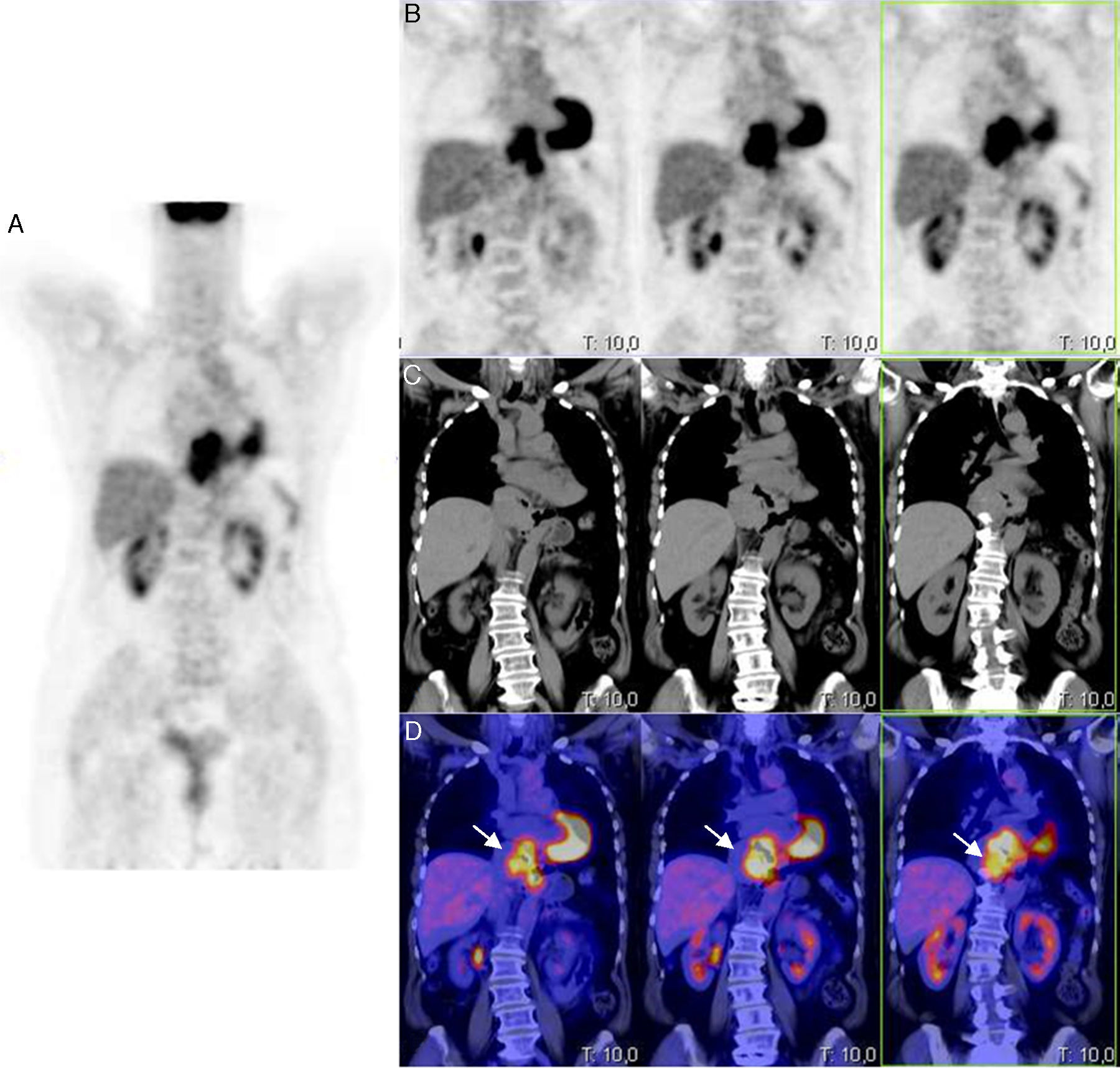
Imagen PET/TC con FDG, en proyecciones PET sagital (A), PET axial (B), TC axial (C) e imagen de superposición PET-TC (D), que muestra un incremento de la actividad metabólica en el tercio inferior esofágico y en la unión esófago-gástrica, con un notable aumento del grosor de la pared esofágica y gástrica.
Ante la alta probabilidad diagnóstica de GIST esofágico c-kit (−) (hasta el 5% no expresan c-kit), por el gran tamaño tumoral, captación positiva en el PET/TC y PAAF no concluyente, se decidió realizar esofaguectomía.
Mediante laparotomía media y abordaje transhiatal se evidenció en esófago distal y UEG una gran tumoración (10×8cm) que rodeaba totalmente al esófago, encapsulada, sin afectación de la serosa, con diversas lobulaciones y sin aparente afectación ganglionar. Se realizó una esofaguectomía subtotal con plastia gástrica de sustitución y anastomosis esófago-gástrica cervical.
El periodo postoperatorio curso sin complicaciones, con adecuada reinstauración de la ingesta oral y tránsito de control sin hallazgos patológicos, por lo que fue dado de alta al séptimo día.
El estudio histopatológico confirmó una lesión multinodular en esófago distal de 8,5×6×5,8cm, rodeada de una fina cápsula translúcida de aspecto blanco-amarillento, arremolinado, bien delimitado, ubicada a nivel transmural, sin infiltrar la capa y con bordes quirúrgicos libres. El análisis microscópico diagnosticó un leiomioma esofágico con el siguiente perfil inmunohistoquímico: desmina (+), actina total (+), actina ML (+), c-kit (−), mioglobina (−), vimentina (−), CK (−), CD34 (−), S100 (−) y Ki-67 (menos del 0,5%).
Para establecer el diagnóstico diferencial entre GIST y leiomioma pueden usarse diversas herramientas diagnósticas como la USE, TC, RM, etc. Recientemente, diversos autores han considerado que el PET/TC podría tener un papel importante en esta encrucijada, dado que los leiomiomas, a diferencia de los GIST, no suelen poseer afinidad por la 18-fluorodesoxiglucosa2. Sin embargo, como ocurrió en nuestro caso, el PET no es infalible, y tiene resultados falsos positivos, especialmente cuando la acumulación de 18F-FDG es un hallazgo incidental. De hecho, la acumulación de 18F-FDG en el esófago distal no es infrecuente. Se puede ver en lesiones benignas inflamatorias como el reflujo gastroesofágico, esófago de Barrett, acantosis glucogénica e infecciones3. Tan solo se han publicado un 8,3% de procesos malignos en hallazgos incidentales de captación incrementada de 18F-FDG en el esófago4. Los leiomiomas con intensa captación pueden ser confundidos con lesiones malignas.
Tradicionalmente se ha sugerido que en los tumores submucosos bien delimitados del esófago no se debe realizar biopsia preoperatoria, por el riesgo de incrementar la rotura de la mucosa durante su enucleación. Sin embargo, debido al incremento de la experiencia con la USE+PAAF, muchos centros la están realizando. Sin embargo, hoy día a pesar de todos los avances diagnósticos, continúa siendo el estudio histológico de la pieza quirúrgica el que nos permite establecer el diagnóstico definitivo GIST versus leiomioma. Típicamente, el leiomioma es positivo para desmina y actina, y negativo para CD34 y CD117, lo contrario ocurre en los GIST5.
Con este caso queremos insistir en la necesidad de seguir avanzando en el diagnóstico diferencial preoperatorio entre estos tumores, debido al abordaje tan radicalmente diferente que precisan. El tratamiento de elección de los leiomiomas de esófago es la enucleación, a diferencia de los GIST, donde lo es la resección tumoral completa (R0) con márgenes histológicos negativos6. Esto en el esófago, habitualmente conlleva una esofaguectomía, salvo en los tumores menores de 2cm donde se puede aceptar la enucleación, la resección endoscópica o el seguimiento sin intervención, pues en estos casos su potencial de diseminación es casi nulo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.