El quilotórax es una complicación poco frecuente en las esofagectomías pero que se asocia a un aumento de la mortalidad posquirúrgica. Se han descrito diversos factores que pueden incrementar su aparición y el tratamiento del mismo es controvertido, siendo la linfografía con embolización percutánea del conducto torácico uno de los usados por varios grupos.
Material y métodoEstudio retrospectivo de los pacientes a los que se les realizó una esofagectomía por cáncer de esófago o de la unión esofagogástrica a Siewert I/II entre enero del 2010 y abril del 2019, y desarrollaron un quilotórax como complicación. Se analizan datos epidemiológicos, el tipo de cirugía, la morbilidad y el tratamiento.
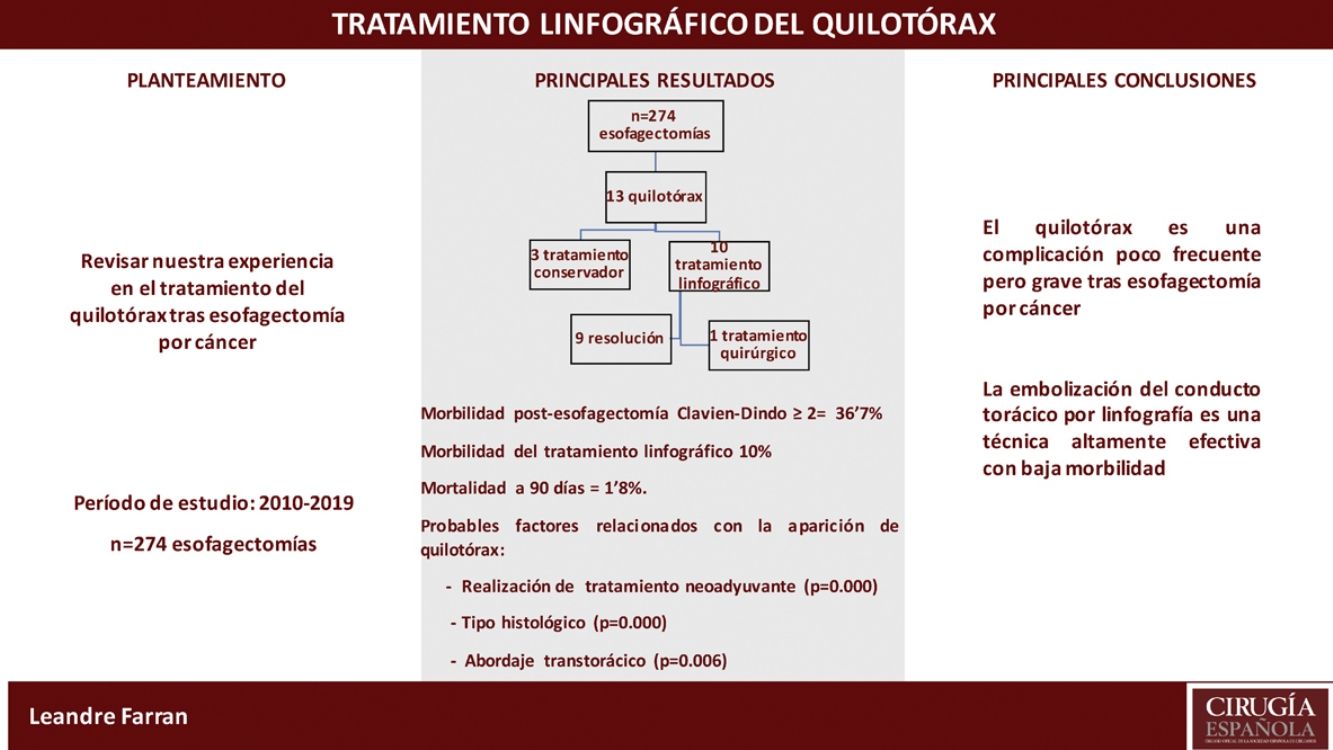
ResultadosSe realizaron 274 esofagectomías por cáncer en el período comprendido. Trece pacientes (4,7%) fueron diagnosticados de quilotórax en el postoperatorio; 3 se resolvieron con tratamiento conservador. En los 10 pacientes restantes se realizó linfografía con punción de la cisterna de Pécquet y embolización del conducto torácico, con resolución del quilotórax en 9. Un paciente (10%) presentó una fístula biliar después del procedimiento.
ConclusionesLa linfografía con punción de la cisterna de Pécquet y embolización del conducto torácico es una técnica con baja morbilidad y buenos resultados en la resolución del quilotórax postesofagectomía.
Chylothorax is a rare complication in esophagectomies that is associated with increased postoperative mortality. Several factors have been described that may favor its appearance. Its treatment is controversial, and lymphography with percutaneous embolization of the thoracic duct is used by several groups.
Material and methodOur retrospective study included patients who underwent esophagectomy for cancer of the esophagus or the esophagogastric junction (Siewert I/II) between January 2010 and April 2019 and developed chylothorax as a complication. Epidemiological data, type of surgery, morbidity and treatment were analyzed.
Results274 cancer-related esophagectomies were performed in the study period. Thirteen patients (4.7%) were diagnosed with chylothorax in the postoperative period; 3 were resolved with conservative treatment. In the remaining 10 patients, lymphography was performed with aspiration of the cisterna chyli and thoracic duct embolization, which resolved the chylothorax in 9. One patient (10%) presented a biliary fístula after the procedure.
ConclusionsLymphography with aspiration of the cisterna chyli and thoracic duct embolization is a technique with low morbidity that provides good results for the resolution of chylothorax after esophagectomy.
El quilotórax (QT) es una de la complicaciones mayores que pueden seguir a una esofagectomía1-3, con una incidencia de entre el 0,4 y el 4%4. Provoca hipoproteinemia, pérdida de lípidos e insuficiencia respiratoria5 y se asocia a un aumento de la mortalidad posquirúrgica y de la estancia hospitalaria6.
Se han descrito diferentes factores que pueden incrementar el riesgo de su aparición: histología de carcinoma escamoso4, índice de masa corporal (IMC) < 25kg/m2 7, quimiorradioterapia neoadyuvante, resección del conducto torácico (CT) y balance ≥ 6,55ml/kg/h en fluidos intraoperatorios6. Algunos autores han defendido, como medida profiláctica, la ligadura en masa del CT durante la cirugía8,9.
El tratamiento del QT es controvertido. La somatostatina ha demostrado su eficacia clínica10, disminuyendo el flujo del CT11; el tratamiento con octreotida, análogo de la somatostatina, disminuye el volumen del QT permitiendo la retirada del drenaje torácico en el 86,6% de los pacientes diagnosticados12. Otros grupos han preconizado la retoracotomía precoz con ligadura del CT13 o la pleurodesis con plasma rico en plaquetas y cola de fibrina14.
La eficacia de la embolización percutánea del CT como tratamiento del QT está bien establecida15 y algunos grupos defienden que es la primera estrategia terapéutica en el abordaje de un QT después de una esofagectomía16.
Este trabajo estudia de manera retrospectiva los QT diagnosticados en los últimos 10 años secundarios a esofagectomías por cáncer realizadas en la Unitat de Cirugía Esofagogàstrica del Hospital Universitari de Bellvitge. Hemos analizado datos epidemiológicos, factores de riesgo y tratamiento.
MétodoEstudio retrospectivo de todos los pacientes a los que se les realizó una esofagectomía por cáncer de esófago o de la unión esofagogástrica Siewert I/II entre enero del 2010 y abril del 2019, y que desarrollaron QT en el postoperatorio. Se analizan datos epidemiológicos, factores de riesgo, tipo de cirugía y morbilidad.
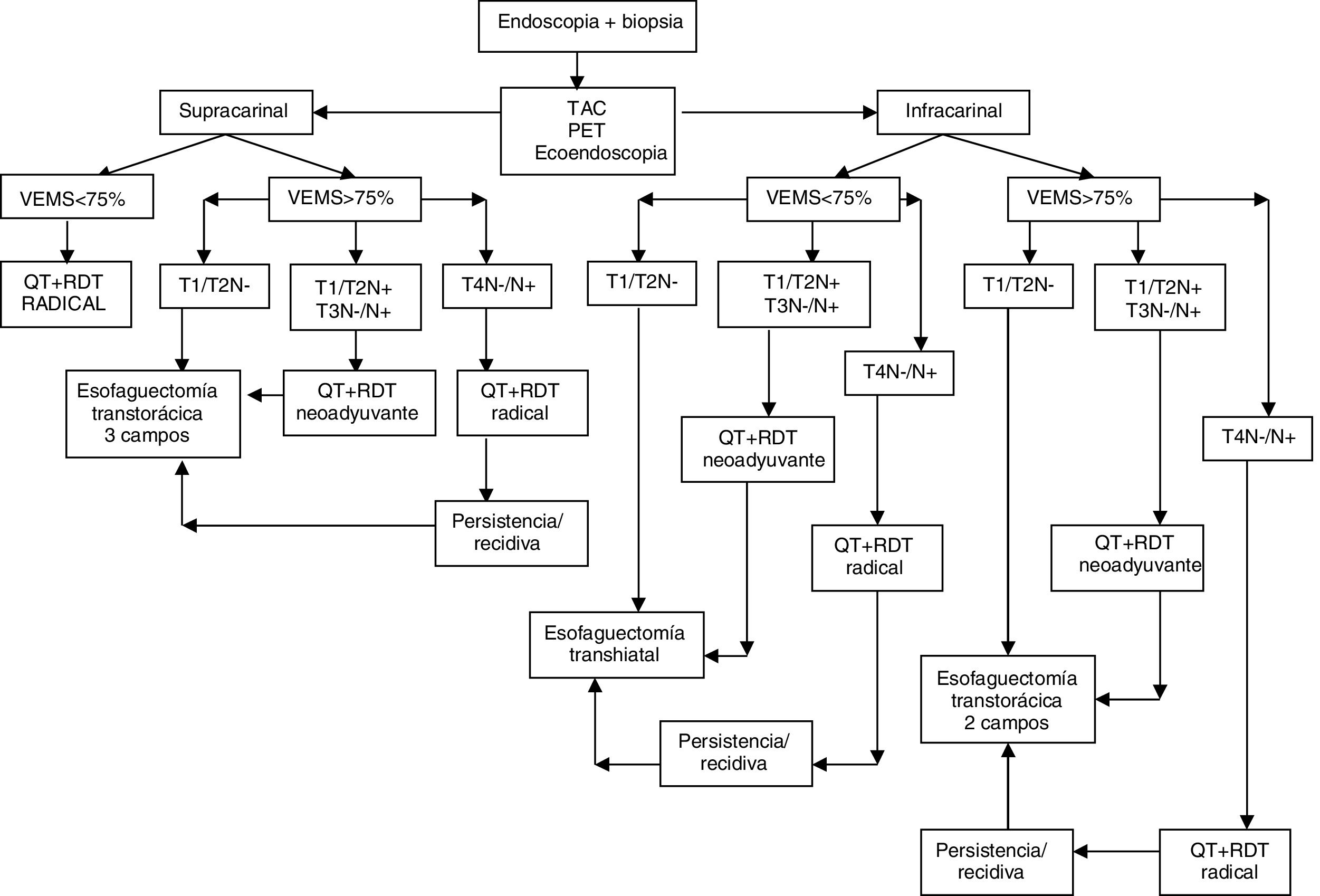
El protocolo de tratamiento de la neoplasia de esófago en nuestra unidad se detalla en la figura 1.
El tratamiento neoadyuvante para la neoplasia de esófago y Siewert I se realiza con cisplatino 75mg/m2 por vía intravenosa (día 1) y 5-fluorouracilo en infusión continua 1.000mg/m2/día (días 1-4 o 5) o carboplatino y 5-fluorouracilo a las mismas dosis en los pacientes con antecedentes de oto o nefrotoxicidad. Se administran 2 ciclos de quimioterapia en la primera y cuarta semana de la radioterapia. La dosis total de radioterapia es de 45Gy, 1,8Gy/fracción en el tumor y profilaxis en las áreas linfoides.
En los tumores Siewert II, esquema FLOT (fluorouracilo, leucovorina, oxaliplatino, taxanos) cada 2-3 semanas.
El abordaje quirúrgico se realiza por vía transtorácica siempre que el paciente presente un volumen espiratorio máximo por segundo > 75% en las pruebas de función respiratoria; en caso contrario, realizamos la esofagectomía por vía transhiatal.
En el abordaje transtorácico, realizamos una linfadenectomía estándar o extendida (adenopatías paraesofágicas infracarinales, subcarinales y parabronquiales) cuando la esofagectomía es 2 o 3 campos, respectivamente, incluyendo en todas ellas la ligadura y la resección en bloque del CT. En carcinomas escamosos supracarinales se asocia una linfadenectomía cervical bilateral. En el campo abdominal, añadimos una linfadenectomía del compartimento ii (estaciones ganglionares 7-11). Se confecciona sistemáticamente una yeyunostomía para alimentación enteral (Fresubin®, Fresenius Kabi Deutschland GmbH, 61346 Bad Homburg. Germany), que se inicia a las 6 h de la cirugía. Realizamos un control radiológico con una tomografía computarizada a la semana de la intervención; si se descarta dehiscencia, iniciamos dieta oral.
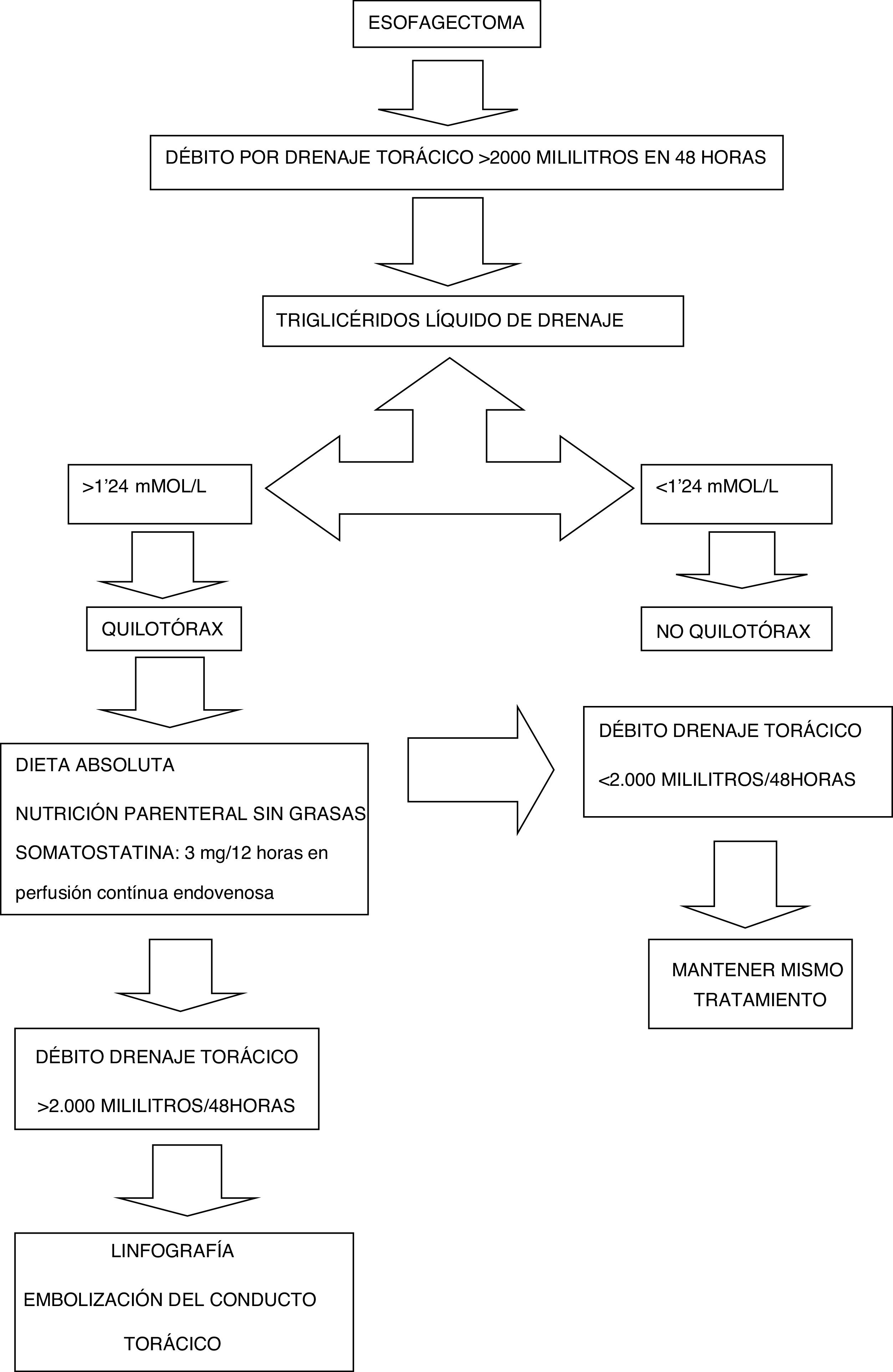
El diagnóstico de sospecha de QT se realiza cuando el débito por los drenajes torácicos es superior a 2.000ml acumulados a las 48 h de la intervención y se confirma con un nivel de triglicéridos del líquido del drenaje superior a 1,24 mmol/l o 110mg/dl. En este momento, se inicia el tratamiento conservador: dieta absoluta por vía enteral, somatostatina a dosis de 3mg/12 h en infusión continua y NPT. Si el débito del QT no disminuye a menos de 2.000ml en las siguientes 48 h después del diagnóstico, indicamos la embolización linfográfica (fig. 2).
Técnica de embolización linfográficaEl estudio linfográfico diagnóstico se realiza mediante punción ecodirigida de ganglios inguinales o disección de linfáticos interdigitales. Se inyecta una solución de esteres etílicos de ácido grasos yodados (Lipiodol® Ultra Fluid, Guerbet, Aulnay-susBois, Francia) y se realiza la comprobación de la opacificación de la cisterna chyli (cisterna de Pécquet). Se procede entonces a su punción mediante aguja 21G del set coaxial de punción percutánea (AccuStick™. Boston Scientific, Francia) y tras introducción de guía de nitinol de 0,018” (Nitrex™, ev3, EE.UU.) se avanzará la misma para recambiar por el set coaxial de punción percutánea (fig. 3).
Una vez retirado el dilatador del set y tras la comprobación de la situación endoluminal con inyección de unos 2ml de contraste radiopaco isoosmolar, se navegará a través del CT mediante microcatéter (Progreat®2’7 Frx130 cm (Terumo, Tokio, Japón), para intentar avanzar lo más cercano posible al punto de fuga.
Una vez alcanzada la posición deseada, se embolizará con el agente de elección de manera retrógrada la totalidad del segmento de CT cateterizado, así como del tracto extraluminal de abordaje. En nuestro centro, el agente embolizante de elección en la actualidad es la mezcla de n-Butil-2-Cianoacrilato (Glubran® 2, GEM S.r.l., Viareggio (LU), Italia) con esteres etílicos de ácidos grasos yodados (Lipiodol®), pudiendo realizarse también mediante microcoils.
Para el análisis estadístico se utilizó el programa estadístico IBM SPSS versión 18.0 (SPSS Inc., Chicago, IL, EE. UU.).
Los datos cuantitativos se expresaron como media y desviación estándar, o como mediana y rango intercuartílico cuando los datos no siguieron una distribución normal. Los datos cualitativos se expresaron como frecuencias y porcentajes. Se utilizó la prueba de la t de Student para comparar variables cuantitativas. En el caso de variables cuantitativas que no seguían una distribución normal se aplicó la U de Mann-Whitney. Para la comparación de las variables cualitativas, se empleó la prueba de la chi al cuadrado. En todos los casos, se aceptó como significación estadística cuando la p fue < 0,05.
ResultadosEntre enero del 2010 y abril del 2019 se realizaron 274 esofagectomías por cáncer de esófago o de la unión Siewert I/II en la Unitat de Cirurgia Esofagogàstrica del Hospital Universitari de Bellvitge. De ellas, 239 hombres (86,9%) y 35 mujeres (13,1%), con una edad media de 60,4 años (30-85). El 72,7% de los tumores se localizaban a nivel infracarinal; el 61,7% de ellos eran adenocarcinomas y el 69% de los pacientes recibieron tratamiento neoadyuvante.
Dentro de los procedimientos quirúrgicos, el 77,1% fueron esofagectomías transtorácicas (45,5% a 2campos y 31,6% a 3campos) y 22,9% transhiatales; de estas últimas, el 4,7% coloplastias.
De 211 pacientes a los que se realizó un abordaje transtorácico, el 12,8% (27 casos) se realizó por toracoscopia.
El 36,7% de los pacientes presentaron complicaciones ≥ 2 según la clasificación de Clavien-Dindo. El tiempo de hospitalización fue de 16 días y la mortalidad a 90 días fue del 1,8%.
Se diagnosticaron 13 pacientes (4,7%) con QT posquirúrgico, todos en las primeras 48 h. Los 13 fueron intervenidos por toracotomía. Las características y el tratamiento empleado se reflejan en la tabla 1. En todos los casos, se inició el tratamiento conservador con somatostatina, nutrición parenteral y drenaje torácico; en 3 de ellos se resolvió el QT en 5, 6 y 9 días, respectivamente.
Características de los pacientes diagnosticados de quilotórax y tratamiento
| Sexo | Edad, años | Histología | Localización | TNM pre | NA | IQ | TNM post | Tratamiento | Resolución |
|---|---|---|---|---|---|---|---|---|---|
| V | 48 | ADK | Infracarinal | T3N+ | Sí | Lewis | T0N0 | SMT + drenaje | Sí |
| V | 66 | ADK | Infracarinal | T3N+ | Sí | Lewis | T3N1 | Embolización | Sí |
| V | 52 | ADK | Infracarinal | T1N– | No | Lewis | T1bN0 | Embolización | Sí |
| V | 48 | ADK | Infracarinal | T3N+ | Sí | Lewis | T3N0 | Espasmo CP | Sí |
| V | 56 | ESC | Infracarinal | T4N+ | No | Lewis | T3N0 | Embolización | Sí |
| V | 69 | ADK | Infracarinal | T3N+ | Sí | Lewis | T3N3 | SMT + drenaje | Sí |
| V | 59 | ESC | Supracarinal | T3N+ | Sí | McKeown | T3N2 | Embolización | Sí |
| V | 65 | ESC | Supracarinal | T3N+ | Sí | McKeown | T3N1 | Embolización | No |
| V | 50 | ADK | Infracarinal | T4N+ | Sí | Lewis | T0N0 | Espasmo CP | Sí |
| V | 64 | ADK | Infracarinal | T3N+ | Sí | Lewis | T3N3 | Embolización | Sí |
| V | 50 | ADK | Infracarinal | T4N+ | Sí | Lewis | T3N2 | Espasmo CP | Sí |
| V | 55 | ADK | Infracarinal | T2N+ | Sí | Lewis | T0N0 | SMT + drenaje | Sí |
| V | 56 | ADK | Infracarinal | T2N+ | Sí | Lewis | T0N0 | Embolización | Sí |
ADK: adenocarcinoma; ESC: carcinoma escamoso; NA: neoadyuvancia; SMT: somatostatina.
Se indicó una linfografía en los 10 casos restantes; en 7 se identificó la fuga en el CT y se logró embolizarla, resolviéndose el QT en 6. En 3 pacientes se puncionó la cisterna de Pécquet. aunque no se logró cateterizar el CT ni embolizarlo; a pesar de esto, el QT se solucionó en todos ellos.
Un paciente presentó una fístula biliar de bajo débito posterior a la punción transhepática de la cisterna de Pécquet, que se resolvió espontáneamente.
En la tabla 2 se comparan las características de los pacientes que desarrollaron QT frente a los que no.
Comparativa entre pacientes que desarrollaron QT postesofagectomía frente al total de pacientes resecados
| Quilotórax | No quilotórax | Significación | |
|---|---|---|---|
| Varones | 100% | 86,9% | NS |
| Edad | 56,7 años | 60,4 años | NS |
| NA/no NA | 83,3%/16,7% | 67,7%/31,9% | 0,000 |
| ADK/ESC | 75%/25% | 60,4%/39,2% | 0,000 |
| Supracarinal/Infracarinal | 16,7%/83,3% | 27,8%/72,2% | NS |
| Técnica: TH/TT | 0/13 | 63/198 | 0,006 |
| Días en UCI | 3,5 días (3-32) | 3 días (3-90) | NS |
| Días Hospitalización | 30 días (11-151) | 16 días (7-119) | 0,016 |
| Fallecimiento a 90 días | 0 | 1,8% | NS |
ADK: adenocarcinoma; ESC: carcinoma escamoso; NA: neoadyuvancia; NS: no significación estadística; TH: transhiatal; TT: transtorácica; UCI: Unidad de Cuidados Intensivos.
La lesión del CT durante la esofagectomía es una complicación con una incidencia baja, entre el 0,6 y el 4%1-3, aunque algunos grupos describen hasta un 12%6; en nuestra serie fue del 4,7%. Dentro de los factores de riesgo estudiados, el IMC < 25ha sido considerado por algunos autores un factor predisponente7. La histología de carcinoma escamoso, descrita por Shah et al.4 como otro factor de riesgo para la aparición de QT no la hemos podido corroborar en nuestra serie. Al contrario, encontramos una diferencia estadísticamente significativa a favor del adenocarcinoma en los pacientes diagnosticados de QT. La proporción en nuestro medio entre adenocarcinomas y carcinomas escamosos no explicaría esta diferencia, ni el tratamiento neoadyuvante, que es el mismo en ambos tumores.
El tratamiento neoadyuvante con quimiorradioterapia6,17 es otro factor de riesgo en la aparición de QT postesofagectomía, por la fibrosis que provoca una mayor dificultad en la disección del mediastino18; en nuestro caso, 11 de los pacientes que presentaron QT habían recibido tratamiento neoadyuvante con quimio y radioterapia, y solo en 2 se indicó directamente la cirugía. Aunque existe significación estadística que concuerda con lo publicado por diversos autores respecto la radioterapia como factor de riesgo, el escaso número de pacientes de nuestra serie no permite diferenciarlo de su asociación con la quimioterapia. De todos modos, ningún paciente con quimioterapia como único tratamiento neoadyuvante desarrolló QT.
A pesar que hay autores que han demostrado un aumento del riesgo de QT en la resección del CT comparado con su preservación6, nuestro grupo realiza una resección sistemática del CT distal al cayado de la vena ácigos en la linfadenectomía mediastínica en bloque, con ligadura de ambos cabos con sutura reabsorbible; para su identificación no utilizamos ninguna técnica auxiliar. Otros estudios defienden que la ligadura en masa del CT pueden prevenir el QT después de una esofagectomía8,9.
El abordaje terapéutico del QT (fig. 3) lo iniciamos siempre con tratamiento conservador, con nutrición parenteral total y somatostatina10; pensamos que en el QT con un volumen inferior a 1.000 cc/24 h puede ser resolutivo. En el resto de los casos, nuestra opción es la embolización del CT15,16. De los 10 pacientes en que se intentó la embolización, se realizó el procedimiento completo en 7 con resolución del QT en 6; en 3 casos, no fue posible la cateterización del CT ni la embolización del mismo, por lo que se optó por la disrupción de la cisterna de Pécquet. Este fenómeno ya fue descrito por Cope y Kaiser19, en que la disrupción de la cisterna de Pécquet provoca un espasmo de la misma con resolución del QT. En un estudio de Boffa et al.20, de 22 linfografías realizadas, consigue la embolización del CT en 12 y en las 10 restantes provoca una disrupción, aunque afirman que es preferible la embolización a la disrupción. Los angiorradiólogos de nuestro grupo optan por la disrupción cuando no consiguen canalizar el CT.
Tuvimos un caso de fracaso en la resolución del QT, a pesar de que el CT estaba correctamente embolizado. Se resolvió cuando fue necesario realizar una toracotomía izquierda urgente por un hemotórax iatrogénico; durante el acto quirúrgico realizamos un talcaje pleural14. En este caso, creemos que el fracaso en la resolución del QT podría deberse a una segunda lesión a nivel de la linfadenectomía cervical izquierda que realizamos sistemáticamente en una esofagectomía por neoplasia supracarinal.
En conclusión, los pacientes que en nuestra serie han presentado QT como complicación de una esofagectomía son varones diagnosticados de adenocarcinoma, con tratamiento neoadyuvante, abordaje transtorácico y resección del CT.
Aunque el bajo número de casos impide generalizar conclusiones, creemos que el tratamiento del QT postesofagectomía debe iniciarse con medidas conservadoras (dieta absoluta, somatostatina y nutrición parenteral) y, en caso de no resolución, el tratamiento de elección debería ser un estudio linfográfico con embolización de la lesión del CT. Es un procedimiento que, en manos de angiorradiólogos expertos, presenta una baja morbilidad y es efectivo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.