La gastrectomía vertical es la técnica de cirugía bariátrica más realizada en el mundo. Una de sus principales complicaciones es el reflujo gastroesofágico. A la vista de estos resultados queda claro que deben realizarse de forma protocolizada controles endoscópicos en todos los pacientes intervenidos de gastrectomía vertical sobre todo si tenemos en cuenta la gran cantidad de pacientes asintomáticos que presentan dicha patología y que en muchos casos pueden desencadenar esofagitis severas e incluso adenocarcinomas. Una vez realizadas las pruebas diagnósticas adecuadas, debe iniciarse tratamiento médico conservador con IBP y hacer un seguimiento estricto de estos pacientes. En caso de que fracase el tratamiento conservador, debe plantearse un tratamiento quirúrgico. La reconversión a Bypass Gástrico es la cirugía de elección por su seguridad y resultados. Existen otras técnicas endoscópicas como el Stretta o Linx que pueden plantearse como alternativas, aunque todavía hacen falta más estudios que demuestren su efectividad.
VSG is the most used surgical procedure in the world. Among the main complications linked to this procedure is GERD. It is apparent that endoscopic control protocols should be undertaken in all patients recovering from a VSG procedure. This is particularly key when taking into account the large number of patients suffering from GERD that show no symptoms, a situation that in many cases leads to severe esophagitis or even adenocarcinoma. Once the pertinent diagnostic tests have been carried out, the specialist should seek a conservative medical treatment including PPI. In the event that this treatment should fail, the next step to be considered should be a surgical procedure. In this case, the ideal procedure would be a reconversion to gastric bypass due to its low-risk and its results. There are other alternatives such as the Stretta, Linx or ARMS procedures; however, further research is necessary to prove their reliability.
Como ya se ha venido planteando en capítulos anteriores, la obesidad patológica ha ido aumentando progresivamente en los últimos años hasta llegar a índices epidémicos. Esto ha conllevado un aumento significativo de las cirugías realizadas para esta patología. Asimismo, la obesidad se ha considerado un factor de riesgo importante para el desarrollo de síntomas de reflujo gastroesofágico (RGE)1 y la solución en muchos casos ha sido practicar una intervención bariátrica que solucionara la patología de base y así evitarlo. Sin embargo, todas las técnicas bariátricas no son iguales en cuanto a resultados, complicaciones, riesgos, etc., y en muchos casos se pueden llegar a considerar contraproducentes, sobre todo si consideramos que no todos los pacientes que van a ser intervenidos de una cirugía bariátrica han sido estudiados en lo que al RGE se refiere, por lo que en muchas ocasiones no sabemos de qué situación partimos en cuanto a esta patología y, por lo tanto, es difícil indicar una técnica bariátrica adecuada.
Actualmente la gastrectomía vertical laparoscópica (GVL) es la técnica bariátrica más utilizada en el mundo2. Por eso, con el paso del tiempo se ha ido observando un aumento de pacientes con complicaciones secundarias a este procedimiento y en la mayoría de los casos asociadas a RGE.
Si analizamos detenidamente la técnica, este procedimiento puede alterar las arquitecturas anatómicas y fisiológicas antirreflujo normales del esófago debido a una reducción de la distensibilidad gástrica, un aumento de la presión intragástrica y una alteración anatómica en el esfínter esofágico inferior (EEI) y ángulo de Hiss3. Estos cambios aumentan el reflujo del contenido gástrico hacia el esófago inferior, aumentando de forma importante la esofagitis, el riesgo de esófago de Barrett (EB) e incluso de adenocarcinoma4. Estos factores que exacerban el RGE se podrían contrarrestar, según refieren algunos autores, acelerando el vaciamiento gástrico y la pérdida de peso que ocurre pasado un tiempo tras la cirugía, lo que explicaría la mejoría del RGE pasados 3años. Sin embargo, este vaciamiento gástrico exacerbado se puede asociar a un píloro «fijo» en el 80% de los casos y a presencia de bilis en el estómago en el 40%, a los 10,5años de la cirugía5. Estudios con escintigrafía scan demuestran tasas de reflujo biliar del 31,8% tras la GVL, lo que podría ser la causa de la esofagitis y el esófago de Barrett6.
Con el escenario descrito anteriormente nos encontramos ante una técnica bariátrica ampliamente extendida, donde parece evidente el potencial refluxógeno de la misma. Asimismo, la GVL se asocia a una reganancia ponderal importante con el paso del tiempo, siendo un condicionante más para el empeoramiento del RGE.
Pruebas diagnósticas en el seguimiento del paciente sometido a GVLCon todos los datos anteriormente descritos parece evidente que hay que planificar un seguimiento estricto de estos pacientes, puesto que parece inevitable la aparición de RGE.
Sería importante saber establecer las pruebas diagnósticas que debemos realizar en los pacientes sometidos a GVL para así podernos adelantar a las complicaciones del mismo y, en base a ello, establecer un tratamiento adecuado, sobre todo si tenemos en cuenta que muchos pacientes presentan RGE postoperatorio de novo y con ausencia de síntomas que no nos van a hacer sospechar la existencia de patología. A esto hay que añadir, como decíamos anteriormente, que a muchos de estos pacientes no se les han realizado estudios previos y no sabemos de la situación de la que partimos.
El diagnóstico definitivo de RGE en general se establece según cuatro criterios: síntomas, hallazgos endoscópicos, radiología digestivas y estudios de fisiología esofágica, como la manometría de alta resolución y la pH-metría esofágica7,8.
Escalas de calidadLas escalas de calidad permiten cuantificar de una forma objetiva los síntomas de los pacientes y poder hacer comparaciones siguiendo los mismos parámetros.
El cuestionario GerdQ, validado por Jonasson et al.9 en 2009 en el King College de Londres y posteriormente por Pérez-Alonso et al.10 en el año 2009, ha demostrado ser útil en el diagnóstico del RGE y que puede disminuir el uso de endoscopia digestiva y optimizar el uso de recursos.
De cualquier forma, estas escalas nos permiten el diagnóstico clínico, pero resultan insuficientes a la hora de identificar la severidad de las lesiones esofágicas.
GastroscopiaLa realización sistemática de una endoscopia preoperatoria a los pacientes que van a ser sometidos a una cirugía bariátrica está más que discutida, y lo mismo sucede con el seguimiento postoperatorio de estos pacientes.
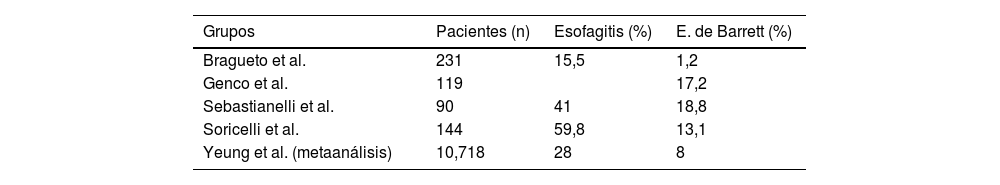
Hay múltiples estudios4,11-14 a medio y a largo plazo que informan de la aparición de EB y esofagitis en la gastroscopia, como los que se describen en la tabla 1, con porcentajes nada desdeñables. Muchos de estos pacientes no presentaban síntomas de RGE, por lo que con estos resultados se nos sugiere la necesidad de gastroscopia a todos los pacientes, independientemente de la clínica.
Dado que la GVL está ampliamente extendida en todo el mundo, en pacientes jóvenes con muchos años por delante para poder desarrollar complicaciones, es de especial interés cómo debemos realizar el seguimiento y la periodicidad de este. Se desconoce si la progresión a EB y adenocarcinoma sucede de manera idéntica en los pacientes intervenidos de gastrectomía vertical respecto del resto de la población. Tampoco está clara la decisión a tomar tras el diagnóstico de un EB en un paciente portador de una gastrectomía vertical: ¿seguimiento o conversión a bypass gástrico?15. Lo que parece claro es que se hace indispensable la realización de gastroscopias postoperatorias en todos los pacientes intervenidos de GVL para después poder plantear una adecuada actitud terapéutica. Hay por tanto múltiples estudios que relacionan la GVL con el desarrollo de reflujo, esofagitis y EB, con una alta tasa de pacientes asintomáticos, por lo que parece importante recomendar la realización de controles endoscópicos a partir de los 5años a todos los pacientes, independientemente de la presencia o ausencia de síntomas de RGE16.
Ph-metría y manometríaEn los últimos años son numerosos los trabajos que han indagado sobre los efectos fisiopatológicos de la cirugía bariátrica en el RGE en pacientes sometidos a GVL. Raj et al.17 describen un incremento significativo de 10,9±11,8 a 40,2±38,6 puntos en una población de 30pacientes que se sometieron a GVL. Usando manometría convencional, Braghetto et al.18 reportaron que la presión de EEI post manga gástrica laparoscópica se reduce debido a la sección de las slingfibers de la unión esofagogástrica cuando se realiza el grapado próximo al ángulo de HIS. Hampel et al.19 sugieren que la falta de distensibilidad gástrica, dada la resección fúndica y la eliminación del ángulo de HIS, aumentaría la presión gástrica basal post-GVL, creando un aumento de presión intraluminal que superaría la presión en reposo del EEI. Así se explica el aumento del porcentaje de pacientes que presentan inversión del gradiente esofagogástrico.
Los estudios anteriores apoyarían que la manometría y la pH-metría pueden jugar un papel importante en el diagnóstico del RGE en los pacientes sometidos a GVL y debe ser muy tenida en cuenta en los algoritmos de seguimiento de estos pacientes.
Estudio esofagogastroduodenal (EGD)El EGD puede servir para diagnosticar complicaciones como hernia de hiato (HH), estenosis y dilatación del fundus, por lo que puede ser útil de cara a la planificación quirúrgica. Se han observado discrepancias entre las pruebas diagnósticas a la hora de determinar la presencia o ausencia de HH. Parece que la endoscopia puede sobreestimar su presencia, mientras que el EGD es más fiable20. En cualquier caso, este tipo de estudios baritados deben ser considerados siempre que se plantea una reintervención quirúrgica por RGE en este tipo de pacientes.
Tratamiento en paciente con enfermedad por RGE tras GVLEn la estrategia de control de los pacientes sometidos a GVL debería incorporarse, como dijimos anteriormente, un seguimiento clínico estricto, puesto que sabemos que un importante número de pacientes va a desarrollar RGE. El dilema está a partir de qué momento y con qué periodicidad habría que realizar una endoscopia, pruebas funcionales y estudios baritados, ya que no hay estudios lo suficientemente potentes que apoyen este seguimiento. Lo que parece evidente es que un seguimiento a partir del quinto año se hace más que recomendable, como ya propusieron Ferrer et al.16.
Una vez realizadas las pruebas diagnósticas oportunas que nos lleven al diagnóstico de un RGE patológico, debemos plantear cuál es la mejor opción terapéutica para el paciente y en qué momento tomar la decisión de plantear la cirugía de revisión y qué tipo de técnica.
De cualquier forma, lo lógico sería plantear un tratamiento escalonado, comenzando por una propuesta conservadora que nos permita conocer la respuesta del paciente tanto desde el punto de vista clínico como desde el fisiológico.
Tratamiento conservadorLas opciones terapéuticas conservadoras incluyen cambios en el estilo de vida y medicación con inhibidores de la bomba de protones (IBP): este debe ser el primer paso a seguir. Más del 50% de los pacientes que se someten a GVL necesitan IBP durante el postoperatorio inmediato. El número de pacientes que necesitan IBP puede llegar al 26%, como se muestra en un amplio (n>11.000) estudio retrospectivo a nivel nacional en Francia. En algunos estudios se sugiere una dosis inicial de 40-80mg de IBP dos veces al día durante dos semanas, seguido de una reducción de la dosis. En pacientes con buenos resultados la dosificación del IBP debe reducirse, tanto como sea posible, para limitar los posibles efectos secundarios de los IBP21.
Reconversión a bypass gástricoLa conversión a bypass gástrico en Y de Roux (BPGY) ha demostrado excelentes resultados en cuanto a la resolución de los síntomas de RGE, por lo que ante un RGE refractario al tratamiento médico tras GVL, debemos plantear una conversión a BPGY22,23. Se hace indispensable, antes de tomar cualquier decisión quirúrgica, tener perfectamente documentada la causa del mismo con las pruebas diagnósticas oportunas, ya que el RGE en un paciente intervenido de GVL puede tener muchas causas. En la mayoría de las ocasiones se debe simplemente a la propia alteración anatómica de la técnica, que implica un aumento de presiones sobre el tubo gástrico que condiciona una relajación del esfínter esofágico superior e incluso el desarrollo de HH. En otras ocasiones viene dado por un defecto de la técnica primaria que condiciona estenosis, rotaciones de la plastia, etc. Por todo esto es importante planificar de forma adecuada la cirugía.
En el estudio de Parmar et al.24 se revisaron retrospectivamente 22 GVL que requirieron conversión a BPGYL, observando una mejoría del RGE en el 100% de los pacientes, pudiendo el 80% suspender la medicación con IBP. Abdemur et al.24 describen una resolución completa de RGE después de la conversión de GVL a BPGYL en el 77% de los pacientes y mejoría en el 23%. Hay estudios que describen una resolución del RGE en el 75% de los pacientes al año de la cirugía. El riesgo de complicaciones quirúrgicas es solo ligeramente superior a la cirugía primaria, lo que nos lleva a poder indicarla de forma más generosa22,25-27.
En cuanto a la reparación asociada de HH durante la cirugía de BPGYL, clásicamente ha variado en función del tamaño de la misma y del cirujano que realiza la intervención. En el estudio de Curell et al.28 se hace un análisis retrospectivo de 700 pacientes intervenidos de GVL. De ellos, 35 presentan RGE. Durante la cirugía de conversión hubo varios pacientes que presentaron HH a los que no se les reparó, ya que se consideró que eran de pequeño tamaño y que con la conversión a BPGYL sería suficiente. Dos de estos pacientes necesitaron una tercera cirugía para tratar la persistencia de HH, por lo que el examen y la reparación del hiato parecen un punto clave en la cirugía de conversión.
Los pacientes que se someten a reconversión a BPGYL tras GVL suelen presentar una reganancia ponderal. Parece que esto se debe en parte a que, a pesar de que se les añade un componente de malabsorción, tras la mejoría de los síntomas tienden a comer más28, por lo que es un aspecto a considerar a la hora de establecer el componente malabsortivo. Este dato es importante, porque cuando intervenimos a estos pacientes no suelen tener un índice de masa corporal (IMC) muy alto y tendemos a hacer una cirugía menos hipoabsortiva, pero hay que considerar hacer una cirugía de futuro.
Otras técnicasAl margen de las técnicas quirúrgicas propiamente dichas, se pueden establecer otras alternativas mínimamente invasivas para el tratamiento del RGE en pacientes sometidos a GVL, ya que en muchos de ellos se eligió este procedimiento por la edad o por las comorbilidades, y en muchas ocasiones hay que recomendar técnicas no quirúrgicas.
Los métodos endoscópicos para el tratamiento de la RGE incluyen la plicatura, el aumento de volumen del EEI con biopolímeros inertes y la ablación térmica. Hay varios estudios que describen un refuerzo endoscópico de la unión esofagogástrica en poblaciones heterogéneas con síntomas de RGE que muestran resultados iniciales prometedores20,29.
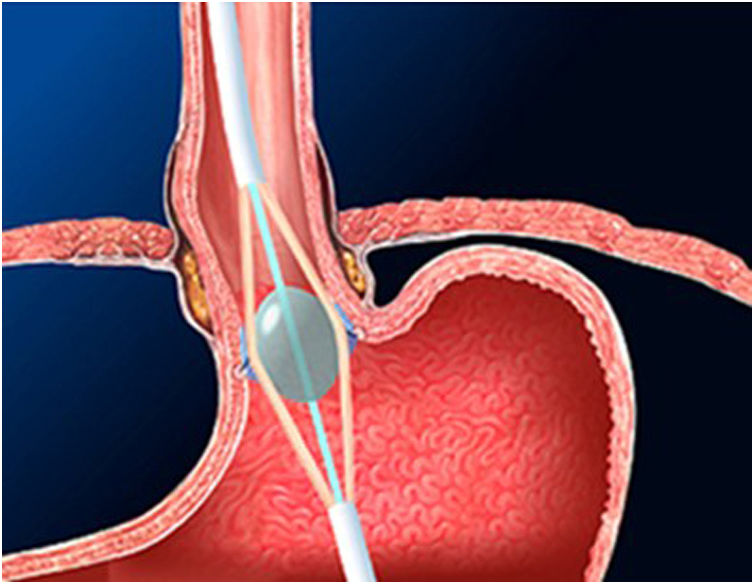
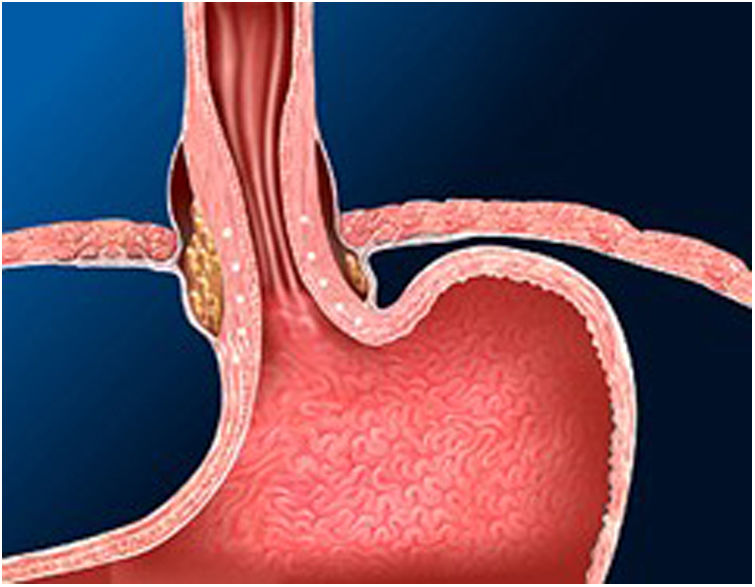
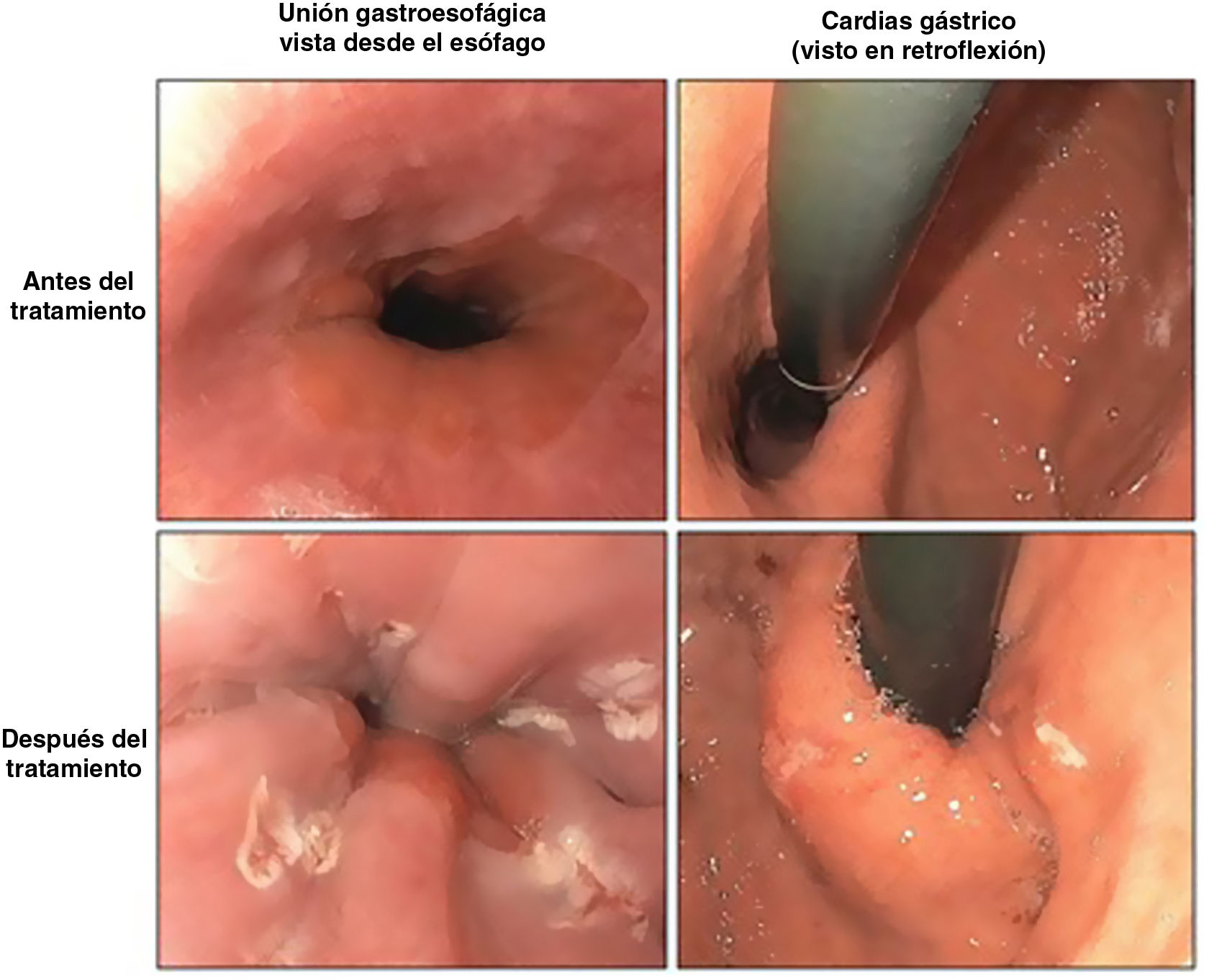
La técnica de Stretta (figs. 1-3) es otra técnica endoscópica que se utiliza ampliamente en Estados Unidos con buena eficacia a largo plazo. Consiste en la realización de radiofrecuencia en la capa muscular de la parte inferior del EEI a través del endoscopio. Con esto se consigue disminuir la sensibilidad esofágica al ácido y disminuir la distensibilidad de la unión gastroesofágica, produciendo alivio sintomático en los pacientes.
Esta técnica estaría indicada en pacientes con RGE demostrada en las pruebas diagnósticas, que no presenten trastornos de la motilidad esofágica ni disfagia y en ausencia de hernia de hiato mayor de 3cm. Solo estaría indicada en pacientes con esofagitis gradoA yB de la clasificación de Los Ángeles.
Es una técnica segura, efectiva y que puede repetirse en caso de ser necesario, además de normalizar el pH y permitir disminuir la dosis de IBP después de GVL. Sin embargo, faltan estudios a largo plazo en pacientes bariátricos30-32.
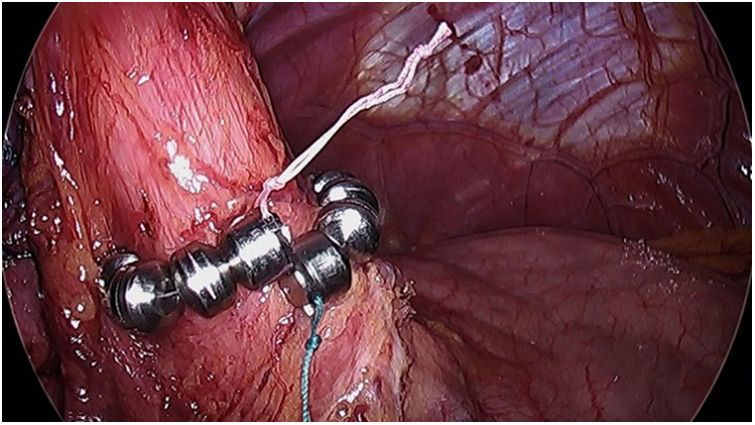
El esfínter magnético (LINX) (fig. 4) consiste en un anillo flexible con imanes que se coloca alrededor del esfínter esofágico superior (EES), ayudando a mantenerlo cerrado previniendo RGE. Hawasli et al.33 publicaron en 2019 un estudio de 13 pacientes a los que se les implantó dicho dispositivo. Tuvieron que excluir un paciente por pérdida durante el seguimiento y otro que requirió retirada del dispositivo por disfagia. Cinco pacientes tuvieron resolución completa de los síntomas, mientras que 6 pacientes experimentaron recurrencia de RGE después de 7meses sin IBP
Las indicaciones son similares que las descritas para la técnica de Stretta. No obstante, no se recomienda colocar en pacientes con IMC >35, ya que aunque no se han hecho estudios específicos, en un análisis retrospectivo realizado con 170 pacientes se observó que a partir de dicho IMC no se podían demostrar buenos resultados34.
Esta técnica es segura y puede plantearse como una alternativa a la reconversión a BPGYL. No obstante, hace falta un estudio prospectivo aleatorizado que garantice los resultados y muestre la efectividad a largo plazo.
La mucosectomía antirreflujo consiste en la disección submucosa de la unión gastroesofágica (UGE) en el cardias, tras la cual la cicatrización que se produce en el defecto mucoso hace que se contraiga dicha zona y se estreche la luz esofágica. Los resultados que se describen en la literatura documentan una mejoría de los síntomas en el 50-70% de los pacientes, pero son pocos estudios y con series pequeñas de pacientes35.
ConclusionesLa GVL es la técnica más utilizada en el mundo. Se ha demostrado en numerosos estudios el gran porcentaje de pacientes que presentan RGE de novo o empeoramiento del mismo tras la realización de esta técnica. Además, se ha puesto de manifiesto que los hallazgos encontrados en las pruebas diagnósticas no siempre se correlacionan con la clínica. Aunque hay una clara tendencia en publicaciones recientes32 a favor de realizar endoscopias postoperatorias sistemáticas a todos los pacientes independientemente de la clínica, todavía no hay un claro consenso en cuanto al momento o a los intervalos de tiempo en los que deberían realizarse.
Una gran parte de los pacientes con RGE van a responder a tratamiento con IBP. Sin embargo, habrá una parte de estos pacientes que vayan a requerir algún tipo de intervención. La cirugía revisional es un procedimiento efectivo y seguro tras el fracaso de la GVL, y el BPGYL es la técnica de elección en caso de la presencia de RGE o esofagitis.
Hay otras técnicas no quirúrgicas como la radiofrecuencia, LINX o la mucosectomía antirreflujo, que pueden plantearse como alternativas, aunque hacen falta más estudios a largo plazo para poder validar la efectividad de los procedimientos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.