Melanoma anorrectal es un tumor infrecuente y muy agresivo. Su clínica es muy inespecífica, por lo que se requiere un alto índice de sospecha para evitar un retraso diagnóstico. La cirugía radical no ofrece ninguna mejora en la supervivencia y debe reservarse para aquellos pacientes en los que la escisión local no es factible. La linfadenectomía inguinal no está indicada de forma sistemática y debe valorarse de forma individualizada. La quimioterapia adyuvante no es efectiva. El papel de la radioterapia es controvertido. Puede utilizarse, bien como terapia hipofraccionada tras escisión local o bien como tratamiento paliativo. En cualquier caso, los resultados oncológicos son desalentadores. El objetivo de este artículo es realizar una revisión de la literatura existente sobre las características clinicopatológicas y el manejo del melanoma anorrectal.
Anorectal melanoma is an uncommon and aggressive disease. Because the patients often present with non specific complaints, a high clinical suspicion is important to avoid a delayed diagnosis. Patients undergoing radical surgery have no significant survival difference compared to those undergoing wide local excision. Abdominoperineal resection should be reserved for selected patients in whom local excision is not technically possible or cannot obtain a clear margin. The indiscriminate use of groin dissection is not advisable in anorectal melanoma and should be use in selected cases. Systemic chemotherapy is generally a non effective treatment and continues be studied. Radiation therapy can be used as hypofractionated radiation therapy combined with local excision or in a palliative setting. The oncological outcomes in anorectal melanoma are very poor. The aim of the present study is to review clinicopathology features and management of anorectal melanoma.
El melanoma anorrectal (MA), descrito inicialmente por Moore hace 150 años1, es un tumor raro y de muy mal pronóstico. La evidencia científica disponible sobre esta neoplasia es heterogénea y poco concluyente. Además, es una entidad de difícil diagnóstico clínico, debido a una sintomatología muy inespecífica y a que en un tercio de los casos se presenta como una lesión no pigmentada2. Solo una exploración minuciosa, unida a un elevado índice de sospecha, impedirá el retraso diagnóstico.
Todos estos factores hacen que, a diferencia de otras neoplasias anorrectales, el MA carezca de un esquema terapéutico plenamente definido. El mayor debate se fundamenta en la radicalidad de la resección quirúrgica (amputación abdominoperineal [AAP] vs. resección local [EL]) aunque, según la literatura más reciente, la supervivencia es similar para ambas opciones quirúrgicas3. En cualquier caso, los resultados oncológicos que se obtienen son poco alentadores, con supervivencias medias que no sobrepasan los 15-20 meses4–6 y que no son mejoradas por ninguna de las terapias adyuvantes disponibles (quimiorradioterapia o inmunoterapia) a pesar de que la mayoría de los pacientes afectos de MA fallecerán por metástasis a distancia.
MetodologíaSe ha realizado una revisión de toda la literatura existente utilizando para ello las bases de datos MEDLINE, Pubmed y Ovid hasta el 2012. Se han utilizado como palabras clave: «anorectal melanoma», «anorectal neoplasm», «abdominoperineal resection», «wide local excision», «anal canal», «chemoradiotherapy» y «radical surgery». Se han seleccionado aquellos artículos que, a criterio de los autores, aportaban información científica más concluyente. Según una revisión sistemática muy reciente, hasta agosto de 2012 se habían publicado un total de 2.652 casos de MA, la mayoría recogidos por centros especializados, con periodos de revisión no inferiores a 40 años7.
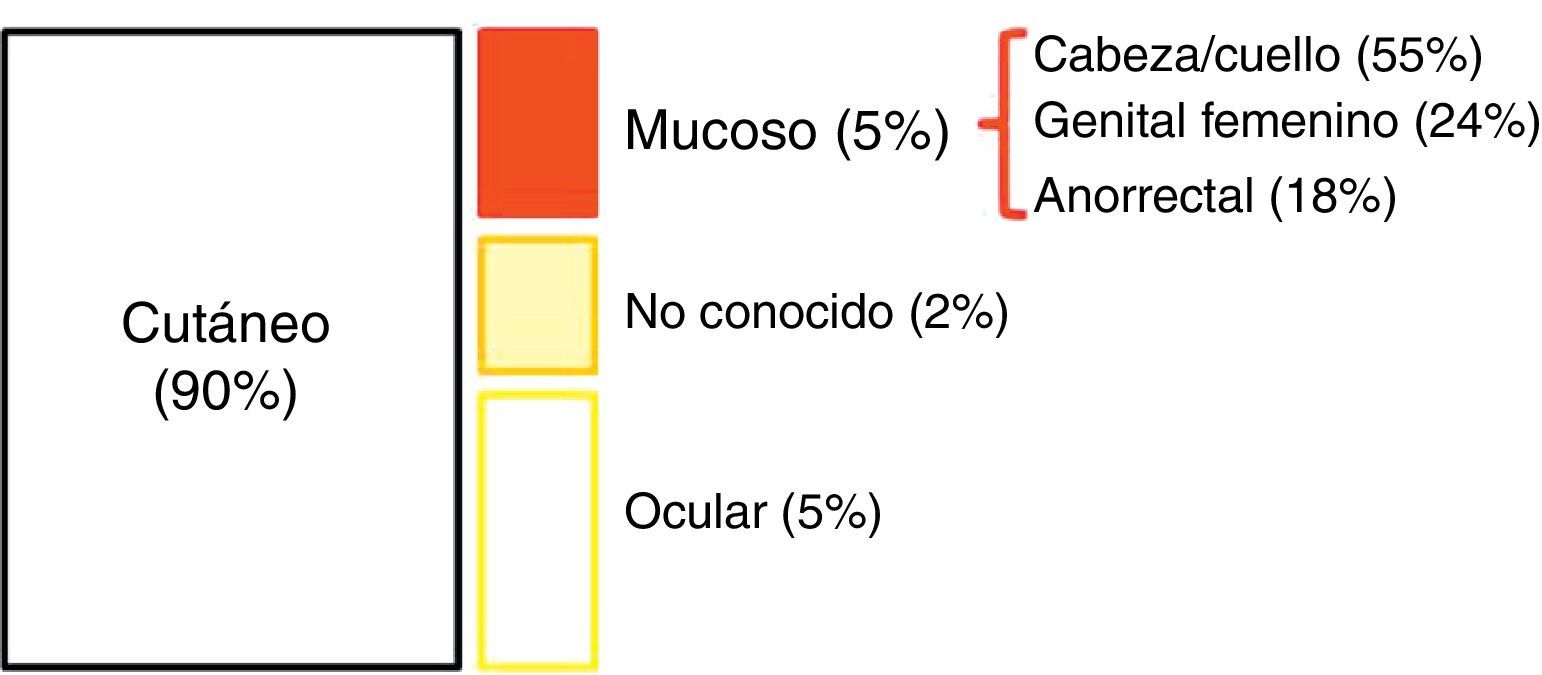
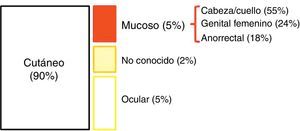
EpidemiologíaLos datos epidemiológicos sobre MA son muy heterogéneos. Su incidencia (que se ha duplicado en los últimos 20 años) ronda, en países occidentales, los 1-2 casos por millón de habitantes2,4; además, el MA representa algo menos del 1% (0,1-4,6%) de las neoplasias malignas anorrectales y va a suponer aproximadamente el 1-2% de todos los melanomas2,7–9. El 90% de los melanomas asientan en la piel; el 10% restante se reparte entre el melanoma ocular (5%), el melanoma de origen desconocido (2%) y el melanoma que asienta en mucosas (3%). Dentro de este último, el MA representa la tercera localización más frecuente, tras cabeza/cuello y aparato genital femenino4 (fig. 1). Sin embargo, entre los melanomas primarios que asientan en el tracto gastrointestinal, la localización anorrectal es la más frecuente10.
El MA es algo más frecuente en mujeres, en proporción 1,5:12,7,9, si bien algunos autores afirman que este pequeño incremento es la expresión de que las exploraciones perineales son más habituales en el sexo femenino9. Esta enfermedad afecta generalmente a enfermos añosos, presentando un pico de incidencia en la 8.ª década de la vida (50% de los pacientes), a diferencia del melanoma cutáneo (MC), en el que solo el 25% de los pacientes son mayores de 70 años2,7,9. No obstante, se han descrito casos de MA en pacientes de 11 y 19 años11, e incluso un estudio institucional americano, basado en la National Cancer Institute's Surveillance, Epidemiology and End Results (SEER), encuentra un incremento de la incidencia de MA en jóvenes varones homosexuales (entre 25 y 44 años), por lo que se apunta hacia una evidencia indirecta que asocie MA e infección de HIV12.
Etiopatogenia, factores de riesgo e histología. Similitudes y diferencias con el melanoma cutáneoLa etiopatogenia y factores de riesgo del MA son poco conocidos pero se intuyen ciertas diferencias con respecto a los melanomas ocular y cutáneo, hecho que podría tener implicaciones significativas desde el punto de vista terapéutico7. De hecho, factores epidemiológicos (el MC es casi 20 veces más frecuente en la raza caucásica que en la afroamericana, mientras que el MA es solo 2 veces más frecuente en blancos) sugieren que determinados componentes de riesgo ambientales (por ejemplo, radiación ultravioleta) asociados de forma clara al MC no están implicados en el desarrollo de los melanomas mucosos en general ni del anorrectal en particular7,9.
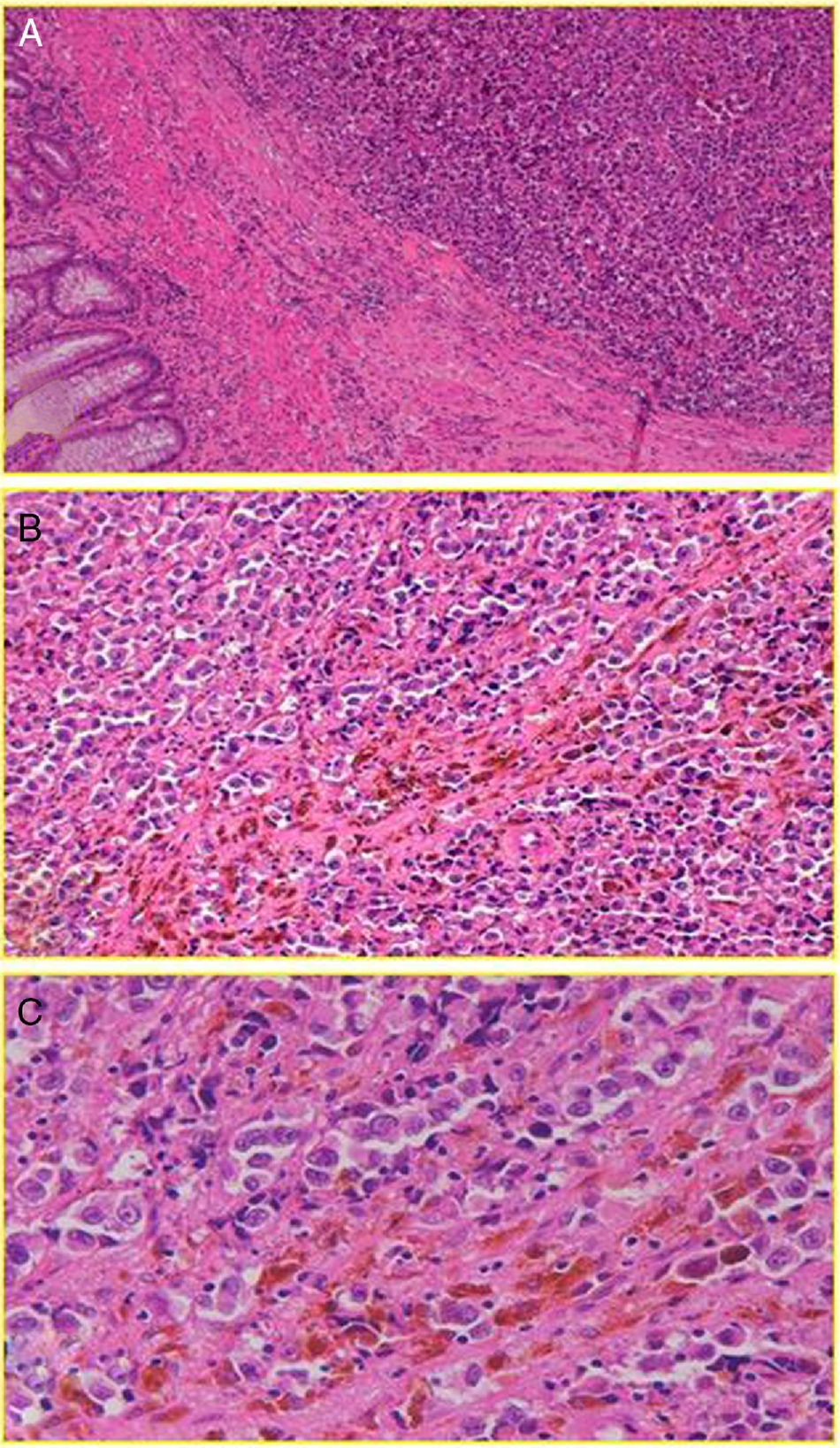
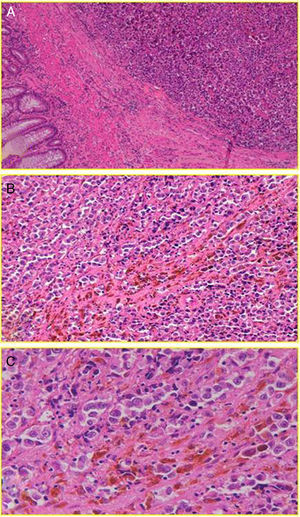
Con respecto a la histología, podríamos afirmar que esta no parece idéntica a la del MC, si bien el MA tiene también su origen en la transformación maligna de los melanocitos, en este caso, del canal anal. Estos se organizan en nichos tumorales que pueden ser epitelioides (44%), mixtos (31%) o espiculados (25%)13. Posteriormente, estas células invaden el plano escamoso, expresando una serie de proteínas inmunoespecíficas para el melanoma como las HMB-45, S-100 y vimentina2,8 (fig. 2). Pero en contraste con el MC, un número desproporcionadamente alto (hasta el 87% [10-87%] según la mayoría de las series) de MA van a ser «amelanóticos»2,7. No sabemos a ciencia cierta si esta característica va a tener o no implicaciones en el pronóstico de la enfermedad (más allá de una obvia disminución del índice de sospecha), si bien hay estudios que muestran resultados de supervivencia comparables para ambos tipos de lesiones14. Quizá lo más relevante sea hacer hincapié en el hecho de que ni todas las lesiones pigmentadas del canal anal son melanomas malignos, ni todos los melanomas malignos están pigmentados.
A nivel molecular (concretamente en la expresión de la mutación del gen BRAF) también existen diferencias entre el MC y el MA. Esto hace pensar en una etiopatogenia molecular distinta para cada una de estas entidades, hecho que tendría importantes implicaciones diagnósticas y terapéuticas, en especial ante una posible terapia génica15.
ClínicaEl MA va a presentar una sintomatología perfectamente atribuible a entidades anorrectales benignas y mucho más comunes: la rectorragia es el síntoma más frecuente, presente en el 53-96% de los pacientes, seguida por la presencia de un nódulo o sensación de masa, tenesmo y, de forma más esporádica, prurito, cambio del hábito intestinal o proctalgia2,7,8,10. Este cortejo sintomático, de apariencia banal, se prolongará una media de 3-8 meses hasta el diagnóstico definitivo y conlleva una tasa de errores diagnósticos próxima al 55%7. Según algunas series, la confusión del MA con la enfermedad hemorroidal tiene, de forma estadísticamente significativa, un impacto negativo en las cifras de supervivencia6,7,16.
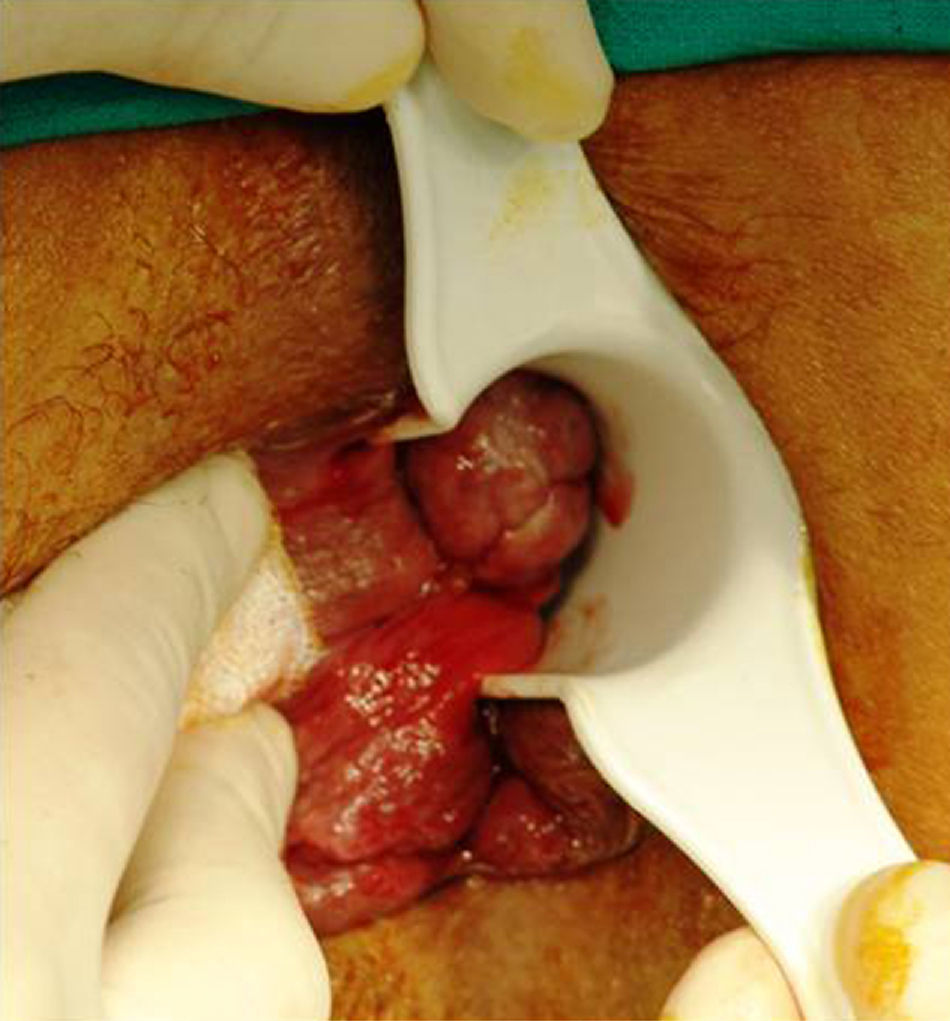
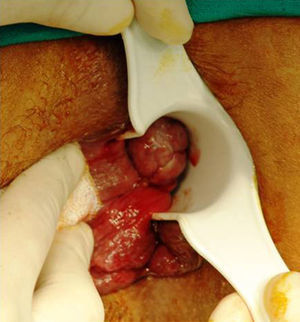
Anatómicamente, la mayoría de los melanomas anorrectales se localizan en el canal anal o en la línea pectínea. Solo un 2-5% asientan exclusivamente en mucosa rectal7. Suelen ser tumores (pigmentados o no) de 2,9-3,8cm de diámetro6, de aspecto ulcerado, plano o polipoide (fig. 3). Una lesión pigmentada y polipoidea puede ser confundida con facilidad con una hemorroide trombosada. De hecho, en una amplia revisión del Memorial Sloan-Kettering Cancer Center (MSKCC), el 8% de los diagnósticos de MA se realizó tras el estudio anatomopatológico de piezas de hemorroidectomía, por lo que se recomienda, de forma sistemática, analizar todas las piezas resecadas y enviarlas al patólogo identificadas topográficamente10,17.
Diagnóstico y estudio de extensiónLa anuscopia y exploración anal minuciosas (acompañadas de un buen índice de sospecha) son fundamentales para determinar el tamaño, localización y características (fijación, pigmentación, profundidad…) de la lesión. Algunos autores desaconsejan la biopsia aislada ya que se trata de una lesión muy vascularizada, con alta probabilidad de falsos negativos, e incluso de diseminación iatrogénica18.
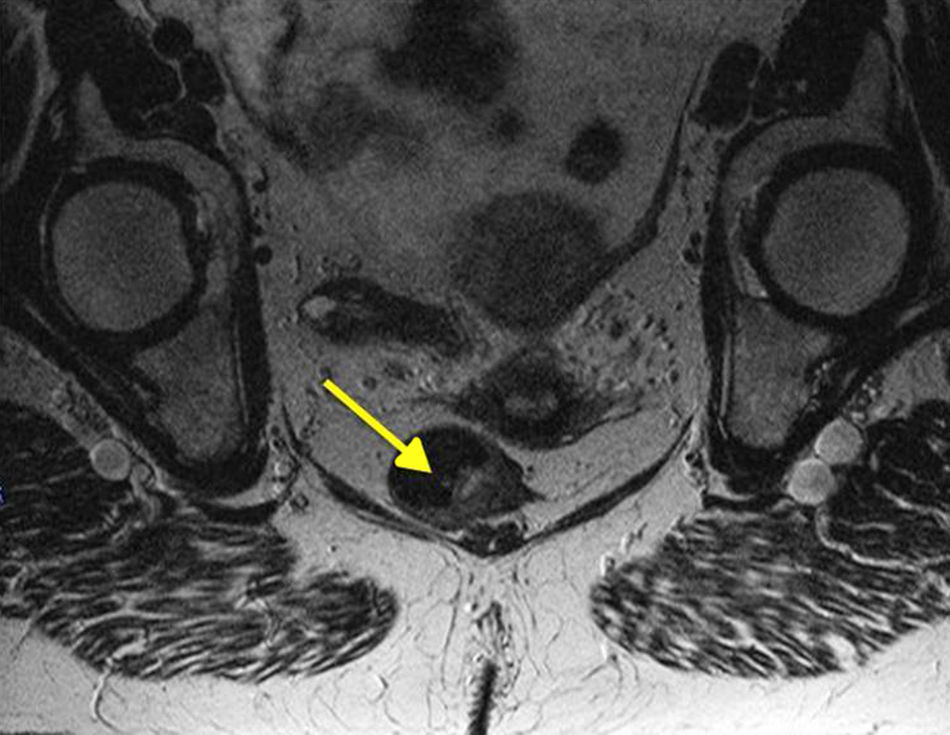
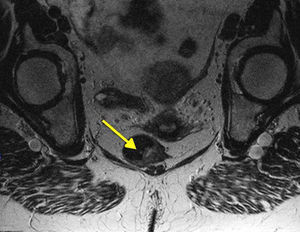
Por otra parte, casi el 20% de los MA van a presentar adenopatías inguinales positivas y el 7-25% empezarán con metástasis a distancia (generalmente ósea, pulmonar, hepática o cerebral). Esto hace que sea importante tanto la exploración y estudio de la región inguinal como la realización de pruebas de imagen avanzadas (RM pélvica [fig. 4], TC y ecografía endoanal) que nos ayuden a tomar decisiones terapéuticas, aunque la utilidad clínica de estas exploraciones, específicamente para el MA, no ha sido suficientemente documentada2,7,8. El PET-scan presenta una baja sensibilidad, por lo que la mayoría de los autores no recomiendan su realización de forma sistemática, reservándolo para lesiones dudosas tras la TC19.
Un aspecto controvertido es el grosor de la lesión que, según algunos autores, está relacionado con la diseminación linfática, la recurrencia local tras cirugía y los resultados oncológicos, aportándose cifras de supervivencias de 33 meses para tumores<4mm de grosor, frente a 8 meses para los>4mm18,20. No obstante, la literatura es especialmente heterogénea al abordar esta cuestión, utilizando clasificaciones referidas al MC, algunas ya obsoletas (como la de Clark), otras más recientes (Breslow) o no aportando ningún dato sobre el grosor de la lesión, lo que ocurre, según una revisión sistemática reciente, en más de la mitad de las publicaciones10. Por otra parte, y dado que, a diferencia del MC, la mayoría de los MA presentan en el momento del diagnóstico un grosor ≥ 4 mm6,13,17,20, el valor clínico y pronóstico de este parámetro es discutible, por lo que la clasificación del American Joint Committee on Cancer para el MC no es aplicable al MA, sin que exista en la actualidad un sistema validado para la estadificación de los melanomas anorrectales, si bien algunos autores simplifican su clasificación en los 3 estadios clásicos (i: localizado; ii: diseminado a ganglios linfáticos y iii: metástasis a distancia)2,21. Según algunos estudios, en el MA, y a diferencia de lo que ocurre con el MC, será la profundidad de la invasión tumoral, y no el grosor de la lesión, lo que determine la probabilidad de diseminación linfática o a distancia17,21 y por ello, una revisión sistemática muy reciente propone un nuevo sistema que amplía a 4 estos 3 estadios, considerando estadio i si el tumor no infiltra la muscular propia y ii si esta aparece infiltrada en el estudio endosonográfico7 (tabla 1).
TratamientoEl tumor: amputación abdominoperineal o resección localEl tratamiento quirúrgico clásico del MA, la amputación abdominoperineal, nunca ha sido validado de forma prospectiva. De hecho, la elevada morbilidad asociada a este procedimiento y la «percepción» de que con una cirugía radical no se obtenían ventajas apreciables en la supervivencia, hizo que se cuestionase (actualmente de forma bastante documentada) los beneficios de la AAP como opción inicial de tratamiento en el MA. La primera publicación al respecto data de 1982. En ella, Cooper et al.22, tras analizar a 227 pacientes, encontraban supervivencias similares para cirugía radical o EL. Desde entonces, ha habido múltiples series, revisiones generales4–6,8,21 y algunas revisiones sistemáticas3,10 que aportan conclusiones similares, si bien no existe hasta la fecha ningún ensayo aleatorizado y controlado que las demuestre de forma fehaciente. Un estudio publicado en 201023, realizado a partir de la SEER americana y que analiza los resultados de 143 pacientes (51 AAP vs. 92 EL), concluye que, en el tratamiento quirúrgico del MA, la supervivencia no se correlaciona con la radicalidad de la intervención quirúrgica. Igualmente, Nilsson et al.4 analizan 251 pacientes (66 AAP vs. 86 EL) diagnosticados de MA y recogidos en el registro sueco de tumores, obteniendo una supervivencia media de 14 meses, sin diferencia estadística para ambos grupos. A iguales conclusiones llegan las series más extensas5,6 y algunas revisiones generales2,8. Se han publicado además 2 revisiones sistemáticas que corroboran estas afirmaciones. Droesch et al., tras revisar solo las series que aportaban datos sobre supervivencia (14 estudios en total, en 30 años de revisión), no objetivan diferencias entre cirugía radical y local en ninguno de los estadios tumorales3. Una muy reciente, publicada en 2012 por Kanaan et al., analiza 21 publicaciones, con casi 700 pacientes incluidos, obteniendo una supervivencia media similar para la AAP y la EL (21 y 20 meses, respectivamente)10. Debemos reseñar, no obstante, que hay series, como la realizada en MSKCC, que obtienen una mayor supervivencia para los pacientes sometidos a cirugía radical, si bien este hecho no se corrobora con una actualización de los resultados de la misma institución2,17.
Otro tema es la recurrencia local. Es un tema importante, puesto que la aparición de una recurrencia local (y sus síntomas: dolor, rectorragia, incontinencia…) va a tener un gran impacto en la calidad de vida de estos pacientes, hecho de cierta relevancia, especialmente ante expectativas de supervivencia muy cortas20. En muchos estudios no se aportan datos sobre recurrencia local aislada y, en general, la literatura aporta resultados más dispares que en los referidos al tema de la supervivencia. Existen bastantes publicaciones con cifras de recurrencia local significativamente menores tras AAP3,6,17,20,24, si bien otros autores obtienen tasas que son independientes del tipo de cirugía realizado4,21,25. Estas discrepancias se eliminan si consideramos exclusivamente a aquellos pacientes en los que fue posible una resección R0. En un estudio institucional sueco, se consideró R0 la obtención de un margen de resección mayor o igual de 1cm, demostrándose que, en estos pacientes, las tasas de recurrencia local tras AAP o EL no difieren de forma significativa. Obviamente, la AAP obtiene un mayor número de resecciones R0, pero, si es posible realizar un EL con margen suficiente, las tasas de recurrencia local y la supervivencia son similares en ambas técnicas4.
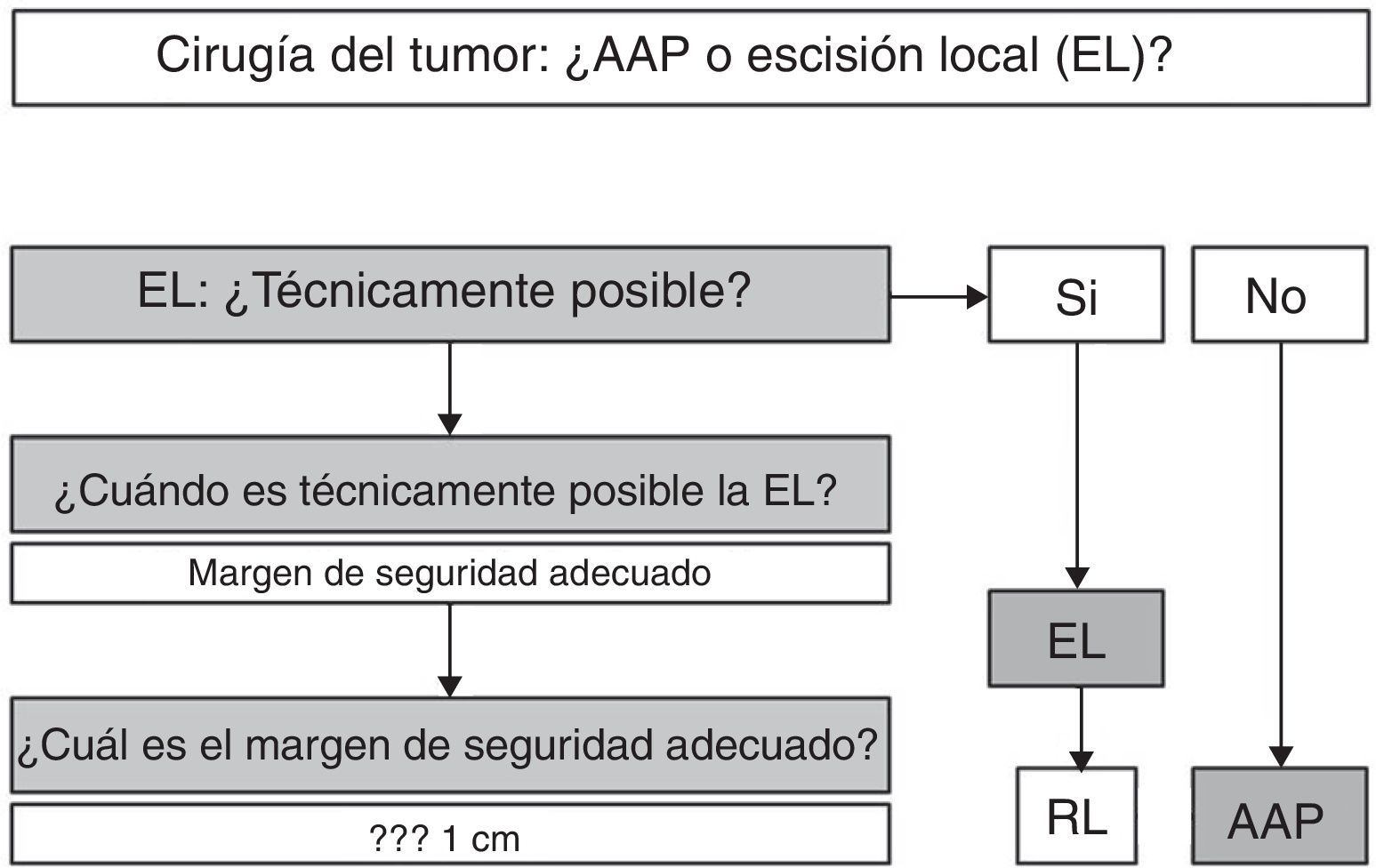
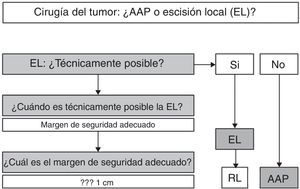
En resumen (fig. 5), y dado que en el MA la supervivencia libre de enfermedad va a estar relacionada más con la aparición de metástasis a distancia que con el control local de la enfermedad, podemos afirmar que, según la evidencia científica disponible, en el MA la cirugía radical no ofrece ninguna mejora en la supervivencia, por lo que la AAP debe reservarse solo para aquellos pacientes en los que la EL no sea técnicamente posible2,3,7,8,10. La EL será técnicamente posible si nos permite obtener una resección R0, es decir, un margen de resección adecuado4. En este sentido, algunos autores aportan pautas en las que el margen depende de la profundidad de invasión del melanoma, aconsejando EL y margen de 1cm en lesiones menores de 1mm de grosor, EL y margen de 2cm para lesiones de 1-4mm y AAP para los MA con un grosor mayor de 4 mm20. Sin embargo, el hecho de que la mayoría de los MA presenten en el momento del diagnóstico un grosor>4mm (17 de 19 en el estudio antes mencionado) y que un alto porcentaje de pacientes presenten inicialmente metástasis ganglionares y a distancia hace que la decisión deba ser individualizada, si bien la mayoría de los autores consideran una resección R0 si el margen de resección es>10 mm4,21. En caso de recidiva local tras EL, y en ausencia de enfermedad a distancia, se podría optar, de entrada, por una AAP2,6.
En cualquier caso, la decisión debe ser individualizada. Hemos de tener claro que una actitud agresiva no mejora la supervivencia, por lo que la EL debe ser primera opción, siempre y cuando las características del tumor (tamaño, infiltración del aparato esfinteriano…) la hagan técnicamente factible. Es aconsejable, pero no imperativa, la obtención de una resección R0.
Una situación especial sería el escaso número de pacientes (11-18%) en los que el tumor está limitado a la submucosa y no presentan afectación ganglionar según el estudio de extensión (estadio i, según la clasificación propuesta [tabla 1]). En estos casos, según una reciente revisión sistemática, podría indicarse una cirugía radical dado que se trata de los pacientes que, a priori, presentarían menores tasas de diseminación y un pronóstico más favorable7.
Los ganglios linfáticos: el papel de la linfadenectomíaEs importante matizar que la «típica» diseminación linfática del MA es desconocida, existiendo la posibilidad de una propagación a ganglios ilíacos profundos, mesorrectales o presacros. Tampoco hay evidencia de que la realización de una linfadenectomía (inguinal, mesorrectal o pélvica) conlleve unas mejora en la supervivencia13. Una serie retrospectiva muy reciente del MSKC de Nueva York26 concluye que los resultados oncológicos tras la resección quirúrgica no se correlacionan con la presencia o no de metástasis linfáticas.
Por otra parte, las linfadenectomías no están exentas de morbilidad. En el caso concreto de la linfadenectomía inguinal, la aparición de complicaciones como el linfedema puede tener impacto en la calidad de vida de los pacientes. Esto hace que en el MA no esté indicada la realización de una linfadenectomía inguinal de forma sistemática2,9,26. No obstante, pueden existir indicaciones selectivas, si existen nódulos inguinales palpables y no hay evidencia de afectación a distancia o en otras cadenas ganglionares9. Una opción es la detección y disección del ganglio centinela pero esta técnica, aunque puede constituir un prometedor avance en la individualización del tratamiento del MA, no presenta en la actualidad el aval científico suficiente7,27.
Adyuvancia: inmunoterapia y quimiorradioterapiaEl melanoma muestra una mayor inmunosusceptibilidad que los tumores de otra estirpe y, por ello, ha sido objeto de una gran variedad de ensayos basados en inmunoterapia, con algunos resultados esperanzadores, especialmente en el MC avanzado. Sin embargo, en el caso concreto del MA el uso de la inmunoterapia (interferón, interleucinas, vacunas…), no va más allá de la terapia experimental2,9.
El MA no responde a quimioterapia. El fármaco más utilizado, la dacarbazina (o su análogo en administración oral, la temozolomida) ha mostrado, tanto en régimen de monoterapia como en combinación con otros fármacos, respuestas que rondan escasamente el 20%9. La llamada bioquimioterapia (combinación de un agente biológico con un quimioterápico convencional) ha demostrado cierta utilidad en el MC metastásico27. Su aplicación al MA, también con diseminación a distancia, mostró en la serie publicada por Kim et al. unos resultados aceptables: 11% respuesta completa, 44% de respuesta favorable e incremento de 3 meses en la mediana de supervivencia28.
La utilización de RT en el tratamiento del MA es muy controvertida. Si bien el melanoma ha sido históricamente un tumor radiorresistente, algunos estudios recientes ponen en duda esta atribución. En el caso concreto del MA, un estudio de la MD Anderson publicado en octubre de 201129 obtuvo una tasa de recurrencia local del 17% con la combinación de resección local seguida de RT hipofraccionada (25-36Gy en 5-6 fracciones) frente a las tasas de recurrencia del 50% que, según la mayoría de las series, obtiene la EL como único tratamiento. Sin embargo, debemos resaltar que, en esta serie, las mejoras en el control local de la enfermedad no se correspondieron con un incremento en la supervivencia, debido, como ya hemos dicho, a que es la enfermedad sistémica la que constituye el patrón de recurrencia predominante para esta enfermedad. Por otra parte, sí está establecido el papel de la RT como terapia paliativa para el 40-50% de pacientes con enfermedad irresecable, recurrente o diseminada, que desarrollan sintomatología acompañante, tipo dolor óseo, compresión medular, hemorragia tumoral o disfunción del SNC9.
Factores pronósticosLos datos de los que disponemos son bastante heterogéneos. Se han implicado factores como el tamaño, la duración de los síntomas, el grosor (en escalas utilizadas en el MC) o determinados marcadores moleculares. No hay nada claro al respecto5. De hecho, no hay unanimidad en que la presencia de metástasis ganglionares tenga implicaciones en el pronóstico del MA13 si bien muchos autores consideran este hecho un indicador muy negativo, especialmente si las adenopatías son mesentéricas17, con más impacto incluso que el demostrado para el MC4,29.
No obstante, hay algunos factores claramente implicados. Uno de ellos es la invasión de la submucosa, que no está en absoluto relacionada con el «grosor» de la lesión y que, como sabemos, permite el acceso a los canales linfovasculares y facilita la diseminación del tumor. Por ello, algunos autores opinan que, al igual que ocurre con el adenocarcinoma30 y a diferencia del MC, será la profundidad de la invasión tumoral, y no el grosor de la lesión, lo que determine la probabilidad de diseminación linfática o a distancia y, por ende, la supervivencia de los pacientes afectos de MA7,21. Otro factor muy relacionado con el pronóstico es la invasión perineural del tumor primario, asociada, en algunos estudios, con un 100% de recurrencia, frente a tasas del 67% si esta particularidad estaba ausente9,26.
Resultados oncológicosComo hemos visto, el MA es una enfermedad altamente letal. Las cifras son desalentadoras: 80% de recurrencias tras cirugía «curativa», 12-15% de supervivencia a los 5 años y 17-21 meses de supervivencia media (30 meses para estadio i y de 22 meses para estadio ii)2,3,10.
ConclusiónEl MA es una entidad infrecuente y con ciertas diferencias con el MC. Su clínica es muy inespecífica, por lo que se requiere un alto índice de sospecha para evitar un retraso diagnóstico. La cirugía radical no ofrece ninguna mejora en la supervivencia, por lo que la AAP debe reservarse exclusivamente para aquellos pacientes en los que la EL no sea factible. La linfadenectomía inguinal no está indicada de forma sistemática y debe valorarse de forma individualizada. La adyuvancia no es efectiva. El uso de RT es controvertido y, actualmente, se indica bien como terapia hipofraccionada tras EL, bien como tratamiento paliativo. En cualquier caso, los resultados oncológicos son desalentadores.
Conflicto de interesesNo hay conflictos de intereses por parte de ninguno de los autores.