El objetivo del presente estudio es describir las características clínicas y el manejo de los pacientes tratados en nuestra institución por metástasis GI de cáncer pulmonar primario; así como realizar una revisión sistemática de casos reportados en la literatura.
Se realizó un análisis retrospectivo de una base de datos prospectiva y revisión sistemática de la literatura utilizando las normas MOOSE (Meta-analysis Of Observational Studies in Epidemiology).
Se incluyeron 91 pacientes, 5 de la base de datos de nuestra institución y 86 de la base de datos PubMed usando las palabras claves «intestinal metastasis» y «lung cancer». La mediana de tiempo entre el diagnóstico de cáncer pulmonar y el diagnóstico de metástasis GI fue 2 meses, la mediana de supervivencia global fue 4 meses.
Este grupo de pacientes presentan mal pronóstico. El tratamiento estándar no se encuentra bien establecido. Ninguno de los tratamientos descritos ha mostrado tener impacto significativo sobre la supervivencia.
Aim of the present study is to report clinical characteristics and outcomes of patients treated in authors’ hospital for GI metastasis from primary lung cancer, and to report and analyse the same data concerning patients retrieved from a systematic literature review.
We performed a retrospective analysis of prospectively collected data, and a systematic review using the Meta-analysis Of Observational Studies in Epidemiology (MOOSE) guidelines.
Ninety-one patients were included, 5 patients from the authors’ hospital and 86 through PubMed database using the keywords “intestinal metastasis” AND “lung cancer”. The median time between primary lung cancer diagnosis and GI metastasis diagnosis was 2 months and the median overall survival was 4 months.
This group of patients present a poor prognosis and the gold standard treatment is not defined. None of the reported treatments had a significant impact on survival.
El cáncer de pulmón es la neoplasia con la tasa de mortalidad por cáncer más alta registrada, variando entre el 18 y el 23%1,2. A pesar de los avances en cuanto a prevención, se ha informado que aproximadamente el 50% de los casos presentan metástasis al momento del diagnóstico3. Sin embargo, gracias a nuevas tecnologías en el diagnóstico y tratamiento, la supervivencia de los pacientes ha aumentado en los últimos años, facilitando el desarrollo de metástasis a largo plazo4.
Diferentes estudios han reportado que las metástasis gastrointestinales (GI) de cáncer pulmonar primario son infrecuentes, cuya incidencia varía entre el 0,3 y el 1,7%5. Por otro lado, los estudios post mortem han estimado que la incidencia de este tipo de lesiones metastásicas varían del 4,6 al 14%5,6. Esta discrepancia entre la incidencia estimada en los estudios de casos clínicos y las autopsias parece indicar que, en la mayoría de los casos, existen metástasis asintomáticas no diagnosticadas3.
A pesar del aumento de publicaciones al respecto, aún no hay consenso sobre el manejo de estos pacientes debido a la alta mortalidad asociada7. Se cree que las metástasis GI representa un factor pronóstico que ocurre de manera tardía en el curso del cáncer de pulmón3. La dificultad de su detección hace aún más complejo el poder desarrollar estudios prospectivos. Por otra parte, la escasa literatura existente, limitada principalmente a reporte de casos y estudios retrospectivos8, no permite contar hoy en día con los datos diagnósticos y terapéuticos adecuados que permitan mejorar el pronóstico de los pacientes.
El objetivo del presente estudio es reportar las características clínicas y los resultados de los pacientes tratados en nuestro centro por metástasis GI de cáncer pulmonar primario, así como realizar una revisión sistemática de los datos encontrados en la literatura.
Métodosese realizó un análisis retrospectivo de datos recogidos prospectivamente en pacientes con metástasis GI de cáncer pulmonar primario, tratados en el Hospital de la Santa Creu i Sant Pau entre 2012 y 2017. Todos los pacientes ingresados en dicho centro firmaron un consentimiento informado autorizando el uso de sus datos clínicos con fines educativos.
Obtuvimos también la aprobación de la junta de Revisión Institucional.
Al mismo tiempo, se realizó una revisión sistemática de la literatura de acuerdo con las normas para la realización de Meta-analysis Of Observational Studies in Epidemiology (MOOSE)9. Incluye solo artículos sobre la metástasis GI del cáncer pulmonar primario.
Estrategia de búsquedaLa revisión se llevó a cabo en la base de datos PubMed con las palabras clave: «intestinal metastasis» y «lung cancer». La búsqueda permitió identificar 414 artículos publicados, que datan de enero de 2000 a agosto de 2017.
Los criterios de inclusión utilizados fueron: 1) diagnóstico de metástasis GI de cáncer pulmonar primario; 2) atículos escritos en inglés o español, y 3) estudios que incluían solo a pacientes adultos.
Los estudios fueron excluidos en caso de: 1) involucrar animales, y 2) ser revisiones sistemáticas, metaanálisis, documentos de imágenes, documentos de comentarios o correspondencia.
Los datos recogidos fueron: edad, sexo, condición de fumador, localización de la neoplasia pulmonar, TNM, subtipo histológico, intervalo entre el diagnóstico de cáncer de pulmón y diagnóstico de metástasis intestinal, forma de presentación clínica, pruebas diagnósticas empleadas, localización de la metástasis GI, presencia de metástasis extraintestinales, tratamiento y tiempo de supervivencia.
La búsqueda, la extracción de los datos y el análisis de la calidad de los artículos fueron realizados por dos autores de manera independiente (A.B. y J.S.).
Análisis estadísticoLos datos cuantitativos se presentan como media ± desviación estándar y porcentajes. El análisis de supervivencia se realizó mediante el método de Kaplan-Meier. El análisis de los subgrupos se realizó estratificando a los pacientes según edad, sexo, hábito de fumar, estadio tumoral, estadio ganglionar, subtipo histológico, diagnóstico sincrónico vs. metacrónico, presentación clínica, localización de las metástasis y presencia de metástasis extraintestinales. Se consideró la significancia estadística cuando el valor de p fue menor a 0.05. Los cálculos se llevaron a cabo con el software SPSS 22.0 (SPSS Inc., Chicago, IL, EE. UU.).
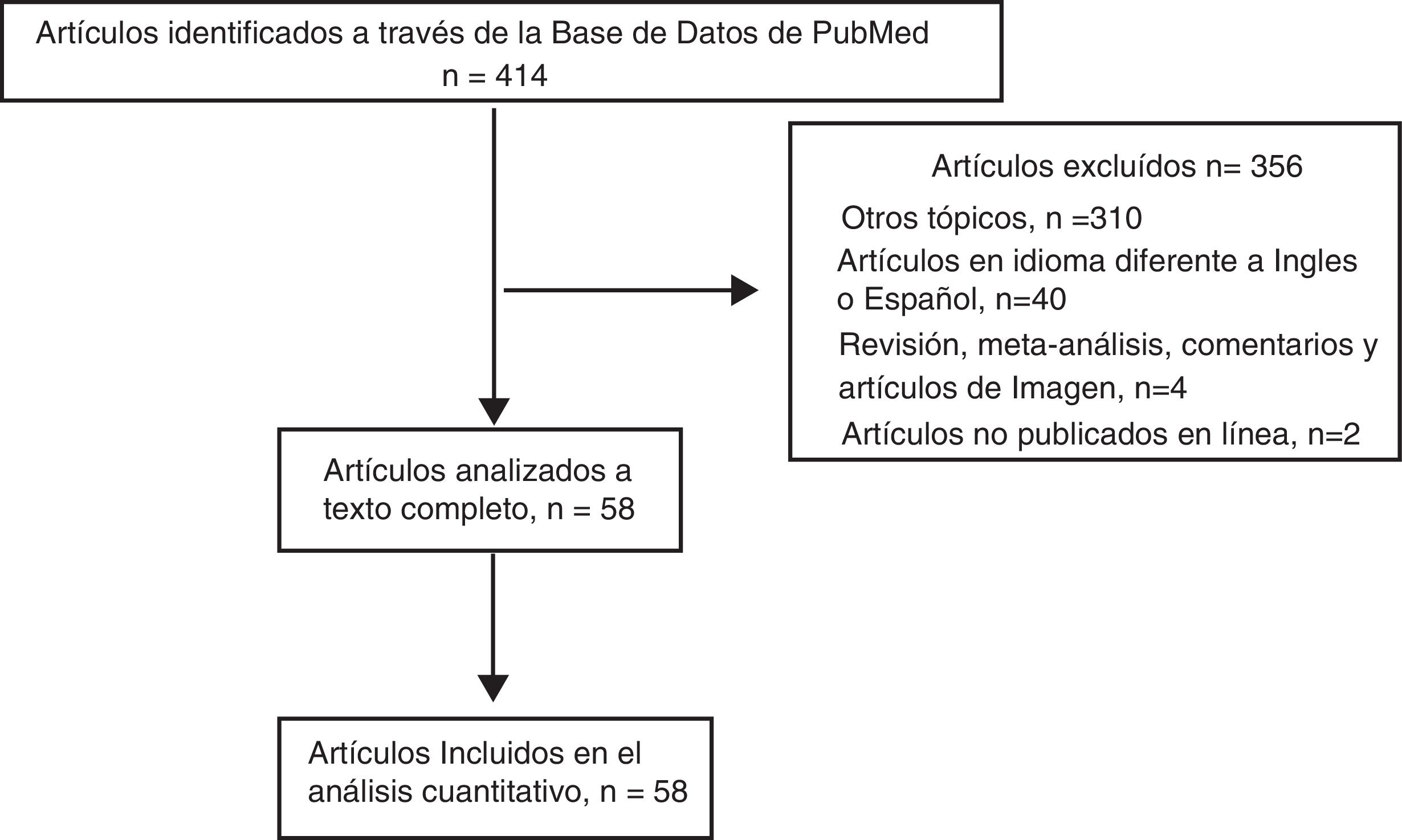
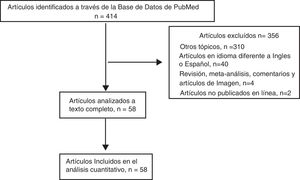
ResultadosDe los 414 documentos identificados en la búsqueda, 356 se excluyeron porque no cumplían los criterios de inclusión (fig. 1). Los otros 58 estudios, publicados entre marzo de 2001 y agosto de 2016, se analizaron a texto completo y se incluyeron en el análisis cuantitativo, como se muestra en el diagrama de flujo (fig. 1)10-67. Los artículos incluidos fueron análisis retrospectivos, cartas al editor o informes de casos10-67.
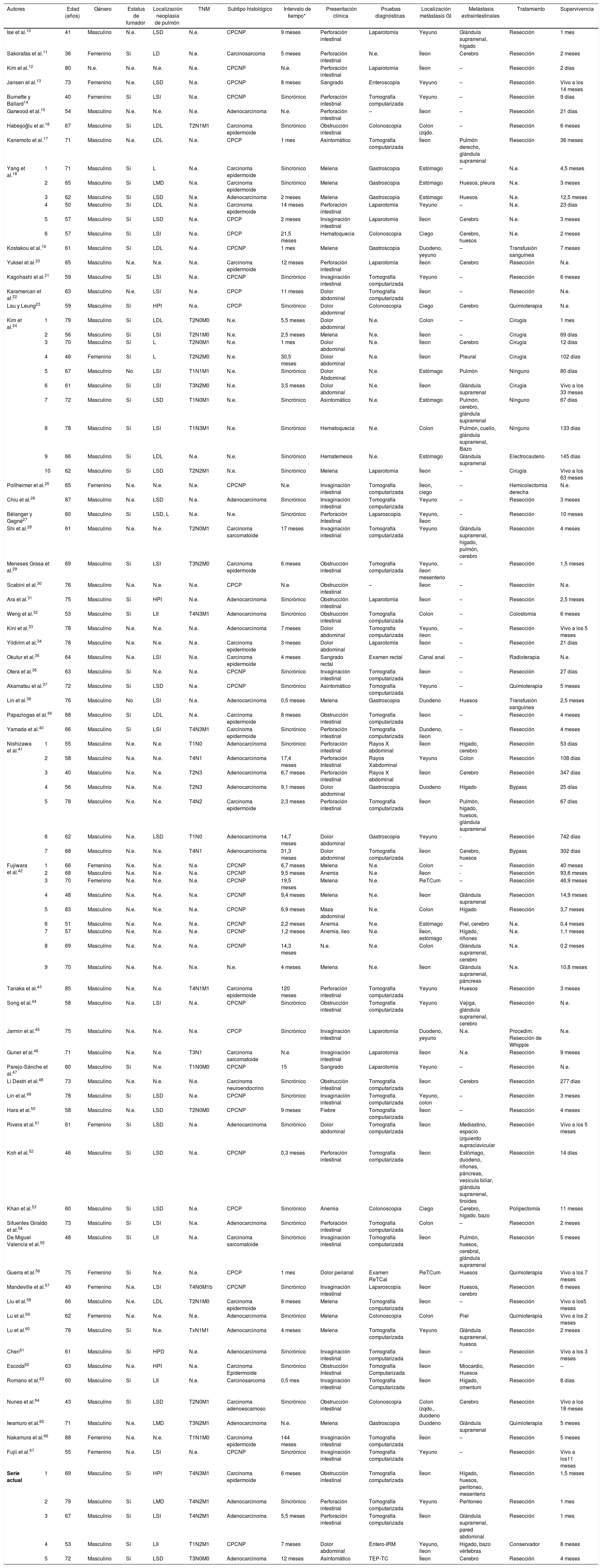
Las características de los pacientes se detallan en la tabla 1. Se reclutó a un total de 91 pacientes en esta revisión (86 provenientes de la literatura y 5 de la serie de los autores), 77 varones (83,7%), 13 mujeres (14,1%) y un paciente de género no especificado. La edad promedio fue de 64,34 ± 11,08 años (rango 41-88)10-67.
Características de los pacientes
| Autores | Edad (años) | Género | Estatus de fumador | Localización neoplasia de pulmón | TNM | Subtipo histológico | Intervalo de tiempo* | Presentación clínica | Pruebas diagnósticas | Localización metástasis GI | Metástasis extraintestinales | Tratamiento | Supervivencia | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ise et al.10 | 41 | Masculino | N.e. | LSD | N.e. | CPCNP | 9 meses | Perforación intestinal | Laparotomía | Yeyuno | Glándula suprarrenal, hígado | Resección | 1 mes | |
| Sakorafas et al.11 | 36 | Femenino | Si | LD | N.e. | Carcinosarcoma | 5 meses | Perforación intestinal | N.e. | Íleon | Cerebro | Resección | 2 meses | |
| Kim et al.12 | 80 | N.e. | N.e. | N.e. | N.e. | CPCNP | N.e. | Perforación intestinal | Laparotomía | Íleon | – | Resección | 2 días | |
| Jansen et al.13 | 73 | Femenino | N.e. | LSD | N.e. | CPCNP | 8 meses | Sangrado | Enteroscopia | Yeyuno | – | Resección | Vivo a los 14 meses | |
| Burnette y Ballard14 | 40 | Femenino | Sí | LSI | N.e. | CPCNP | Sincrónico | Perforación intestinal | Tomografía computarizada | Yeyuno | – | Resección | 9 días | |
| Garwood et al.15 | 54 | Masculino | N.e. | N.e. | N.e. | Adenocarcinoma | N.e. | Perforación intestinal | – | Íleon | – | Resección | 21 días | |
| Habeşoğlu et al.16 | 67 | Masculino | Sí | LDL | T2N1M1 | Carcinoma epidermoide | Sincrónico | Obstrucción intestinal | Colonoscopia | Colon izqdo. | – | Resección | 6 meses | |
| Kanemoto et al.17 | 71 | Masculino | N.e. | LDL | N.e. | CPCP | 1 mes | Asintomático | Tomografía computarizada | Íleon | Pulmón derecho, glándula suprarrenal | Resección | 36 meses | |
| Yang et al.18 | 1 | 71 | Masculino | Sí | L | N.e. | Carcinoma epidermoide | Sincrónico | Melena | Gastroscopia | Estómago | – | N.e. | 4,5 meses |
| 2 | 65 | Masculino | Si | LMD | N.e. | Carcinoma epidermoide | Sincrónico | Melena | Gastroscopia | Estómago | Huesos, pleura | N.e. | 3 meses | |
| 3 | 62 | Masculino | Sí | LSD | N.e. | Adenocarcinoma | 2 meses | Melena | Gastroscopia | Estómago | Huesos | N.e. | 12,5 meses | |
| 4 | 50 | Masculino | Sí | LDL | N.e. | Carcinoma epidermoide | 14 meses | Perforación intestinal | Laparotomía | Yeyuno | – | N.e. | 23 días | |
| 5 | 57 | Masculino | Sí | LSD | N.e. | CPCP | 2 meses | Invaginación intestinal | Laparotomía | Íleon | Cerebro | N.e. | 3 meses | |
| 6 | 57 | Masculino | Sí | LSI | N.e. | CPCP | 21,5 meses | Hematoquecia | Colonoscopia | Ciego | Cerebro, huesos | N.e. | 2 meses | |
| Kostakou et al.19 | 61 | Masculino | Sí | LDL | N.e. | CPCNP | 1 mes | Melena | Gastroscopia | Duodeno, yeyuno | – | Transfusión sanguínea | 7 meses | |
| Yuksel et al.20 | 65 | Masculino | N.e. | N.e. | N.e. | Carcinoma epidermoide | 12 meses | Perforación intestinal | Laparotomía | Íleon | Cerebro | Resección | N.e. | |
| Kagohashi et al.21 | 59 | Masculino | Sí | LSI | N.e. | CPCNP | Sincrónico | Invaginación intestinal | Tomografía computarizada | Yeyuno | – | Resección | 6 meses | |
| Karamercan et al.22 | 63 | Masculino | N.e. | LSI | N.e. | CPCP | 11 meses | Dolor abdominal | Tomografía computarizada | Íleon | – | Resección | N.e. | |
| Lau y Leung23 | 59 | Masculino | Sí | HPI | N.e. | CPCP | Sincrónico | Dolor abdominal | Colonoscopia | Ciego | Cerebro | Quimioterapia | N.e. | |
| Kim et al.24 | 1 | 79 | Masculino | Sí | LDL | T2N0M0 | N.e. | 5,5 meses | Dolor abdominal | N.e. | Colon | – | Cirugía | 1 mes |
| 2 | 56 | Masculino | Sí | LSI | T2N1M0 | N.e. | 2,5 meses | Melena | N.e. | Íleon | – | Cirugía | 69 días | |
| 3 | 70 | Masculino | Sí | L | T2N0M1 | N.e. | 1 mes | Dolor abdominal | N.e. | Íleon | Cerebro | Cirugía | 12 días | |
| 4 | 46 | Femenino | Sí | L | T2N2M0 | N.e. | 30,5 meses | Dolor abdominal | N.e. | Íleon | Pleural | Cirugía | 102 días | |
| 5 | 67 | Masculino | No | LSI | T1N1M1 | N.e. | Sincrónico | Dolor Abdominal | N.e. | Estómago | Pulmón | Ninguno | 80 días | |
| 6 | 61 | Masculino | Sí | LSI | T3N2M0 | N.e. | 3,5 meses | Dolor abdominal | N.e. | Íleon | Glándula suprarrenal | Cirugía | Vivo a los 33 meses | |
| 7 | 72 | Masculino | Sí | LSD | T1N0M1 | N.e. | Sincrónico | Asintomático | N.e. | Estómago | Pulmón, cerebro, glándula suprarrenal | Ninguno | 67 días | |
| 8 | 78 | Masculino | Sí | LSI | T1N3M1 | N.e. | Sincrónico | Hematoquecia | N.e. | Colon | Pulmón, cuello, glándula suprarrenal, Bazo | Ninguno | 133 días | |
| 9 | 66 | Masculino | Sí | LDL | N.e. | N.e. | Sincrónico | Hematemesis | N.e. | Estómago | Glándula suprarrenal | Electrocauterio | 145 días | |
| 10 | 62 | Masculino | Sí | LSD | T2N2M1 | N.e. | Sincrónico | Melena | Laparotomía | Íleon | – | Cirugía | Vivo a los 63 meses | |
| Pollheimer et al.25 | 65 | Femenino | N.e. | N.e. | N.e. | CPCNP | N.e. | Invaginación intestinal | Tomografía computarizada | Íleon, ciego | – | Hemicolectomía derecha | N.e. | |
| Chiu et al.26 | 87 | Masculino | N.e. | LSD | N.e. | Adenocarcinoma | Sincrónico | Invaginación intestinal | Tomografía computarizada | Yeyuno | – | Resección | 3 meses | |
| Bélanger y Gagné27 | 60 | Masculino | Si | LSD, L | N.e. | N.e. | Sincrónico | Perforación Intestinal | Laparoscopia | Yeyuno, Íleon | – | Resección | 10 meses | |
| Shi et al.28 | 61 | Masculino | N.e. | N.e. | T2N0M1 | Carcinoma sarcomatoide | 17 meses | Invaginación intestinal | Tomografía computarizada | Yeyuno | Glándula suprarrenal, hígado, pulmón, cerebro | Resección | 4 meses | |
| Meneses Grasa et al.29 | 69 | Masculino | Sí | LSI | T3N2M0 | Carcinoma epidermoide | 6 meses | Obstrucción intestinal | Tomografía computarizada | Yeyuno, íleon mesenterio | – | Resección | 1,5 meses | |
| Scabini et al.30 | 76 | Masculino | N.e. | N.e. | N.e. | CPCP | N.e. | Obstrucción intestinal | – | Íleon | – | Resección | N.e. | |
| Ara et al.31 | 75 | Masculino | Sí | HPI | N.e. | Adenocarcinoma | Sincrónico | Obstrucción intestinal | Laparotomía | Íleon | – | Resección | 2,5 meses | |
| Weng et al.32 | 53 | Masculino | Sí | LII | T4N3M1 | Adenocarcinoma | Sincrónico | Obstrucción intestinal | Tomografía computarizada | Colon | – | Colostomía | 6 meses | |
| Kini et al.33 | 78 | Masculino | N.e. | N.e. | N.e. | Adenocarcinoma | 7 meses | Dolor abdominal | Tomografía computarizada | Yeyuno, íleon | – | Resección | Vivo a los 5 meses | |
| Yildirim et al.34 | 78 | Masculino | N.e. | N.e. | N.e. | Carcinoma epidermoide | 3 meses | Dolor abdominal | Laparotomía | Íleon | – | Resección | 21 días | |
| Okutur et al.35 | 64 | Masculino | N.e. | LSI | N.e. | Carcinoma epidermoide | 4 meses | Sangrado rectal | Examen rectal | Canal anal | – | Radioterapia | N.e. | |
| Otera et al.36 | 63 | Masculino | Si | N.e. | N.e. | CPCNP | Sincrónico | Invaginación intestinal | Tomografía computarizada | Íleon | – | Resección | 27 días | |
| Akamatsu et al.37 | 72 | Masculino | Sí | LSD | N.e. | CPCNP | Sincrónico | Asintomático | Tomografía computarizada | Yeyuno | – | Quimioterapia | 5 meses | |
| Lin et al.38 | 76 | Masculino | No | LSI | N.e. | Adenocarcinoma | 0,5 meses | Melena | Gastroscopia | Duodeno | Huesos | Transfusión sanguínea | 2,5 meses | |
| Papaziogas et al.39 | 68 | Masculino | Sí | LDL | N.e. | Carcinoma epidermoide | 8 meses | Obstrucción intestinal | Tomografía computarizada | Íleon | – | Resección | 4 meses | |
| Yamada et al.40 | 66 | Masculino | Sí | LSI | T4N3M1 | Carcinoma epidermoide | Sincrónico | Perforación intestinal | Tomografía computarizada | Duodeno, íleon | – | Resección | 4 meses | |
| Nishizawa et al.41 | 1 | 55 | Masculino | N.e. | N.e. | T1N0 | Adenocarcinoma | Sincrónico | Perforación intestinal | Rayos X abdominal | Íleon | Hígado, cerebro | Resección | 53 días |
| 2 | 58 | Masculino | N.e. | N.e. | T4N1 | Adenocarcinoma | 17,4 meses | Perforación Intestinal | Rayos Xabdominal | Yeyuno | Colon | Resección | 108 días | |
| 3 | 40 | Masculino | N.e. | N.e. | T2N3 | Adenocarcinoma | 6,7 meses | Perforación intestinal | Rayos X abdominal | Íleon | Cerebro | Resección | 347 días | |
| 4 | 56 | Masculino | N.e. | N.e. | T2N3 | Adenocarcinoma | 9,1 meses | Dolor abdominal | Gastroscopia | Duodeno | Hígado | Bypass | 25 días | |
| 5 | 78 | Masculino | N.e. | N.e. | T4N2 | Carcinoma epidermoide | 2,3 meses | Perforación intestinal | Tomografía computarizada | Íleon | Pulmón, hígado, huesos, glándula suprarrenal | Resección | 67 días | |
| 6 | 62 | Masculino | N.e. | LSD | T1N0 | Adenocarcinoma | 14,7 meses | Dolor abdominal | Gastroscopia | Yeyuno | - | Resección | 742 días | |
| 7 | 68 | Masculino | N.e. | N.e. | T4N1 | Adenocarcinoma | 31,3 meses | Dolor abdominal | Tomografía computarizada | Íleon | Cerebro, huesos | Bypass | 302 días | |
| Fujiwara et al.42 | 1 | 66 | Femenino | N.e. | N.e. | N.e. | CPCNP | 6,7 meses | Melena | N.e. | Colon | – | Resección | 40 meses |
| 2 | 68 | Masculino | N.e. | N.e. | N.e. | CPCNP | 9,5 meses | Anemia | N.e. | Íleon | - | Resección | 93,6 meses | |
| 3 | 70 | Femenino | N.e. | N.e. | N.e. | CPCNP | 19,5 meses | Melena | N.e. | ReTCum | – | Resección | 46,9 meses | |
| 4 | 48 | Masculino | N.e. | N.e. | N.e. | CPCNP | 9,4 meses | Melena | N.e. | Íleon | Glándula suprarrenal | Resección | 14,9 meses | |
| 5 | 83 | Masculino | N.e. | N.e. | N.e. | CPCNP | 6,9 meses | Masa abdominal | N.e. | Colon | Hígado | Resección | 3,7 meses | |
| 6 | 51 | Masculino | N.e. | N.e. | N.e. | CPCNP | 2,2 meses | Anemia | N.e. | Estómago | Piel, cerebro | N.e. | 0,4 meses | |
| 7 | 57 | Masculino | N.e. | N.e. | N.e. | CPCNP | 1,2 meses | Anemia, íleo | N.e. | Íleon, estómago | Hígado, riñones | N.e. | 1,1 meses | |
| 8 | 69 | Masculino | N.e. | N.e. | N.e. | CPCNP | 14,3 meses | N.e. | N.e. | Colon | Glándula suprarrenal, cerebro | N.e. | 0.2 meses | |
| 9 | 70 | Masculino | N.e. | N.e. | N.e. | N.e. | 4 meses | Melena | N.e. | Íleon | Glándula suprarrenal, páncreas | N.e. | 10,8 meses | |
| Tanaka et al.43 | 85 | Masculino | N.e. | N.e. | T4N1M1 | Carcinoma epidermoide | 120 meses | Perforación intestinal | Tomografía computarizada | Yeyuno | Huesos | Resección | 3 meses | |
| Song et al.44 | 58 | Masculino | N.e. | LSI | N.e. | CPCNP | Sincrónico | Obstrucción intestinal | Tomografía computarizada | Yeyuno | Vejiga, glándula suprarrenal, cerebro | Resección | N.e. | |
| Jarmin et al.45 | 75 | Masculino | N.e. | N.e. | N.e. | CPCP | Sincrónico | Invaginación intestinal | Laparotomía | Duodeno, yeyuno | N.e. | Procedim. Resección de Whipple | N.e. | |
| Guner et al.46 | 71 | Masculino | N.e. | N.e. | T3N1 | Carcinoma sarcomatoide | N.e. | Invaginación intestinal | Laparotomía | Íleon | N.e. | Resección | 9 meses | |
| Parejo-Sánche et al.47 | 60 | Masculino | Sí | N.e. | T1N0M0 | CPCNP | 15 | Sangrado | Laparotomía | Yeyuno | – | Resección | N.e. | |
| Li Destri et al.48 | 73 | Masculino | N.e. | N.e. | N.e. | Carcinoma neuroendocrino | Sincrónico | Obstrucción intestinal | Tomografía computarizada | Íleon | Cerebro | Resección | 277 días | |
| Lin et al.49 | 78 | Masculino | Sí | LSD | N.e. | CPCNP | Sincrónico | Invaginación intestinal | Tomografía computarizada | Yeyuno, colon | – | Resección | 3 meses | |
| Hara et al.50 | 58 | Masculino | N.e. | LSD | T2N0M0 | CPCNP | 9 meses | Fiebre | Tomografía computarizada | Íleon | – | Resección | 4 meses | |
| Rivera et al.51 | 61 | Femenino | Sí | LSD | N.e. | Adenocarcinoma | Sincrónico | Dolor abdominal | Tomografía computarizada | Íleon | Mediastino, espacio izquierdo supraclavicular | Resección | Vivo a los 5 meses | |
| Koh et al.52 | 46 | Masculino | Sí | LSD | N.e. | CPCNP | 0,3 meses | Perforación intestinal | Tomografía computarizada | Íleon | Estómago, duodeno, riñones, páncreas, vesícula biliar, glándula suprarrenal, tiroides | Resección | 14 días | |
| Khan et al.53 | 60 | Masculino | Sí | LSD | N.e. | CPCP | Sincrónico | Anemia | Colonoscopia | Ciego | Cerebro, hígado, bazo | Polipectomía | 11 meses | |
| Sifuentes Giraldo et al.54 | 73 | Masculino | Sí | LSI | N.e. | Adenocarcinoma | Sincrónico | Perforación intestinal | Tomografía computarizada | Colon | – | Resección | 2 meses | |
| De Miguel Valencia et al.55 | 48 | Masculino | Sí | LII | N.e. | Carcinoma sarcomatoide | Sincrónico | Invaginación intestinal | Tomografía computarizada | Íleon | Pulmón, huesos, cerebral, glándula suprarrenal | Resección | 5 meses | |
| Guerra et al.56 | 75 | Femenino | Sí | N.e. | N.e. | CPCP | 1 mes | Dolor perianal | Examen ReTCal | ReTCum | Huesos | Quimioterapia | Vivo a los 7 meses | |
| Mandeville et al.57 | 49 | Femenino | N.e. | LSI | T4N0M1b | CPCNP | Sincrónico | Invaginación intestinal | Laparoscopia | Íleon | Huesos, cerebro | Resección | 6 meses | |
| Liu et al.58 | 66 | Masculino | N.e. | LDL | T2N1M0 | Carcinoma epidermoide | 8 meses | Melena | Tomografía computarizada | Íleon | – | Resección | Vivo a los5 meses | |
| Lu et al.59 | 62 | Femenino | N.e. | N.e. | N.e. | Adenocarcinoma | Sincrónico | Melena | Colonoscopia | Colon | Piel | Quimioterapia | Vivo a los 2 meses | |
| Lu et al.60 | 78 | Masculino | Sí | N.e. | TxN1M1 | Adenocarcinoma | 4 meses | Melena | Tomografía computarizada | Yeyuno | Glándula suprarrenal, huesos | Resección | 2 meses | |
| Chen61 | 61 | Masculino | Si | HPD | N.e. | Adenocarcinoma | Sincrónico | Invaginación intestinal | Tomografía computarizada | Íleon | – | Resección | Vivo a los 3 meses | |
| Escoda62 | 63 | Masculino | N.e. | HPI | N.e. | Carcinoma Epidermoide | Sincrónico | Obstrucción Intestinal | Tomografía Computarizada | Íleon | Miocardio, Huesos | Resección | – | |
| Romano et al.63 | 60 | Masculino | Si | LII | N.e. | Carcinosarcoma | 0,5 mes | Invaginación intestinal | Tomografía Computarizada | Íleon | Hígado, omentum | Resección | 8 días | |
| Nunes et al.64 | 43 | Masculino | Sí | LSD | T2N0M1 | Carcinoma adenoescamoso | Sincrónico | Obstrucción intestinal | Colonoscopia | Colon izqdo., duodeno | Cerebro | Resección | Vivo a los 18 meses | |
| Iwamuro et al.65 | 71 | Masculino | N.e. | LMD | T3N2M1 | Adenocarcinoma | N.e. | Melena | Gastroscopia | Duodeno | Glándula suprarrenal | Quimioterapia | 5 meses | |
| Nakamura et al.66 | 88 | Femenino | N.e. | N.e. | T1N1M0 | Carcinoma epidermoide | 144 meses | Invaginación intestinal | Tomografía computarizada | Íleon | – | Resección | 5 meses | |
| Fujii et al.67 | 55 | Femenino | N.e. | LSI | N.e. | CPCNP | Sincrónico | Invaginación intestinal | Tomografía computarizada | Yeyuno | – | Resección | Vivo a los11 meses | |
| Serie actual | 1 | 69 | Masculino | Sí | HPI | T4N3M1 | Carcinoma epidermoide | 6 meses | Obstrucción intestinal | Tomografía computarizada | Íleon | Hígado, huesos, peritoneo, mesenterio | Resección | 1,5 meses |
| 2 | 79 | Masculino | Sí | LMD | T4N2M1 | Adenocarcinoma | Sincrónico | Perforación intestinal | Tomografía computarizada | Yeyuno | Peritoneo | Resección | 1 mes | |
| 3 | 67 | Masculino | Sí | LSI | T4N2M1 | Adenocarcinoma | 5,5 meses | Perforación intestinal | Tomografía computarizada | Íleon | Glándula suprarrenal, pared abdominal | Resección | 1 mes | |
| 4 | 53 | Masculino | Sí | LII | T1N2M1 | CPCNP | 7 meses | Dolor abdominal | Entero-IRM | Yeyuno, íleon | Hígado, bazo vértebras | Conservador | 8 meses | |
| 5 | 72 | Masculino | Sí | LSD | T3N0M0 | Adenocarcinoma | 12 meses | Asintomático | TEP-TC | Íleon | Cerebro | Resección | 4 meses | |
CPCNP: carcinoma de pulmón de células no pequeñas; CPCP: carcinoma de pulmón de células pequeñas; HPD: hilio pulmonar derecho; HPI: hilio pulmonar izquierdo; IRM: imágenes de resonancia magnética; LD: lóbulo derecho; LID: lóbulo inferior derecho; L: língula; LLI: lóbulo lingual izquierdo; LMD: lóbulo medio derecho; LSD: lóbulo superior derecho; LSI: lóbulo superior izquierdo; N.e.: no especificado; TC: tomografía computarizada; TEP: tomografía por emisión de positrones. * Intervalo de tiempo entre el diagnóstico de cáncer pulmonar y el diagnóstico de metástasis GI. GI: Gastrointestinal. a: Procedimiento quirúrgico no especificado.
La localización más frecuente de cáncer pulmonar primario fue el lóbulo superior izquierdo (17 pacientes, 18,7%), seguido por el lóbulo superior derecho en (16 pacientes, 17,6%) y el lóbulo inferior derecho (8 pacientes, 8,8%) (tabla 1). El subtipo histológico fue reportado en 78 pacientes (cáncer de pulmón no microcítico en 69 pacientes, 75,9%; cáncer microcítico de pulmón en 9 pacientes, 9,9%). El cáncer de pulmón no microcítico se dividió en: 23 adenocarcinomas (25,3%), 16 carcinomas epidermoides (17,6%), 3 carcinomas sarcomatoides (3,3%) y 2 carcinosarcomas (2,2%) (tabla 1).
En 33 casos (38,8%), el cáncer de pulmón primario y la metástasis GI se diagnosticaron de manera sincrónica, y en 52 casos (61,2%) de manera metacrónica. La mediana del tiempo entre el diagnóstico de cáncer de pulmón primario y el diagnóstico de metástasis GI (reportada en 85 casos, 93,4%) fue de 2 meses (IC del 95%: 0,1-38) (tabla 1).
Con respecto a la presentación clínica, se evidenció obstrucción intestinal en 26 pacientes (28,6%; 15 invaginaciones intestinales, 10 estenosis neoplásicas y una compresión por infiltración neoplásica mesentérica), seguido de hemorragia digestiva en 25 pacientes (27,5%; 15 melenas, 7 anemias crónicas, una hematoquecia, 1 hematemesis y 1 sangrado rectal), perforación intestinal en 17 pacientes (18,7%) y dolor abdominal en 14 pacientes (15,4%). Cinco pacientes se encontraban asintomáticos (5,5%) y en 3 pacientes (3,3%) se observó fiebre, dolor perianal y masa abdominal (tabla 1).
La tomografía computarizada (TC) fue la prueba diagnóstica más utilizada (35 pacientes, 38,5%) seguida por la endoscopia (gastroscopia, colonoscopia o enteroscopia en 15 pacientes, 16,5%) y laparotomía (11 pacientes, 12,1%) (tabla 1).
El sitio más común de metástasis fue el íleon (40 pacientes, 44%), seguido por el colon (18 pacientes, 19,8%) y el yeyuno (16 pacientes, 17,6%). Se reportaron metástasis extraintestinales en 50 pacientes (54,9%) (tabla 1).
En cuanto a las opciones de tratamiento, se realizó resección intestinal en 67 pacientes (73,6%), quimioterapia, radioterapia o tratamiento conservador en 6 pacientes (6,6%) y tratamiento endoscópico en 2 pacientes (2,2%) (tabla 1).
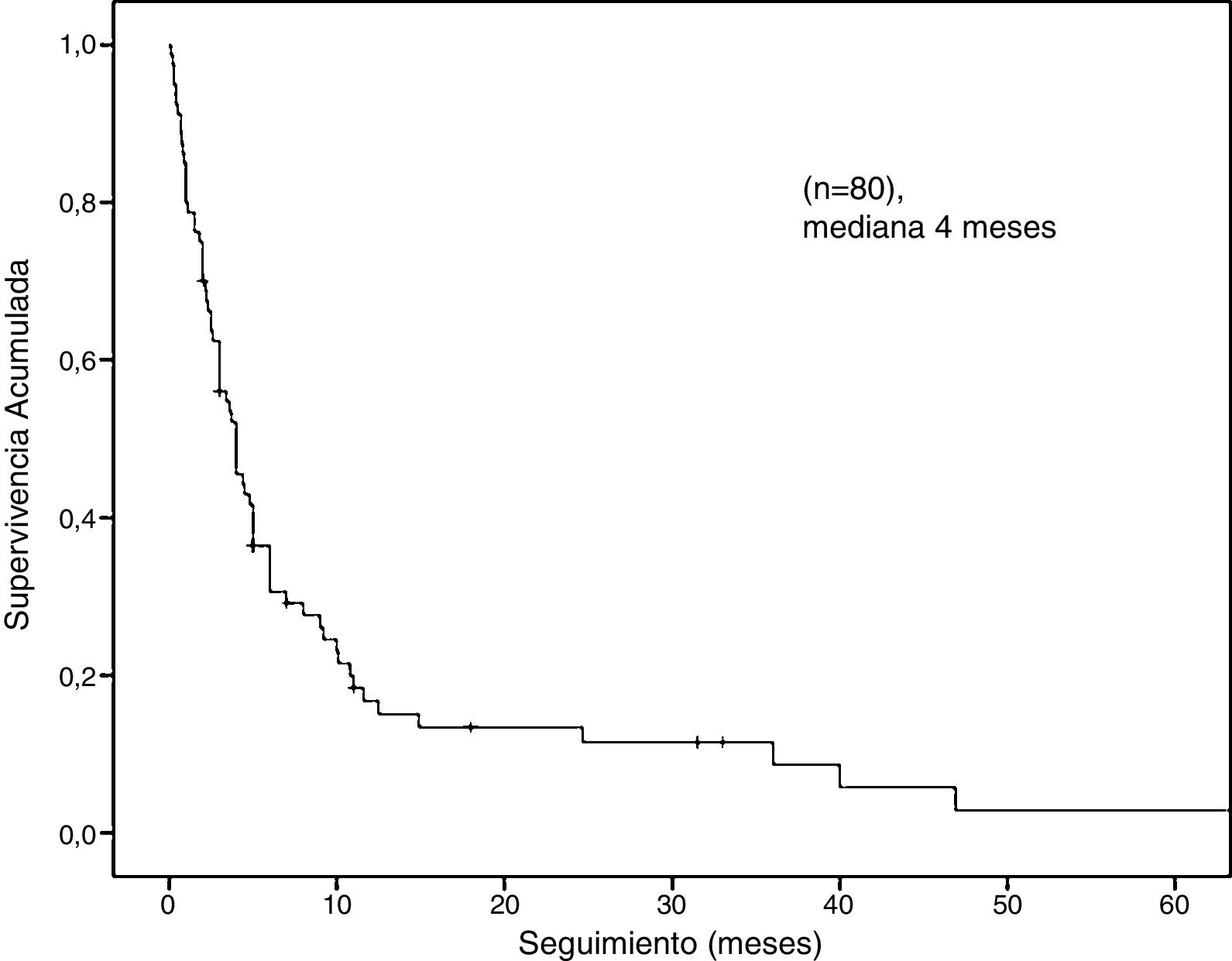
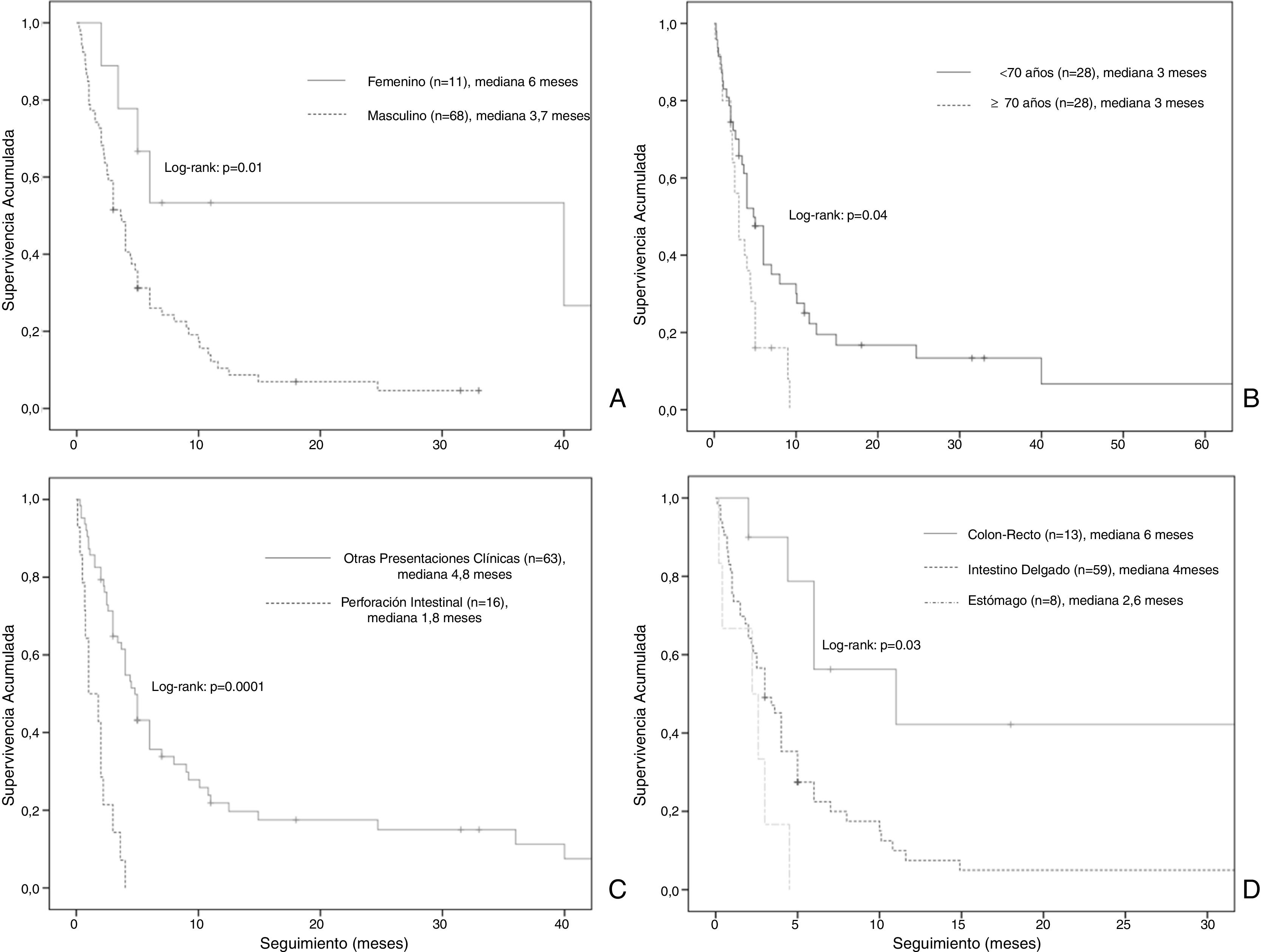
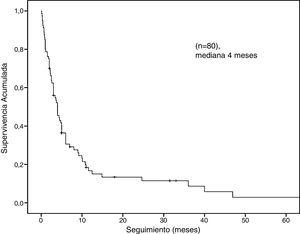
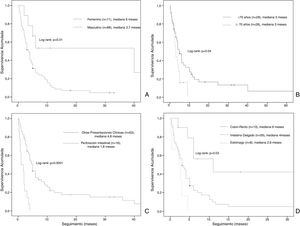
La mediana de la supervivencia global fue de 4 meses (IC del 95%: 2,68-5,31) (fig. 2). El análisis de supervivencia estratificado reveló diferencias estadísticamente significativas al comparar a los pacientes por género (masculino vs. femenino: 3,7 meses, IC del 95%: 2,7-4,6 vs. a 6 meses, IC del 95%: 0-36,5, log-rank: p = 0,01), edad (< 70 vs. ≥ 70: 4 meses, IC del 95%: 2,4-5,5 vs. 3 meses, IC del 95%: 2,1-3,8, log-rank: p = 0,04), la presentación clínica (perforación intestinal vs. otros: 1,8 meses, IC del 95%: 0,4-3,1 vs. a 4,8 meses, IC del 95%: 3,9-5,6, log-rank: p = 0,0001) y localización de las metástasis (colon-recto vs. intestino delgado vs. estómago: 6 meses, IC del 95%: 3,3-86 vs. 4 meses, IC del 95%: 3-4,9 vs. 2,6 meses, IC del 95%: 1,6-3,5, log-rank: p = 0,03) (fig. 3).
No se observaron diferencias estadísticamente significativas cuando los pacientes fueron estratificados de acuerdo con su condición de fumador, subtipo histologico, estadio tumoral (T), estadio ganglionar (G) linfáticos, presencia de metástasis extraintestinales y diagnóstico sincrónico vs. metacrónico.
DiscusiónDesde marzo del 2001 hasta agosto del 2017, se han reportado 86 casos en la literatura acerca del manejo de metástasis gastrointestinales de neoplasia primaria de pulmón10-67 y entre 2012 y 2017 se han tratado 5 pacientes en nuestro por dicha entidad, reclutándose para este estudio un total de 91 pacientes.
El tratamiento definitivo de este tipo de lesiones aún se encuentra en debate, debido principalmente a la falta de literatura con un número considerable de pacientes y a la dificultad para realizar ensayos clínicos dada la heterogeneidad de sus características.
A menudo, el tratamiento se ve condicionado por la presentación clínica de los pacientes, por lo que la obstrucción, la perforación y la hemorragia intestinal masiva, representan condiciones que obligan a la cirugía urgente. Por esta razón, y aunado al mal estado de los pacientes en el momento del diagnóstico de metástasis GI (cáncer en estadio avanzado, edad avanzada, síntomas graves), la tasa media de supervivencia es baja7.
El objetivo del presente estudio ha sido analizar nuestra casuística y acerca del manejo de las metástasis GI del cáncer primario de pulmón. Se debe considerar la posibilidad de sesgo en el presente estudio debido al número relativamente bajo de pacientes y al gran número de datos perdidos.
El subtipo histológico de cáncer pulmonar mas frecuentemente relacionado con metástasis GI es un tema de debate3,5,7,8,24; sin embargo, en nuestra serie el carcinoma de células grandes fue el subtipo mas frecuente (75,9%).
La mayoría de los pacientes con metástasis GI de cáncer primario de pulmón son asintomáticos5, lo cual puede apreciarse en la discrepancia existente entre la incidencia estimada en los estudios clínicos y los estudios post mortem24. Este subdiagnóstico clínico se debe a que los síntomas GI referidos por el paciente son confundidos con los efectos adversos de la quimioterapia68, razón por la que se requiere un alto grado de sospecha por parte del médico para su identificación temprana.
Los síntomas sin complicaciones asociadas más frecuentemente observados son el dolor abdominal (50% de los pacientes) y la pérdida de peso7,69. Entre las complicaciones mas frecuentes se describe la perforación de intestino delgado7,70, así como la obstrucción intestinal que puede ocurrir como consecuencia de una masa oclusiva24 o por invaginación del segmento de íleon afectado7,33. Finalmente, se ha descrito una hemorragia digestiva aguda que puede presentarse se en forma de melena, en caso de afectación de estómago, duodeno o intestino delgado71 o de rectorragias, debido a la afectación del tracto GI inferior68.
En la presente serie, la obstrucción del intestino delgado representa la complicación más frecuentemente observada (28,6%), alcanzando hasta un 35% según Di et al.7.
Las metástasis GI de cáncer pulmonar primario han sido descritas en el esófago (6,3%), intestino delgado (2,6%), estómago (1,2%) y colon (0,7%)3. De acuerdo con la literatura, los segmentos de intestino delgado más afectados son yeyuno e íleon7,24,72, mientras que el duodeno suele verse afectado en un menor número de casos73. En la presente serie, la localización más frecuente de las metástasis fue el íleon (44%).
La TC es la prueba diagnóstica más utilizada, en la experiencia de los autores como en los casos de la literatura5. Esta prueba ha sido ampliamente descrita5, por su versatilidad, sencillez y rápido acceso en el contexto de una urgencia, con una sensibilidad del 72%74; sin embargo, ha mostrado dificultad para la detección de pequeñas lesiones74.
La tomografía por emisión de positrones-TC (TEP-TC) ha demostrado ser útil en el diagnóstico de metástasis de cáncer primario de pulmón, al igual que en el caso de metástasis GI asintomáticas75,76. No obstante, en el presente estudio, fue empleada en un solo caso, y hasta el momento no hay datos suficientes sobre la sensibilidad y especificidad de esta prueba77.
El abordaje endoscópico se ha descrito en varias series como una prueba de diagnóstico para pacientes que presenten sangrado digestivo o anemia68,69,76,77. Un estudio reciente describe el uso de cápsulas endoscópicas como la prueba diagnóstica más viable para lesiones de intestino delgado y como método de diagnóstico no invasivo que podría reducir el subdiagnóstico de metástasis78. Según la literatura existente47, la resonancia magnética es una prueba diagnóstica menos común y ha sido empleada en un solo paciente de nuestra serie.
El tratamiento más idóneo de las metástasis GI de cáncer pulmonar aún es tema de debate en la literatura entre los autores que apoyan el tratamiento conservador8,79 y aquellos que están a favor del abordaje quirúrgico3,24. De cualquier modo, en caso de perforación, obstrucción intestinal, o hemorragia masiva, el tratamiento quirúrgico suele ser el abordaje más racional3.
De acuerdo con la literatura la tasa de mortalidad perioperatoria varía entre 20% y 100%8,79; sin embargo, debe tenerse en cuenta que la mayoría de estas muertes no se debieron a complicaciones quirúrgicas inmediatas7. Goh et al. sugieren que la selección adecuada de los pacientes para cirugía podría aumentar la tasa de supervivencia3, considerando que los factores más importantes que afectan los resultados postoperatorios son la presencia de metástasis extraintestinales múltiples y la perforación intestinal3. En el presente estudio se evidenció solo un caso de mortalidad perioperatoria.
La técnica quirúrgica más frecuentemente realizada, es la resección intestinal con anastomosis primaria por laparotomía3,8; no obstante, un estudio reciente muestra la viabilidad del abordaje laparoscópico80.
La supervivencia media oscila entre 1 y 6 meses3,7,8,24. La serie más grande publicada en la literatura reporta un análisis retrospectivo de 100 casos publicados anteriormente (incluidas autopsias) que muestran una supervivencia media de 2,3 meses7 y concluye que los factores de riesgo principalmente asociados a la mortalidad son: edad mayor a 70 años, perforación intestinal y presencia de metástasis extraintestinales7, lo cual ha sido ratificado en la presente revisión.
La tasa de supervivencia evidenciada en el presente estudio es es similar a la descrita en la literatura (4 meses, IC del 95%: 2,68-5,31) y en el análisis de subgrupos se evidenciaron diferencias estadísticamente significativas cuando los pacientes fueron estratificados de acuerdo a edad, sexo, presentación clínica y localización de la metástasis en el tracto GI.
A pesar de los datos publicados no existe todavía un tratamiento estandarizado, y ninguno de los tratamientos descritos parece tener un impacto significativo sobre la supervivencia. No obstante, el tratamiento quirúrgico no debe ser diferido en caso de perforación obstrucción o hemorragia intestinal masiva. Por esta razón, en pacientes con abdomen agudo e historial de cáncer de pulmón, debe considerarse la metástasis GI como un diagnóstico diferencial. Al momento del diagnóstico del cáncer pulmonar primario, la realización de una TEP-TC podría ser útil para diagnosticar eventuales metástasis sincrónicas.
AutoríaAndrea Balla: diseños de estudio, adquisición de datos, análisis e interpretación de resultados, preparación de manuscritos, revisión crítica y aprobación de la versión final del manuscrito.
José D. Subiela: diseño de estudios, adquisición de datos, análisis e interpretación de resultados, preparación de manuscritos, revisión crítica y aprobación de la versión final del manuscrito.
Jesús Bollo: diseño de estudios, adquisición de datos, análisis e interpretación de resultados, preparación de manuscritos, revisión crítica y aprobación de la versión final del manuscrito.
Carmen Martínez: análisis e interpretación de los resultados, preparación del manuscrito, revisión crítica y aprobación de la versión final del manuscrito.
Carlos Rodriguez Luppi: análisis e interpretación de los resultados, preparación del manuscrito, revisión crítica y aprobación de la versión final del manuscrito.
Pilar Hernández: análisis e interpretación de los resultados, preparación del manuscrito, revisión crítica y aprobación de la versión final del manuscrito.
Yuliana Pascual-González: análisis e interpretación de los resultados, preparación del manuscrito, revisión crítica y aprobación de la versión final del manuscrito.
Silvia Quaresima: análisis e interpretación de los resultados, preparación del manuscrito, revisión crítica y aprobación de la versión final del manuscrito.
Eduard M. Targarona: diseños de estudio, adquisición de datos, análisis e interpretación de resultados, preparación del manuscrito, revisión crítica y aprobación de la versión final del manuscrito.
Conflicto de interesesEl Dr. Andrea Balla, el Dr. José D. Subiela, el Dr. Jesús Bollo, la doctora Carmen Martínez, el Dr. Carlos Rodriguez Luppi, el Dr. Pilar Hernández, Dr. Yuliana Pascual-González, la doctora Silvia Quaresima y el profesor Eduard M. Targarona no tienen conflictos de interés o vínculos financieros para divulgar.