La lesión pancreática es un evento infrecuente y de difícil diagnóstico en fase temprana, por lo que el cirujano debe tener siempre presente esta posibilidad después de un traumatismo abdominal debido a las consecuencias que acarrean las lesiones desapercibidas. Dada su localización retroperitoneal es habitual la lesión asociada de otros órganos y estructuras vasculares abdominales, que junto con las lesiones extraabdominales explican la alta morbimortalidad de estos pacientes. El objetivo de este trabajo es presentar una descripción concisa de la incidencia de estas lesiones, los mecanismos lesionales, los métodos diagnósticos recomendados, las indicaciones de las diferentes modalidades terapéuticas conservadoras, endoscópicas y quirúrgicas disponibles, y realizar un análisis de las complicaciones específicas del páncreas y de la mortalidad en estos pacientes, basándonos en una revisión de la literatura de los últimos 60 años, habiendo identificado 6.364 pacientes. Dada la localización retroperitoneal del páncreas, es habitual la lesión asociada de otros órganos y estructuras vasculares abdominales, que junto con las lesiones extraabdominales explican la alta morbimortalidad de estos pacientes.
Pancreatic injury is an uncommon event often difficult to diagnose at an early stage. After abdominal trauma, the surgeon must always be aware of the possibility of pancreatic trauma due to the complications associated with missed pancreatic injuries. Due to its retroperitoneal position, asociated organs and vascular injuries are almost always present, which along with frequent extra abdominal injuries explain the high morbidity and mortality. The aim of this study is to present a concise description of the incidence of these injuries, lesional mechanisms, recommended diagnostic methods, therapeutic indications including nonoperative management, endoscopy and surgery, and an analysis of pancreas-specific complications and mortality rates in these patients based on a 60-year review of the literature, encompassing 6,364 patients. Due to pancreatic retroperitoneal position, asociated organs and vascular injuries are almost always present, which along with frequent extraaabdominal injuries explain the high morbidity and mortality of these patients.
La lesión pancreática de origen traumático es infrecuente, representando entre el 0,5-8%1 de los pacientes víctimas de traumatismo. El primer dato disponible se remonta a la publicación de Travers en Lancet de 18272,3, donde describía los hallazgos en una autopsia.
El objetivo de este artículo fue realizar una revisión sobre los traumatismos pancreáticos. Para ello se realizó una búsqueda a través de PubMed y Embase, seleccionando artículos publicados en inglés y en español durante los últimos 60 años (1956-2015). Se excluyó la población pediátrica. Fueron identificadas un total de 28 series con un total de 6.364 pacientes (tabla 1).
Incidencia por autor, sexo y edad
| Autor y año (total de pacientes) | Varones, n (%) | Mujeres, n (%) | Edad promedio (rango) |
|---|---|---|---|
| Ivatury et al.9, 1990 (103) | 90 (87) | 13 (13) | 27 (13-51) |
| Young et al.49, 1998 (62) | 56 (90) | 6 (10) | 32 (N/D) |
| Dubois et al.55, 2001 (4) | N/D | N/D | N/D |
| Vasquez et al.7, 2001 (62) | 54 (87) | 8 (13) | 28 (16-56) |
| Ilahi et al.38, 2002 (40) | 30 (75) | 10 (25) | 35 (N/D) |
| Lin et al.18, 2003 (48) | 40 (83) | 8 (17) | 37 (18-71) |
| Beyrouti et al.56, 2005(14) | 12(86) | 2(14) | 24 (N/D) |
| Rickard et al.48, 2005 (70) | 66 (94) | 4 (6) | 28 (N/D) |
| Zang et al.57, 2005 (71) | N/D | N/D | N/D |
| Scollay et al.4, 2006 (111) | 83 (75) | 28 (25) | 32 (14-84) |
| Cerwenka et al.19, 2007 (47) | N/D | N/D | N/D |
| Teh et al.37, 2007 (50) | N/D | N/D | N/D |
| Ouaïssi et al.47, 2008 (40) | 30 (75) | 10 (25) | 29 (15-65) |
| Petrone et al.3, 2008 (3465) | N/D | N/D | N/D |
| Seamon et al.8, 2008 (42) | 38 (90) | 4 (10) | 33 (N/D) |
| Lochan et al.50, 2009 (11) | 7 (64) | 4 (34) | 30 (13-51) |
| Antonacci et al.6, 2011 (55) | 30 (65) | 13 (35) | 39 (15-90) |
| Heuer et al.1, 2011 (284) | 206 (72) | 78 (28) | 41 (16-N/D) |
| Lee et al.39, 2012 (58) | 41 (71) | 17 (29) | 40 (28-46) |
| Önder et al.20, 2012 (26) | 20 (77) | 6 (13) | 25 (15-56) |
| Jahromi et al.58, 2013 (25) | N/D | N/D | N/D |
| Yalin et al.17, 2013 (95) | 81 (85) | 14 (15) | 33 (17-51) |
| Memon et al.14, 2013 (30) | 28 (93) | 2 (7) | 28 (N/D) |
| Jeroukhimov et al.32, 2015 (13) | 8 (62) | 5 (38) | 24 (N/D) |
| Krige et al.46, 2015 (432) | 394 (91) | 38 (9) | 26 (N/D) |
| Moschetta et al.5, 2015 (136) | 90 (66) | 46 (36) | 46 (N/D) |
| Negoi et al.36, 2015 (942) | N/D | N/D | N/D |
| Rodriguez et al.15, 2015 (28) | 26 (93) | 2 (7) | 30 (22-41) |
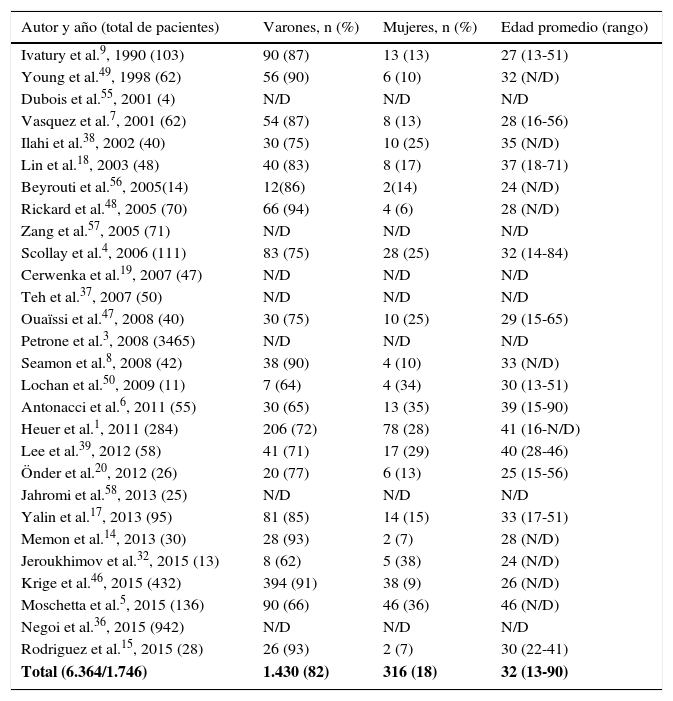
| Total (6.364/1.746) | 1.430 (82) | 316 (18) | 32 (13-90) |
El total de pacientes hallados fue de 6.364; de ese total solo en 1.746 fue detallado el sexo.
N/D: no disponible.
El páncreas presenta una baja prevalencia de lesión traumática, debido principalmente a su localización retroperitoneal protectora, lo que a la vez dificulta y retrasa el diagnóstico. Tras la revisión se encontró una variación de la prevalencia entre 0,21% y 5,37%. En las regiones con más incidentes violentos la franca mayoría de los pacientes son varones y jóvenes1,4–9, observándose en nuestro estudio un 82% de varones con una edad media de 32 años (tabla 1).
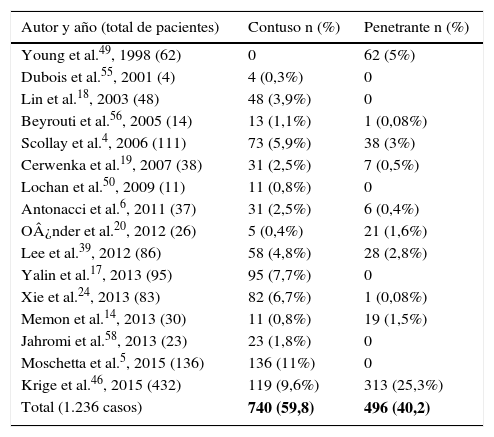
Mecanismo de lesiónExisten algunas publicaciones que reportan mayor frecuencia de encontrar lesión pancreática secundaria a traumatismo abdominal penetrante3,8,10–15, entre el 1% y el 12% de los casos7,15–17, y de alrededor del 5%18,19 de traumatismo contuso. Esta distribucio¿n vari¿a segu¿n el origen de las series y el tipo de traumatismo. Asi¿, en estudios publicados en el Reino Unido el traumatismo abdominal cerrado es el responsable de lesio¿n pancreática en un 82% de los pacientes, mientras que en estudios procedentes de Estados Unidos y Sudáfrica mantienen la primaci¿a los traumatismos penetrantes4,14,20. En la revisión realizada pudo identificarse el mecanismo lesional en 1.236 casos, siendo el 59,8% por mecanismo contuso y el 40,2% por mecanismo penetrante. De estos, el 59% fue por arma de fuego (tabla 2).
Mecanismo de lesión pancreática
| Autor y año (total de pacientes) | Contuso n (%) | Penetrante n (%) |
|---|---|---|
| Young et al.49, 1998 (62) | 0 | 62 (5%) |
| Dubois et al.55, 2001 (4) | 4 (0,3%) | 0 |
| Lin et al.18, 2003 (48) | 48 (3,9%) | 0 |
| Beyrouti et al.56, 2005 (14) | 13 (1,1%) | 1 (0,08%) |
| Scollay et al.4, 2006 (111) | 73 (5,9%) | 38 (3%) |
| Cerwenka et al.19, 2007 (38) | 31 (2,5%) | 7 (0,5%) |
| Lochan et al.50, 2009 (11) | 11 (0,8%) | 0 |
| Antonacci et al.6, 2011 (37) | 31 (2,5%) | 6 (0,4%) |
| O¿nder et al.20, 2012 (26) | 5 (0,4%) | 21 (1,6%) |
| Lee et al.39, 2012 (86) | 58 (4,8%) | 28 (2,8%) |
| Yalin et al.17, 2013 (95) | 95 (7,7%) | 0 |
| Xie et al.24, 2013 (83) | 82 (6,7%) | 1 (0,08%) |
| Memon et al.14, 2013 (30) | 11 (0,8%) | 19 (1,5%) |
| Jahromi et al.58, 2013 (23) | 23 (1,8%) | 0 |
| Moschetta et al.5, 2015 (136) | 136 (11%) | 0 |
| Krige et al.46, 2015 (432) | 119 (9,6%) | 313 (25,3%) |
| Total (1.236 casos) | 740 (59,8) | 496 (40,2) |
Ante un traumatismo abdominal cerrado se produce una fuerza de compresio¿n directa del páncreas contra las vértebras lumbares, que asociada a la falta de desplazamiento del órgano por su localización retroperitoneal, causa transeccio¿n de la glándula a nivel de los vasos mesentéricos superiores e incluso rotura del ducto12,13,16,21. Cabe sen¿alar que en la revisio¿n se hallaron arti¿culos que haci¿an referencia a mecanismos lesionales poco frecuentes11,22–27.
Lesiones asociadasLa presencia de lesiones asociadas es más la regla que la excepción debido a su localización7,11. Krige et al.10 reportaron la presencia de lesiones aisladas solo en un 11% de los casos. La lesión aislada en el mecanismo contuso varía del 15% al 55%, mientras que es prácticamente nulo cuando el mecanismo es penetrante28.
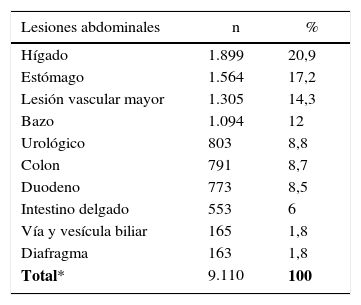
En nuestra revisión hemos contabilizado 4.559 pacientes con lesión pancreática, quienes presentaron 9.110 lesiones asociadas intraabdominales (1,9 lesiones por paciente). Las más frecuentes correspondieron al hígado con 1.899 lesiones (20,9%), seguidas de 1.564 lesiones gástricas (17,2%) y 1.305 lesiones vasculares mayores (14,3%) (tabla 3). A su vez se identificó un 8,5% de lesiones duodenales asociadas, porcentaje que se acrecentaba al 12% y 21% si el mecanismo de lesión es penetrante7,14.
Lesiones asociadas abdominales y extraabdominales
| Lesiones abdominales | n | % |
|---|---|---|
| Hígado | 1.899 | 20,9 |
| Estómago | 1.564 | 17,2 |
| Lesión vascular mayor | 1.305 | 14,3 |
| Bazo | 1.094 | 12 |
| Urológico | 803 | 8,8 |
| Colon | 791 | 8,7 |
| Duodeno | 773 | 8,5 |
| Intestino delgado | 553 | 6 |
| Vía y vesícula biliar | 165 | 1,8 |
| Diafragma | 163 | 1,8 |
| Total* | 9.110 | 100 |
| Lesiones extraabdominales | n | % |
|---|---|---|
| Tórax | 234 | 44,5 |
| Musculoesquelético | 138 | 26,2 |
| Craneoencéfalo | 92 | 17,5 |
| Columna y cuello | 57 | 10,8 |
| Corazón | 5 | 1 |
| Total (4.559 lesiones) | 526 | 100 |
La sospecha se establece en función del mecanismo de lesión y la clínica de presentación, aunque suele ser muy inespecífica29,30. Es importante detectar la integridad del conducto pancreático, lo que permite reducir la tasa de complicaciones31, indicar la técnica más apropiada y evitar tratamientos agresivos innecesarios. Estudios de imagen como la ecografía o la Focused Assessment Sonography for Trauma aportan pocos datos o inespecíficos, como la presencia de líquido libre intraabdominal, y no son útiles para valorar la totalidad de la glándula.
La tomografía axial computarizada (TAC) es el estudio de imagen de elección en los pacientes con traumatismo cerrado estables hemodinámicamente16. Tanto la sensibilidad como la especificidad de la prueba la sitúan alrededor del 85% para la detección de lesión pancreática16. Sin embargo, la sensibilidad para detectar lesión ductal es más limitada (43-54%)32,33. Una desventaja de la técnica es hallar el momento ideal para su realización, puesto que inmediatamente tras un traumatismo cerrado, el páncreas puede parecer normal entre el 20-40% de las ocasiones16, y si se realiza después de las primeras 24h la lesión puede pasar desapercibida debido a la ausencia de reacción inflamatoria34.
Si los hallazgos de la TAC no son determinantes de lesión, o existe una pequeña laceración en el parénquima, la colangiopancreatografía retrógrada endoscópica (CPRE) ha demostrado ser útil y más sensible33 en la valoración del estado del conducto principal, pudiendo disminuir la severidad de la lesión diagnosticada por TAC o de manera intraoperatoria, por lo que puede contribuir a eliminar procedimientos innecesarios o reducir la extensión de la cirugía30,32,34. Otra prueba útil en la evaluación de la integridad del conducto pancreático principal es la colangiopancreatografía mediante resonancia magnética (CPRM). Puede contribuir a mejorar la selección de pacientes para un tratamiento conservador35. Su inconveniente se centra en que no puede ser utilizada en el momento inicial de la valoración, y no constituye una opción diagnóstica16. Una variante es la resonancia dinámica tras estimulación con secretina, que si bien posee una elevada especificidad diagnóstica, no está indicada en aquellos pacientes con múltiples lesiones debido a que se trata de una prueba de larga duración30.
La elevación de las cifras de secretina y amilasa tras un traumatismo abdominal solían considerarse indicadores de lesión pancreática. Niveles iniciales normales pueden estar presentes hasta en el 35% de los casos de sección ductal completa, demostrando su baja sensibilidad y especificidad16. Actualmente se considera que su elevación a las 3h de la lesión puede indicar daño pancreático30,36, recomendándose un control seriado.
Finalmente, la opción diagnóstica más invasiva, pero mandatoria ante un paciente inestable, es la cirugía. Durante la laparotomía es importante confirmar el estado del conducto pancreático, ya que la lesión puede ser sutil y pasar desapercibida. El uso de la ecografía intraoperatoria puede ayudar en el diagnóstico de una lesión parenquimatosa e incluso ductal. En los casos en los que persista la sospecha de lesión ductal la administración de secretina puede demostrar su existencia mediante el aumento del flujo de secreción pancreática30.
Otra técnica intraoperatoria para detectar lesión ductal es la pancreatografía, canulando la ampolla de Vater a través de una duodenotomía. En los casos que ha requerido una pancreactectomía distal se puede realizar de manera retrógrada a través del orificio del conducto principal3,30. La naturaleza invasiva de estas 2 técnicas intraoperatorias, así como la también de la colecistocolangiograma por punción de la vesícula biliar para tratar de poner de manifiesto la falta de integridad del conducto pancreático, las hacen hoy en día poco atractivas y muy raramente indicadas.
En opinión de Subramanian et al.30, el examen simple del área de la lesión durante varios minutos con ayuda de una lupa magnificada es capaz de poner de manifiesto la fuga de líquido claro pancreático en la mayoría de las lesiones que involucran el conducto pancreático.
La laparoscopia también desempeña un papel en el diagnóstico y en el tratamiento de la lesión pancreática, ya que puede utilizarse para estadificar la lesión, resecar lesiones distales o el drenaje en las proximales33.
En el estudio de Teh et al.37 los hallazgos intraoperatorios confirmaron los aportados por la TC en un 54,5% de los casos, confirmando la presencia de lesión ductal en el 91%. En los estudios de Moschetta et al.5 e Ilahi et al.38, la confirmación de las lesiones durante la cirugía alcanzó el 100% de los casos. Xie et al.24 también ofrecen buena correlación entre los hallazgos de la TAC y la laparotomía, y Lee et al.39 confirman la presencia de lesión en el 100% de las CPRE realizadas.
Clasificación de las lesionesLa escala más utilizada para determinar el grado de lesión pancreática es la establecida por la Sociedad Americana de Cirugía del Traumatismo (American Association for the Surgery of Trauma [AAST])40 (tabla 4).
Escala de grados de lesión pancreática de la Asociación Americana de Cirugía del Traumatismo (American Association for the Surgery of Trauma [AAST])
| Grado | Tipo de lesión | Descripción de la lesión |
|---|---|---|
| I | Hematoma Laceración | Contusión menor sin daño ductal Laceración superficial sin daño ductal |
| II | Hematoma Laceración | Contusión mayor sin daño ductal ni pérdida de tejido Laceración mayor sin daño ductal ni pérdida de tejido |
| III | Laceración | Sección distal o daño parenquimatoso con lesión ductal |
| IV | Laceración | Sección proximal o daño parenquimatoso afectando la ampolla de Vater |
| V | Laceración | Disrupción masiva de la cabeza pancreática |
Fuente: Moree et al.40.
Históricamente las lesiones más frecuentes han sido grado i (60%), grado ii (20%), grado iii (15%) y grado iv (5%)3,28. En la revisión realizada de 18 series de casos con un total de 1.631 pacientes, en los que se especificaba el grado de lesión en 1.212, el grado de lesio¿n pancreática más frecuente fue el grado iii, con 275 (23%) pacientes, seguido del grado ii (196, 16%), grado I (111, 9%), grado iv (92, 8%) y grado v (35, 3%). En 503 de estos pacientes (41,5%) los autores dividieron los grados en 2 categori¿as, unificando los grados i y ii (304, 25%) y los grados iii, iv y v (199, 16%).
En nuestra revisión la localizacio¿n anato¿mica de la lesio¿n solo estaba referida en 7 de esas series, siendo el cuerpo la localizacio¿n más frecuente (33,2%), seguido de la cola (29,1%), la cabeza (26,8%) y el cuello (5,7%). En el 5,2% de los casos restantes la lesio¿n estaba agrupada en el cuello y el cuerpo. En un total de 95 pacientes se haci¿a referencia al grado de lesio¿n ductal encontrada, presentando dan¿o ductal grado i el 15%, grado IIa el 19%, IIb el 23%, IIIa 32% y IIIb el 11%. Esta graduacio¿n se realiza en funcio¿n de los hallazgos mediante CPRE41 (tabla 5).
Clasificación de daño ductal mediante CPRE
| Grado | Descripción |
|---|---|
| I | Conducto pancreático principal normal en la CPRE |
| IIa | Lesión de las ramas del conducto pancreático principal en la CPRE con extravasación de contraste dentro del parénquima |
| IIb | Lesión de las ramas del conducto pancreático principal con extravasación del contraste al espacio retroperitoneal |
| IIIa | Lesión del conducto pancreático principal en la CPRE en el cuerpo o la cola del páncreas |
| IIIb | Lesión del conducto pancreático principal en la CPRE en la cabeza del páncreas |
CPRE: colangiopancreatografía retrógrada endoscópica.
Fuente: Takishima et al.41.
En general, los grados i y ii pueden resolverse mediante tratamiento conservador, mientras que a partir del grado iii se indica tratamiento quirúrgico3,16,19,28,33.
Inicialmente la utilización de la CPRE era únicamente diagnóstica, pero en los últimos tiempos su utilización se ha ido incrementando como herramienta terapéutica de manera segura y satisfactoria29,35, reduciendo así la estancia hospitalaria42, y ha demostrado ser una opción efectiva en el tratamiento de las complicaciones tardías35.
Por otro lado, el tratamiento quirúrgico no queda solo relegado a lesiones a partir de grado iii16,36, sino también a aquellos pacientes que presenten signos de irritación peritoneal o inestabilidad hemodinámica. Los factores que determinan la elección de una técnica quirúrgica incluyen la estabilidad del paciente, el grado de lesión, la posible existencia de lesiones asociadas, la integridad del conducto pancreático, la localización anatómica y la extensión de la lesión30,42.
Durante la laparotomía es primordial controlar la hemorragia activa y la contaminación intestinal3,30. En el traumatismo penetrante puede ser suficiente con la exposición de la región pancreática en la trayectoria del daño30, mientras que en el traumatismo contuso es necesaria la exposición completa del órgano. La maniobra de Kocher extendida permite obtener acceso a la cara anterior y posterior de la cabeza y el cuello del páncreas. Para examinar la cara anterior del cuerpo y la cola se divide el ligamento gastrocólico y se accede a la transcavidad de los epiplones. Con la sección del ligamento gastrohepático se logra inspeccionar el borde superior del páncreas y los elementos vasculares del eje esplénico. La liberación de las adherencias inferiores al retroperitoneo y la elevación del borde inferior permite visualizar la cara posterior, donde discurre el conducto pancreático principal. Para la exposición total de la cola es necesario movilizar el bazo mediante disección roma.
La presencia de saponificación, líquido claro en el lecho pancreático, lesión central penetrante o heridas profundas en el parénquima son datos que indican la alta probabilidad de lesión del conducto pancreático43. Los hematomas deben ser explorados, ya que pueden ocultar una sección del conducto, aunque se trate de lesiones pancreáticas aisladas. Los principios básicos de tratamiento incluyen hemostasia, desbridamiento del tejido necrótico, resección anatómica y drenaje30.
Las técnicas quirúrgicas más empleadas incluyen:
- -
Drenaje externo: permite tratar más del 60% de las lesiones3. Son preferibles los sistemas de drenaje cerrados30, que se retirarán cuando el débito sea mínimo y el paciente tolere la nutrición enteral.
- -
Pancreatorrafia y drenaje: se sutura una porción de epiplón mayor viable sobre la zona de la lesión. Es necesario utilizar un drenaje por el alto riesgo de desarrollo de fístula30.
- -
Pancreatectomía distal: utilizada en los grados iii y iv2,10,16,30,36,44, con preservación del bazo. La conservación del bazo en esta situación de traumatismo es discutida, ya que implica un mayor tiempo quirúrgico, por lo que debe considerarse los beneficios a obtener frente a las consecuencias de una cirugía más prolongada en función de la reserva fisiológica y hemodinámica del paciente y su edad. Para plantearse la preservación del bazo asociada a una pancreatectomía distal en situación de cirugía no electiva, el paciente debe estar hemodinámicamente estable y normotérmico y la lesión debe limitarse al páncreas. Debe liberarse el cuerpo pancreático con ligadura de los vasos gástricos y completar la sección pancreática. Se recomienda colocar drenajes cerrados aspirativos en el lecho pancreático y en el hipocondrio izquierdo. La reparación ductal se determina por los hallazgos intraoperatorios y la extensión de la lesión10,45.
- -
Pancreaticoyeyunostomía o pancreaticogastrostomía: aplicables en casos de transección parcial de la zona del cuello o en lesiones grado iv16, con intento de preservar tejido pancreático y prevenir el desarrollo de insuficiencia pancreática.
- -
Pancreaticoyeyunostomía distal en Y-Roux: pacientes estables con lesiones en el cuello pancreático grado iv y pocas lesiones asociadas o sin ellas30. Se completa la sección pancreática mediante ligadura y sección de los elementos residuales y se individualiza el conducto para su posterior cierre. Se confecciona una Y de Roux con un segmento de yeyuno ascendido en posición transmesocólica para completar la anastomosis. Se colocan drenajes a nivel de la anastomosis y el muñón.
- -
Duodenopancreatectomía cefálica (DPC): con el desarrollo de las cirugías de control de daños, el procedimiento de Whipple ha quedado relegado como última opción quirúrgica2, recomendándose en casos de disrupción masiva de la cabeza pancreática asociada a hemorragia incoercible de la vena cava o porta, daño duodenal asociado importante o destrucción de la ampolla de Vater2,16,30,44. El daño ductal aislado en la cabeza pancreática no constituye una indicación para realizar un Whipple de urgencia, sino que debe drenarse a través de un stent ductal2. Debe realizarse de manera escalonada («cirugía de control de daños»), con una primera intervención destinada al control hemostático/contaminación. Tras la resucitación del paciente, en 24-48h se realiza el segundo paso para completar la reconstrucción. Este procedimiento asocia una importante morbimortalidad cuando se realiza por causa traumática, con mortalidades cercanas al 30-40%3,16,30. Algunas revisiones consideran que únicamente el 10% de los pacientes sometidos a la DPC por traumatismo pancreático realmente tienen indicación para este procedimiento16.
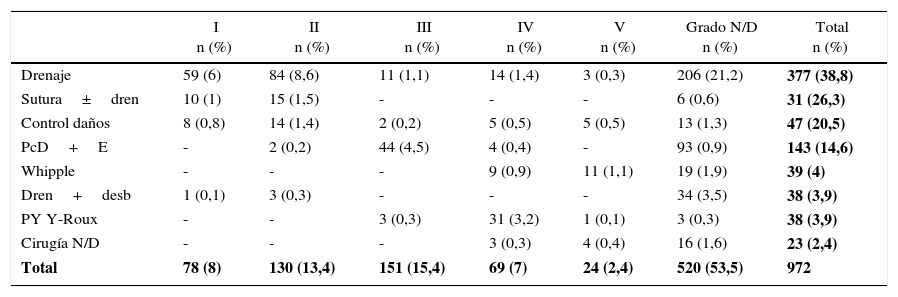
Entre las series analizadas la cirugía más frecuentemente realizada fue el drenaje, con 377 (38,1%) pacientes. La técnica Whipple se llevó a cabo en 39 (4,1%) pacientes con grados iv y v (tabla 6).
Tratamiento quirúrgico según grado de lesión pancreática AAST
| I n (%) | II n (%) | III n (%) | IV n (%) | V n (%) | Grado N/D n (%) | Total n (%) | |
|---|---|---|---|---|---|---|---|
| Drenaje | 59 (6) | 84 (8,6) | 11 (1,1) | 14 (1,4) | 3 (0,3) | 206 (21,2) | 377 (38,8) |
| Sutura±dren | 10 (1) | 15 (1,5) | - | - | - | 6 (0,6) | 31 (26,3) |
| Control daños | 8 (0,8) | 14 (1,4) | 2 (0,2) | 5 (0,5) | 5 (0,5) | 13 (1,3) | 47 (20,5) |
| PcD+E | - | 2 (0,2) | 44 (4,5) | 4 (0,4) | - | 93 (0,9) | 143 (14,6) |
| Whipple | - | - | - | 9 (0,9) | 11 (1,1) | 19 (1,9) | 39 (4) |
| Dren+desb | 1 (0,1) | 3 (0,3) | - | - | - | 34 (3,5) | 38 (3,9) |
| PY Y-Roux | - | - | 3 (0,3) | 31 (3,2) | 1 (0,1) | 3 (0,3) | 38 (3,9) |
| Cirugía N/D | - | - | - | 3 (0,3) | 4 (0,4) | 16 (1,6) | 23 (2,4) |
| Total | 78 (8) | 130 (13,4) | 151 (15,4) | 69 (7) | 24 (2,4) | 520 (53,5) | 972 |
Dren+desb: drenaje y desbridamiento; N/D: no disponible; PcD+E: pancreatectomía distal con esplenectomía; PY Y-Roux: pancreatoyeyunostomía en Y de Roux; Sutura±dren: sutura con o sin drenaje.
Con la evidencia actual no se recomienda el uso de la somatostatina en traumatismo, requiriéndose estudios de nivel i para la justificación de su uso. Por otro lado, el soporte nutricional adecuado es crucial en este tipo de pacientes. La nutrición enteral basada en una solución peptídica con dieta elemental mediante sondaje nasoyeyunal es la ideal. Otra alternativa es la yeyunostomía percutánea. La nutrición parenteral total es más cara, pero puede ser útil si el acceso enteral distal no es factible.
MorbilidadTrece series con 1.009 pacientes7,14,15,17–20,39,46–50 detallan las complicaciones asociadas al traumatismo pancreático, hallándose una tasa general de complicaciones que oscila entre 35% y 80%, y relacionada con el páncreas entre 30-36%. Las complicaciones órgano-específicas más habituales son la pancreatitis aguda (15%), pseudoquistes (9%), abscesos (6%) y fístulas pancreáticas (4%)28.
Según Krige et al.46 sobre 432 traumatismos pancreáticos consecutivos, los predictores de morbilidad fueron el grado AAST y las relaparotomías. Sin embargo, otros grupos han considerado factores de riesgo el tiempo quirúrgico, la complejidad de la cirugía (siendo la derivación de peor pronóstico que la resección), la parada cardiorrespiratoria en quirófano17, retrasos en el diagnóstico de tan solo 24h18,51 y el tratamiento inicial inapropiado52.
La incidencia de fístula pancreática (FP) presenta un amplio rango debido a la variabilidad de definiciones entre autores. La International Study Group for Pancreatic Fistula53 propuso como definición la comunicación anormal entre el epitelio ductal pancreático y otra superficie epitelial, y en el caso de ser postoperatoria o tras traumatismo, exteriorización por drenaje. El débito puede ser cualquier volumen medible tras el tercer día postoperatorio, con un nivel de amilasa 3 veces superior al valor sérico, sin ser necesaria la confirmación radiológica. La incidencia de FP observada en nuestra serie fue del 11%. Según la experiencia de Young et al.49 se presentan más FP en el manejo con solo drenaje que tras procedimientos con resección. Más del 90% cierran en 8 semanas, y solo el 10% requieren cirugía16.
Se encontraron un 8,3% de abscesos, habitualmente asociados a lesión mayor del conducto, y en la mayoría de los casos de localización peripancreática, subhepática o subfrénica, resolviéndose con drenaje percutáneo. Los abscesos intraparenquimatosos son poco habituales y suelen requerir drenaje quirúrgico12.
La pancreatitis puede llegar a 18% de los casos postoperatorios16, presentando buena evolución. Ante una recidiva se recomienda CPRE o CPRM12. La evolución a pancreatitis necrohemorrágica se presenta solo en el 10-15%19,51 y su mortalidad es del 80%12,19.
Las complicaciones a largo plazo incluyen los pseudoquistes y la estenosis del conducto pancreático. Los pseudoquistes se presentan en el 5,6% de los pacientes analizados. El tratamiento es endoscópico mediante CPRE cuando se origina en el conducto principal. Sin embargo, las lesiones de las ramas secundarias se resuelven de manera espontánea o mediante drenaje percutáneo. Solo 3 estudios reportaron la estenosis ductal: Lin et al.18 9%, Ouaïssi et al.39 2% y Krige et al.52 0,2%.
Otras complicaciones, aunque infrecuentes, incluyen hemorragia secundaria del lecho pancreático o vasos circundantes, debido a autodigestión retroperitoneal, la insuficiencia pancreática tras cirugía resectiva y pseudoaneurismas, principalmente de la arteria esplénica19.
MortalidadTras analizar 14 series y 1.354 pacientes la mortalidad hallada fue del 18%, en concordancia con los datos de la literatura (10-30%)1,4,17. En los artículos analizados consideraron factores de mal pronóstico la edad avanzada, la inestabilidad hemodinámica, el traumatismo contuso y las lesiones asociadas36. También influye el grado de lesión del conducto pancreático, la infraestadificación del mismo y el retraso diagnóstico18,19.
Según Heuer et al.1 más del 70% de las muertes tras traumatismo pancreático ocurren en las primeras 24h, debidas a lesiones de grandes vasos o lesiones severas de órganos adyacentes20. De hecho, los pacientes que presentan shock hemodinámico al ingreso tienen una mortalidad del 35%, disminuyendo al 3,7% si llegan estables46. En muchos estudios se excluyen los fallecimientos en las primeras 24h, o previo a la intervención quirúrgica, lo que podría explicar la gran variabilidad en las mortalidades publicadas. La publicación de Scollay et al.4 presenta la mayor mortalidad (46%), incluyendo pacientes diagnosticados por necropsia tras fallecer en el servicio de urgencias. Al excluirlos se obtiene un 34% de mortalidad, equiparable a lo publicado por otros grupos.
La mortalidad atribuible a la lesión pancreática es baja. De las 6 series7,14,20,39,47,48 en las que se discernía este subgrupo de mortalidad, supone tan solo el 11% de la mortalidad total. La mortalidad tardía tampoco se atribuye a la lesión del páncreas, siendo esta secundaria a lesión del conducto pancreático20 con desarrollo de sepsis intraabdominal y fallo multiorgánico54.
Un estudio multicéntrico alemán1 encuentra una disminución en la mortalidad del 10% desde el año 2000, que adjudican a la mejora en la asistencia prehospitalaria. Por otro lado, la introducción en las 2 últimas décadas del concepto de cirugía de control de daños mejora la supervivencia de los pacientes más graves15. Seamon et al.8 estudiaron retrospectivamente 42 pacientes sometidos a cirugía de control de daños tras traumatismo pancreático, concluyendo que la presencia de shock o lesión vascular mayor dicta la extensión de la cirugía y encuentra menor mortalidad cuando se realizan intervenciones abreviadas basadas en empaquetamiento y drenaje.
ConclusionesAnte la sospecha de lesión pancreática se debe realizar una meticulosa evaluación de la integridad del conducto pancreático mayor, dado que el principal predictor de morbimortalidad será el daño ductal18,36,50, y es este el que nos marcará el tratamiento a seguir:
- -
Se recomienda tratamiento no quirúrgico cuando se ha descartado lesión ductal, mediante TAC, CPRE30 o CPRM, con lesiones grado i y ii de la AAST secundarias a mecanismo contuso36 y en pacientes con estabilidad hemodinámica.
- -
En lesiones grados iv y v, en ausencia de daño duodenal o de la ampolla de Vater, se recomienda colocación de drenaje36.
- -
Ante un paciente hemodinámicamente inestable se aconseja cirugía de control de daños16, dado que la rapidez en el control del sangrado y la recuperación del shock hemodinámico es esencial para disminuir la alta mortalidad inmediata46.
- -
En las lesiones pancreáticas no sangrantes con lesiones asociadas importantes, una opción terapéutica sería la colocación de un drenaje cerrado aspirativo en el saco menor2.
- -
Si existe lesión ductal o complicaciones tardías la colocación de un stent transpapilar mediante CPRE o un drenaje nasopancreático favorece la curación, sobre todo si esta colocación se realiza en estadios tempranos30, interrumpiendo el punto de fuga y bloqueando la salida de jugo pancreático, o con la conversión de un sistema de alta a baja presión a nivel ductal mediante la apertura del esfínter35.
- -
En el caso de los pseudoquistes actualmente la técnica de elección es el drenaje pseudoquiste-gástrico mediante ecoendoscopia. Ha mostrado mayor eficacia sobre todo en lesiones pequeñas, con mala ventana, e incluso cambiando la actitud terapéutica en más de un tercio de los casos52. El drenaje simple transabdominal radio-guiado constituye una alternativa útil.
- -
Se debe descartar la presencia de pseudoaneurismas en pacientes con pancreatitis necrosante, para así prevenir el sangrado a consecuencia de su rotura. En caso de estar presente debe angioembolizarse.
Los autores declaran no tener ningún conflicto de intereses.