Los pólipos serrados del colon constituyen un grupo heterogéneo de lesiones con potencial de transformación a cáncer colorrectal a través de la «vía serrada» de la carcinogénesis. El descubrimiento de estas lesiones ha supuesto un cambio de paradigma en el concepto de la secuencia adenoma-carcinoma, de modo que hasta un 30% de los tumores se desarrollan por esta vía. Los principales factores que se asocian a un mayor riesgo de malignización en los pólipos serrados son el tamaño≥10mm, la multiplicidad, la histología de adenoma serrado sésil, la presencia de displasia asociada y la localización proximal. La evidencia actual indica que estas lesiones deben ser resecadas completamente y que el paciente requiere un programa de vigilancia endoscópica. El síndrome de poliposis serrada es una entidad clínico-patológica asociada a un aumento del riesgo de padecer cáncer colorrectal. Estos pacientes y sus familiares requieren una evaluación multidisciplinar en unidades de alto riesgo de cáncer colorrectal.
Serrated polyps of the colorectum are a heterogeneous group of lesions with potential malignant transformation through the «serrated pathway» of carcinogenesis. The discovery of these lesions has been a paradigm shift in the concept of the adenoma-carcinoma sequence, so that up to 30% of tumors develop through this pathway. The main factors associated with an increased risk of malignancy in serrated polyps are size≥10mm, multiplicity, sessile serrated adenoma histology, presence of associated dysplasia and proximal location. Current evidence indicates that these lesions should be resected completely, and the patient requires an endoscopic surveillance program. Serrated polyposis syndrome is a clinicopathological entity characterized by multiple and/or large serrated polyps with an increased risk of developing colorectal cancer. These patients and their families, require multidisciplinary assessment in specialized high risk colorectal cancer units.
El cáncer colorrectal (CCR) constituye en la actualidad la neoplasia más incidente en España teniendo en cuenta ambos sexos, y ocupa el segundo lugar en mortalidad por cáncer1–3. Estos datos contrastan con el hecho de que el CCR constituye el paradigma de neoplasia susceptible de prevención4,5. Ello es debido a que conocemos su historia natural (la mayoría de los CCR provienen de una lesión premaligna conocida como adenoma), disponemos de múltiples armas para su detección precoz (colonoscopia, prueba de sangre oculta en heces), y la detección en fases precoces mejora de forma significativa el pronóstico. Así, en las últimas décadas el pronóstico de los pacientes con CCR ha mejorado gracias a la existencia de programas de cribado o screening cuyo objetivo es detectar a individuos asintomáticos que presentan lesiones precancerosas (pólipos) o adenocarcinomas en una fase inicial de progresión tumoral, disminuyendo la incidencia y mortalidad por CCR3,4,6.
Hasta hace pocos años se consideraba que la mayoría de los CCR procedían de una lesión precursora común conocida como pólipo adenomatoso o adenoma. Esta lesión, aunque benigna, posee potencial de malignización a través de la llamada «vía tradicional» de la carcinogénesis relacionada con la inestabilidad cromosómica e iniciada mediante la inactivación del gen APC. Sin embargo, hoy sabemos que esta vía está implicada solamente en un 70-80% de los CCR7. Uno de los avances más significativos en los últimos años en el campo de la oncología digestiva en relación con el CCR ha sido el reconocimiento de las «lesiones serradas» como precursoras de CCR a través de la llamada «vía serrada» de carcinogénesis, responsable de hasta un 20-30% de todos los CCR7–9. Estas lesiones, con unas características endoscópicas y anatomopatológicas específicas que las diferencian de los adenomas, tienen una importante relevancia clínica, dado que se ha observado que la mayoría de los CCR de intervalo detectados en programas de cribado de CCR (aquellos tumores detectados entre 2 colonoscopias) corresponden a este tipo de lesión. Además, estudios recientes han demostrado que los pacientes con pólipos serrados múltiples y/o grandes tienen un riesgo incrementado de desarrollar CCR10–12.
El objetivo de este artículo es describir el concepto de vía serrada de carcinogénesis, pólipo serrado y del síndrome de poliposis serrada (SPS), así como explicar sus implicaciones clínicas para el diagnóstico, tratamiento y seguimiento de estas lesiones.
Metodología de búsquedaSe ha realizado una búsqueda en PubMed de artículos científicos (originales y revisiones) en lengua inglesa con las siguientes palabras: «serrated polyps»; «hyperplastic polyposis»; «serrated polyposis» e «hyperplastic polyps».
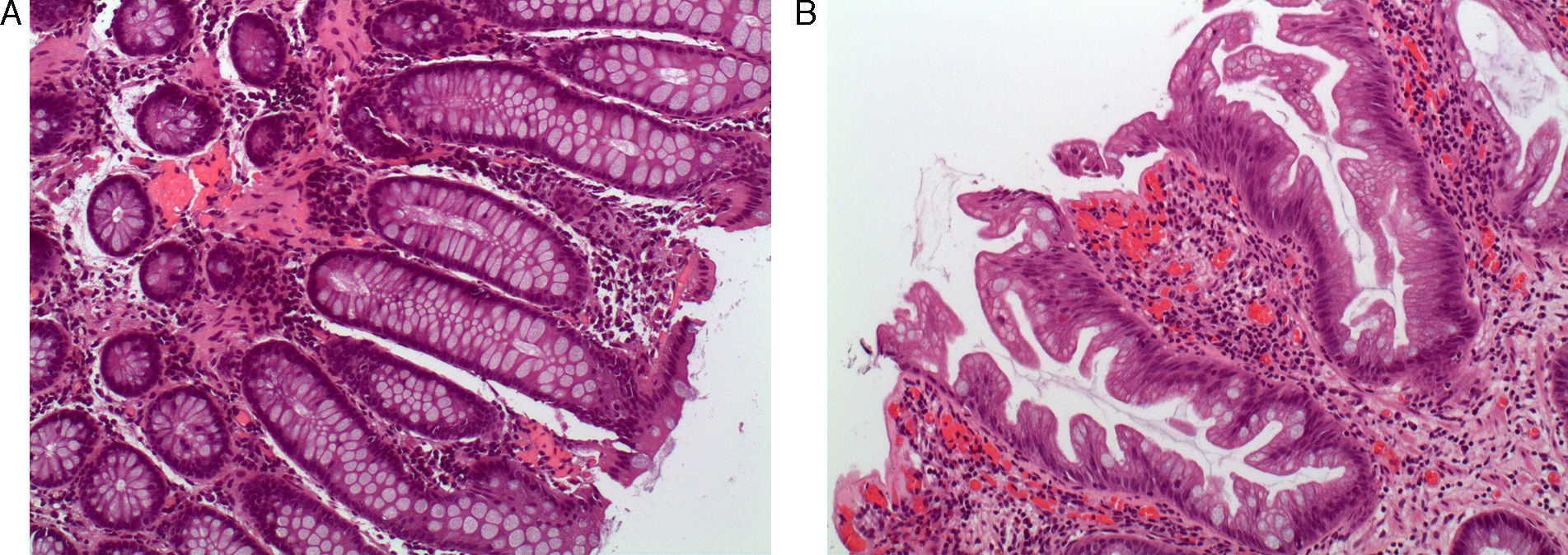
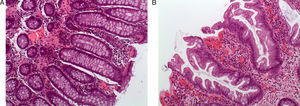
Pólipos serrados: concepto y clasificaciónTradicionalmente el pólipo hiperplásico se ha considerado una lesión benigna sin riesgo de progresión neoplásica. Sin embargo, los pólipos hiperplásicos son solo una parte del espectro de los pólipos serrados, y hoy sabemos que algún subtipo de estos tiene potencial de transformación a carcinoma colorrectal a través de la denominada «vía serrada»7,8. Este grupo de lesiones tienen como característica histológica común la apariencia en «dientes de sierra» en el epitelio de la cripta debido a una acumulación de los colonocitos en la misma secundario a una inhibición de la apoptosis (fig. 1 A y 1B).
Aspecto histológico de los pólipos serrados. (A) Mucosa colónica normal (hematoxilina eosina×100). Nótese la morfología recta de las criptas en el corte longitudinal. (B) Adenoma serrado sésil (hematoxilina eosina×100). La característica principal de los pólipos serrados la constituye el aspecto en dientes de sierra de las criptas en el corte longitudinal. El aspecto de la cripta en los cortes transversales suele ser estrellado. Nótese la presencia de serración de la cripta hasta la base de la misma, característica típica del adenoma serrado sésil. Imágenes originales cedidas por la Dra. Cuatrecasas.
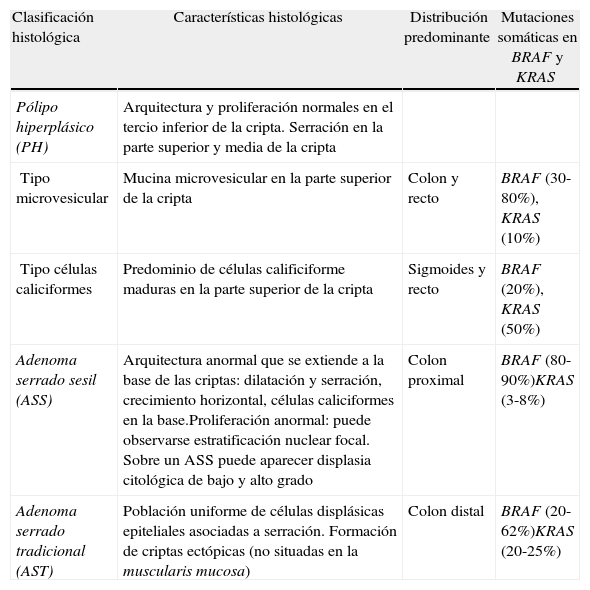
Pese a que las lesiones serradas se describieron hace más de 2 décadas, ha existido cierta controversia en cuanto a su clasificación anatomopatológica. En la actualidad, las lesiones serradas se clasifican mediante los criterios de la OMS en 3 categorías (tabla 1):
Clasificación anatomopatológica de los pólipos serrados
| Clasificación histológica | Características histológicas | Distribución predominante | Mutaciones somáticas en BRAF y KRAS |
| Pólipo hiperplásico (PH) | Arquitectura y proliferación normales en el tercio inferior de la cripta. Serración en la parte superior y media de la cripta | ||
| Tipo microvesicular | Mucina microvesicular en la parte superior de la cripta | Colon y recto | BRAF (30-80%), KRAS (10%) |
| Tipo células caliciformes | Predominio de células calificiforme maduras en la parte superior de la cripta | Sigmoides y recto | BRAF (20%), KRAS (50%) |
| Adenoma serrado sesil (ASS) | Arquitectura anormal que se extiende a la base de las criptas: dilatación y serración, crecimiento horizontal, células caliciformes en la base.Proliferación anormal: puede observarse estratificación nuclear focal. Sobre un ASS puede aparecer displasia citológica de bajo y alto grado | Colon proximal | BRAF (80-90%)KRAS (3-8%) |
| Adenoma serrado tradicional (AST) | Población uniforme de células displásicas epiteliales asociadas a serración. Formación de criptas ectópicas (no situadas en la muscularis mucosa) | Colon distal | BRAF (20-62%)KRAS (20-25%) |
Constituye el subtipo más numeroso dentro de las lesiones serradas (se estima que alrededor del 80-90%)13. Mediante endoscopia se puede identificar como una lesión poco elevada, normalmente <5mm, pálida o blanquecina, o de coloración similar a la mucosa circundante. Habitualmente está cubierta de una fina capa de moco y presenta una débil red vascular, al contrario de los adenomas que normalmente son hipervasculares. Los pólipos hiperplásicos (PH) suelen ser numerosos y se localizan predominantemente en recto y colon sigmoide. Histológicamente se caracterizan por conservar una arquitectura normal, con poca distorsión y proliferación sin displasia. Presentan cúmulos celulares en «dientes de sierra» en la parte superior y media de la cripta, y proliferación normal en la cripta inferior. Los PH se dividen en 2 subtipos histológicos (microvesicular y rico en células caliciformes). Pese a que el subtipo microvesicular se ha asociado a un mayor riesgo de malignización, los datos actuales son controvertidos7.
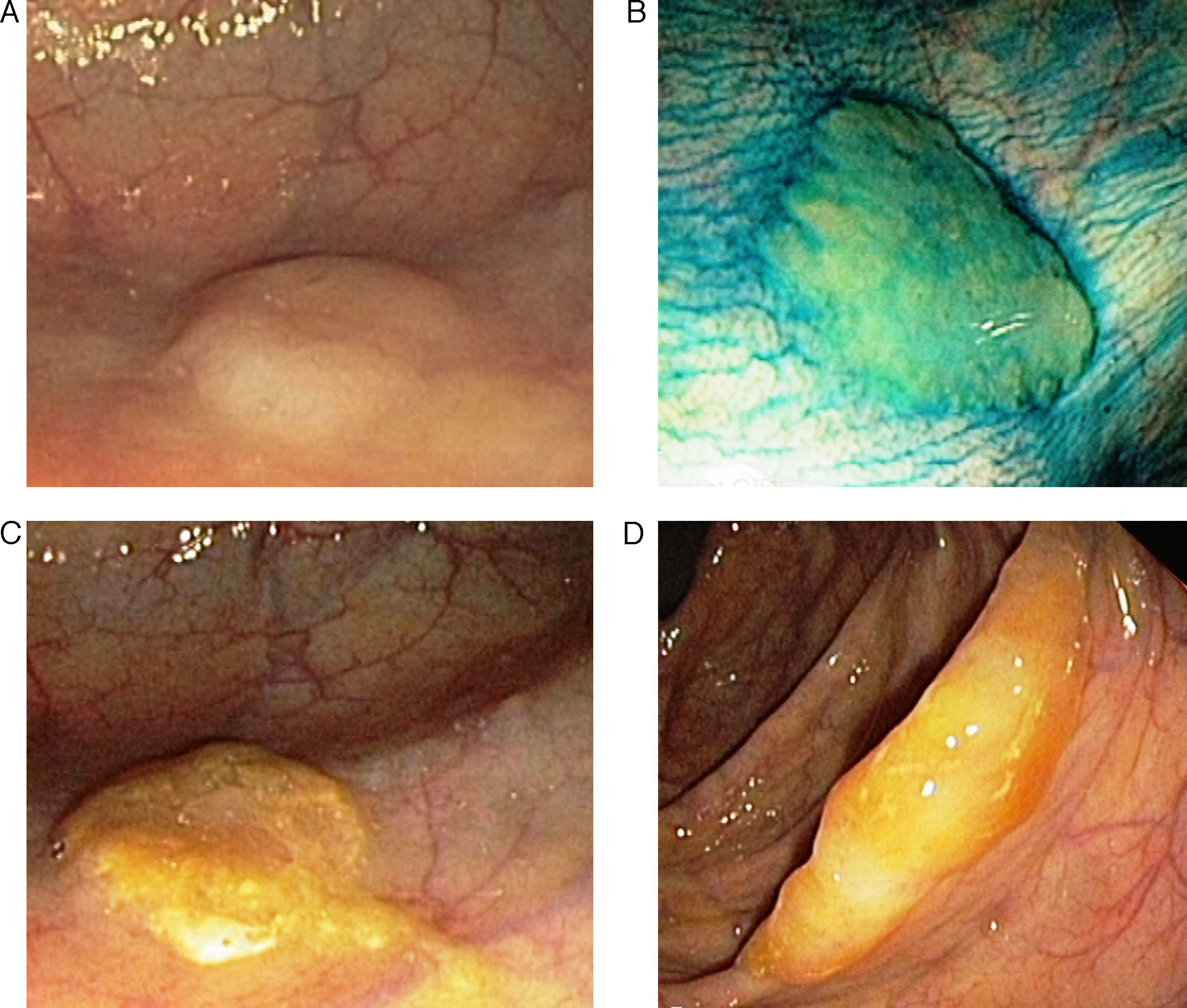
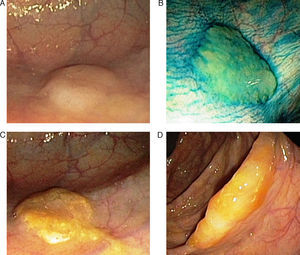
Adenoma o pólipo serrado sésilSupone un 15-20% de las lesiones serradas y se considera la lesión preneoplásica clave en la vía serrada de carcinogénesis7,8,13,14. El aspecto macroscópico revela lesiones planas o poco elevadas, mayores de 5mm, habitualmente cubiertas por una capa de moco, y de predominio en colon proximal15. Estas características y la localización habitual en el colon derecho son responsables de que este tipo de lesiones pasen desapercibidas con mucha frecuencia16 (fig. 2).
Aspecto endoscópico de los pólipo serrados. (A) Pólipo plano localizado en el colon derecho. Es muy característica la pérdida del patrón vascular como único signo de la presencia de un pólipo serrado. (B) La aplicación de cromoendoscopia con índigo carmín facilita la caracterización de la lesión y la determinación de sus límites. (C y D). Pólipos planos en el colon derecho. La presencia de un tapón de moco en la superficie del pólipo es una característica muy típica de los pólipos serrados. Imágenes originales extraídas de los archivos de la Unidad de Endoscopia del Hospital Clínic de Barcelona.
Al examinarla bajo el microscopio, la cripta presenta una arquitectura anormal, está dilatada y muestra un crecimiento desordenado. Estas alteraciones se extienden a la parte inferior de la misma, observándose «dientes de sierra» en su base. Es muy característica la presencia de criptas que crecen paralelas a la muscularis mucosae con forma de T invertida o de L. Debido a esta característica, si la biopsia endoscópica no es suficientemente profunda para evaluar la base de la cripta, el diagnóstico diferencial entre PH y adenoma o pólipo serrado sésil (ASS) puede ser difícil. Deben distinguirse los ASS sin displasia citológica de los que sí la presentan, que al igual que en los adenomas puede ser de bajo y alto grado.
Adenoma serrado tradicionalSe trata de un subtipo de lesión poco frecuente (1-6%)14, habitualmente pediculada y más común en el colon izquierdo (60%). Presenta dientes de sierra muy prominente y displasia citológica similar a los adenomas, lo que la diferencia del ASS.
Pese a que esta clasificación goza de consenso entre los anatomopatólogos, todavía existe una importante variabilidad interobservador17, de forma que lo más frecuente es que los ASS sean clasificados como pólipos hiperplásicos.
Vía serrada de carcinogénesisLa caracterización molecular genética y epigenética de los pólipos y adenocarcinomas serrados en los últimos años, junto con su mejor caracterización histológica, ha proporcionado pruebas convincentes a favor de la llamada «vía serrada» de carcinogénesis, y su distinción de la secuencia adenoma-carcinoma clásica7. Por ejemplo, a diferencia de la vía clásica de carcinogénesis, donde la pérdida de heterocigosidad o pérdida alélica en los genes APC y p53 es la característica principal, este es un fenómeno poco frecuente en las lesiones serradas. Las alteraciones moleculares propias de la «vía serrada» incluyen: 1) la activación de la vía de señalización de las MAPK cinasas (mutación en BRAF y KRAS), 2) el silenciamiento epigenético de genes a través de la hipermetilación de sus regiones promotoras, y 3) la adquisición del fenotipo de inestabilidad de microsatélites (IMS) secundaria a metilación del promotor del gen MLH1, integrante de la familia de los genes reparadores del ADN cuya mutación germinal es responsable del síndrome de Lynch. Tomando como base los estudios de correlación molecular e histológica, se reconocen 2 subtipos de vía serrada de carcinogénesis: la «vía serrada sésil» y la «vía serrada alternativa». La llamada «vía serrada sésil» se caracteriza por presentar mutación en el protooncogén BRAF como alteración más precoz, y mostrar el llamado CpG Island Methylator Phenotype (CIMP-high), caracterizado por la metilación aberrante de genes supresores de tumores que contribuirían a la progresión neoplásica. Esta vía se caracteriza por la presencia de IMS secundaria a metilación de MLH1. La lesión preneoplásica central en esta vía es el ASS, y típicamente los CCR aparecen con más frecuencia en el colon proximal. La llamada «vía serrada alternativa» se caracteriza por mutación en el protooncogén KRAS, la presencia de un fenotipo metilador más atenuado (llamado CIMP-low), y frecuente metilación del promotor de MGMT. La correlación histológica y molecular en esta vía es menor que en la «vía serrada sésil», y la lesión preneoplásica se cree que es el adenoma serrado tradicional (AST).
Síndrome de poliposis serradaEl SPS, antes conocido como síndrome de poliposis hiperplásica, se caracteriza fenotípicamente por la presencia de múltiples pólipos serrados y/o de gran tamaño en el colon, que predispone al desarrollo de CCR8,16,18,19. Aunque su incidencia real es desconocida, estudios de cribado en población de riesgo medio mediante sigmoidoscopia estiman una incidencia de 1/3,000 sigmoidoscopias20. Por otro lado, 2 estudios recientes en población de cribado basados en prueba de sangre oculta en heces han observado que entre 1/151 y 1/294 individuos con una prueba en heces positiva que se somete a una colonoscopia es diagnosticado de SPS21,22. Estos datos sugieren que la prevalencia es mayor a la publicada. Esto se debe a la dificultad para la detección endoscópica de las lesiones serradas, a la falta de consenso en la clasificación de las mismas por parte de los anatomopatólogos, y al desconocimiento de esta entidad dentro de la comunidad médica, pasando desapercibida con frecuencia13,15,23,24.
De acuerdo con la definición de la OMS el diagnóstico de SPS se establece por la presencia de alguno de los siguientes criterios:
- a.
Presencia de al menos 5 pólipos serrados proximales a sigma, siendo 2 de ellos iguales o mayores a 10mm.
- b.
Cualquier número de pólipos serrados proximales al colon sigmoide en un individuo con antecedentes familiares de primer grado (padres, hermanos, hijos) de SPS.
- c.
Más de 20 pólipos serrados de cualquier tamaño distribuidos a lo largo del colon.
Esta clasificación, aunque fue establecida de forma arbitraria, ha sido de gran utilidad para estandarizar el diagnóstico clínico. Dentro del SPS se reconocen 3 fenotipos diferentes: proximal, distal y mixto. El fenotipo proximal se caracteriza por la presencia de múltiples ASS localizados principalmente en el colon proximal; el fenotipo distal por la presencia de múltiples PH en el recto-sigma, y el mixto por la presencia de pólipos serrados distribuidos por todo el colon. Pese a estas diferencias, no se ha descrito un mayor riesgo de desarrollo de CCR en función del fenotipo25. Por otro lado, es muy frecuente la presencia de adenomas sincrónicos en los pacientes con SPS (hasta en el 70% de los casos)6,10. A diferencia de la poliposis adenomatosa familiar, no existe un riesgo aumentado de lesiones gastroduodenales o neoplasias extracolónicas en el SPS26. La edad al diagnóstico del SPS suele ser entre los 50-60 años, y existe una clara asociación con el hábito tabáquico26.
Actualmente se desconoce la genética del SPS, aunque muestra características sugestivas de una prediposición genética, que incluye la multiplicidad de lesiones, la edad temprana de diagnóstico y la mayor prevalencia de historia familiar de neoplasia. Así, hasta el 50% de los pacientes con SPS presentan historia familiar de CCR y el riesgo de CCR en los familiares de primer grado se multiplica por 5 con respecto a la población general27. Sin embargo, raramente existen varios casos de SPS dentro de una familia. En una pequeña proporción de pacientes con SPS que presentan una poliposis adenomatosa concomitante se han identificado mutaciones germinales bialélicas en MUTYH28.
Importancia clínica de los pólipos serrados y del síndrome de poliposis serradaExisten 3 razones principales que implican a los pólipos serrados en la carcinogénesis colorrectal. En primer lugar, el SPS se ha asociado en diferentes estudios con el desarrollo de CCR. Un estudio reciente con una cohorte numerosa de pacientes con SPS ha mostrado que hasta el 35% de los pacientes desarrollan CCR y, además, que el número de PH y ASS se correlaciona con la presencia de CCR10. En segundo lugar, se ha establecido una relación clínica y molecular entre los pólipos serrados y el CCR esporádico, especialmente con aquellos tumores con IMS29. Los pólipos serrados, en particular los ASS, están localizados habitualmente en el colon proximal y comparten características moleculares con el cáncer esporádico con IMS (causado por la metilación somática del gen MLH129–31), como el fenotipo CIMP y la presencia de mutaciones en el gen BRAF7. Estas 2 características, como se ha comentado con anterioridad, constituyen la base molecular de la «vía serrada». Por último, recientemente se ha descrito que los pacientes con pólipos serrados esporádicos (aquellos que ocurren en ausencia de SPS) tienen mayor riesgo de neoplasia colorrectal sincrónica y metacrónica. El mayor riesgo de CCR en los pólipos serrados está relacionado con la multiplicidad, la histología de ASS, tamaño ≥10mm y la localización proximal; estas características definen el pólipo serrado de alto riesgo y a la vez hacen más probable la presencia tanto de adenomas convencionales como de neoplasias sincrónicas avanzadas (incluyendo adenomas avanzados y CCR). Así, pese a que la evidencia actual es escasa, en los pacientes con este tipo de lesiones se recomienda realizar una vigilancia endoscópica periódica11,12,14,32,33.
Aunque existen datos a favor de la mayor rapidez de progresión de las lesiones serradas10,34, su historia natural sigue siendo desconocida, especialmente en cuanto a su tasa de crecimiento y la incidencia de progresión a cáncer. En el SPS, son numerosos los estudios que lo relacionan con el desarrollo de CCR. En las publicaciones de varias series de casos, entre el 25 y el 70% de los pacientes con SPS presentaban un CCR al diagnóstico o durante el seguimiento10,18,20,35–40. En la serie más larga, con una cohorte de 77 pacientes, hasta el 35% de los sujetos desarrollaron CCR (28,5% al diagnóstico y 6,5% durante la vigilancia)10.
Los pólipos serrados se han relacionado con la aparición de CCR de intervalo en los programas de cribado poblacional de CCR, que es aquel que aparece entre 2 exploraciones endoscópicas de cribado y traduce el fracaso en la detección precoz de estas lesiones. El CCR de intervalo comparte las mismas características clínicas y moleculares que los pólipos serrados, localización proximal y alteraciones moleculares propias de la vía serrada (mutación en el gen BRAF y CIMP), por lo que se ha sugerido que una de las principales causas del CCR de intervalo son los pólipos serrados inadvertidos41.
Por último, varios estudios han demostrado que el uso de cromoendoscopia o narrow band imaging, 2 técnicas endoscópicas de mapeo basadas en el uso de colorantes o en la modificación del espectro de la luz, facilitan la detección de pólipos serrados, tanto en población de riesgo medio como en pacientes con SPS23,24,33,42–44. Así, la mayoría de los autores recomiendan el uso de estas técnicas para optimizar la tasa de detección, especialmente en pacientes con SPS (fig. 2B).
Manejo terapéutico de los pólipos serrados y del síndrome de poliposis serrada SPSPólipos serrados esporádicosLa evidencia actual recomienda la resección completa de los pólipos serrados8,10–12,14,15. La única excepción la constituyen los PH de pequeño tamaño (<5mm) localizados en el recto-sigma, que no han demostrado asociarse a un incremento del número de adenomas proximales ni de CCR y por tanto su resección no está formalmente indicada. Cualquier pólipo serrado proximal al colon sigmoide debe ser considerado como una lesión potencialmente premaligna y por tanto se recomienda su resección completa. En caso de que exista duda de si la resección ha sido completa (hecho que ocurre con frecuencia en lesiones planas de gran tamaño localizadas en el colon proximal) se recomienda repetir la exploración en el plazo de 3-6 meses para comprobar la base de resección33.
Además del tratamiento endoscópico, existen diferentes escenarios clínicos en los que el tratamiento quirúrgico puede estar indicado:
- 1)
Irresecabilidad. En el caso de que un pólipo serrado se considere irresecable endoscópicamente, habitualmente por tamaño y/o localización, debe considerarse una resección quirúrgica segmentaria, teniendo en cuenta factores relacionados con el pólipo (histología de ASS o AST, presencia de displasia) y con el paciente (edad, comorbilidad)45.
- 2)
Multiplicidad. Los individuos que presentan múltiples pólipos serrados en el colon proximal (sin cumplir criterios de SPS) de difícil control endoscópico podrían beneficiarse de una colectomía parcial dado el riesgo incrementado de neoplasia avanzada sincrónica y metacrónica45.
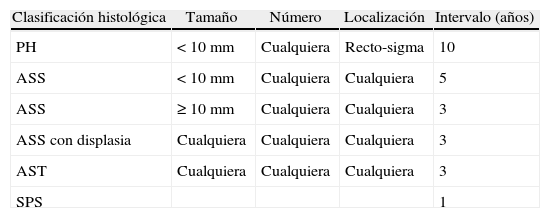
Con la información disponible, es difícil definir una estrategia de vigilancia basada en la evidencia, por lo que son necesarios más estudios para evaluar qué intervalos son los adecuados. Sin embargo, recientemente la US Multi-Society Task Force on Colorectal Cancer, un grupo de expertos que engloba las principales sociedades americanas involucradas en el manejo del CCR, ha publicado un documento de consenso que propone una estrategia de vigilancia para los pólipos serrados en función del tamaño, número, localización e histología de las lesiones (tabla 2)33. Así, la situación de mayor riesgo la define la presencia de ASS de≥10mm o con displasia asociada, o la presencia de un AST, en la que se recomienda la realización de una colonoscopia de vigilancia en el plazo de 3 años.
Recomendaciones para la vigilancia de los pólipos serrados
| Clasificación histológica | Tamaño | Número | Localización | Intervalo (años) |
| PH | <10mm | Cualquiera | Recto-sigma | 10 |
| ASS | <10mm | Cualquiera | Cualquiera | 5 |
| ASS | ≥10mm | Cualquiera | Cualquiera | 3 |
| ASS con displasia | Cualquiera | Cualquiera | Cualquiera | 3 |
| AST | Cualquiera | Cualquiera | Cualquiera | 3 |
| SPS | 1 |
Fuente: Lieberman et al.33
ASS: adenoma serrado sésil; AST: adenoma serrado tradicional; PH: pólipo hiperplásico; SPS: síndrome de poliposis serrada.
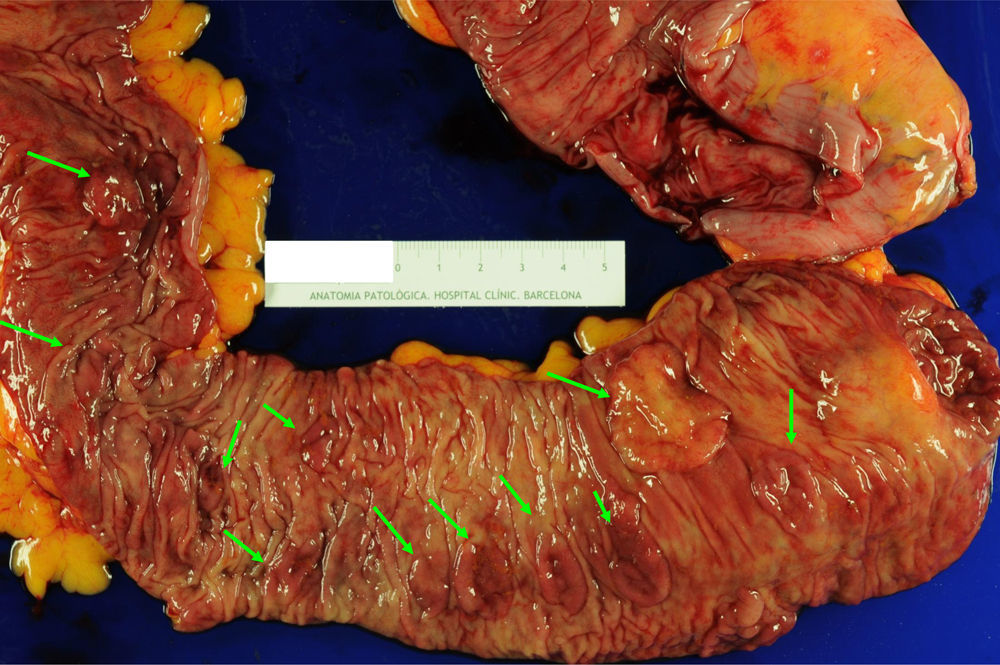
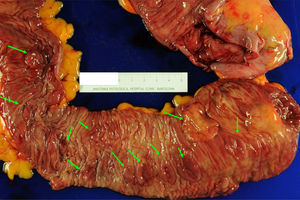
El manejo del SPS es empírico y contempla la resección de los pólipos, la vigilancia endoscópica y la realización de consejo genético. Ante el hallazgo de un CCR, se recomienda la realización de una colectomía total con anastomosis ileorrectal para eliminar el riesgo de lesiones metacrónicas6,10,16,26 (fig. 3). Tras la cirugía, se recomienda la realización de rectoscopias de vigilancia cada 6-12 meses para valoración del remanente rectal. Si la presentación es en forma de múltiples pólipos, la actitud depende de la posibilidad de resección endoscópica completa. Si esto es posible, se recomienda llevar a cabo colonoscopias de vigilancia cada 1-2 años realizando resección de todos los pólipos, o al menos aquellos >3-5mm. Si por el contrario los pólipos no son resecables por tamaño o número, o no se puede realizar un seguimiento endoscópico adecuado, se debe considerar la opción de una colectomía total con anastomosis ileorrectal.
Pieza de colectomía en paciente con síndrome de poliposis serrada. Este caso se trata de una paciente de 59 años diagnosticada de SPS en el contexto del cribado poblacional de CCR. Se indicó una colectomía total con anastomosis ileorrectal por poliposis no controlable endoscópicamente. Puede observarse la presencia de múltiples pólipos planos (flechas verdes) de predominio en el colon proximal (válvula ileocecal a la derecha de la imagen). Estos pólipos mostraron histología de adenoma serrado sésil, y en 2 de ellos se detectó adenocarcinoma (T1N1M0 y T2N1M0). Imagen original cedida por la Dra. Cuatrecasas.
En relación con el riesgo de CCR en los familiares, se recomienda la realización de colonoscopias de cribado a todos los familiares de primer grado (padres, hermanos, hijos) a partir de los 35-40 años o 10 años antes de la edad del caso más joven. Se recomiendan endoscopias de vigilancia cada 5 años, modificando dichos intervalos en caso de la detección de pólipos27.
ConclusionesLos pólipos serrados constituyen un grupo heterogéneo de lesiones (PH, ASS y AST) que se caracterizan por una apariencia histológica en «dientes de sierra». Considerados benignos hasta hace pocos años, hoy sabemos que estos presentan potencial de transformación a CCR a través de la denominada «vía serrada» de carcinogénesis. La evidencia actual indica que los pólipos serrados requieren resección completa y vigilancia endoscópica, basada en los factores asociados a mayor riesgo de transformación neoplásica como son el tamaño ≥10mm, la presencia de displasia asociada, la multiplicidad de lesiones y la localización proximal.
El SPS es una entidad caracterizada por la presencia de pólipos serrados múltiples y/o grandes que asocia un riesgo elevado de CCR. El manejo de los pacientes con SPS y sus familiares requiere una evaluación multidisciplinar que incluya endoscopistas, gastroenterólogos y cirujanos expertos en un contexto de unidades de alto riesgo de CCR.
Finalmente, a pesar de los grandes avances en la descripción de las lesiones serradas y el progresivo conocimiento de sus características moleculares y comportamiento clínico, son necesarios más estudios prospectivos para establecer recomendaciones y guías del manejo terapéutico basadas en la evidencia.
Conflicto de interesesNinguno.
A Miriam Cuatrecasas por la cesión de las imágenes histológicas.