En la actualidad el tratamiento de la vía biliar extrahepática afectada por cáncer, estenosis, lesiones iatrogénicas y otras patologías consiste en la resección de las mismas, y una anastomosis en los casos más graves de la placa hiliar biliar al intestino delgado.
Material y métodosNuestro grupo ha desarrollado un tubo tridimensional de colágeno y agarosa para reparar la vía biliar. Se emplearon 40 animales de experimentación, que fueron estudiados fisiológica e histológicamente a las 4 semanas, 3 y 6 meses.
ConclusionesNuestras prótesis mostraron gran histocompatibilidad y mantenían una normofisiología que hace pensar en las posibles aplicaciones clínicas que podrían tener en un futuro.
In recent years, with widespread laparoscopic cholecystectomy and liver transplantation, complications involving the biliary system are increasing. All current techniques have a high risk of recurrence or high-morbidity.
Material and methodsA 3-dimensional collagen bile duct modified with agarose hydrogel was developed to substitute the affected extrahepatic bile duct. It was used in 40 guinea pigs and the histology and physiology was studied at 4 weeks, 3 and 6 months after transplantation.
ConclusionsThe graft shows to have a high potential in applications to treat hepatobiliary diseases which require surgery.
En la actualidad el tratamiento de la vía biliar extrahepática afectada por cáncer, estenosis, lesiones iatrogénicas y otras patologías consiste en la resección de las mismas, y una anastomosis en los casos más graves de la placa hiliar biliar al intestino delgado. Esta técnica, en muchos casos, tiene un transcurso dificultado por infecciones retrógradas de la vía biliar a través de los patógenos que ascienden del intestino, o debido a complicaciones como la estenosis de la anastomosis, que requieren una nueva intervención para rehacer la técnica quirúrgica. En menor número de casos, el estancamiento de las secreciones biliares y la dificultad para el flujo de la bilis, requerirán un trasplante hepático incluso en aquellos casos en los que únicamente la porción afectada es extrahepática. En aquellos pacientes receptores de injertos hepáticos, puede ocurrir en el seno de un rechazo crónico una nueva estenosis de la anastomosis biliar, requiriendo de este modo un retrasplante1.
Si pudiéramos obtener un tubo artificial que funcionara morfológica e histológicamente de la misma manera que la vía biliar nativa, podría utilizarse como sustituto de las vías biliares patológicas, evitando de este modo complejas técnicas quirúrgicas que dificultan el paso de la bilis y, finalmente, evitando el trasplante hepático en aquellas enfermedades en las que el parénquima hepático se encuentra indemne. Nuestro grupo está desarrollando, basado en esta idea y gracias a las nuevas biotecnologías, un conducto artificial que mantiene las propiedades morfológicas, histológicas y funcionales de la vía biliar nativa.
En la bibliografía actual existen pocas referencias a conductos artificiales creados para sustituir vías biliares patológicas, algunas con la ayuda de biopolímeros y otras con la de estructuras histológicas de otra índole. Hasta el momento, estas o bien no presentaban una biocompatibilidad suficiente para permitir el flujo de la bilis (biopolímeros), o bien no se integraban histológicamente en el ambiente (intestino, vasos sanguíneos)2–4.
En cuanto hemos tenido las técnicas suficientes para obtener colágeno y poder moldearlo a nuestro antojo, nuestro equipo modificó una estructura tridimensional tubular de colágeno bovino, cubierta por hidrogeles, totalmente biocompatible. Estos nuevos conductos fueron implantados en animales de experimentación (cobayas) sustituyendo a la vía biliar nativa. Se evaluó la funcionalidad histológica y fisiológica de los mismos.
Material y métodosSustituto biliarSe construyeron tubos tridimensionales de colágeno de 4mm de diámetro y 1mm de grosor de la pared (fig. 1). El tamaño de los poros formados es de 200nm. Posteriormente se recubrieron todas sus superficies con hidrogel agarosa al 2%. Para su almacenamiento se emplearon estufas a 37°C.
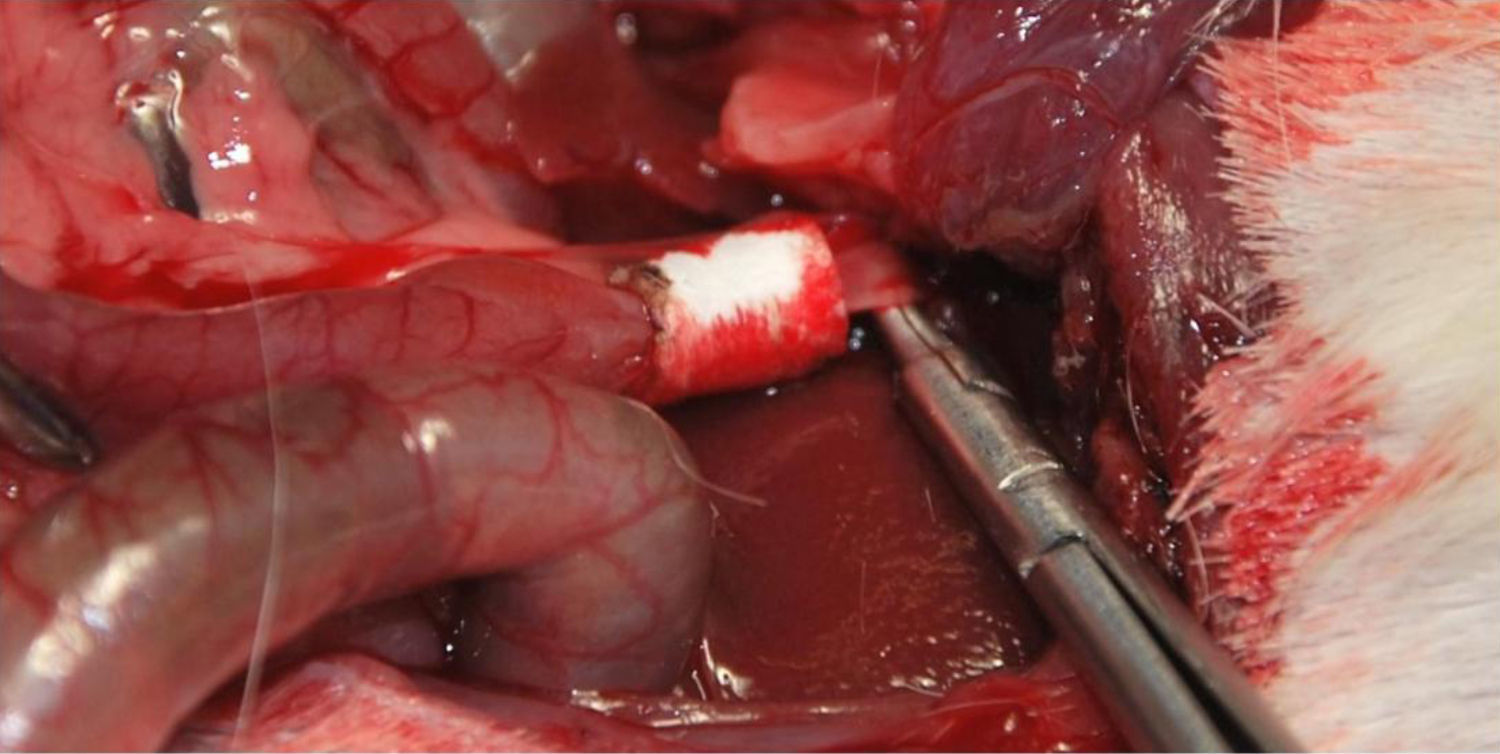
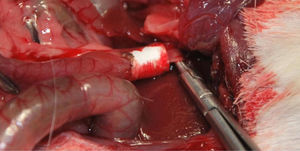
Implantación del conducto artificial en los animales de experimentaciónSe implantó el conducto a 40 cobayas (Grupo 1: 13 cobayas; Grupo 2: 13 cobayas; Grupo 3: 14 cobayas) de la raza Dunkin Hurtley con un peso aproximado de 1kg±200g. En todas ellas se sustituyó la vía biliar extrahepática en la porción comprendida entre la inserción del conducto cístico y la ampolla de Vater. Para la intervención se realizó una incisión subcostal derecha para acceder directamente a las vías biliares, realizando una inducción anestésica con 20mg/kg de ketamina, y manteniendo una infusión continua de propofol a razón de 0,2mg/kg/min. Una vez identificado el conducto común hepático en el interior del ligamento hepatoyeyunal, se realizó una sección circunferencial por debajo de la inserción del conducto cístico. A este nivel se interpuso la prótesis de colágeno con la ayuda de material de sutura compuesto de ácido poliláctico de reabsorción lenta de calibre 10/0 a través del microscopio quirúrgico (fig. 2). Los animales de experimentación se estabularon según la normativa vigente. Durante los primeros 7 días postoperatorios se administró por vía subcutánea analgesia y antibioterapia (azitromicina).
Estudio morfológico y funcionalLos animales fueron sacrificados a las 4 semanas, 3 meses y 6 meses tras la sustitución del conducto biliar. Tras el sacrificio se realizó un estudio histológico mediante tinción de hematoxilina-eosina. Del mismo modo, los especímenes fueron expuestos a antígenos de membrana epitelial y de queratina de bajo peso molecular. Todo ello fue comparado con los especímenes obtenidos de la vía biliar nativa conseguida de 10 cobayas control. Todos ellos fueron estudiados del mismo modo.
ResultadosTodos los animales de experimentación sobrevivieron hasta el momento de su sacrificio (4 semanas en el Grupo 1; 3 meses en el Grupo 2; 6 meses en el Grupo 3) tras la implantación del conducto artificial. Se desarrollaron fisiológicamente, ganancia de peso y tamaño, de manera similar a los animales control (1,9kg±200 g). En todos los grupos se realizó una medición de los niveles sanguíneos de bilirrubina y enzimas hepáticas tras el sacrificio, obteniendo niveles normales en los 40 animales intervenidos (tabla 1).
Cambios en las enzimas biliares y hepáticas en los tests sanguíneos de las cobayas trasplantadas a lo largo del periodo de estudio frente a los valores normales del grupo control
| 4 semanas tras Tx (n=13) | 3 meses tras Tx (n=13) | 6 meses tras Tx (n=14) | Controles (n=10) | |
| Bil total (mg/dL) | 0,12 (±0,02) | 0,11 (±0,02) | 0,10 (±0,02) | 0,10 (±0,02) |
| ALP (IU/L) | 27 (±5) | 24 (±5) | 20 (±5) | 20 (±5) |
| ALT (IU/L) | 90 (±5) | 82 (±5) | 80 (±5) | 78 (±5) |
Los resultados se presentan como la media del grupo±desviación estándar.
Macroscópicamente todos los conductos artificiales implantados parecían completamente degradados a partir de las 4 semanas, aunque persistían adherencias y ligera inflamación de los tejidos adyacentes. Los especímenes extraídos a partir de los 3 meses (3 y 6 meses) se encontraban completamente reabsorbidos, y el aspecto era comparable al de la vía biliar nativa, persistiendo ligeras adherencias de los tejidos circundantes. El aspecto macroscópico del hígado era completamente normal, sin observarse signos de cirrosis.
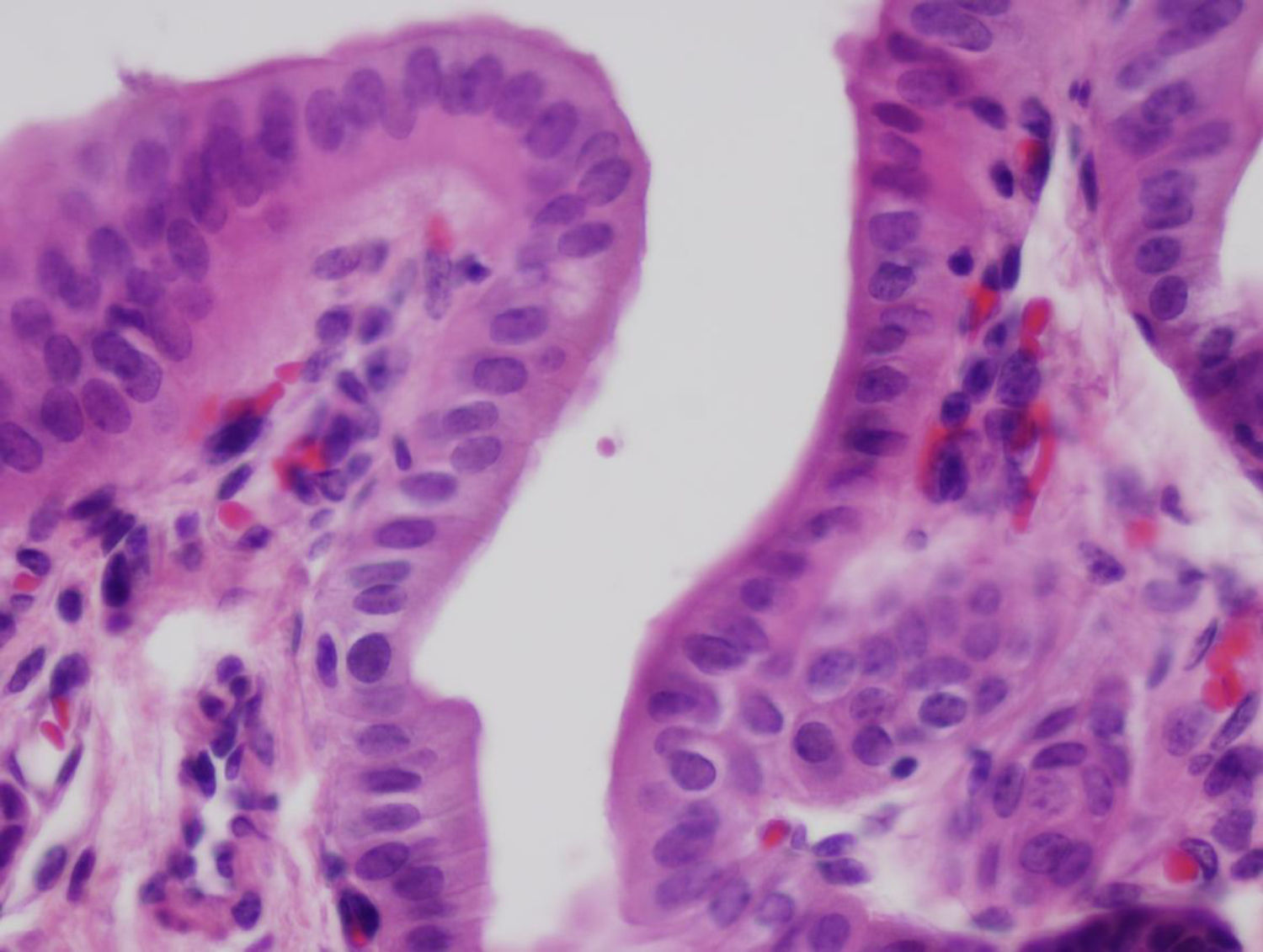
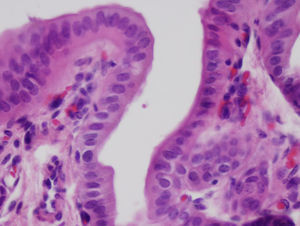
El neoconducto a partir de las 4 semanas estaba parcialmente reabsorbido, observándose algunos granulomas en los extremos distales donde estaban presentes las suturas de ácido poliláctico. Se observan algunas áreas con la presencia de tejido glandular bajo el epitelio biliar. Todo el trayecto del neoconducto se encontraba reepitelizado, aparentemente con el mismo grosor en todos sus extremos, con algunas áreas irregulares (fig. 3). En el estudio realizado al neoconducto a partir de los 3 y 6 meses, el tubo artificial era indetectable. Todo el conducto estaba cubierto por un epitelio columnar simple. El colágeno que conformaba el tubo artificial estaba sustituido por tejido conjuntivo denso y cubierto en su cara intraabdominal por un epitelio de características similares al mesotelio de otros órganos. Apenas existía presencia de tejido glandular bajo la superficie del epitelio biliar. En todos los casos, el tejido hepático no sufrió ningún tipo de alteración, sin presencia de estasis biliar ni de cirrosis, como se demostró a través de los cortes histológicos del parénquima hepático obtenidos. No se evidenciaron restos de las suturas empleadas. La transición en los extremos entre el neoconducto y la vía biliar nativa no pudo llegar a localizarse, debido a la inexistencia de diferencias tisulares entre las porciones.
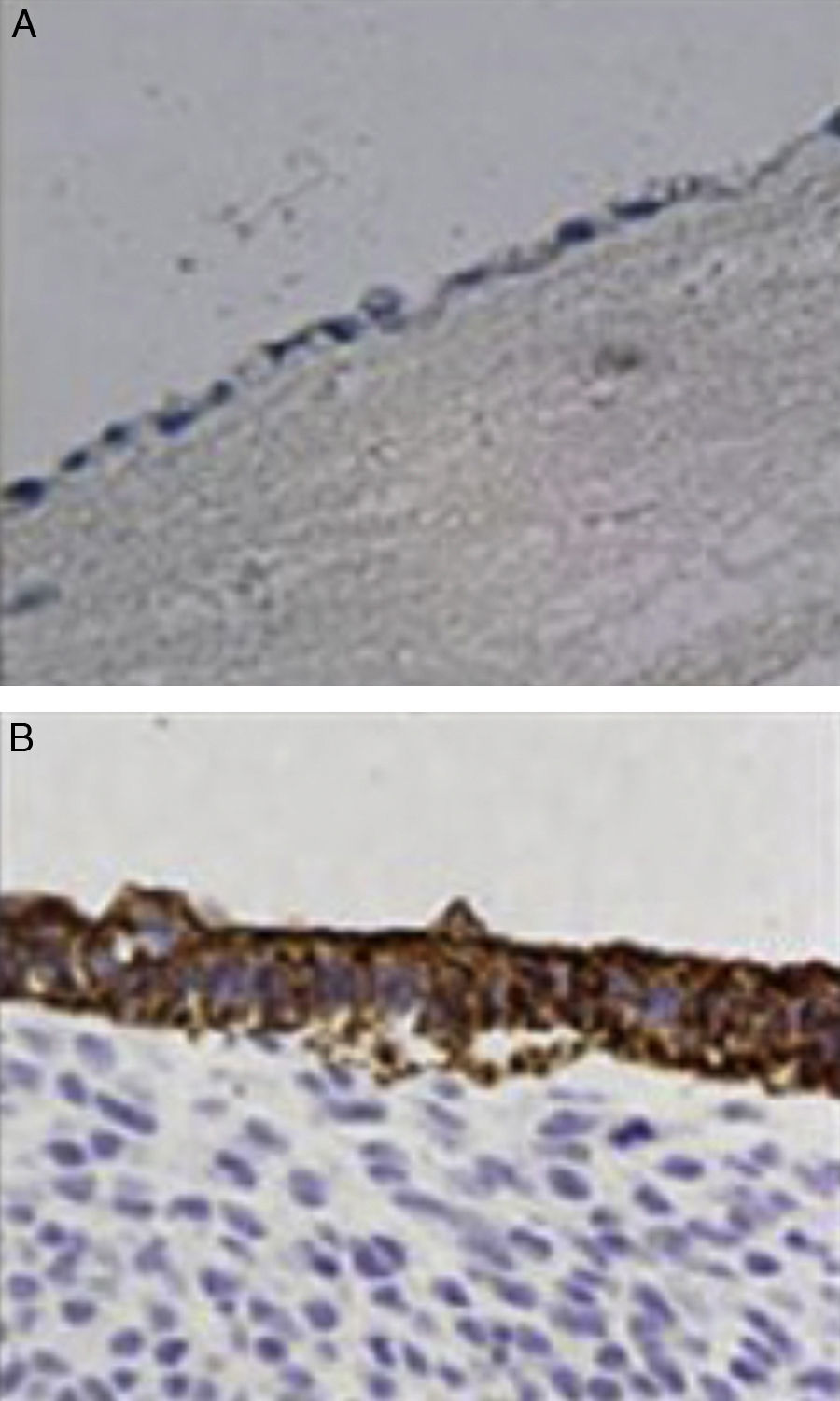
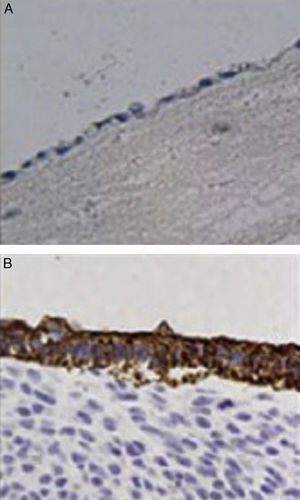
InmunohistoquímicaTodos los especímenes fueron expuestos a los antígenos frente a membrana epitelial y frente a queratina de bajo peso molecular (CAM 5.2 anticuerpo). Todas las células que recubrían la luz del neoconducto fueron positivas para el antígeno frente a membrana epitelial, mostrando una organización similar a las células epiteliales de la vía biliar nativa. Por otro lado, la positividad para los antígenos que muestra la queratina de bajo peso molecular fue menor que la observada en los controles (fig. 4).
DiscusiónEl conducto tridimensional implantado se integra morfológica y fisiológicamente dentro de la vía biliar, manteniendo las funciones de conducción de la bilis y evitando técnicas con morbimortalidad elevada, así como costes sanitarios altos. La integración tisular que se produce a partir de las 4 semanas lleva a pensar que el conducto sirve de estructura para la regeneración a partir de los extremos nativos del tejido biliar nativo. Podríamos deducir múltiples aplicaciones que pueden desarrollarse en la clínica actual. Ante la presencia de estenosis o afecciones cancerígenas propias de la vía biliar extrahepática, estos segmentos pueden ser extirpados y sustituidos por el conducto artificial mediante anastomosis término-terminales. De este modo podemos preservar la papila de Vater, manteniendo las funciones biológicas de esta válvula, evitando infecciones retrógradas que ocurren en las anastomosis biliodigestivas. Si nuestro proyecto llega a ser factible, la disponibilidad en todo momento de un neoconducto biliar puede evitar derivaciones con grandes riesgos y ser utilizadas en multitud de técnicas que necesiten la extirpación de segmentos de conductos biliares, evitando las complicaciones derivadas y, finalmente, el trasplante.
Podemos pensar que nuestra prótesis se ha integrado correctamente si no aparecen complicaciones tras su implantación. No debemos observar signos o síntomas derivados de la obstrucción al flujo de la bilis producidos por una estenosis del conducto, así como tampoco observar signos que nos hagan pensar en la presencia de una fuga de bilis intraabdominal, debido a dehiscencias o puntos de fuga en las anastomosis. Ninguna de estas complicaciones estuvo presente en nuestros casos. La función favorable que hemos observado en los neoconductos formados en los periodos estudiados nos sugiere que estos injertos podrían ser aplicables a la práctica clínica.
Algunos autores han publicado recientemente el exitoso resultado en la formación de órganos artificiales como los vasos sanguíneos5,6 y el intestino delgado7,8, mediante cultivos celulares. Este principio ha sido utilizado por algunos autores como Rosen et al. para facilitar la reconstrucción de partes de la circunferencia del conducto biliar mediante el uso de submucosa intestinal, a partir de la cual se producía la reepitelización4. En nuestro caso, la reepitelización se produce desde los extremos del conducto artificial, extendiéndose a lo largo de todo el trayecto mediante la migración celular que permiten los poros de la estructura tridimensional que forma el colágeno. La tasa de reepitelización fue similar desde ambos extremos. Esto permite su uso en un mayor número de indicaciones clínicas y facilita la técnica. Grosso modo, podríamos asegurar que las células pluripotenciales biliares son viables y que se diferencian en células epiteliales de manera uniforme, migrando a través del conducto implantado, aunque para poder asegurarlo son necesarios más estudios histológicos dirigidos.
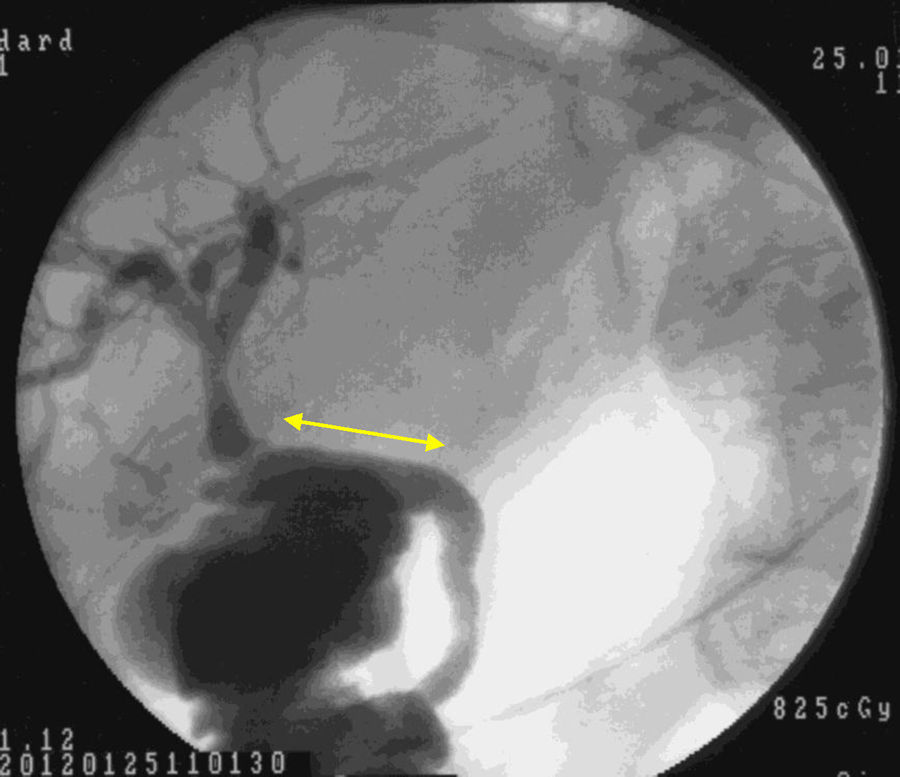
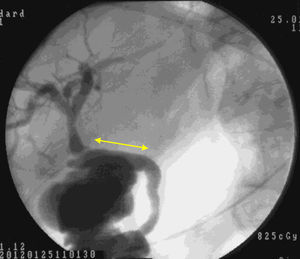
El examen macroscópico mostró que a partir de las 4 semanas, nuestro conducto biocompatible era completamente similar morfológicamente a la vía biliar nativa. La histología y la inmunohistoquímica demostraron que histológicamente la disposición tisular era similar, con una expresión antigénica parecida. En el nuevo ambiente creado, la bilis fluía a través del neoconducto hasta el duodeno (fig. 5). A través de nuestra investigación no hemos podido determinar qué factores estimulan la diferenciación celular y la reepitelización, bien a través de componentes en la bilis, bien mediante estímulos de quimiotaxis.
Nuestro tubo tridimensional de colágeno implantado en los animales de experimentación adquirió una función y forma similares a las de la vía biliar nativa a partir de las 4 semanas tras el injerto. La creación de un neoconducto biliar nos abre nuevas vías terapéuticas para el tratamiento de afecciones confinadas a la vía biliar extrahepática, evitando complejas técnicas quirúrgicas con elevados costes socioeconómicos y alta morbimortalidad. Si en estudios futuros se demuestra la viabilidad a largo plazo de esta prótesis, nuestro conducto tendrá indudablemente una gran aplicación clínica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.