La radioquimioterapia es el tratamiento de elección en el cáncer de recto para conseguir el control de la enfermedad. Los pacientes con respuesta patológica completa (RPC) presentan mejor pronóstico. El objetivo del trabajo es conocer nuestra incidencia de RPC y analizar los resultados oncológicos.
MétodosPacientes con neoplasia de recto estadios ii/iii, recogidos prospectivamente en el periodo comprendido entre 2007 y 2011. Los pacientes son sometidos a neoadyuvancia y a cirugía radical. Se dividen en 22 grupos según tengan o no RPC y se comparan las variables demográficas, clínicas e histológicas y su relación con la evolución oncológica.
ResultadosSe analizan 162 pacientes (62% varones) con una edad media de 65 a. La incidencia de RPC es del 11,7% (19 pacientes). El 50% de los pacientes son T2, el 46% son T3 y el 3% son T4, mientras que el 25% son N1 y el 53% son N2 antes de la neoadyuvancia. En 25 pacientes (15%)se ha practicado una amputación de recto y en 125 (77%) una resección anterior baja. La morbilidad global es del 26,5%(43 pacientes). Con una mediana de seguimiento de 26 meses, ningún paciente con RPC ha presentado recurrencia tumoral. En el grupo de NO-RPC la recidiva local es del 1,4% (p=0,78) y las metástasis del 8,4% (p=0,21), siendo la supervivencia global y la libre de enfermedad mayor en el grupo con RPC pero sin diferencias significativas (p=0,39, p=0,23).
ConclusiónLa presencia de RPC después de tratamiento neoadyuvante se relaciona con mejores resultados oncológicos.
Neoadjuvant chemo-radiotherapy is the treatment of choice for rectal cancer in order to reduce local recurrence. Patients with a pathological complete response (PCR) have a better prognosis. The aim of this study was to determine the influence of PCR on the oncological outcomes in our patients.
MethodsAll patients with stage ii/iii rectal cancer treated with neoadjuvant chemo-radiotherapy and radical resection between 2007 and 2011were identified from a prospective database, and grouped based on whether they achieved PCR or not (non-PCR). Clinical, histological and oncological outcome data were compared.
ResultsA total of 162 patients were included (62% men), with a mean age of 65 years. In terms of pre-operative TNM staging, 82 patients (50%) were T2, 75 (46%) were T3, and 5 (3%) were T4. Forty-two patients (25%) were N1, and 87 (53%) were N2. Low anterior resection and abdominoperineal resection were performed in 125 (77%) and 25 (15%) patients. Forty-three patients (26.5%) had postoperative morbidity. PCR was achieved in 19 patients (11.7%). After a median follow-up of 26 months, there are no recurrences in the PCR group, and in the non-PCR group, local recurrence was 1.4% (P=.78), and distant metastasis was 8.4% (P=.21). Overall survival (P=.39) and survival free of diseases (P=.23) were better in the PCR group, but the differences were not significant.
ConclusionPatients with pathological complete response have better oncological outcome.
El cáncer de recto es uno de los tumores más frecuentes en nuestra sociedad y por ello, objeto de continuos análisis para mejorar sus resultados.
El tratamiento de elección para los estadios ii y iii es la radioquimioterapia seguida de cirugía1 siendo el objetivo de este tratamiento, por un lado, disminuir el estadio tumoral con el ánimo de disminuir la tasa de recidiva local y, por otro, conseguir la esterilización del tumor, es decir, que no exista tumor en el examen clínico. Es lo que se denomina respuesta clínica completa (RCC)2.
Aunque existe una gran variabilidad de respuesta a la neoadyuvancia, entre el 10 y el 30% de los pacientes presentan ausencia de células tumorales en la pieza quirúrgica (ypT0N0), es lo que se denomina respuesta patológica completa (RPC)3. Si bien las implicaciones terapéuticas de la RPC pueden ser controvertidas, parece ser que representa un factor de buen pronóstico4.
El objetivo del trabajo es conocer la incidencia de RPC en nuestra experiencia y analizar su relación con los resultados oncológicos.
Material y métodosPacientes afectos de neoplasia de recto localizado en tercio medio e inferior en estadios ii y iii, sometidos a tratamiento neoadyuvante en el periodo comprendido entre enero de 2007 y diciembre de 2011.
Los pacientes se han recogido en una base de datos prospectiva que incluye los datos demográficos, sintomatología, métodos diagnósticos y biopsia con diagnóstico de adenocarcinoma. Los métodos de estadificación usados han sido TAC toracoabdominal y la ecografía endoanal-RMN rectal para el estudio local. Se han excluido los pacientes sometidos a cirugía urgente, los pacientes con cirugía no curativa (resecciones R1-R2) y los pacientes fallecidos en el postoperatorio, por carecer, lógicamente, de seguimiento.
Los regímenes de neoadyuvancia han sido 5-FU tanto en perfusión continua como en bolus intravenoso o mediante vía oral (capecitabina). El protocolo más usado ha sido la infusión continua durante 6 semanas. La radioterapia preoperatoria se realizó mediante la técnica de 3-4 campos con una dosis media de 50,4Gy.
A las 4 semanas de finalizar el tratamiento, se realizó RMN rectal para reevaluar el estadio tumoral y a las 6 semanas de la neoadyuvancia se practicó cirugía radical mediante la técnica de la escisión total del mesorrecto.
El estadio patológico del tumor se describe según la American Joint Committee on Cancer5 y el grado de regresión tumoral según la clasificación de Dworak6. Los estudios fueron realizados siempre por patólogos expertos.
La RPC se define por la ausencia de células de adenocarcinoma tanto en la pared rectal como en los ganglios linfáticos mesentéricos de la pieza quirúrgica (ypT0N0). Los pacientes se dividen en 2 grupos según presenten RPC o NO-RPC y se comparan las variables clínicas e histológicas y su relación con la evolución oncológica: recurrencia tumoral, supervivencia global y supervivencia libre de enfermedad.
El análisis estadístico se realizó con el programa SPSS 15.0 (SPSS, Inc, Chicago, IL, EE. UU.). Se ha usado la prueba de Kolmogorov-Smirnov para comprobar la normalidad de la muestra. Los datos se exponen como media ± desviación estándar y en el seguimiento como mediana (rango). La diferencias entre variables cualitativas se analizaron mediante el test de χ2 de Pearson o por la prueba exacta de Fisher, y las cuantitativas mediante el test de la t de Student. Se consideró significación estadística para p menor de 0,05. Se estimaron las funciones de supervivencia por el método de Kaplan-Meier y la prueba de long rank para comparar las muestras.
ResultadosEl grupo de estudio está formado por 162 pacientes (62% varones), con una edad media de 65 años, presentando 19 de ellos RPC (11,7%).
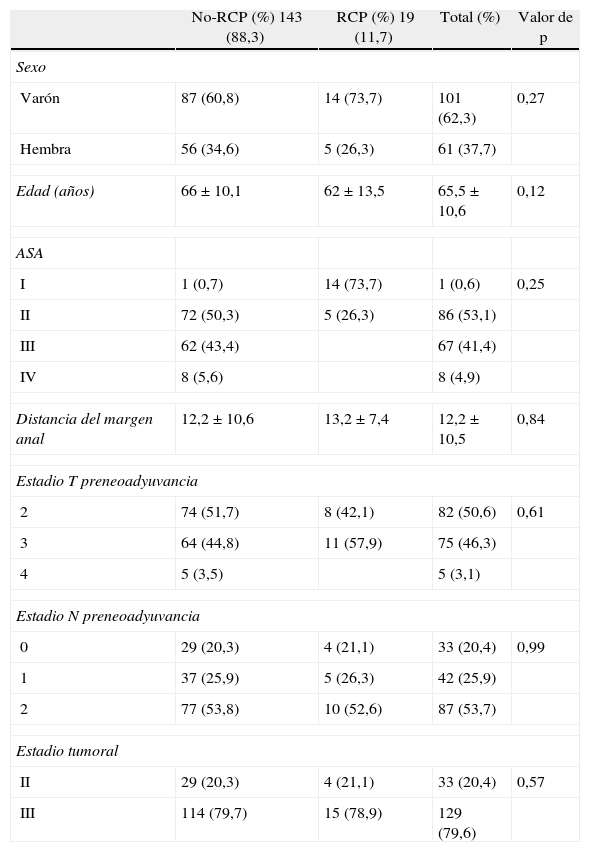
No existen diferencias demográficas en el estadio clínico del tumor entre los pacientes con RPC vs. NO-RPC (tabla 1), destacando un estadio T2 pretratamiento neoadyuvante del 50% y T3 del 46% del total de la serie con una afectación ganglionar del 79,6%.
Variables demográficas y clínicas
| No-RCP (%) 143 (88,3) | RCP (%) 19 (11,7) | Total (%) | Valor de p | |
| Sexo | ||||
| Varón | 87 (60,8) | 14 (73,7) | 101 (62,3) | 0,27 |
| Hembra | 56 (34,6) | 5 (26,3) | 61 (37,7) | |
| Edad (años) | 66±10,1 | 62±13,5 | 65,5±10,6 | 0,12 |
| ASA | ||||
| I | 1 (0,7) | 14 (73,7) | 1 (0,6) | 0,25 |
| II | 72 (50,3) | 5 (26,3) | 86 (53,1) | |
| III | 62 (43,4) | 67 (41,4) | ||
| IV | 8 (5,6) | 8 (4,9) | ||
| Distancia del margen anal | 12,2±10,6 | 13,2±7,4 | 12,2±10,5 | 0,84 |
| Estadio T preneoadyuvancia | ||||
| 2 | 74 (51,7) | 8 (42,1) | 82 (50,6) | 0,61 |
| 3 | 64 (44,8) | 11 (57,9) | 75 (46,3) | |
| 4 | 5 (3,5) | 5 (3,1) | ||
| Estadio N preneoadyuvancia | ||||
| 0 | 29 (20,3) | 4 (21,1) | 33 (20,4) | 0,99 |
| 1 | 37 (25,9) | 5 (26,3) | 42 (25,9) | |
| 2 | 77 (53,8) | 10 (52,6) | 87 (53,7) | |
| Estadio tumoral | ||||
| II | 29 (20,3) | 4 (21,1) | 33 (20,4) | 0,57 |
| III | 114 (79,7) | 15 (78,9) | 129 (79,6) | |
No existen tampoco diferencias en la altura del tumor desde el margen anal entre ambos grupos (7,1 vs. 6,9cm).
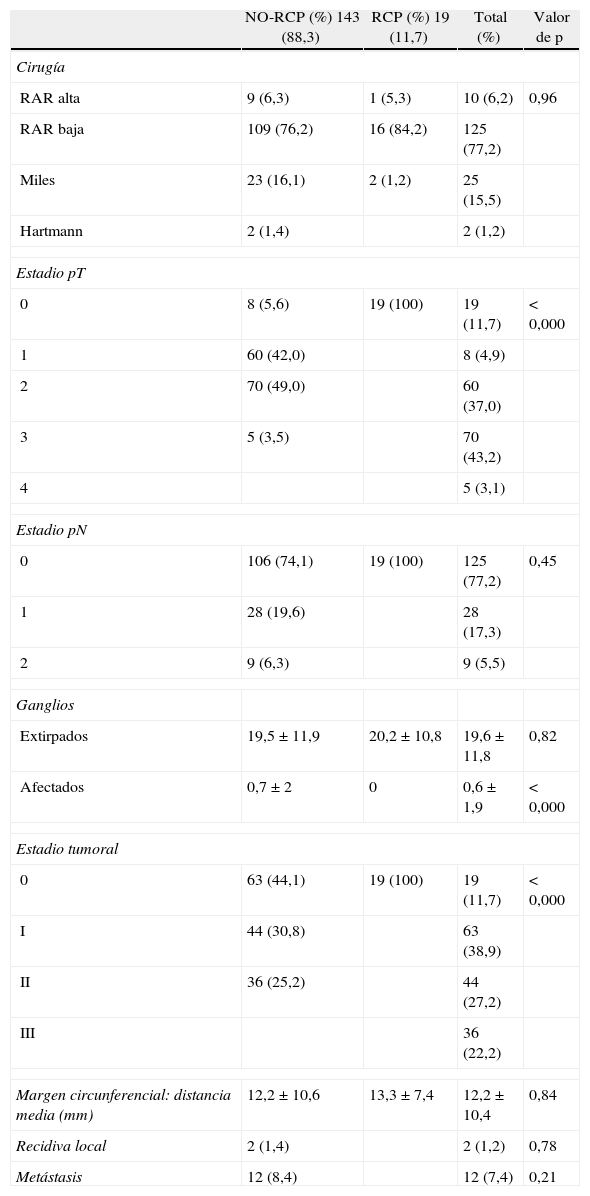
En el total de la serie se ha practicado resección anterior alta en 10 casos (6,2%) y baja en 125 casos (77,2%), amputación de recto en 25 (15,5%) y la técnica de Hartmann en 4 (1,2%), no existiendo diferencias significativas entre ambos grupos (RPC vs. NO-RPC) en cuanto a técnicas quirúrgicas. Se ha practicado colostomía terminal en 27 pacientes (16,7%) e ileostomía de protección en el 77,2%. En el 6,2% (10 casos) no se practicó estoma.
En la estratificación radiológica, comparando antes y después de la neoadyuvancia, aparece una disminución en el estadio tumoral, en la invasión de la pared y en la afectación ganglionar, existiendo lógicamente una diferencia significativa entre ambos grupos, con un descenso de los estadios tumorales (tablas 1 y 2).
Técnica quirúrgica y variables histológicas
| NO-RCP (%) 143 (88,3) | RCP (%) 19 (11,7) | Total (%) | Valor de p | |
| Cirugía | ||||
| RAR alta | 9 (6,3) | 1 (5,3) | 10 (6,2) | 0,96 |
| RAR baja | 109 (76,2) | 16 (84,2) | 125 (77,2) | |
| Miles | 23 (16,1) | 2 (1,2) | 25 (15,5) | |
| Hartmann | 2 (1,4) | 2 (1,2) | ||
| Estadio pT | ||||
| 0 | 8 (5,6) | 19 (100) | 19 (11,7) | < 0,000 |
| 1 | 60 (42,0) | 8 (4,9) | ||
| 2 | 70 (49,0) | 60 (37,0) | ||
| 3 | 5 (3,5) | 70 (43,2) | ||
| 4 | 5 (3,1) | |||
| Estadio pN | ||||
| 0 | 106 (74,1) | 19 (100) | 125 (77,2) | 0,45 |
| 1 | 28 (19,6) | 28 (17,3) | ||
| 2 | 9 (6,3) | 9 (5,5) | ||
| Ganglios | ||||
| Extirpados | 19,5±11,9 | 20,2±10,8 | 19,6±11,8 | 0,82 |
| Afectados | 0,7±2 | 0 | 0,6±1,9 | < 0,000 |
| Estadio tumoral | ||||
| 0 | 63 (44,1) | 19 (100) | 19 (11,7) | < 0,000 |
| I | 44 (30,8) | 63 (38,9) | ||
| II | 36 (25,2) | 44 (27,2) | ||
| III | 36 (22,2) | |||
| Margen circunferencial: distancia media (mm) | 12,2±10,6 | 13,3±7,4 | 12,2±10,4 | 0,84 |
| Recidiva local | 2 (1,4) | 2 (1,2) | 0,78 | |
| Metástasis | 12 (8,4) | 12 (7,4) | 0,21 | |
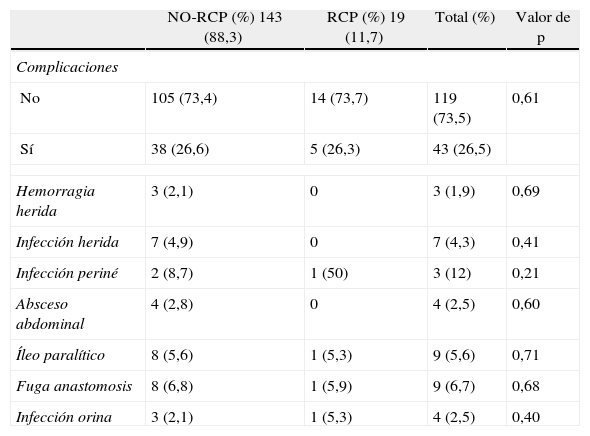
El 26,5% de los pacientes presentan complicaciones sin diferencias entre los 2 grupos referentes al porcentaje y al tipo de complicaciones, refiriendo en la tabla 3 las más importantes: destaca una incidencia de fuga anastomótica global del 6,7% y de infección del periné del 12%.
Morbilidad
| NO-RCP (%) 143 (88,3) | RCP (%) 19 (11,7) | Total (%) | Valor de p | |
| Complicaciones | ||||
| No | 105 (73,4) | 14 (73,7) | 119 (73,5) | 0,61 |
| Sí | 38 (26,6) | 5 (26,3) | 43 (26,5) | |
| Hemorragia herida | 3 (2,1) | 0 | 3 (1,9) | 0,69 |
| Infección herida | 7 (4,9) | 0 | 7 (4,3) | 0,41 |
| Infección periné | 2 (8,7) | 1 (50) | 3 (12) | 0,21 |
| Absceso abdominal | 4 (2,8) | 0 | 4 (2,5) | 0,60 |
| Íleo paralítico | 8 (5,6) | 1 (5,3) | 9 (5,6) | 0,71 |
| Fuga anastomosis | 8 (6,8) | 1 (5,9) | 9 (6,7) | 0,68 |
| Infección orina | 3 (2,1) | 1 (5,3) | 4 (2,5) | 0,40 |
No ha aparecido ningún caso de recurrencia tumoral en el grupo RPC mientras que 14 pacientes (9,8%) del grupo NO-RPC sí la presentan. Se trata de 2 recidivas locales (1,4%) y de 12 metástasis a distancia (8,4%).
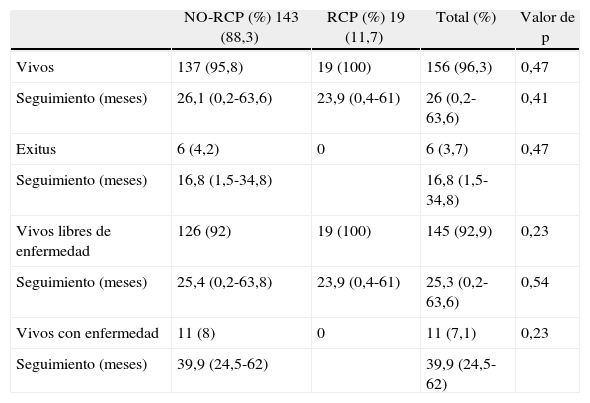
En la tabla 4 se indican los resultados oncológicos, siendo la mediana total de seguimiento de los 156 (96,3%) pacientes vivos de 26 (0,2-63,6) meses y de los 6 (3,7%) exitus fue de 16,8 (1,5-34,8) meses, de los cuales 5 (3%) fallecieron debido al propio tumor y 1 (0,7%) por causas sin relación con el tumor. No se aprecian diferencias significativas entre ambos grupos. La mediana de seguimiento de los 145 pacientes libres de enfermedad es de 25,3 (0,2-63,6) meses existiendo 11 pacientes vivos con enfermedad metastásica.
Resultados oncológicos
| NO-RCP (%) 143 (88,3) | RCP (%) 19 (11,7) | Total (%) | Valor de p | |
| Vivos | 137 (95,8) | 19 (100) | 156 (96,3) | 0,47 |
| Seguimiento (meses) | 26,1 (0,2-63,6) | 23,9 (0,4-61) | 26 (0,2-63,6) | 0,41 |
| Exitus | 6 (4,2) | 0 | 6 (3,7) | 0,47 |
| Seguimiento (meses) | 16,8 (1,5-34,8) | 16,8 (1,5-34,8) | ||
| Vivos libres de enfermedad | 126 (92) | 19 (100) | 145 (92,9) | 0,23 |
| Seguimiento (meses) | 25,4 (0,2-63,8) | 23,9 (0,4-61) | 25,3 (0,2-63,6) | 0,54 |
| Vivos con enfermedad | 11 (8) | 0 | 11 (7,1) | 0,23 |
| Seguimiento (meses) | 39,9 (24,5-62) | 39,9 (24,5-62) |
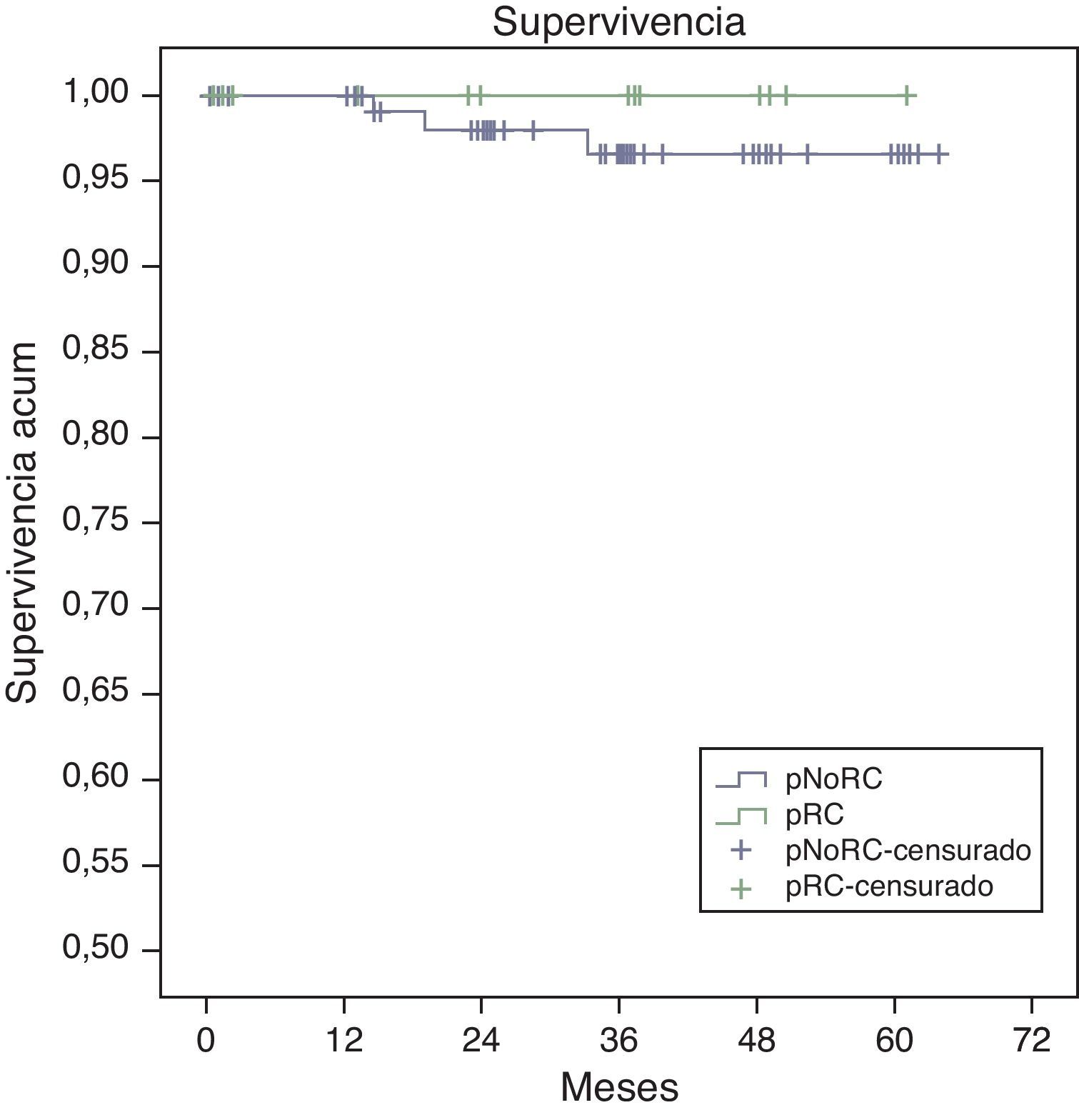
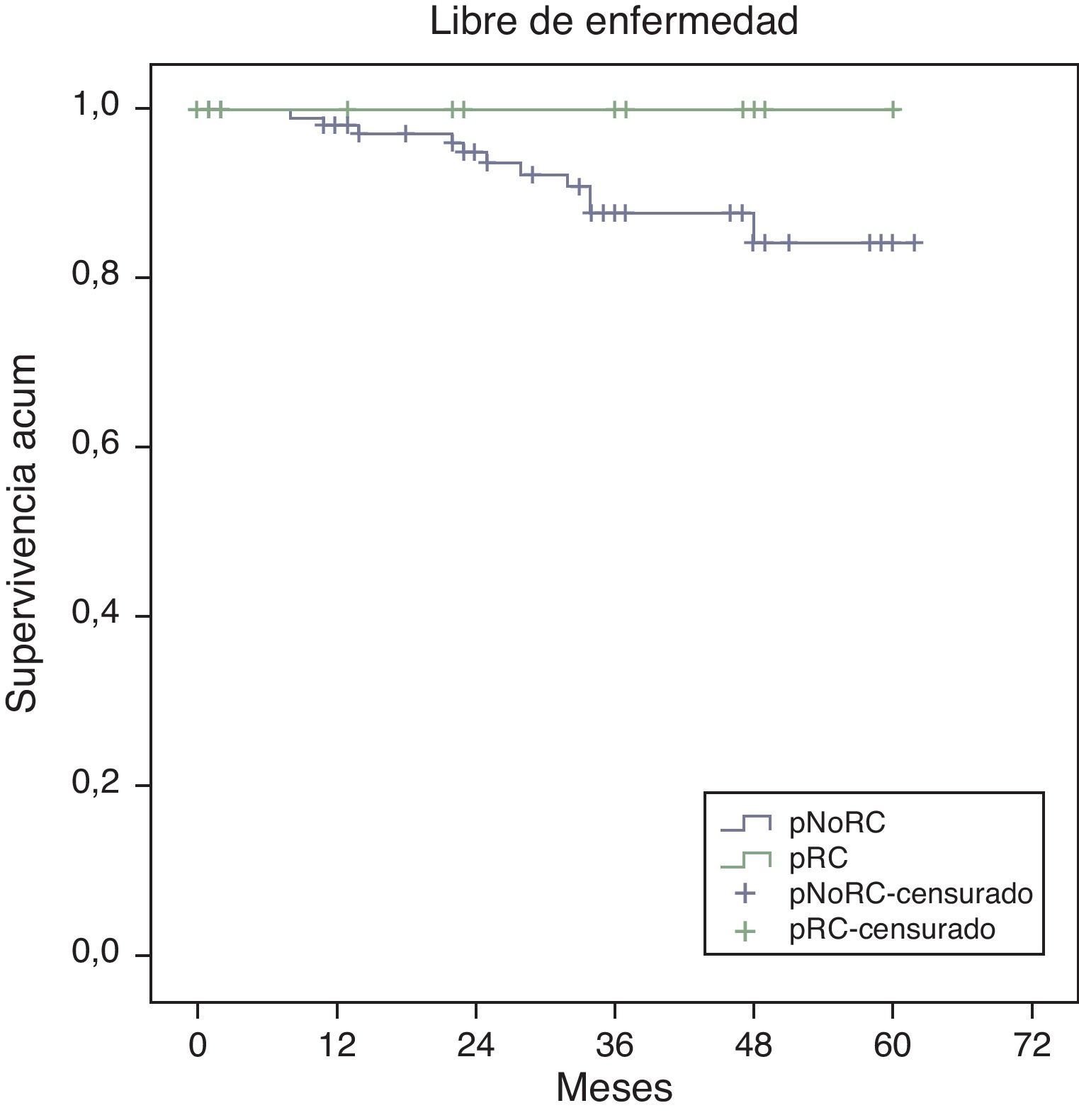
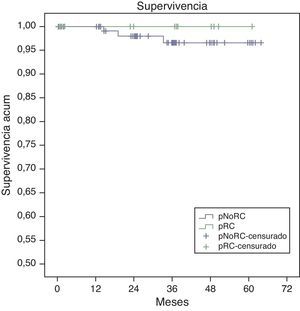
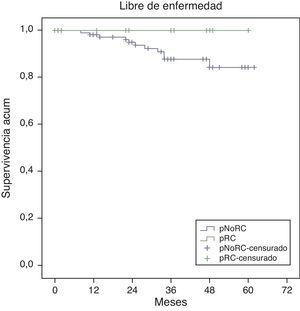
La supervivencia global estimada a 5 años, representada por las curvas de Kaplan-Meier (fig. 1), es del 100% en el grupo RPC y del 93% en el grupo de NO-RPC, sin diferencias significativas (p=0,39; long rank). El cálculo estimado de supervivencia libre de enfermedad a los 5 años es del 100% en el grupo de RPC mientras que en el grupo de NO-RPC es del 84% sin diferencias significativas (p=0,23; long rank) (fig. 2)
La mediana de aparición de las metástasis fue de 26,5 (8-40) meses y la mediana de aparición de la recidiva local fue de 23 (14-32) meses.
DiscusiónUno de los avances más importantes en el tratamiento del cáncer de recto es la capacidad de predecir o identificar a los pacientes que presentan una evidencia clínico-radiológica de RCC después de radioquimioterapia preoperatoria. La regresión del tumor se considera como un factor de buen pronóstico7 y ha dado lugar a la aparición de nuevos conceptos terapéuticos, con una conducta expectante y un follow-up intensivo para evitar una cirugía agresiva. Es la propuesta del «wait and see» preconizada por Habr-Gama et al.8,9.
Aunque exista una disminución del tamaño tumoral y del estadio tumoral hasta en un tercio de los casos10, esta actitud no está exenta de riesgos ya que la RCC no siempre se correlaciona con la RPC pues solo en algunos (entre el 25 y el 50% de los pacientes con RCC) se confirmará (después de la cirugía radical) la presencia de una RPC. Además, tampoco se predice la respuesta ganglionar, encontrándose afectación ganglionar hasta en un 25% de los pacientes T011. Por tanto, debe demostrarse su papel como factor de buen pronóstico aunque realmente signifique un cambio de actitud en enfermos seleccionados12.
Las variables demográficas de nuestra serie son similares a las descritas en la literatura12 con una edad media centrada en la sexta década y con predominio del sexo masculino. Respecto al estadio tumoral, nuestra serie presenta una menor incidencia de estadio ii respecto a la publicada en un reciente metaanálisis (20 vs. 34%) y una mayor incidencia de estadio iii (79 vs. 64%) siendo la distancia media del tumor respecto al margen anal similar12 (5,3 vs. 7,1cm).
Nuestra incidencia de RPC del 11,7%, dentro de los límites descritos (10-30%), es inferior a otras tasas descritas8,9. Los trabajos procedentes de Brasil2,8,9 han demostrado que ante una ausencia de tumor (RCC) detectable mediante exploraciones clínico-endoscópicas-radiológicas, se pueden aplicar conductas expectantes con la misma supervivencia que la obtenida con cirugía radical, confirmándose la existencia de una RPC posteriormente en la pieza quirúrgica. Pero estos mismos autores10 señalan que esta actitud puede fallar en una quinta parte de los casos, por tanto, el principal problema es identificar a los pacientes que puedan beneficiarse de este cambio de conducta. Con la intención de re-estadificar a nuestros pacientes, realizamos una RM posradioquimioterapia pero no hemos encontrado en ningún caso una RCC radiológica que hubiera podido cambiar nuestra actitud, aunque este cambio debe efectuarse bajo un ensayo clínico controlado.
Nuestros resultados son similares a los descritos13,14 respecto a que no existe ninguna diferencia entre los estadios clínico-histológicos ni respecto al tratamiento efectuado dependiendo de la presencia o no de RPC.
Diversos factores influyen en la obtención de RPC. Por un lado, el propio estadio del tumor, ya que cuanto menor es la invasión de la pared, mayor respuesta15 y, por otro, los distintos regímenes de neoadyuvancia16. Sin lugar a dudas, uno de los factores más importantes es el intervalo entre la neoadyuvancia y la cirugía. El efecto de la radioquimioterapia es variable en extensión y en duración siendo un proceso continuo por lo que es un motivo de controversia el intervalo óptimo entre el fin del tratamiento y la fecha de la cirugía17.
Después del ensayo Lyon se consideró como tratamiento estándar la cirugía a las 6 semanas consiguiendo tasas de RPC del 26%18, pero algunos tumores pueden tener RPC después de las 8 semanas, encontrando valores de RPC del 16% antes de las 8 semanas y valores del 31% de RPC después de 8 semanas19. Incluso se plantea que el efecto radiosensibilizador puede durar hasta las 12 semanas20, beneficiándose los pacientes de ciclos adicionales de quimioterapia21.
Nuestro protocolo se ha basado en la realización de cirugía a las 6 semanas de finalizar la neoadyuvancia pero, en vista de los resultados obtenidos, hemos cambiado la cirugía a las 8 semanas realizando una nueva RM de re-estadificación del tumor a las 6 semanas del fin de la radioquimioterapia.
Los resultados respecto a las técnicas quirúrgicas utilizadas como a la morbilidad están dentro del rango nacional22, siendo los resultados clínicos también similares a los descritos, sin diferencias entre los pacientes con RPC y los que no la presentan23.
Los resultados histológicos y la morbilidad son similares a los descritos en otra serie nacional con una media de seguimiento parecida24, destacando un descenso en los estadios finales histológicos tanto referente a la invasión de la pared como a la ganglionar, ya que después de la neoadyuvancia y de la cirugía, el examen histológico nos muestra un descenso significativo en el estadio tumoral global de la serie con un 22% en estadio iii, un 27% en estadio ii y un 38% en estadio i.
La optimización de la técnica quirúrgica mediante la realización de la escisión total del mesorrecto ha provocado un descenso en la tasa de recidiva local, pasando de valores del 30-40% a un 4% con mejora de estos resultados mediante programas docentes quirúrgicos. El impacto de la RPC en la recidiva local también es importante ya que provoca otro descenso en sus valores con tasas medias del 0,7% y una supervivencia global superior al 90% y con supervivencias libres de enfermedad del 87%12.
Nuestra tasa de recidiva local del 1,4% y de metástasis del 8,4% en el grupo NO-RPC y la ausencia de recurrencia tumoral en el grupo RPC es similar a los datos publicados12 y refuerzan el impacto de la RPC en los resultados oncológicos, sin ninguna recidiva en este grupo, con una mediana de seguimiento de 23,9 meses (rango: 0,4-61). Estos resultados son concordantes con los descritos25 con recidivas del 0,9% y metástasis del 8,9% pero con un mayor seguimiento (46 meses) aunque la mediana de detección de la recidiva pélvica fue de 26 meses, siendo en nuestra serie de 23 meses.
La incidencia de recidiva local en pacientes con RPC es muy baja, sin embargo la tasa de metástasis no ha descendido tanto e indica la necesidad de quimioterapia adyuvante. El reto actual es cómo identificar a los pacientes que puedan beneficiarse de más dosis de quimioterapia21.
Considerando que el 55-80% de las recidivas locales del cáncer de recto ocurren dentro de los 2 primeros años de seguimiento12,26, a pesar de que nuestra serie tenga una mediana de seguimiento de 26 meses, podemos destacar que los pacientes con RPC presentan mejores resultados oncológicos. Pero también es importante destacar que, hoy en día, han aparecido recidivas locales hasta en un tercio de los pacientes a partir de los 5 años de seguimiento tras recibir neoadyuvancia2, mientras que en otros trabajos la mediana de recidiva local es de 26 meses25, lo cual puede generar controversias en la elaboración de los esquemas de seguimiento.
Todos los pacientes que han fallecido, en nuestra serie, en relación con el tumor, eran del grupo NO-RPC, con una mayor supervivencia tanto global (100 vs. 93%; p=0,39) como libre de enfermedad (100 vs. 84%; p=0,23) en el grupo RPC respecto al grupo NO-RPC.
En conclusión, la presencia de RPC después de radioquimioterapia implica mejores resultados oncológicos siendo un factor pronóstico positivo indicativo de menor recurrencia y mayor supervivencia, aunque en nuestra experiencia, debido al pequeño número de pacientes y al corto periodo de seguimiento, no existen diferencias significativas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.