La resección quirúrgica representa en la actualidad la única posibilidad terapéutica para pacientes afectos de carcinoma de páncreas (CP). Procedimientos quirúrgicos agresivos han sido descritos en un intento de incrementar la resecabilidad. La resección venosa representa en la actualidad una técnica quirúrgica aceptada en centros con importante experiencia en cirugía pancreática. Por el contrario, la resección arterial en enfermos afectos de CP sigue siendo una técnica muy controvertida. La infiltración arterial en estos pacientes suele ser considerada un criterio de irresecabilidad. En los últimos años, importantes avances en la técnica quirúrgica y en el tratamiento postoperatorio de estos pacientes han permitido reducir la morbimortalidad de las resecciones pancreáticas. Por otra parte, notables mejoras en el tratamiento neoadyuvante y adyuvante así como un mayor conocimiento en la biología del tumor además de nuevas opciones diagnósticas han permitido mejorar la supervivencia.
En el presente artículo, destacamos importantes puntos que un cirujano moderno debe de considerar para tratar a afectados de CP con infiltración arterial.
As surgical resection remains the only hope for cure in pancreatic cancer (PC), more aggressive surgical approaches have been advocated to increase resection rates. Venous resection demonstrated to be a feasible technique in experienced centers, increasing survival. In contrast, arterial resection is still an issue of debate, continuing to be considered a general contraindication to resection. In the last years there have been significant advances in surgical techniques and postoperative management which have dramatically reduced mortality and morbidity of major pancreatic resections. Furthermore, advances in multimodal neo-adjuvant and adjuvant treatments, as well as the better understanding of tumor biology and new diagnostic options have increased overall survival.
In this article we highlight some of the important points that a modern pancreatic surgeon should take into account in the management of PC with arterial involvement in light of the recent advances.
En los países occidentales, el cáncer de páncreas (CP) representa la cuarta y quinta causa de muerte relacionada con el cáncer en hombres y mujeres respectivamente, con más de 100.000 muertes anuales en Europa y EE. UU.1,2. Aproximadamente un 80-90% de los CP son lesiones localmente avanzadas o con diseminación sistémica al momento del diagnóstico. En pacientes susceptibles de tratamiento quirúrgico, la cirugía, siempre que se obtengan márgenes libres, representa el único tratamiento que puede ofrecer una prolongada supervivencia3.
La resección vascular en la pancreatectomía por CP es un tema controvertido. La afectación venosa, siempre que sea posible una reconstrucción del flujo venoso, es un factor de complejidad técnica, pero no debe de representar un concepto de irresecabilidad. La afectación arterial ha supuesto durante mucho tiempo una contraindicación para la resección quirúrgica, debido a la alta tasa de morbimortalidad y al limitado beneficio oncológico. En los últimos años, un número reducido de grupos han ido modificando este criterio4-7. La estandarización de los procedimientos quirúrgicos, la participación de cirujanos generales con amplia experiencia en cirugía vascular y la centralización de la cirugía de páncreas en hospitales de referencia son factores que han contribuido a esta modificación.
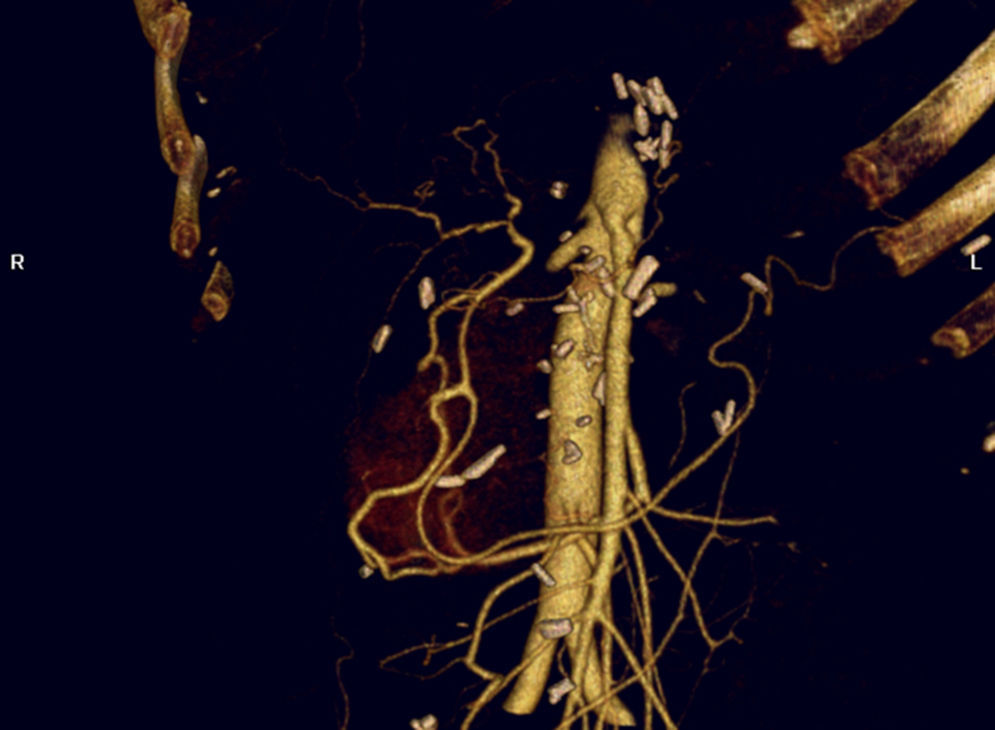
La localización anatómica del páncreas y su proximidad con los grandes ejes vasculares abdominales condiciona la afectación arterial en los procesos neoformativos. La arteria hepática común (AHC), el tronco celiaco (TC) y la arteria mesentérica superior (AMS) son los ejes arteriales más frecuentemente afectos por el proceso neoformativo. En determinados casos, bien por la propia extensión tumoral de la enfermedad, bien por la presencia de variantes anatómicas vasculares se ven afectados otros ejes arteriales como la arteria hepática derecha (AHD)4.
DiagnósticoLa estadificación preoperatoria es un paso de singular importancia en los enfermos afectos de CP. Su finalidad es reconocer las lesiones consideradas en el límite de la resecabilidad (CPLR) en las que el tratamiento neoadyuvante es necesario y el tumor inoperable o irresecable.
La afectación venosa portal/mesentérica o arterial fue el criterio establecido para definir el CPLR en la primera definición efectuada de este concepto8. Posteriormente, diferentes clasificaciones han sido descritas9-11. En todas ellas, la afectación arterial define CPLR o lesiones irresecables.
La tomografía axial computarizada (TAC), la PET/TAC y la biopsia por aguja fina guiada por ecografía endoscópica (EE) han demostrado ser adecuados métodos de diagnóstico y estadificación en el CP11. La TAC y la EE se consideran igualmente pruebas necesarias para obtener información sobre la afectación arterial en pacientes con CP12.
La inclusión arterial dentro del magma tumoral, o la combinación de afectación mayor del 50% de la circunferencia arterial, con irregularidad de la pared vascular o estenosis del mismo son criterios radiológicos de invasión arterial. Sin embargo, la valoración tomográfica del estado arterial en algunos pacientes con CP es difícil de establecer13. En muchos casos la TAC no logra identificar la afectación arterial o venosa14 que por otra parte es relativamente frecuente (21-64%)15,16.
Sugiyama et al. han reportado que la precisión de la EE para la identificación de la afectación vascular portal es mayor que la de la TAC, la ecografía y la angiografía17. Otros grupos han reportado conclusiones similares18,19. No existe sin embargo uniformidad en este criterio. La afectación vascular es evaluada con mucha más dificultad a través de EE19,20, reportándose de manera global una sensibilidad del 50-100%20–23 y una especificidad del 58-100%20,23.
La precisión diagnóstica de la resonancia magnética para la afectación vascular es muy similar a la de la TAC24,25. Por ello se reserva esta técnica diagnóstica para aquellos pacientes en los que exista contraindicación para realizar una TAC; alergia a iodo, insuficiencia renal o embarazo.
Manejo quirúrgico de la afectación vascularArteria mesentérica superiorLa exploración quirúrgica es la que confirma finalmente la infiltración vascular. En la duodenopancreatectomía cefálica estándar la afectación arterial se suele apreciar tras efectuar la transección del cuello del páncreas.
El abordaje «arterial-inicial» define una modificación técnica que permite identificar de forma precoz la afectación arterial en enfermos con CP26. Se efectúa inicialmente la disección de la AMS. El cuello del páncreas y el estómago son divididos en la parte final de la resección. Se han descrito una variedad de diferentes técnicas bajo este término27–35.
En grupos que consideren la afectación arterial como una contraindicación absoluta para la resección quirúrgica, este abordaje vascular inicial resulta necesario en un intento de evitar que se detecte tardíamente la invasión arterial. Cuando esto sucede, el cirujano puede optar por 2 diferentes opciones: 1) considerar irresecable la lesión tumoral, o 2) resecar la lesión, dejando tumor adherido al vaso afectado. Un margen de resección macroscópicamente positivo (R2) va siempre asociado a una reducida supervivencia36.
En grupos en los que la afectación arterial no suponga un criterio de irresecabilidad, el abordaje vascular inicial no adquiere la misma importancia. Sin embargo, efectuarlo supone siempre obtener un control vascular de la AMS y la VMS desde una fase inicial de la intervención, lo cual resulta aconsejable en enfermos con tumores localmente avanzados.
La forma más frecuente de anomalía anatómica de la arteria hepática resulta del remplazo total de la rama derecha que se origina a partir de la AMS, lo cual ocurre en el 9,8-21% de la población normal37. El abordaje «arterial-inicial» facilita también su temprana identificación y preservación.
En el CP, la afectación de la AMS se presenta en lesiones localizadas principalmente en el proceso uncinado. Esta afectación suele estar habitualmente limitada a la porción más distal de la arteria. La afectación proximal de la AMS próxima a su origen aórtico suele aparecer en lesiones de gran tamaño en donde la VMS suele estar igualmente infiltrada.
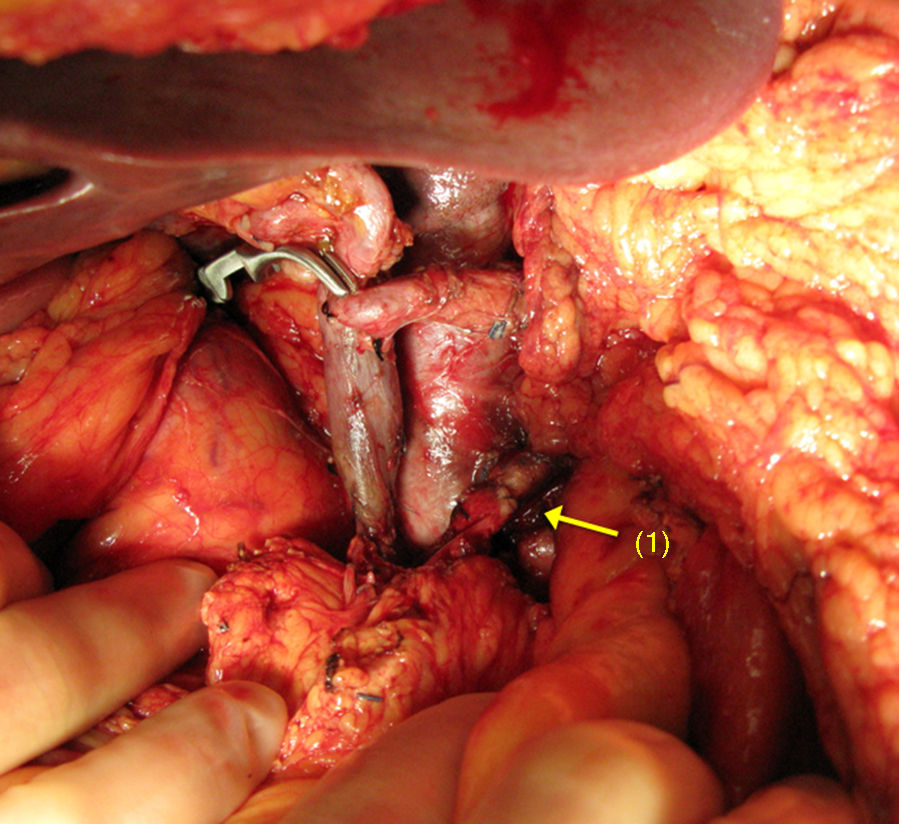
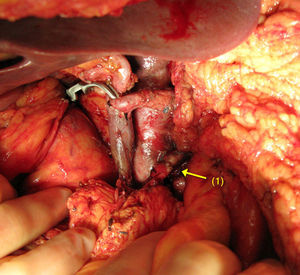
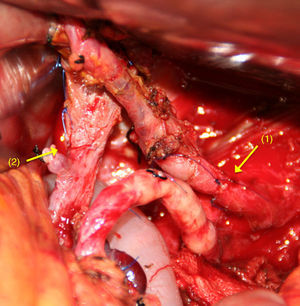
Cuando la AMS es invadida, la reconstrucción se realiza mediante una anastomosis terminoterminal (fig. 1). La movilización de ambos extremos permite efectuar una reconstrucción arterial libre de tensión. Es poco frecuente la utilización de injertos vasculares en este tipo de tumores.
La experiencia existente en el mundo al respecto de esta situación es escasa y se reduce a grupos con un alto volumen de cirugía pancreática3,38–44.
Tronco celiacoLa resección oncológica estándar de tumores del cuerpo y cola de páncreas es la pancreatectomía distal asociada a esplenectomía45. La resección se asocia a la exéresis del plexo celiaco, el plexo linfoneural que rodea los vasos mesentéricos superiores y los ganglios linfáticos regionales alrededor del páncreas. En algunas ocasiones la resección vascular debe extenderse a un segmento de la vena porta, la glándula adrenal izquierda, los vasos cólicos medios y la porción infiltrada de los órganos adyacentes.
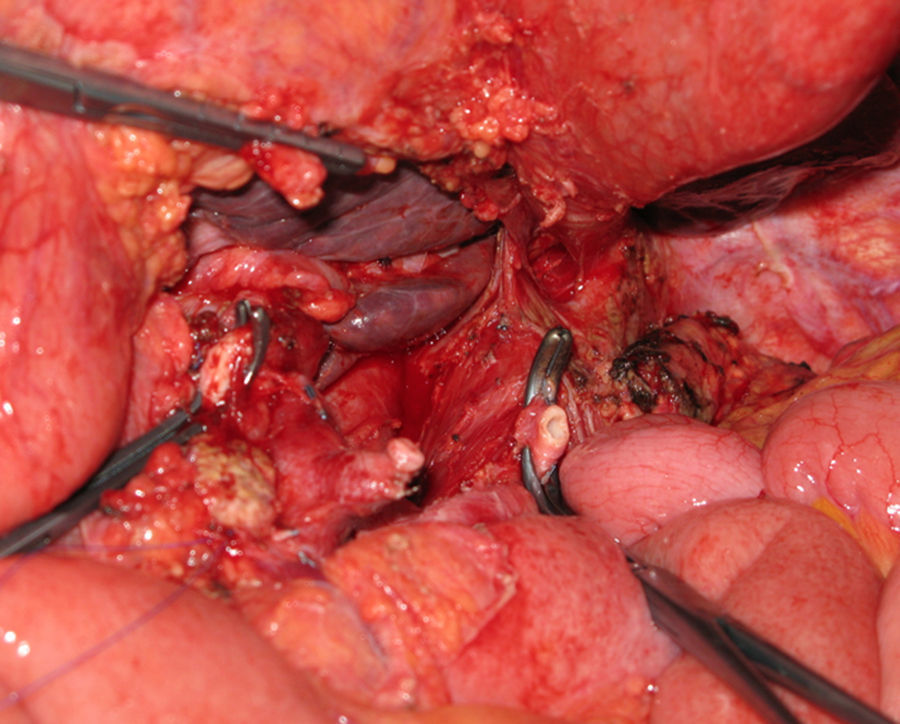
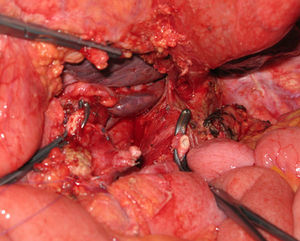
La pancreatectomía distal con resección en bloque del TC ha tenido una notable difusión en la cirugía de páncreas durante los últimos años (fig. 2). Reportada por vez primera por Appleby en 1953 para obtener un vaciamiento ganglionar completo alrededor del eje celiaco en tumores gástricos avanzados46, fue adoptada por Nimura para el tratamiento de tumores pancreáticos localizados en el cuerpo pancreático47. En 1991, Nagino48 et al. e Hishinuma et al.49 describieron modificaciones en la técnica con el objeto de preservar el estómago en ausencia de invasión del mismo por el CP. Hasta el año 2003, menos de 25 casos habían sido descritos en la literatura médica47–50,53,56,58-60. Desde entonces, el número de pacientes se ha ido incrementado ligeramente, aunque la experiencia se limita a un pequeño número de grupos51,52,54,55,57,61,62.
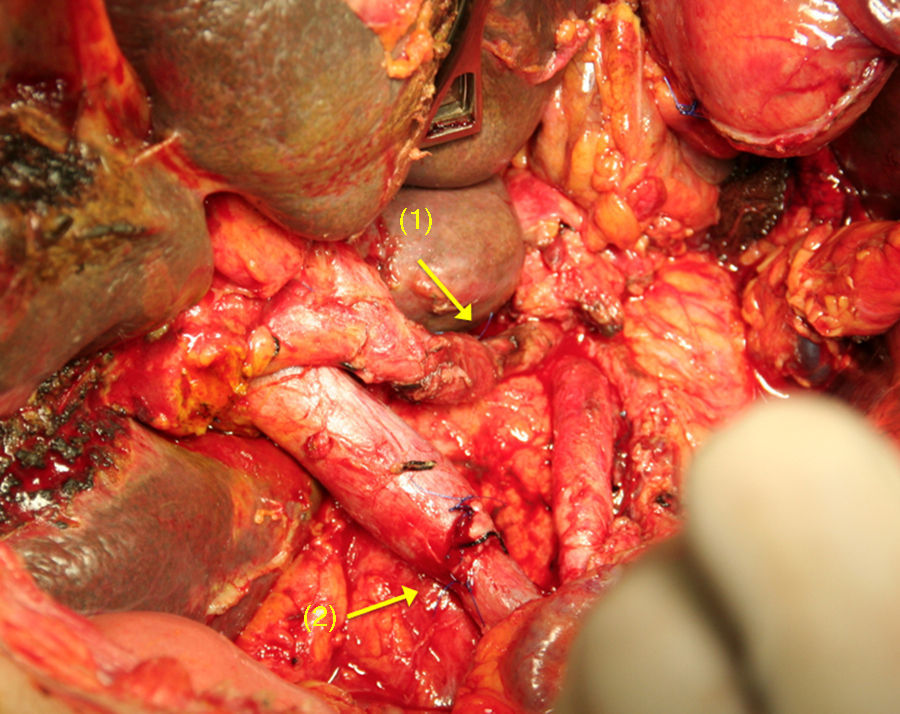
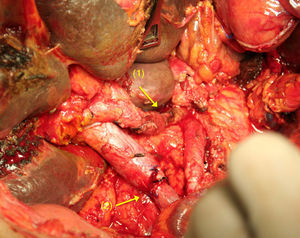
El reto del procedimiento radica en efectuar la resección del tronco celiaco con sus 3 ramas viscerales, preservando un adecuado flujo arterial al hígado56,63,64. En la operación de Appleby, la vascularización hepática debe evaluarse y preservarse durante la intervención (aporte sanguíneo colateral a partir de la AMS a través de las arcadas pancreaticoduodenales y la arteria gastroduodenal). Si no fuera posible la preservación, se debe de efectuar una rearterialización hepática con la finalidad de evitar consecuencias isquémicas en el hígado56,63,64 (fig. 3). De manera similar, para garantizar un aporte sanguíneo al estómago, las arterias gástrica derecha y gastroepiplóicas deben ser preservadas.
Tras el pinzamiento de la AHC se debe de apreciar latido arterial en el ligamento hepatoduodenal. Tras ello se puede seccionar la misma preservando siempre la arteria gastroduodenal para asegurar el adecuado aporte sanguíneo hacia el hígado. La presencia de latido arterial en el hilio hepático suele asociarse a la confirmación de flujo arterial intrahepático mediante la realización de ecografía Doppler intraoperatoria. Se considera necesario un flujo arterial mayor de 22cm/s para prevenir isquemia hepática y fracaso hepático postoperatorio63
En aquellos casos en los que tras el pinzamiento se observe: 1) ausencia de latido arterial a nivel del hilio hepático, 2) cambio de color y consistencia en el hígado y 3) falta de flujo arterial intrahepático (ecografía Doppler intraoperatoria) se aconseja reconstruir la AHC. Obviamente, el otro motivo para efectuar una rearterialización hepática es cuando por circunstancias técnicas u oncológicas se efectúa una duodenopancreatectomía total.
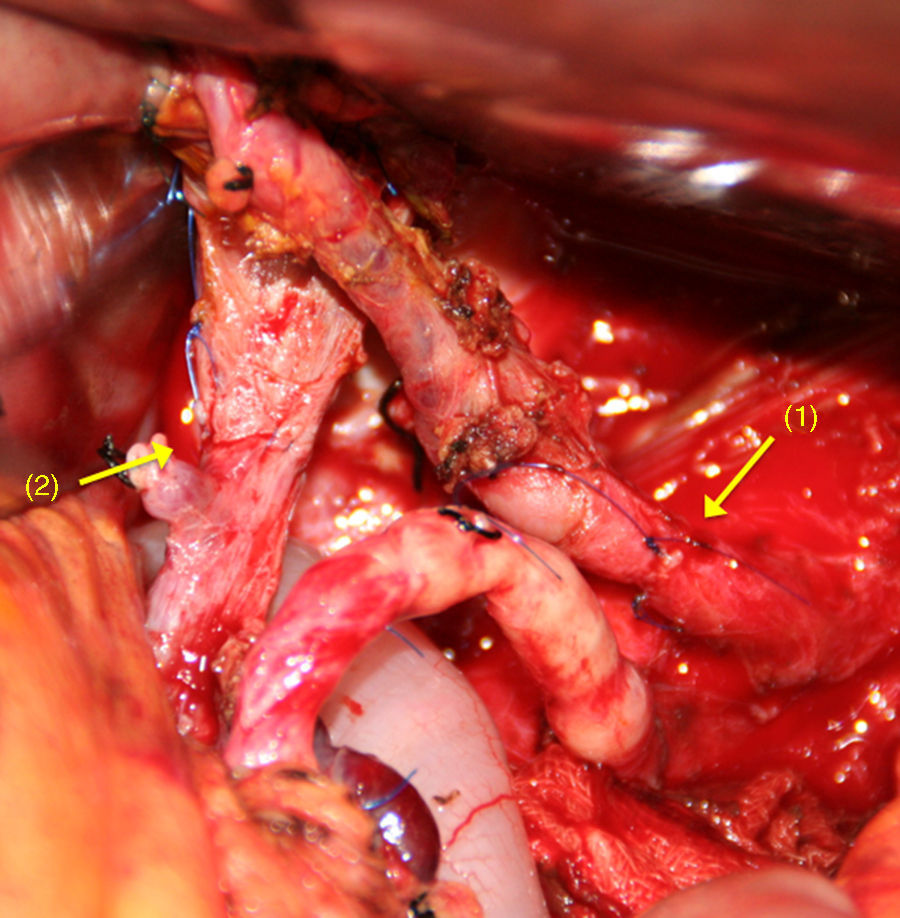
Tras la división del TC y la AHC, y después de una amplia movilización de los extremos arteriales proximales y distales65–70, se realiza una anastomosis terminoterminal libre de tensión (fig. 4). Si esto no fuera posible, puede realizarse la interposición de un injerto vascular autógeno51,56 (arteria esplénica, cólica media o gastroepiplóica), o sintético71.
Las ventajas derivadas de la realización del procedimiento de Appleby son: 1) incrementar la resecabilidad, obteniendo un numero de resecciones radicales R0 que sin este procedimiento no serían posibles; 2) mejorar la calidad de vida del paciente mediante un adecuado control del dolor invalidante que caracteriza la presencia de un carcinoma de cuerpo de páncreas y 3) ofrecer la posibilidad de tener una prolongada supervivencia.
Arteria hepática derechaUna AHD originaria de la AMS se localiza en la zona posterior de la cabeza pancreática, teniendo un recorrido a través de la zona lateral derecha de la vena porta72–74.
Esta variante anatómica debe de ser conocida preoperatoriamente75. La lesión inadvertida de una AHD anómala puede condicionar importantes complicaciones en el postoperatorio precoz (fístula biliar, isquemia o formación de abscesos hepáticos) o tardío (estenosis de la anastomosis bilioentérica)76,77.
La presentación de esta anomalía anatómica representa un reto quirúrgico en enfermos con CP. No resecar una AHD accesoria o remplazada durante una duodenopancreatectomía puede dar lugar en ocasiones a una resección incompleta. Por otro lado, la simple ligadura arterial puede asociarse a una importante morbilidad. Se puede efectuar solo en pacientes portadores de una anomalía arterial tipo 6 de la clasificación de Michel72,78,79.
Diversas publicaciones han reportado que la resección y reconstrucción de la AHD es posible y segura80,81. Si la sección o lesión de la misma se produce en su porción más distal, el diámetro y las características de la arteria dificultan la realización de la reconstrucción vascular. En esta situación es aconsejable efectuarla con técnica microquirúrgica. En el área de cirugía digestiva, especialmente en cirugía gastrointestinal y hepatobiliopancreática, los cirujanos ocasionalmente se encuentran con la necesidad de reconstruir vasos sanguíneos de diámetros muy reducidos82–86. Para ello precisan muy frecuentemente la ayuda de cirujanos plásticos. Por ello la adquisición de experiencia por los cirujanos generales en la técnica microquirúrgica representa un activo importante para cualquier servicio quirúrgico que facilita la solución a importantes problemas vasculares.
Embolización vascular preoperatoriaSe ha realizado embolización vascular preoperatoria en pacientes con una AHD procedente de AMS, con la intención de incrementar el flujo sanguíneo hepático a través de la arteria hepática izquierda87. Diez días tras la embolización, se ha desarrollado la circulación colateral. De ser posible, la cirugía debe posponerse hasta que esta colateralidad sea suficiente para prevenir complicaciones hepáticas secundarias a la isquemia. En nuestra opinión y la de otros grupos88, esta técnica debe de indicarse de manera selectiva en aquellos pacientes en los cuales se sospeche que, por circunstancias técnicas, no pueda realizarse la reconstrucción arterial con garantías.
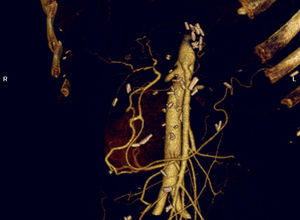
Otro aspecto diferente es la embolización preoperatoria en pacientes con CP que afecte el tronco celiaco. Con la intención de evitar una reconstrucción arterial tras la resección radical, se puede realizar una embolización preoperatoria de la AHC orientada al desarrollo de colateralidad procedente de la AMS89. Representa una excelente alternativa en pacientes en los que por circunstancias anatómicas o técnicas no sea posible ofrecer un adecuado flujo arterial al hígado mediante reconstrucción quirúrgica. Sin reconstrucción, la «arterialización natural hepática» tras pancreatectomía con resección del TC se desarrolla en muy pocos días (fig. 5).
Cirugía mínimamente invasivaLa resección vascular en pacientes con PC mediante técnicas de cirugía mínimamente invasiva representa un autentico reto quirúrgico. A pesar de la mínima experiencia existente en este campo con cirugía laparoscópica, los resultados obtenidos en resecciones venosas90 manifiestan una esperanza para su futuro desarrollo. La única referencia sobre resección arterial con esta vía de abordaje fue efectuada en 2 tiempos91.
La cirugía robótica (CR) representa una excelente alternativa dentro de la cirugía mínimamente invasiva. Desde su inicio en el año 199792, su desarrollo ha sido constante y progresivo, revolucionando el concepto de la cirugía moderna. La CR elimina muchas de las carencias de la cirugía laparoscópica93.
Uno de los campos donde mayores avances se han producido en la CR ha sido en el área pancreática94–97. Mediante este innovador sistema robótico, ha sido posible efectuar procedimientos de alta complejidad con resultados similares a los obtenidos por cirugía abierta94,95,98.
La resección del eje mesentérico-portal ha sido posible realizarla a través del sistema robótico con resultados satisfactorios95,99. Para la operación de Appleby efectuada con soporte robótico, Giulianotti99 realizó el abordaje posterior hacia el tronco celiaco descrito en cirugía abierta54. Si bien los 2 procedimientos quirúrgicos efectuados se realizaron en tumores localmente avanzados, el tiempo quirúrgico y las pérdidas hemáticas intraoperatorias fueron adecuadas a las características de este complejo procedimiento quirúrgico.
Justificación para efectuar resecciones arteriales en pacientes con cáncer de páncreasJustificación técnicaUna de las complicaciones más importantes de la cirugía radical de páncreas es la formación de un seudoaneurisma100–103. Clínicamente se manifiesta mediante la rotura espontánea a la cavidad peritoneal o hacia el tracto gastrointestinal104,105.
En ausencia de complicación de la reconstrucción pancreática efectuada, se ha sugerido que la esqueletización de las arterias viscerales en la exéresis del tejido perineural y linfograso puede condicionar la afectación de la pared vascular104,105. En otros casos puede estar asociada la presencia de un foco infeccioso adyacente 106.
La lesión de la arteria durante la cirugía radical efectuada no siempre es fácil de reconocer. En muchas ocasiones tras la realización de extensas disecciones vasculares, el vaso arterial presenta un hematoma transmural o incluso se puede apreciar una pérdida de consistencia en el mismo. En estos casos está plenamente justificada la resección de la arteria afecta. Sin embargo, la presencia de una arteria de características aparentemente normales tras una compleja disección no descarta una lesión parietal. La presencia de una alteración en la pared arterial obliga a efectuar la resección del vaso afecto.
El pronóstico de los pacientes portadores de seudoaneurismas arteriales postoperatorios depende de 3 factores: momento de aparición, diagnostico precoz y la posibilidad de efectuar el tratamiento mediante técnicas de radiología intervencionista104,107–110.
Justificación oncológicaSignificado de la afectación arterialDos teorías diferentes definen el valor de la afectación vascular y justifican la actitud terapéutica a seguir:
- 1)
La afectación arterial define una mayor agresividad del tumor. La diseminación micrometastásica inadvertida al momento de la presentación limita el beneficio oncológico de la cirugía radical, aun cuando la resección sea R0111,112.
- 2)
La invasión vascular no predice una mayor agresividad tumoral, sino que es un reflejo de localización de la lesión. Esta teoría permitiría justificar una resección radical que incluiría el eje arterial113,114.
Con excepción de grandes tumores, parece asumirse que la presencia de afectación arterial no se relaciona con factores de riesgo y pronósticos clásicos, tales como la diseminación metastásica ganglionar, la infiltración perineural, la diferenciación tumoral y la alta tasa de resecciones con márgenes positivos115. Rehders et al.115 han confirmado igualmente la ausencia de correlación entre afectación vascular y la incidencia de diseminación de células tumorales. Estos hallazgos avalan la hipótesis de que la presencia de afectación arterial es un indicador de topografía tumoral desfavorable más que un indicador de biología tumoral adversa.
Importancia de márgenes libresLos márgenes quirúrgicos en enfermos con CP no están bien definidos116. Según las guías clínicas NCCN11, los márgenes en la pancreatoduodenectomía son: margen AMS (retroperitoneal/uncinado), margen posterior, margen del surco de la vena porta, vena porta propia, margen de transección del cuello pancreático y margen del conducto biliar.
Aunque también existe alguna discrepancia en el significado de la afectación de los márgenes con respecto al pronóstico del enfermo117,118, el objetivo del tratamiento quirúrgico del CP debe de ser siempre efectuar una resección tumoral R0. Aunque se han descrito supervivencias a largo plazo tras resecciones R1121–124, cualquier resección incompleta (R1 o R2) debe considerarse como paliativa124,125., La resección R1 o R2 debe ser evitada mediante un estudio preoperatorio adecuado y una técnica quirúrgica apropiada119,120.
La resección arterial parece estar justificada en un seleccionado número de pacientes en los que no sea posible obtener de otra forma una resección R0.
Desconocimiento de la evolución tumoralLa supervivencia media obtenida en enfermos de CP con resección quirúrgica radical ha experimentado una ligera mejoría. La supervivencia total actual a los 5 y 10 años es del 19 y del 10% respectivamente126. La primera de ellas es un 2% mayor que la descrita por el mismo grupo 21 años antes127. Otros grupos han obtenido resultados similares128,129.
En los últimos años se han descrito supervivencias prolongadas en enfermos con CP tras la realización de tratamientos multidisciplinarios128,130,131. En general estos pacientes son portadores de tumores pequeños, bien diferenciados, sin afectación ganglionar y sin afectación de los márgenes de resección. Pero no siempre es así. Se han observado supervivencias prolongadas en pacientes con tumores localmente avanzados e incluso metastásicos130. Estos resultados demuestran la heterogeneidad del comportamiento biológico del CP. En determinados casos, la biología del cáncer más que los clásicos factores patológicos determina el pronóstico de los pacientes.
La realización de una cirugía radical con márgenes libres es un requisito imprescindible para obtener una supervivencia prolongada.
Estado actual de los tratamientos neoadyuvantes y adyuvantesNuevos e interesantes conceptos surgidos en los últimos años han condicionado cambios en la estrategia terapéutica de pacientes con CP:
El CP es resultado de la acumulación sucesiva de mutaciones genéticas132. La mayoría de los pacientes con CP son portadores de uno o más defectos genéticos133,134.
El CP posee un denso estroma135,136. Las células estrelladas pancreáticas (o miofibroblastos) desempeñan un papel importante en la formación y recambio del estroma135–138. Este no solo es una barrera mecánica; participa en la formación, progresión y producción de metástasis135,136. Las células estromales expresan una variedad de proteínas que se han asociado a resistencia al tratamiento y en consecuencia a un mal pronóstico. Estas proteínas representan nuevas dianas terapéuticas139,140.
La terapia dirigida hacia la modificación del estroma permite aumentar la vascularización tumoral, con el consiguiente incremento en la difusión de fármacos en los tumores pancreáticos. Este aspecto mejora la eficacia de los citados fármacos141.
Dentro de los tumores se ha identificado un subconjunto de células neoplásicas con propiedades pluripotenciales142,143. En el CP estas células madre (1-5% de la población tumoral) son resistentes a la radiación y quimioterapia, lo cual podría explicar la ineficacia de estos tratamientos y el reciente interés en dirigir el tratamiento hacia estas células específicas143,144.
La gemcitabina ha representado en los últimos años el tratamiento de elección para el CP145. Diversos agentes con mecanismos de acción distintos a la gemcitabina se han combinado en una variedad estudios clínicos sin mejoría en los resultados146,147. El único agente que en combinación con gemcitabina ha demostrado una ligera mejoría en la supervivencia entre los pacientes con CP es el erlotinib (inhibidor molecular del factor de crecimiento epidérmico)148.
Los nuevos conceptos sobre las características del CP están abriendo nuevas y esperanzadoras perspectivas terapéuticas. Los nuevos fármacos incluyen pequeñas moléculas inhibidoras de vías de señalización y oncogenes149–156. El reconocimiento de que tanto el microambiente tumoral como las células madre neoplásicas son elementos críticos del CP ha dado lugar al desarrollo de agentes tales como los inhibidores de la vía de señalización «hedgehog», los cuales bloquean estos componentes136,141,143,144. La posibilidad de disponer de modelos preclínicos para recapitular la complejidad de esta enfermedad ayuda a establecer estrategias y prioridades para el desarrollo de nuevos fármacos y terapias innovadoras157. La complejidad genómica del CP demuestra la heterogeneidad de este tipo de cáncer y aconseja individualizar los métodos de tratamiento158.
ConclusionesDurante mucho tiempo, un número muy importante de profesionales médicos han mantenido un concepto escéptico y no-discriminatorio sobre el CP, especialmente en lo referente al papel de la cirugía radical. Esta actitud estaba justificada por las limitaciones terapéuticas existentes. Es indudable que la situación ha cambiado a consecuencia de los avances producidos en los últimos 10 años. Estos avances que repercuten sobre las especialidades médico-quirúrgicas involucradas con el diagnostico y tratamiento del proceso tumoral permiten tener una visión diferente del problema.
Los resultados actuales obtenidos no se pueden considerar por el momento excepcionales. Sin embargo, es innegable que se ha establecido una novedosa y esperanzadora senda terapéutica basada en el conocimiento biológico del proceso tumoral.
El cirujano involucrado en estos procesos mórbidos no debe permanecer al margen de esta nueva situación. El principal objetivo del tratamiento quirúrgico que realiza debe apuntar a la obtención de resecciones con márgenes libres. A partir de la misma, las expectativas del paciente pueden modificarse totalmente. Las estructuras vasculares afectas por el tumor no deben ser impedimento para efectuar un tratamiento radical en un grupo muy seleccionado de pacientes. Conocer con una gran precisión la situación del tumor y disponer de una adecuada experiencia en cirugía digestiva y vascular serán factores decisivos para obtener unos buenos resultados con el tratamiento quirúrgico.
La resección arterial en pacientes afectos de CP debe contemplarse como una opción técnica en pacientes seleccionados dentro del actual arsenal quirúrgico. Esta posibilidad técnica debe de estar incorporada en el seno de un moderno tratamiento multidisciplinar. Su realización fuera de este contexto resulta cuestionable.
Conflicto de interesesLos autores declaran ningún conflicto de interés y ninguna financiación recibida.
Los autores agradecen la colaboración para la realización de este artículo de Isabel de Salas y Pablo Ruiz.