Después de transcurridos más de 50 años desde el primer trasplante de páncreas realizado en la Universidad de Minnesota, las técnicas quirúrgicas empleadas han experimentado muchas modificaciones. La colocación del injerto en posición retroperitoneal reproduce la fisiología del páncreas «nativo». El objetivo del estudio es presentar la experiencia de la aplicación de una técnica modificada, con el injerto pancreático en posición retroperitoneal, con drenaje venoso sistémico y duodenoduodenostomía para el drenaje entérico.
MétodosAnálisis retrospectivo de los trasplantes de páncreas realizados entre mayo de 2016 y enero de 2017 en una sola institución.
ResultadosSe incluyen un total de 10 trasplantes (6 hombres: mediana de edad de 41 años [IQR 36-54]). El tiempo de isquemia fría fue de 10,30 h [IQR 5,30-12,10]. La solución de preservación utilizada fue Celsior (n=7), IGL-1 (n=2) y UW (n=1).
No se han identificado complicaciones relacionadas directamente con la posición retroperitoneal y la derivación duodenoduodenal. Un paciente requirió trasplantectomía a las 12 h por trombosis del injerto proveniente de un donante con paro cardiorrespiratorio prolongado. Otro procedimiento fue abortado debido a una trombosis arterial intraoperatoria en un paciente con ateromatosis ilíaca grave. Los restantes pacientes presentaron una correcta función del injerto, sin requerimientos de insulina. La estancia hospitalaria fue de 13,50 días (IQR 10-27).
ConclusionesLa colocación del injerto retroperitoneal es una técnica factible, que permite un fácil acceso para la disección de los vasos y posterior reconstrucción vascular y que minimiza, a su vez, el riesgo de oclusión intestinal.
In the 50 years since the first pancreas transplant performed at the University of Minnesota, the surgical techniques employed have undergone many modifications. Techniques such as retroperitoneal graft placement have further improved the ability to reproduce the physiology of the «native» pancreas. We herein present our experience of a modified technique for pancreatic transplant, with the organ placed into a fully retroperitoneal position with systemic venous and enteric drainage of the graft by duodeno-duodenostomy.
MethodsAll pancreas transplantations performed between May 2016 and January 2017 were prospectively entered into our transplant database and retrospectively analyzed.
ResultsA total of 10 transplants were performed using the retroperitoneal technique (6 men: median age of 41 years [IQR 36-54]). Median cold ischemia times was 10,30h [IQR 5,30-12,10]. The preservation solution used was Celsior (n=7), IGL-1 (n=2), and UW (n=1).
No complications related to the new surgical technique were identified. In one patient, transplantectomy at 12h was performed due to graft thrombosis, probably related to ischemic conditions from a donor with prolonged cardio-respiratory arrest. Another procedure was aborted without completing the graft implant due to an intraoperative immediate arterial thrombosis in a patient with severe iliac atheromatosis. No primary pancreas non-function occurred in the remaining 8patients. The median hospital stay was 13,50 days [IQR 10-27].
ConclusionsRetroperitoneal graft placement appears feasible with easy access for dissection the vascular site; comfortable technical vascular reconstruction; and a decreased risk of intestinal obstruction by separation of the small bowel from the pancreas graft.
Actualmente, el trasplante de páncreas constituye la única terapia que ha demostrado su efectividad para un control metabólico correcto y se considera el «gold standard» para el tratamiento de la diabetes mellitus de tipo 1 en casos seleccionados.
En 1966, William Kelly y Richard Lillehei realizaron el primer trasplante de páncreas en el mundo en la Universidad de Minnesota1-3. Esta experiencia inicial anticipó el futuro destino del trasplante pancreático: injertos funcionantes con corrección de la diabetes sin necesidad de insulina a largo plazo4,5, pero amenazada por contratiempos quirúrgicos6-13 e inmunológicos14. En este sentido, los refinamientos y avances en la técnica quirúrgica a menudo han sido precedidos por mejoras en la preservación del injerto15-18, la inmunosupresión4,5 y la profilaxis antimicrobiana4. Sin embargo, después de más de 50 años de historia, no existe una técnica quirúrgica estándar entre los distintos grupos de trasplante.
Probablemente, la posición del injerto pancreático sea lo que condiciona el tipo de anastomosis vasculares y de drenaje exocrino. Tradicionalmente, la posición intraperitoneal ha sido la preferida por la mayoría de los centros. En la última década, distintos autores han pregonado la colocación del injerto a nivel retroperitoneal, abogando por una posición más fisiológica.
Si nos centramos en el método de drenaje de la secreción exocrina, la derivación a la vejiga urinaria fue la más utilizada hasta mediados de la década de 1990, momento en que fue sustituida por el drenaje entérico19, considerado el estándar actual. El método más común es aquel en el que se realiza la anastomosis entre el duodeno del injerto y el yeyuno del receptor, con el injerto en posición intraperitoneal. La anastomosis entérica puede realizarse al yeyuno proximal20-22 o al íleon distal23, de forma terminoterminal24,25, terminolateral26,27 o laterolateral28-32. El uso de la anastomosis directa es actualmente más frecuente21,33-36 que la anastomosis en «Y» de Roux28,29,31,32,36. Sin embargo, Boggi et al.28,29 han presentado excelentes resultados con la duodenoyeyunostomía (DY) laterolateral en «Y» de Roux, con la colocación del injerto retroperitoneal y drenaje venoso portal. También se han descrito técnicas de drenaje exocrino al estómago37,38.
Pocas innovaciones quirúrgicas reales han sido descritas recientemente con relación a la colocación del injerto, el tipo de anastomosis intestinal y su contribución a la mejoría de la función del injerto. La duodenoduodenostomía (DD) es una opción interesante para el drenaje de las secreciones digestivas, cuando el páncreas se coloca detrás del colon derecho y está orientado en dirección craneal28,29,39-46.
En definitiva, existe una falta de consenso entre los expertos con relación a la técnica quirúrgica «ideal». La correcta función del injerto a largo plazo solo es posible si técnicamente el trasplante es un éxito. Existe la necesidad de una evaluación más objetiva y la estandarización de las técnicas quirúrgicas para el trasplante de páncreas.
Por este motivo, y tras más de 30 años de experiencia en trasplante de páncreas intraperitoneal en nuestro centro, el objetivo de este artículo es presentar una modificación de la técnica con la colocación del injerto pancreático en posición retroperitoneal, con drenaje venoso sistémico y DD para el drenaje entérico. Se analizarán las potenciales ventajas obtenidas, focalizándonos en las complicaciones postoperatorias.
MétodosSe han analizado, de forma retrospectiva, los trasplantes de páncreas realizados en un solo centro entre mayo de 2016 y enero de 2017, recogidos de forma prospectiva en una base de datos. Las indicaciones para trasplante de páncreas eran pacientes afectos de diabetes mellitus que cumplieran los criterios de inclusión según el protocolo establecido en nuestra institución47.
Se ha realizado terapéutica de inducción con globulina antitimocítica de conejo (Timoglobulina®; dosis total 6mg/kg) y de mantenimiento con inhibidor de la calcineurina (tacrolimus), antimetabolito (micofenolato-mofetil o micofenolato de sodio) y prednisona.
La profilaxis antitrombótica se ha basado en heparina sódica intravenosa antes de la reperfusión del injerto, seguida de heparina de bajo peso molecular y aspirina en el postoperatorio inmediato. Se han utilizado vancomicina y ertapenem como profilaxis antibiótica en el perioperatorio y valganciclovir y cotrimoxazole durante los primeros meses postrasplante.
Técnica quirúrgicaCirugía de bancoPara la reconstrucción vascular del injerto pancreático se han utilizado 2técnicas distintas:
Técnica quirúrgica en el receptorEn el caso de trasplante simultáneo de páncreas y riñón, el injerto pancreático se implanta antes que el riñón. La técnica quirúrgica utilizada para el implante del injerto renal no difiere de la utilizada en el trasplante de riñón aislado, colocado extraperitonealmente en fosa ilíaca izquierda.
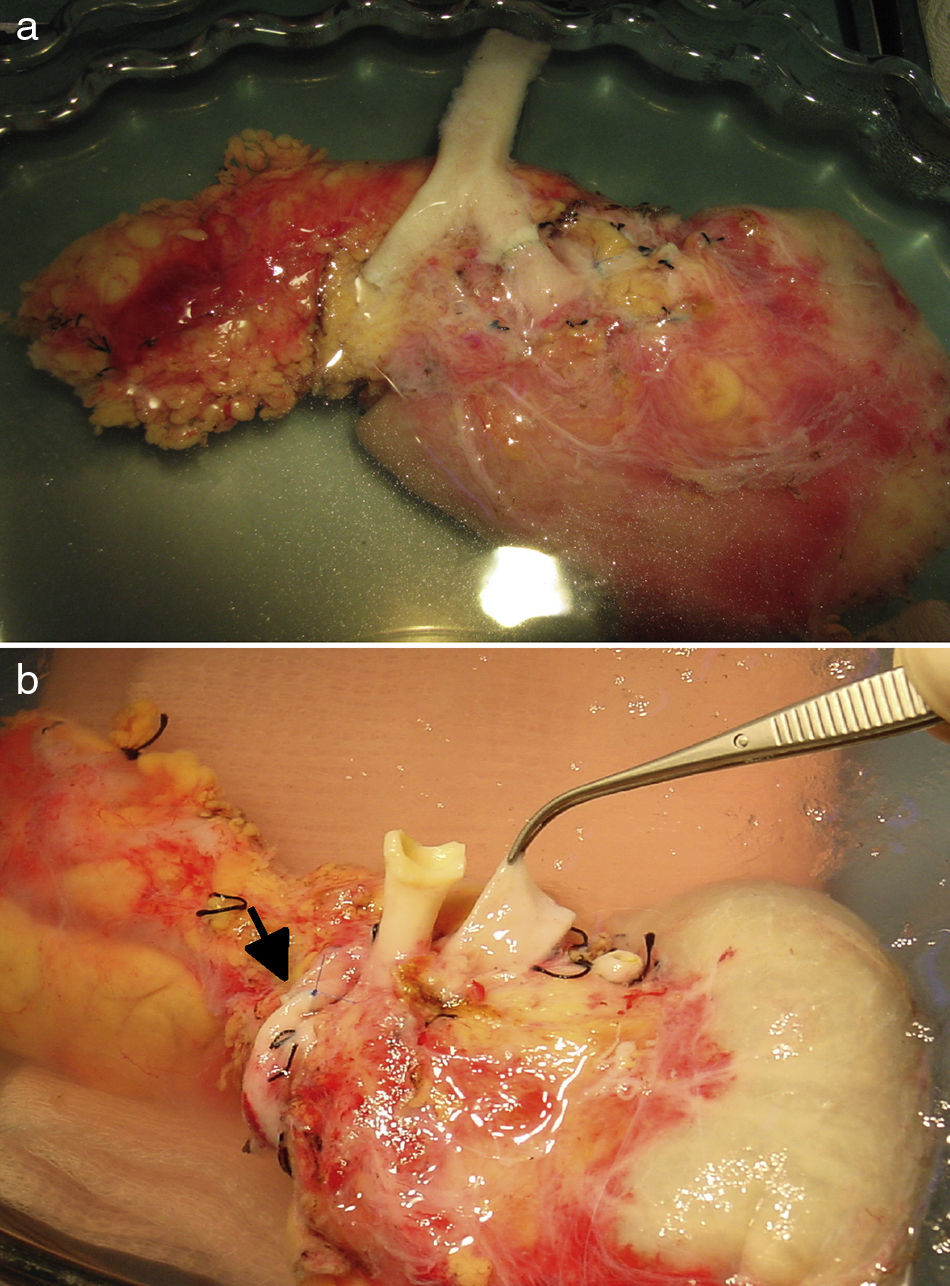
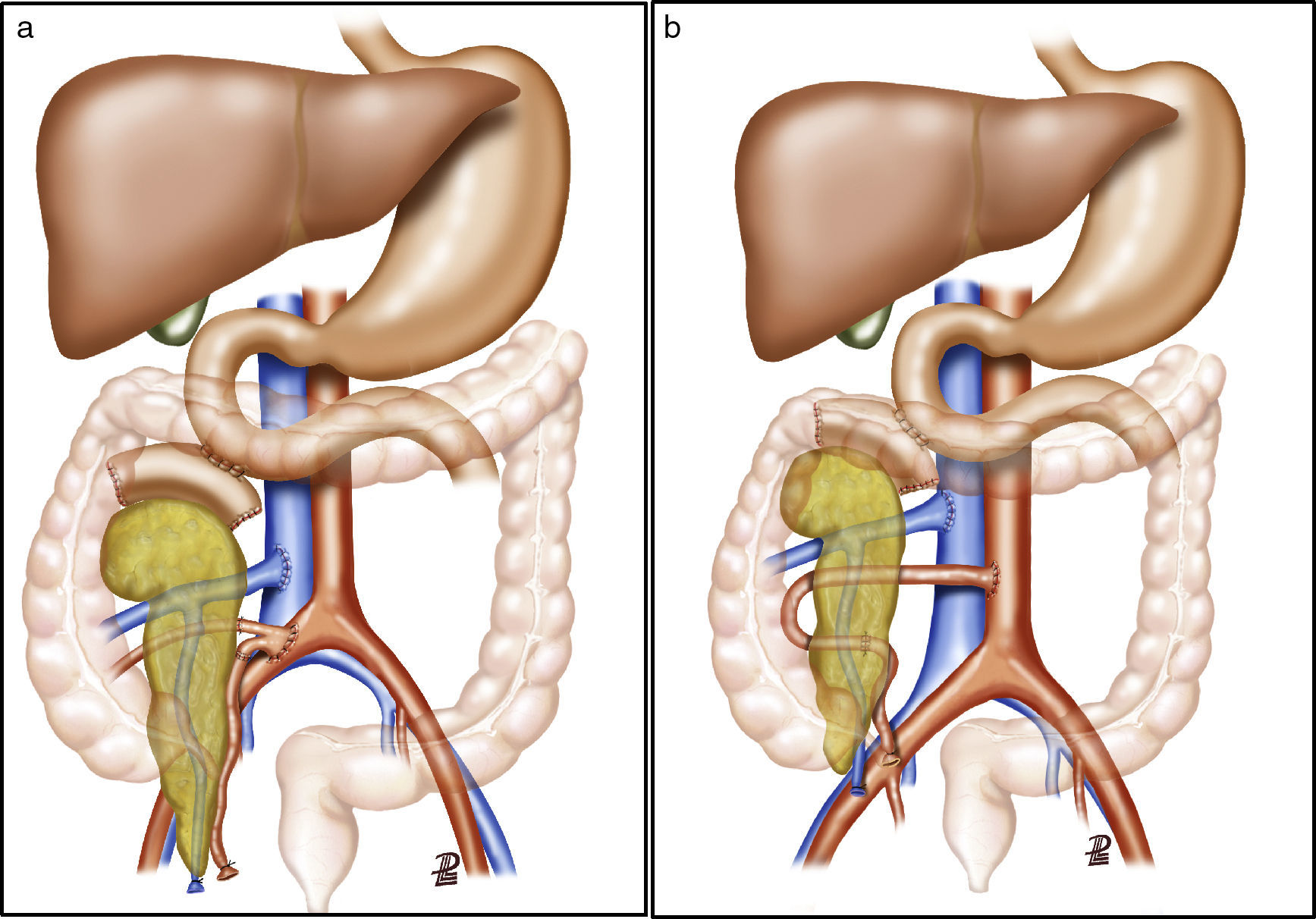
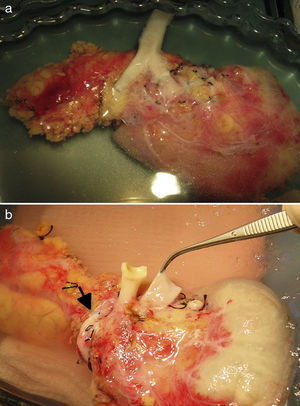
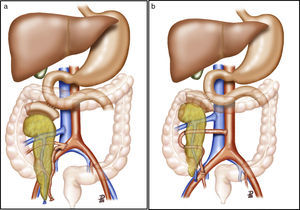
Tras la realización de una incisión de laparotomía media suprainfraumbilical, se libera el colon derecho y se realiza la maniobra de Kocher. La vena cava es disecada en todo su trayecto hasta la vena ilíaca derecha. La arteria ilíaca primitiva derecha junto con la arteria ilíaca externa y la arteria hipogástrica se individualizan con un vessel-loop. El páncreas se coloca con la cabeza pancreática y el duodeno en posición craneal y la cola en posición caudal. Primero, se realiza la anastomosis venosa terminolateral, entre la vena porta del injerto y la vena cava, con 2suturas continuas de prolene 5/0. A continuación se realiza la anastomosis arterial terminolateral mediante suturas continuas de prolene 5/0, entre el segmento de arteria ilíaca primitiva del injerto (fig. 2a) o la arteria mesentérica superior (fig. 2b), en función de la cirugía de banco realizada, con la arteria ilíaca primitiva derecha del receptor. Posteriormente se liberan de forma secuencial los clamps de las anastomosis vasculares, primero la vena y después la arteria, para la reperfusión del injerto.
a) Trasplante de páncreas con drenaje entérico de la secreción exocrina a duodeno nativo, drenaje venoso sistémico y reconstrucción arterial del páncreas mediante injerto arterial en «Y». b) Trasplante de páncreas con drenaje entérico de la secreción exocrina a duodeno nativo, drenaje venoso sistémico y reconstrucción arterial del páncreas mediante anastomosis esplenomesentérica terminoterminal. La ilustración muestra la anastomosis arterial del injerto a la aorta. En nuestra serie, la anastomosis se realizó a la arteria ilíaca primitiva derecha.
La secreción exocrina pancreática se drena al duodeno nativo. Tras la correcta movilización del duodeno del receptor, se procede a la anastomosis laterolateral (2,5-3cm) entre el duodeno del injerto y la 2.ª-3.ª porción duodenal del receptor en 2planos, uno interno para la mucosa con material reabsorbible (vicryl 3/0) y otro externo seromuscular, con sutura no absorbible (seda 3/0). Tras ello, el colon derecho se recoloca en su posición habitual, de manera que el páncreas queda inamovible.
Control postoperatorio inmediatoDe forma sistemática se realiza una ecografía doppler, a las 24h postrasplante y antes del alta hospitalaria. En aquellos casos en los que exista fiebre, dolor abdominal o disfunción del injerto pancreático, se indica una TAC abdominal. Asimismo, entre el 3.er y el 5.° día postoperatorio se realiza un tránsito intestinal para corroborar la estanqueidad de la DD, antes del inicio de dieta oral.
Análisis estadísticoSe ha realizado un análisis descriptivo de las características de los pacientes. Las variables cuantitativas han sido expresadas mediante mediana y rango. El análisis se realizó usando SPSS statistical software (SPSS 20.0, 1989-1995; Chicago, IL, EE. UU.).
El estudio ha sido aprobado por el Comité de Ética del nuestra institución.
ResultadosDurante el período descrito, se han realizado un total de 10 trasplantes de páncreas colocando el injerto en posición retroperitoneal. En todos los casos la indicación fue diabetes mellitus de tipo 1.
En la mayoría de los pacientes, se ha trasplantado el páncreas de forma simultánea con el riñón (n=9), con ambos injertos procedentes del mismo donante cadáver. En un caso, el trasplante de páncreas fue realizado en un paciente trasplantado 20 meses antes de riñón procedente de donante vivo ABO incompatible.
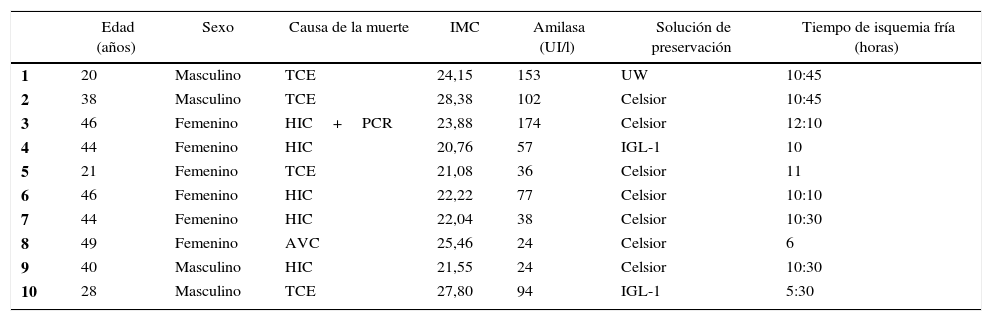
Las variables relacionadas con el donante correspondiente a cada caso de estudio se describen en la tabla 1. La mediana de edad fue de 42 años (20-49), con un IMC de 23,05 (20,76-28,38). El tiempo de isquemia fría fue de 10,30 h (5,30-12,10) y la solución de preservación utilizada para la perfusión del injerto fue Celsior (n=7), IGL-1 (n=2) y UW (n=1).
Características del donante
| Edad (años) | Sexo | Causa de la muerte | IMC | Amilasa (UI/l) | Solución de preservación | Tiempo de isquemia fría (horas) | |
|---|---|---|---|---|---|---|---|
| 1 | 20 | Masculino | TCE | 24,15 | 153 | UW | 10:45 |
| 2 | 38 | Masculino | TCE | 28,38 | 102 | Celsior | 10:45 |
| 3 | 46 | Femenino | HIC+PCR | 23,88 | 174 | Celsior | 12:10 |
| 4 | 44 | Femenino | HIC | 20,76 | 57 | IGL-1 | 10 |
| 5 | 21 | Femenino | TCE | 21,08 | 36 | Celsior | 11 |
| 6 | 46 | Femenino | HIC | 22,22 | 77 | Celsior | 10:10 |
| 7 | 44 | Femenino | HIC | 22,04 | 38 | Celsior | 10:30 |
| 8 | 49 | Femenino | AVC | 25,46 | 24 | Celsior | 6 |
| 9 | 40 | Masculino | HIC | 21,55 | 24 | Celsior | 10:30 |
| 10 | 28 | Masculino | TCE | 27,80 | 94 | IGL-1 | 5:30 |
AVC: accidente vascular cerebral isquémico; HIC: hemorragia intracraneal; IGL-1: Institut Georges Lopez 1; IMC: índice de masa corporal; PCR: parada cardiorrespiratoria; TCE: traumatismo craneoencefálico; UW: Universidad de Wisconsin.
Con relación a los receptores, se han incluido 6 varones y 4 mujeres con una mediana de edad de 41 años (36-54) y un IMC de 22 (17,30-25,28). La duración de la diabetes pretrasplante fue de 29,50 años (19-44). El tiempo de duración de la diálisis fue de 18,50 meses (3-62); hemodiálisis (n=6), diálisis peritoneal (n=2) y prediálisis (n=1).
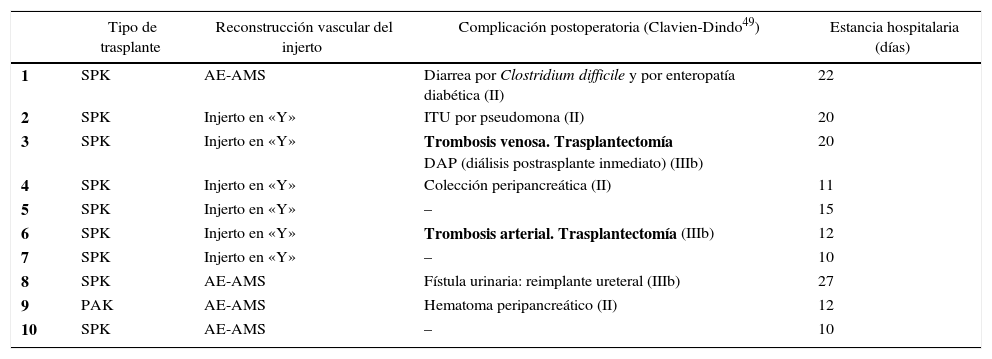
Las variables relacionadas con la intervención quirúrgica, como el tipo de reconstrucción vascular del injerto, junto con las complicaciones postoperatorias se exponen en la tabla 2.
Características del receptor
| Tipo de trasplante | Reconstrucción vascular del injerto | Complicación postoperatoria (Clavien-Dindo49) | Estancia hospitalaria (días) | |
|---|---|---|---|---|
| 1 | SPK | AE-AMS | Diarrea por Clostridium difficile y por enteropatía diabética (II) | 22 |
| 2 | SPK | Injerto en «Y» | ITU por pseudomona (II) | 20 |
| 3 | SPK | Injerto en «Y» | Trombosis venosa. Trasplantectomía DAP (diálisis postrasplante inmediato) (IIIb) | 20 |
| 4 | SPK | Injerto en «Y» | Colección peripancreática (II) | 11 |
| 5 | SPK | Injerto en «Y» | – | 15 |
| 6 | SPK | Injerto en «Y» | Trombosis arterial. Trasplantectomía (IIIb) | 12 |
| 7 | SPK | Injerto en «Y» | – | 10 |
| 8 | SPK | AE-AMS | Fístula urinaria: reimplante ureteral (IIIb) | 27 |
| 9 | PAK | AE-AMS | Hematoma peripancreático (II) | 12 |
| 10 | SPK | AE-AMS | – | 10 |
AE: arteria esplénica; AMS: arteria mesentérica superior; DAP: disfunción aguda precoz del injerto renal; ITU; infección del tracto urinario; PAK: trasplante de páncreas después de riñón; SPK: trasplante simultáneo de páncreas y riñón.
No se ha identificado ninguna complicación relacionada con la colocación del injerto a nivel retroperitoneal. Un paciente requirió trasplantectomía a las 12 h postoperatorias por trombosis venosa del injerto, proveniente de un donante con parada cardiorrespiratoria extensa (40min) y período de isquemia excesivamente largo. En este caso, la duodenotomía se reparó en 2capas, sin complicaciones posteriores. Se abortó otro procedimiento (sin completar la anastomosis intestinal) debido a una trombosis arterial inmediata intraoperatoria en el momento de la reperfusión en un paciente con ateromatosis ilíaca grave. Los 8 pacientes restantes presentaron función correcta del injerto pancreático sin necesidad de insulina. La estancia hospitalaria fue de 13,50 días (10-27).
La localización retroperitoneal no ha imposibilitado la realización de biopsias del injerto por vía percutánea guiada por ecografía. Durante el período de estudio se han realizado un total de 6 biopsias a 4 pacientes trasplantados con la nueva técnica (protocolo n=4; indicación n=1; seguimiento posrechazo n=1). Se ha obtenido muestra para diagnóstico en todos los procedimientos, sin ninguna complicación.
Tras una mediana de seguimiento de 5,83 meses (1,67-9,73), la supervivencia del paciente es del 100% y del injerto del 80%.
DiscusiónA pesar de que el trasplante de páncreas se caracteriza por ser uno de los órganos sólidos con mayor incidencia de complicaciones quirúrgicas, actualmente constituye el mejor método para restaurar la euglucemia en pacientes afectos de diabetes mellitus de tipo 1 y con enfermedad renal crónica, y ofrece mejoría en la calidad de vida de forma clara.
La experiencia en nuestra institución en trasplante de páncreas es amplia, con más de 30 años de historia y más de 500 trasplantes hasta la fecha. En un intento de mejorar los resultados relacionados con la morbilidad postoperatoria, se ha planteado la colocación del injerto pancreático a nivel retroperitoneal. A ello se suma la decisión de derivar las secreciones exocrinas al duodeno nativo del receptor. En este artículo presentamos los resultados de los primeros 10 casos realizados con dicha técnica.
La posición retroperitoneal del injerto imita la posición «fisiológica» de este órgano. Una vez liberado el colon derecho, las estructuras vasculares quedan totalmente expuestas, lo que simplifica la realización técnica de las anastomosis. Además, otro de los objetivos es evitar la torsión de los vasos del injerto. En este sentido, la realización de la anastomosis venosa a la vena cava del receptor permite que el duodeno del donante y receptor se encuentren en estrecha proximidad: esto minimiza a priori el porcentaje de trombosis del injerto. En la presente serie, la trombosis completa del injerto que requirió trasplantectomía se atribuyó a fenómenos de isquemia-reperfusión de un injerto subóptimo. El segundo caso de pérdida del injerto fue consecuencia de un problema técnico durante la anastomosis arterial en el contexto de una importante ateromatosis arterial. Walter et al.46 comparan una serie de 125 casos en los que realizan DD retroperitoneal, con 116 en los que se realizó DY intraperitoneal. En esta serie, la principal causa de pérdida del injerto fue la trombosis (9,5%) con 5casos (4%) en el grupo de DD y 18 casos (15,5%) en el grupo DY. Por otro lado, en la serie publicada por Gunasekaran et al.44, se objetivan más trombosis en el grupo DD (9,5%) que en el DY (0%).
Otra de las ventajas radica en la exposición anatómica, que difiere de la colocación intraperitoneal, donde el espacio potencial que queda entre las anastomosis vasculares y entérica puede servir como defecto a través del cual el intestino nativo puede herniarse y producir una oclusión intestinal. Además, la pancreatitis química, consecuencia de los inevitables fenómenos de isquemia-reperfusión, contribuye a la paresia intestinal, causa a su vez de íleo paralítico postoperatorio. En la presente serie, todos los pacientes han presentado una recuperación postoperatoria rápida, sin problemas para la tolerancia oral. Boggi et al.48, en una serie de 177 trasplantes, publican un 0,6% de obstrucción intestinal como causa de relaparotomía. Walter et al.46 presentan un total de 1,7% en el caso de DY frente al 0% en DD.
En el caso de pacientes a los que se indica un retrasplante pancreático o pacientes que presentan cirugía abdominal previa, el abordaje retroperitoneal junto con la DD representa también una alternativa válida que tener en cuenta.
Uno de los puntos de controversia con relación a las DD se centra en los casos de dehiscencia de la anastomosis intestinal o en los casos de necesidad de trasplantectomía, por la dificultad que implica la reparación del duodeno en ambos escenarios39-41,44,45. El paciente de nuestra serie que requirió trasplantectomía no presentó ningún tipo de evento adverso tras la reparación de la duodenotomía. El grupo alemán con más experiencia en este tipo de anastomosis46, junto con otros autores44, consideran que la DD es una técnica factible y segura, sin aumento de complicaciones intestinales. Además, la colocación retroperitoneal puede facilitar el tratamiento conservador de la fuga entérica en casos seleccionados, por menor probabilidad de contaminación intraperitoneal.
Otra de las preocupaciones que acontece en este contexto es cómo realizar el diagnóstico de rechazo del injerto. La ecografía doppler con biopsia constituye el método de elección en nuestro centro. En el caso de colocación intraperitoneal del injerto, en ocasiones no es posible acceder al páncreas por dificultades técnicas secundarias a la presencia de asas intestinales en el sitio de punción. La DD puede permitir una vía adicional, a través del abordaje por vía endoscópica para la visualización de la mucosa del duodeno del donante, así como para toma de biopsias. Recientemente, Horneland et al.43 han publicado la primera serie de pacientes a los que se les ha realizado una biopsia del injerto pancreático mediante endoscopia a través de la DD. En nuestra serie de 10 pacientes, hasta el momento se ha podido realizar sin problemas la biopsia mediante ecografía en los casos indicados. La DD también permite ampliar el abanico de opciones terapéuticas en caso de fuga exocrina mediante la colocación de stents en el conducto pancreático. Además, proporciona la capacidad de visualizar el injerto mediante gastroscopia simple en el caso de hemorragia intestinal para realización de hemostasia.
En conclusión, la colocación del injerto retroperitoneal con derivación de la secreción exocrina del injerto al duodeno nativo del receptor constituye una técnica factible y segura, con potenciales ventajas sobre la posición intraperitoneal, en términos de fácil acceso para la disección de los vasos y posterior reconstrucción vascular, menor riesgo de oclusión intestinal, fácil acceso endoscópico para la toma de biopsias del injerto y, para fines terapéuticos en caso de que se requiera.
Es necesario aumentar la casuística de nuestra serie para poder obtener resultados en términos de supervivencia del paciente y del injerto a largo plazo, dado que actualmente es considerada por nuestro grupo la técnica quirúrgica de elección del trasplante pancreático.
Autoría/colaboracionesJoana Ferrer: Disen¿o del estudio, adquisicio¿n y recogida de datos, análisis e interpretacio¿n de los resultados, redaccio¿n del arti¿culo, revisio¿n cri¿tica y aprobacio¿n de la versio¿n final.
Víctor Molina: Adquisicio¿n y recogida de datos, revisio¿n cri¿tica y aprobacio¿n de la versio¿n final.
Ramón Rull: Adquisicio¿n y recogida de datos, revisio¿n cri¿tica y aprobacio¿n de la versio¿n final.
Miguel Ángel López-Boado: Adquisicio¿n y recogida de datos, revisio¿n cri¿tica y aprobacio¿n de la versio¿n final.
Santiago Sánchez: Adquisicio¿n y recogida de datos, revisio¿n cri¿tica y aprobacio¿n de la versio¿n final.
Rocío García: Adquisicio¿n y recogida de datos, revisio¿n cri¿tica y aprobacio¿n de la versio¿n final.
M. José Ricart: Análisis e interpretacio¿n de los resultados, revisio¿n cri¿tica y aprobacio¿n de la versio¿n final.
Pedro Ventura-Aguiar: Análisis e interpretacio¿n de los resultados, revisio¿n cri¿tica y aprobacio¿n de la versio¿n final.
Ángeles García-Criado: Adquisicio¿n y recogida de datos, revisio¿n cri¿tica y aprobacio¿n de la versio¿n final.
Enric Esmatjes: Adquisicio¿n y recogida de datos, revisio¿n cri¿tica y aprobacio¿n de la versio¿n final.
Josep Fuster: Análisis e interpretacio¿n de los resultados, redaccio¿n del arti¿culo, revisio¿n cri¿tica y aprobacio¿n de la versio¿n final.
Juan Carlos Garcia-Valdecasas: Disen¿o del estudio, análisis e interpretacio¿n de los resultados, redaccio¿n del arti¿culo, revisio¿n cri¿tica y aprobacio¿n de la versio¿n final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores quieren agradecer al Servicio de Radiología del Hospital Clínic su constante contribución desde el punto de vista asistencial en el estudio pretrasplante y en el seguimiento postoperatorio y su inestimable ayuda para que este artículo haya sido posible.
El presente trabajo ha sido presentado como vídeo en el 12th Biennial E-AHPBA Congress 2017, European-African Hepato-Pancreato-Biliary Association, celebrado del 23 al 26 de mayo de 2017 en Mainz (Alemania) con el título Pancreas transplantation: A retroperitoneal graft placement.
Y ha sido aceptado como comunicación oral en el 16.° Congreso Internacional de la International Pancreas and Islet Transplant Association (IPITA), previsto para los días 20 a 23 de junio de 2017 en Oxford (Reino Unido), bajo el título Pancreas transplantation: Advantages of a retroperitoneal graft position.