El objetivo de este estudio fue analizar la eficacia y la seguridad del tratamiento de los aneurismas y pseudoaneurismas de arterias viscerales mediante la utilización de stenstents recubiertos.
MetodosSerie retrospectiva multicéntrica de pacientes intervenidos por aneurisma o pseudoaneurisma mediante stents recubiertos. Las variables estudiadas fueron: edad, sexo, tipo de lesión (aneurisma/pseudoaneurisma), localización, tasa de éxito terapéutico, tasa de complicaciones durante el procedimiento (según la clasificación SIR) y en el seguimiento. El seguimiento fue realizado mediante evaluación clínica y radiológica.
ResultadosSe trató a 25 pacientes (16 hombres) con una edad media de 59 años (rango 27-79). Diecinueve pacientes presentaban aneurismas y los restantes 6, pseudoaneurismas; la localización principal fue la arteria esplénica (12) seguida por las arterias hepática (5), renal (4), tronco celiaco (3) y gastroduodenal (1). La tasa de éxito fue del 96% (24/25 pacientes). Las complicaciones intraprocedimiento fueron del 12% (4% mayores; 8% menores). El tiempo medio de seguimiento fue de 33 meses (rango 6-72 meses) en los 24 pacientes con éxito técnico, con oclusión completa del aneurisma en todos los casos. En el seguimiento se observaron 2casos de migración (2/24; 8%) y 4de trombosis del dispositivo (4/24; 16%); en ninguno de estos pacientes se produjo daño isquémico del órgano. La mortalidad debida al procedimiento fue del 0%.
ConclusionesEn nuestro estudio, el tratamiento endovascular de los aneurismas y pseudoaneurismas viscerales mediante stents recubiertos demuestra ser seguro y eficaz a largo plazo, tanto de forma electiva como en urgencia, con una alta tasa de éxito terapéutico y una baja tasa de complicaciones.
The aim of this study is to analyze the safety and efficacy of stent-graft endovascular treatment for visceral artery aneurysms and pseudoaneurysms.
MethodsMulticentric retrospective series of patients with visceral aneurysms and pseudoaneurysms treated by means of stent graft. The following variables were analyzed: Age, sex, type of lesion (aneurysms/pseudoaneurysms), localization, rate of success, intraprocedural and long term complication rate (SIR classification). Follow-up was performed under clinical and radiological assessment.
ResultsTwenty-five patients (16 men), with a mean age of 59 (range 27-79), were treated. The indication was aneurysm in 19 patients and pseudoaneurysms in 6. The localizations were: splenic artery (12), hepatic artery (5), renal artery (4), celiac trunk (3) and gastroduodenal artery (1). Successful treatment rate was 96% (24/25 patients). Intraprocedural complication rate was 12% (4% major; 8% minor). Complete occlusion was demonstrated during follow up (mean 33 months, range 6-72) in the 24 patients with technical success. Two stent migrations (2/24; 8%) and 4stent thrombosis (4/24; 16%) were detected. Mortality rate was 0%.
ConclusionIn our study, stent-graft endovascular treatment of visceral aneurysmns and pseudoaneurysms has demonstrated to be safe and is effective in the long-term in both elective and emergent cases, with a high rate of successful treatment and a low complication rate.
Los aneurismas viscerales son dilataciones saculares o fusiformes en el tronco celiaco y sus ramas, las arterias mesentéricas superior o inferior y las arterias renales. Están clásicamente subdivididos en falsos (también llamados pseudoaneurismas) y verdaderos. La pared de los verdaderos aneurismas está constituida por las 3capas de la pared arterial y, en general, se consideran como tales en presencia de una dilatación focal del vaso superior a 1,5 veces el calibre del segmento sano del vaso afectado1. La prevalencia de los verdaderos aneurismas en la población adulta se calcula en torno al 0,1-2%1; la incidencia de los pseudoaneurismas es difícil de calcular. Los aneurismas verdaderos pueden ocurrir como resultado de una enfermedad arterial subyacente como ateroesclerosis, displasia fibromuscular y arteritis, y permanecen generalmente asintomáticos. Los falsos aneurismas son roturas de la pared arterial que quedan contenidas entre la adventicia o los tejidos perivasculares1,2. Los pseudoaneurismas son generalmente resultado de traumatismo directo, inflamación o infección en la pared. En los últimos años hemos asistido a un incremento en el diagnóstico de la enfermedad aneurismática como consecuencia del aumento de la demanda de pruebas de imagen (cada vez con mejor resolución espaciotemporal) y del aumento de los procedimientos percutáneos, laparoscópicos y endoscópicos en la vías urinarias y biliares, que incrementan la incidencia de los pseudoaneurismas3.
La localización más frecuente de los aneurismas y pseudoaneurismas es la arteria esplénica y sus ramas (45-70% de los casos)1,4,5 seguida en un porcentaje menor de la arteria hepática (aproximadamente 19-20% de los casos)4,6,7, de la arteria renal (15-25%)1,4,8 y del tronco celiaco (4-5%)1,4,9. Finalmente, las arterias implicadas con menor frecuencia son la mesentérica superior, la gastroduodenal y las pancreáticas.
La mayor complicación de los aneurismas viscerales es la rotura, que puede ocurrir en aproximadamente un 20% de los casos de aneurismas verdaderos y en un 70% de los pseudoaneurismas, lo que condiciona una mortalidad asociada que oscila entre el 25 y el 100%10-12. La principal indicación para el tratamiento de los aneurismas viscerales es el tamaño: los mayores de 2cm requieren generalmente tratamiento, independientemente de la localización, mientras que en los de menor tamaño se puede tomar una actitud expectante con seguimiento por métodos de imagen1,13,14. Los factores que pueden condicionar un cambio de actitud terapéutica son: la presencia de sintomatología asociada15, el crecimiento de más de 0,5cm al año16, el deseo genésico (la mortalidad maternofetal en caso de rotura es más elevada)14,17 y la presencia de algunas vasculopatías sistémicas asociadas (por ejemplo Ehlers-Danlos de tipo IV)18. La localización también parece influir sobre el riesgo de rotura: los aneurismas de la arteria hepática, de las arterias pancreáticas y de la arteria mesentérica superior son los más relacionados con la rotura19,20. Respecto a los pseudoaneurismas, hay un amplio consenso en la literatura sobre la necesidad de tratamiento, independientemente de la localización y del tamaño, debido a su elevado riesgo de rotura18,21,22. No obstante, en la población pediátrica o en algunos casos de adultos con pseudoaneurismas de tamaño inferior a los 5mm, se ha optado por realizar seguimiento activo con técnicas de imagen, observando la resolución de la enfermedad sin necesidad de tratamiento invasivo23,24.
El tratamiento quirúrgico convencional ha sido considerado, durante muchos años, el tratamiento de elección para esta entidad, con una morbimortalidad en casos electivos del 1,3-5% en el caso de los aneurismas2,14,25 y del 9,4%25 en los pseudoaneurismas; en tratamientos urgentes, la mortalidad variaba dependiendo de la localización, que llegaba a cifras del 25% en la arteria esplénica y de hasta el 100% en el tronco celiaco2,13,26,27. En los últimos años, gracias al importante avance de las técnicas endovasculares, se ha abierto un abanico de posibilidades para el tratamiento mínimamente invasivo de los aneurismas viscerales: embolización con espiras metálicas (coils), inyección de materiales embolizantes líquidos (como la trombina, el N-butil cianoacrilato —NBCA— o el alcohol etilén-vinilo disuelto en sulfóxido de dimetilo), el gelfoam (Pfizer, Puurs, Bélgica), los stents (recubiertos o no recubiertos combinados con coils), los «plugs» o dispositivos de oclusión vascular como el Amplatzer Vascular Plug (St. Jude Medical, St. Paul, Minnesota, EE. UU.) o el Micro Vascular Plug (Covidien, Irvine, California, EE. UU.) o la combinación de 2o más de estas técnicas. En los casos en los que no hay indicación quirúrgica (bien por las características del paciente, bien porque el tratamiento del aneurisma o pseudoaneurisma y su causa no es factible), el tratamiento endovascular es el tratamiento de elección. De estos, el más frecuentemente elegido consiste en la oclusión del vaso patológico mediante coils. Este tratamiento ha demostrado ser seguro y eficaz, si bien lo es a expensas de sacrificar el vaso tratado. La colocación de stents recubiertos es una alternativa que permite potencialmente preservar la permeabilidad vascular y, por lo tanto, la perfusión distal, al tiempo que excluye la dilatación vascular.
Existen pocos trabajos publicados en la literatura médica sobre tratamiento endovascular de aneurismas y pseudoaneurismas viscerales mediante stents recubiertos12,28,29. Nuestro objetivo es analizar la seguridad y eficacia a largo plazo del tratamiento de aneurismas y pseudoaneurismas viscerales con stent recubiertos mediante un análisis retrospectivo multicéntrico.
MétodosSe realizó un análisis retrospectivo multicéntrico de los casos recogidos en bases de datos con introducción prospectiva de pacientes desde febrero de 2006 hasta octubre de 2015. Para ello se incluyó a pacientes con aneurismas viscerales (mayores de 2cm) o pseudoaneurismas viscerales de cualquier tamaño (incluyendo los de arteria esplénica, hepática, renal, gastroduodenal, mesentérica y de tronco celiaco) tratados endovascularmente mediante colocación de sten recubierto.
Se obtuvo el consentimiento informado para la realización del procedimiento en todos los pacientes. En el centro principal de este estudio no fue necesaria la autorización del Comité de Ética para realizar estudios retrospectivos. En ambos centros, el consentimiento informado incluye la aprobación de los pacientes para ceder sus datos clínicos anonimizados con propósitos de investigación y docencia, de conformidad con lo que establece la Ley de Protección de Datos Personales correspondiente.
De cada paciente se recogieron las siguientes variables: edad, sexo, tipo de lesión vascular (aneurisma o pseudoaneurisma), localización de la lesión (hepática, esplénica, gástrica, en el tronco celiaco, mesentérica superior, gastroduodenal, renal) y clínica de presentación (incidental, hemorragia, dolor abdominal).
Los pseudoaneurismas se diferenciaron de los aneurismas verdaderos mediante criterios clínicos (antecedentes de trauma a nivel del vaso, manipulaciones de vías biliares, estado inflamatorio o neoplasia retroperitoneal o intraabdominal) y de imagen (alteración focal en el contexto de una arteria sana, signos de inflamación en la periferia de la lesión, marcada irregularidad de las paredes del aneurisma).
Técnica del procedimientoPreviamente al procedimiento intervencionista se realizó una angio-TC para evaluar y confirmar el diagnóstico y la viabilidad del procedimiento endovascular. El estudio TC se realizó en el primer centro con una TC helicoidal multidetector de 16 coronas Philips MDT MX 8000 (Philips Healthcare, Cleveland, OH, EE. UU.) y en el segundo centro con TC helicoidal multidetector de 64 coronas Siemens SOMATOM Sensation 64 (Siemens, Erlangen, Alemania). Las imágenes nativas adquiridas fueron valoradas en una estación de trabajo con reconstrucciones multiplanares y proyección de máxima intensidad. Las medidas del aneurisma, vaso aferente y eferente se realizaron mediante angiografía por sustracción digital.
Como guía de imagen para el tratamiento se utilizaron 2equipos angiográficos: Digital Innova 2000 (GE, Nueva York, NY, EE. UU.) y Siemens AXIOM Artis (Siemens, Erlangen, Alemania).
En función de la situación hemodinámica del paciente, el procedimiento fue realizado bajo anestesia local y sedación o anestesia general (se prefiere esta en pacientes no colaboradores o en los casos en los que fue necesario una monitorización y tratamiento intensivo durante el procedimiento por la inestabilidad hemodinámica del paciente). Previamente a la colocación del stent, de forma protocolizada, se procedió a realizar heparinización sistémica para evitar complicaciones tromboembólicas durante la colocación del sten (100 UI/kg hasta un máximo de 5.000 UI). Si el procedimiento se prolongaba durante más de 60 min desde el bolo inicial, se administraba un segundo bolo de 1.000 UI de heparina sódica cada hora. En los casos de sangrado secundario a aneurisma o pseudoaneurisma, según la situación clínica del paciente, se valoró el riesgo de heparinización. En ningún caso con correcta exlusión de la lesión se consideró necesario revertir la heparina para disminuir el riesgo de oclusión aguda del stent. Todos los pacientes recibieron antibiótico de amplio espectro previamente al procedimiento para prevenir infecciones debidas a la posible contaminación del sten o secundarias al tejido necrótico en caso de infarto de órgano distal. Tras el procedimiento, se estableció un esquema de doble antiagregación durante 30-60 días (clopidogrel 75mg/día y AAS 100mg/día), manteniendo la monoantiagregación con AAS 100mg/día de forma indefinida. Según la localización de la lesión, se usaron distintos accesos vasculares arteriales (femoral, axilar o humeral) para minimizar las dificultades técnicas en el momento de acceder a la arteria afectada. Para llevar el sten al lugar de liberación y evitar su displazamiento durante este momento se emplearon catéteres guía (6F) o introductores largos (entre 6 y 9 Fr). Como stents fueron utilizados 6tipos diferentes de prótesis recubiertas, tanto autoexpandibles como expandibles por balón: Jostent Grafmaster (Abbott Vascular, Rangendingen, Alemania), Jomed (Jomed International AB, Helsingborg, Suecia), Symbiot (Boston Scientific, Natick, MA, EE. UU.), Advanta (Atrium Medical Corporation, Hudson, NH, EE. UU.), Viabhan (W.L. Gore, Flagstaff, AZ, EE. UU.) y Be-Graft (Bentley Innomed GmbH, Hechingen, Alemania). En algunos casos, si por la longitud del sten no había un correcto sellado de la lesión, se colocó más de un sten de manera telescopada o en ramas diferentes, en caso de división vascular, con la intención de mantener la permeabilidad de todas las divisiones. En caso de presencia de ramas colaterales originadas en el aneurisma, se procedió a su embolización previa mediante coils para evitar endofugas de tipo II.
Se consideraron variables de seguridad durante el procedimiento las complicaciones relacionadas con el sitio de la punción arterial (perforación/disección arterial), la rotura del aneurisma/pseudoaneurisma, la migración del sten o su trombosis aguda, el daño isquémico al órgano distal y la mortalidad durante el procedimiento. Las complicaciones intraprocedimiento fueron catalogadas según la clasificación SIR en menores y mayores30,31 (tabla 1).
Sistema de clasificación de las complicaciones SIR según el pronóstico
| Complicaciones menores |
| A. Sin tramiento ni consecuencias |
| B. Terapia de mantenimiento, sin consecuencias; una noche de observación |
| Complicaciones mayores |
| C. Requiere tratamiento, hospitalización menor (48h) |
| D. Requiere tratamiento mayor, incremento del nivel de asistencia no planificado, hospitalización prolongada (48h) |
| E. Secuelas permanentes |
| F. Muerte |
Se consideró éxito técnico la correcta colocación del sten o de los stents en la localización planeada. Se consideró que el procedimiento fue eficaz cuando la colocación del sten en la situación planificada reunió las siguientes características: sin endofuga, con permeabilidad del sten y con exclusión del aneurisma de la circulación.
El seguimiento de los pacientes fue realizado mediante evaluación clínica y radiológica mediante angio-TC, angio-RM o eco-color doppler más angio-TC. Se definió como eficacia a largo plazo en el seguimiento clínico-radiológico: la exclusión del aneurisma de la circulación con ausencia de endofuga con sten permeable. También se evaluó la seguridad a largo plazo mediante la recogida de las siguientes variables: aparición de nueva sintomatología, migración del sten o trombosis, daño isquémico al órgano distal y mortalidad relacionada a los 30 días del procedimiento.
Análisis estadísticoRealizamos un estudio estadístico descriptivo que incluía las frecuencias y porcentajes para variables categóricas y la media, desviación estándar y la mediana (rango intercuartílico) para variables continuas. El análisis se realizó con el paquete estadístico SPSS versión 20.0 (SPSS, Chicago, Illinois, EE. UU.).
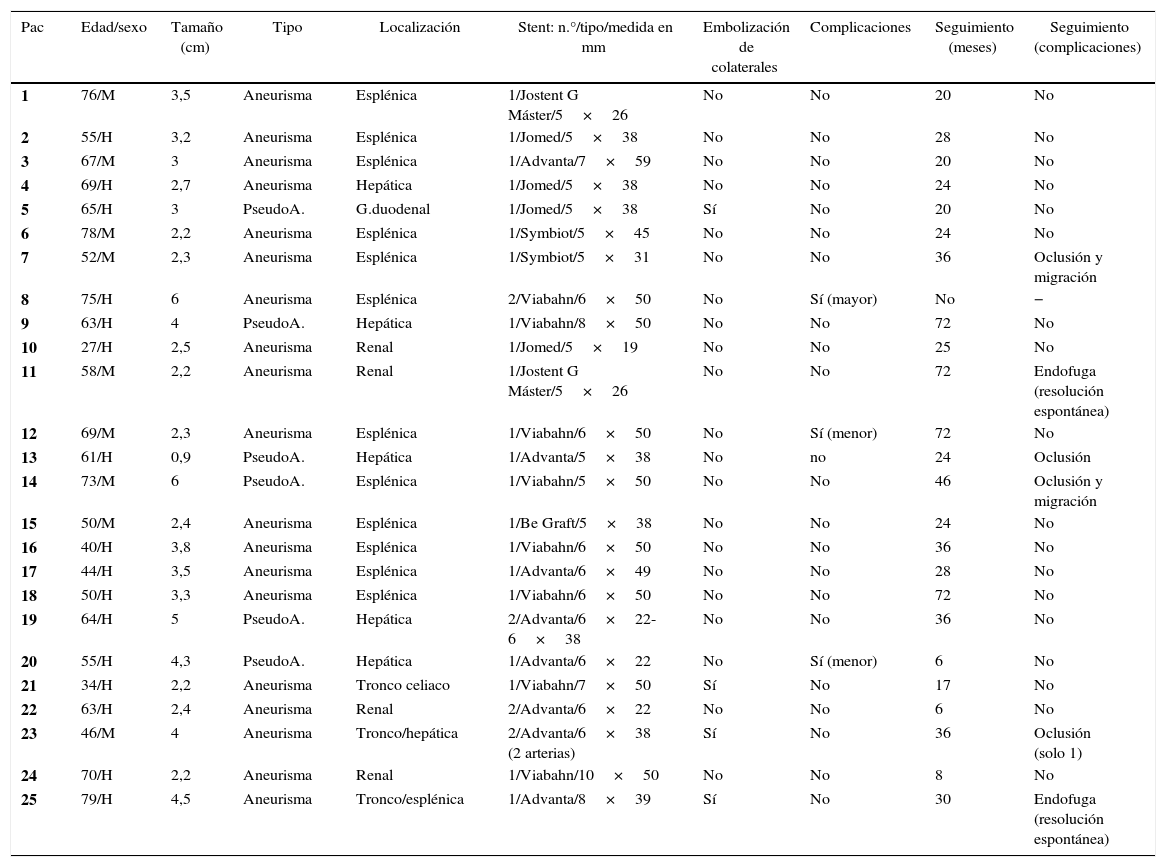
ResultadosSe identificó a 25 pacientes (16 hombres y 9 mujeres) con 25 lesiones con diagnóstico de aneurismas viscerales (n=19) o pseudoaneurismas viscerales (n=6), con una edad media de 59 años (rango 27-79). Para el tratamiento de las 25 lesiones se colocaron un total de 29 stents. La localización de las lesiones fue: arteria esplénica (n=12), arteria hepática (n=5), arteria renal (n=4), tronco celiaco (n=3) y arteria gastroduodenal (n=1). En la tabla 2 se recogen los datos resumidos sobre los pacientes (los pacientes 1, 2 y 3 fueron ya reportados en otra serie)22.
Resumen de pacientes tratados en nuestra serie
| Pac | Edad/sexo | Tamaño (cm) | Tipo | Localización | Stent: n.°/tipo/medida en mm | Embolización de colaterales | Complicaciones | Seguimiento (meses) | Seguimiento (complicaciones) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 76/M | 3,5 | Aneurisma | Esplénica | 1/Jostent G Máster/5×26 | No | No | 20 | No |
| 2 | 55/H | 3,2 | Aneurisma | Esplénica | 1/Jomed/5×38 | No | No | 28 | No |
| 3 | 67/M | 3 | Aneurisma | Esplénica | 1/Advanta/7×59 | No | No | 20 | No |
| 4 | 69/H | 2,7 | Aneurisma | Hepática | 1/Jomed/5×38 | No | No | 24 | No |
| 5 | 65/H | 3 | PseudoA. | G.duodenal | 1/Jomed/5×38 | Sí | No | 20 | No |
| 6 | 78/M | 2,2 | Aneurisma | Esplénica | 1/Symbiot/5×45 | No | No | 24 | No |
| 7 | 52/M | 2,3 | Aneurisma | Esplénica | 1/Symbiot/5×31 | No | No | 36 | Oclusión y migración |
| 8 | 75/H | 6 | Aneurisma | Esplénica | 2/Viabahn/6×50 | No | Sí (mayor) | No | − |
| 9 | 63/H | 4 | PseudoA. | Hepática | 1/Viabahn/8×50 | No | No | 72 | No |
| 10 | 27/H | 2,5 | Aneurisma | Renal | 1/Jomed/5×19 | No | No | 25 | No |
| 11 | 58/M | 2,2 | Aneurisma | Renal | 1/Jostent G Máster/5×26 | No | No | 72 | Endofuga (resolución espontánea) |
| 12 | 69/M | 2,3 | Aneurisma | Esplénica | 1/Viabahn/6×50 | No | Sí (menor) | 72 | No |
| 13 | 61/H | 0,9 | PseudoA. | Hepática | 1/Advanta/5×38 | No | no | 24 | Oclusión |
| 14 | 73/M | 6 | PseudoA. | Esplénica | 1/Viabahn/5×50 | No | No | 46 | Oclusión y migración |
| 15 | 50/M | 2,4 | Aneurisma | Esplénica | 1/Be Graft/5×38 | No | No | 24 | No |
| 16 | 40/H | 3,8 | Aneurisma | Esplénica | 1/Viabahn/6×50 | No | No | 36 | No |
| 17 | 44/H | 3,5 | Aneurisma | Esplénica | 1/Advanta/6×49 | No | No | 28 | No |
| 18 | 50/H | 3,3 | Aneurisma | Esplénica | 1/Viabahn/6×50 | No | No | 72 | No |
| 19 | 64/H | 5 | PseudoA. | Hepática | 2/Advanta/6×22-6×38 | No | No | 36 | No |
| 20 | 55/H | 4,3 | PseudoA. | Hepática | 1/Advanta/6×22 | No | Sí (menor) | 6 | No |
| 21 | 34/H | 2,2 | Aneurisma | Tronco celiaco | 1/Viabahn/7×50 | Sí | No | 17 | No |
| 22 | 63/H | 2,4 | Aneurisma | Renal | 2/Advanta/6×22 | No | No | 6 | No |
| 23 | 46/M | 4 | Aneurisma | Tronco/hepática | 2/Advanta/6×38 (2 arterias) | Sí | No | 36 | Oclusión (solo 1) |
| 24 | 70/H | 2,2 | Aneurisma | Renal | 1/Viabahn/10×50 | No | No | 8 | No |
| 25 | 79/H | 4,5 | Aneurisma | Tronco/esplénica | 1/Advanta/8×39 | Sí | No | 30 | Endofuga (resolución espontánea) |
De los 19 aneurismas, 16 fueron detectados de manera incidental y 3 presentaban dolor abdominal (uno de los cuales cursó con hemorragia en el momento del diagnóstico). Los 6 pseudoaneurismas cursaron con hemorragia o dolor abdominal. Se consideraron urgentes todos los pseudoaneurismas y los aneurismas sintomáticos o de tamaño superior a 5cm.
El procedimiento fue realizado con éxito técnico en 24 pacientes (27 de los 29 stents), sin endofuga en el control inmediato posprocedimiento, con una adecuada permeabilidad del sten. La tasa de eficacia fue del 96%, con la exclusión inmediata del aneurisma en 24 de los 25 casos, comprobada en la serie angiográfica final (fig. 1). En uno de los casos, un aneurisma de tronco celiaco/arteria hepática común, se colocaron 2stents en paralelo: uno desde el tronco común hasta la arteria esplénica y el otro desde el tronco común hasta la arteria gástrica izquierda. El procedimiento se completó con una embolización con coils de la arteria hepática distal al aneurisma y proximal a la gastroduodenal, preservando el flujo hepático distal y excluyendo el aneurisma de la circulación. En otros 4 casos, previamente a la colocación del stent, se realizó embolización de ramas colaterales con origen en el aneurisma para evitar endofuga de tipo II. En 3 pacientes se colocaron 2stents de manera telescopada. Uno de estos casos, un aneurisma de arteria esplénica, fue el paciente en el que no se pudo completar el procedimiento (al colocar el segundo sten se produjo un deficiente posicionamiento de la parte distal y su caída al saco aneurismático. En las series arteriográficas se observó extravasación del medio de contraste, por lo que se decidió embolizar el aneurisma y la arteria proximal con coils; el aneurisma resultó correctamente excluido, aunque el paciente presentó una isquemia esplénica complicada con un absceso). Además de esta complicación intraprocedimiento considerada como mayor (de tipoC), se evidenciaron otras 2complicaciones menores (de tipo B) relacionadas con el sitio de punción arterial, 2pseudoaneurismas (uno femoral y otro axilar) ambos controlados con compresión manual, sin necesidad de transfusión ni otra medida de soporte. El porcentaje global de complicaciones fue del 12% (3/25), de las cuales el 4% (1/25) fueron complicaciones mayores y el 8% (2/25) menores.
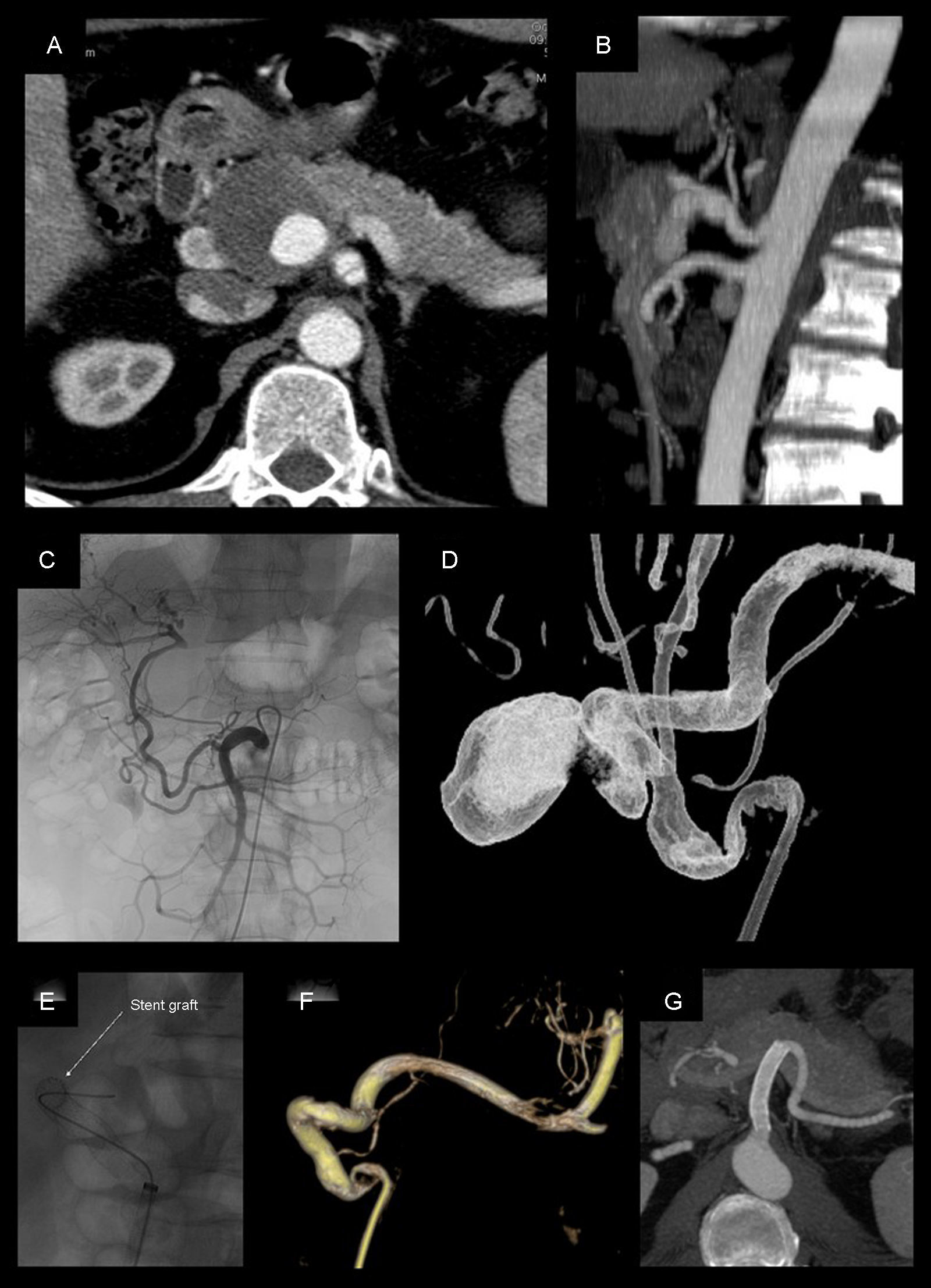
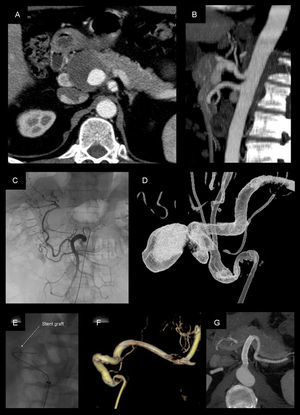
Pseudoaneurisma de la arteria hepática de 4cm tratado mediante colocación de stent recubierto (Viabahn 8×50mm). A-B) Angio-TC previa al tratamiento. C) Angiografia selectiva desde la arteria mesentérica superior, donde se aprecia la repermeabilización de la arteria hepática propia a través de la arteria gastroduodenal. D) Angiografía rotacional realizada desde el tronco celiaco. E-F) Colocación y control angiográfico tras el posicionamento del stent, en la que se evidencia exclusión completa del pseudoaneurisma con permeabilidad. G) Angio-TC a los 72 meses del procedimiento, que evidencia permeabilidad del stent y ausencia de endofuga.
En nuestra serie no detectamos disección, rotura del aneurisma/pseudoaneurisma, trombosis ni migración del sten durante el procedimiento. Tampoco existió mortalidad intraprocedimiento. El tiempo medio de hospitalización en el caso de los aneurismas verdaderos fue de 40 h y en el caso de los pseudoaneurismas fue de 7 días.
Se realizó seguimiento clínico y radiológico en los 24 pacientes en los que se consiguió colocar los stents recubiertos, con un tiempo medio de 33 meses (rango 6-72 meses). En el control radiológico se observó la adecuada exclusión del aneurisma en todos los casos, si bien con oclusión del sten en 4 pacientes (eficacia a largo plazo del 86%). El paciente con la complicación de tipo C intraprocedimiento y embolización con coils fue excluido del seguimiento para valorar la eficacia a largo plazo. El seguimiento radiológico se realizó mediante angio-TC en 20 pacientes y angio-TC más eco-color doppler en 2 pacientes. En los 2 pacientes restantes se optó por realizar seguimiento mediante angio-RM debido a su edad (27 y 34 años). Durante el seguimiento se encontraron 2endofugas, una al mes y otra a los 6 meses. Dichas endofugas no presentaron repercusión sobre el tamaño del saco anurismático y no necesitaron ninguna intervención adicional: se resolvieron espontáneamente a los 6 y a los 24 meses, respectivamente. De los 4 pacientes a los que se les realizó embolización profiláctica para prevenir endofuga de tipo II, 3 no tuvieron endofuga en los controles sucesivos y el cuarto es el descrito anteriormente con endofuga al mes, resuelta a los 6 meses de manera espontánea. Como complicaciones diferidas se produjeron 4trombosis del sten (4/24; 16%): una al mes en un pseudoaneurisma de la arteria hepática, una a los 3meses en un pseudoaneurisma de la arteria esplénica y 2 a los 6 meses (una en un aneurisma de la esplénica y otra en un aneurisma del tronco celiaco). En ninguno de los casos se evidenció daño isquémico del órgano interesado ni sintomatología clínica relacionada.
En los 2pacientes con trombosis del sten, colocado en la arteria esplénica, se produjo migración (2/24; 8%). En uno de ellos la migración fue proximal, probablemente debida a una incorrecta medición por sobrestimación de la arteria tratada, si bien no hubo repercusión clínica ni recanalización del aneurisma. En el segundo caso se produjo una perforación de la pared gástrica 36 meses después de su colocación. En este último caso, debido a las comorbilidades oncológicas de este paciente, que condicionaban una breve esperanza de vida, se decidió conducta no invasiva. El paciente falleció 10 meses después debido a la enfermedad de base: un adenocarcinoma de la cabeza del páncreas. Este caso fue ya reportado en la literatura21.
DiscusiónPese a que la cirugía sigue siendo el tratamiento de elección en pacientes con aneurismas y pseudoaneurismas viscerales, dado que en numerosas ocasiones permite tratar en el mismo acto la causa y la lesión vascular, en los últimos 10años la radiología intervencionista ha ofrecido varias alternativas de tratamiento en las lesiones vasculares aneurismáticas y pseudoaneurismáticas, con una disminución, en general, de los tiempos de hospitalización respecto a la cirugía convencional y con una tasa de mortalidad que varía entre el 0 y el 10,5%9,12,15,32-34. Esto en gran parte se debe a que se trata de técnicas mínimamente invasivas y que pueden ser realizadas con anestesia local y sedación, lo que permite su aplicación en pacientes con elevado riesgo anestésico. Este hecho se ve apoyado por los resultados en nuestra serie, en la que tuvimos una mortalidad del 0%. En nuestra experiencia el tratamiento con sten recubierto tuvo una tasa de éxito técnico del 96%, con una eficacia inmediata del 100% y a largo plazo del 86% en aquellos pacientes con éxito técnico. Si no consideráramos la permeabilidad del sten como parte de la variable eficacia (como es en el caso de la embolización con plugs y coils) y solamente lo hiciéramos con la exclusión de la hemorragia, la eficacia a largo plazo continuaría siendo del 100%.
Las complicaciones durante el procedimiento fueron del 12% (4% mayores; 8% menores). En el seguimiento se constató la oclusión completa del aneurisma en todos los casos, con una tasa de trombosis del sten del 16% (en ninguno de estos pacientes se produjo daño isquémico del órgano) y de migración del 8%.
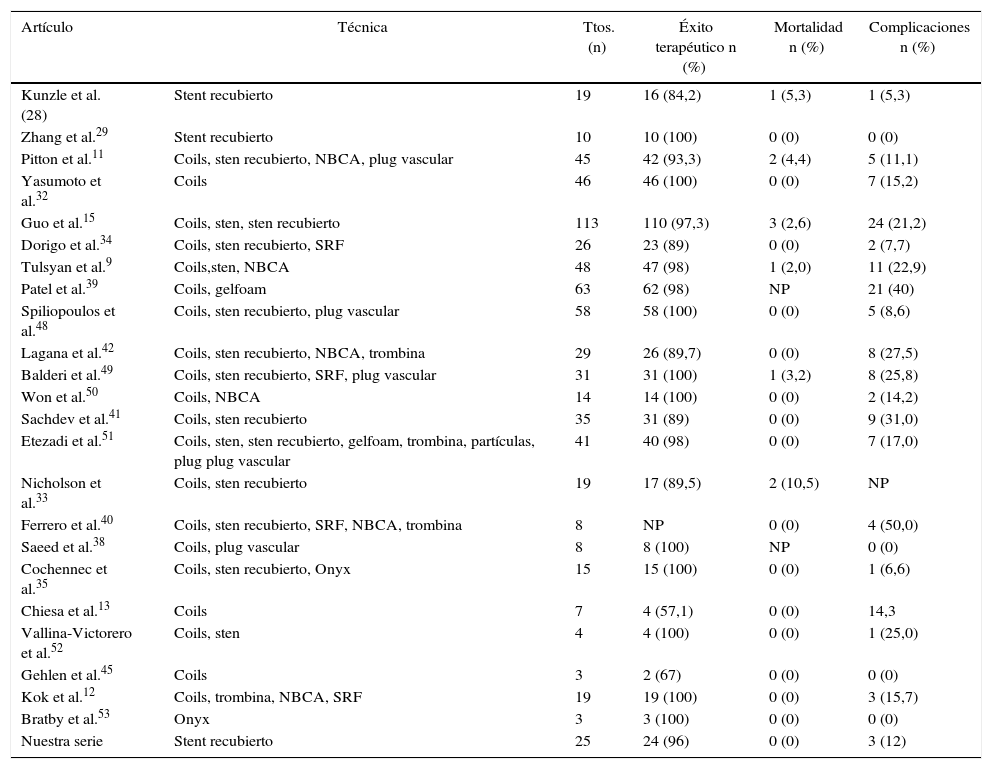
En nuestra serie no se produjo ninguna muerte debida al procedimiento. En la literatura el éxito técnico del tratamiento endovascular incluyendo todas las técnicas (coils, stent y coils, sten recubierto, etc.) se encuentra entre un 57,1 y un 100%12,13,29,32,35 dependiendo de varios factores como la morfología de los vasos aferente y eferente y del propio aneurisma y su localización, así como de la presencia de enfermedad asociada y de la experiencia del operador. Nuestros resultados, con un éxito técnico del 96%, estarían encuadrados dentro de este rango. Cabe destacar que conforme ha ido evolucionando la tecnología usada en radiología intervencionista, ha habido también una mejoría en los resultados clínicos obtenidos en los procedimientos. En la tabla 3 se resumen las principales series de la literatura que versan sobre la técnica endovascular y se comparan con la nuestra. En un estudio comparativo de Shukla et al.4, la técnica endovascular y la cirugía convencional no presentan diferencias significativas respecto a las complicaciones mayores periprocedimiento y a la mortalidad a los 30 días en el tratamiento de aneurismas no rotos. En caso de aneurismas rotos, varios trabajos han demostrado una menor morbimortalidad en pacientes tratados por vía endovascular4,36,37. Es importante resaltar la importancia de la selección de los pacientes en el tratamiento endovascular para conseguir una adecuada exclusión del aneurisma con permeabilidad de todas las arterias viscerales, en caso contrario y con potencial daño isquémico grave, la técnica quirúrgica debería ser el tratamiento de elección. Así mismo, hay que tener en cuenta que los pacientes tratados por vía endovascular necesitan retratamiento con mayor frecuencia que los tratados quirúrgicamente. En los pacientes con aneurismas rotos, la tasa de retratamiento en el tratamiento endovascular es de un 15% de los casos comparado con un 8,2% de los pacientes tratados quirúrgicamente, si bien estas diferencias no presentan significación estadística4.
Estudios de tratamiento endovascular de aneurismas y pseudoaneurismas viscerales
| Artículo | Técnica | Ttos. (n) | Éxito terapéutico n (%) | Mortalidad n (%) | Complicaciones n (%) |
|---|---|---|---|---|---|
| Kunzle et al. (28) | Stent recubierto | 19 | 16 (84,2) | 1 (5,3) | 1 (5,3) |
| Zhang et al.29 | Stent recubierto | 10 | 10 (100) | 0 (0) | 0 (0) |
| Pitton et al.11 | Coils, sten recubierto, NBCA, plug vascular | 45 | 42 (93,3) | 2 (4,4) | 5 (11,1) |
| Yasumoto et al.32 | Coils | 46 | 46 (100) | 0 (0) | 7 (15,2) |
| Guo et al.15 | Coils, sten, sten recubierto | 113 | 110 (97,3) | 3 (2,6) | 24 (21,2) |
| Dorigo et al.34 | Coils, sten recubierto, SRF | 26 | 23 (89) | 0 (0) | 2 (7,7) |
| Tulsyan et al.9 | Coils,sten, NBCA | 48 | 47 (98) | 1 (2,0) | 11 (22,9) |
| Patel et al.39 | Coils, gelfoam | 63 | 62 (98) | NP | 21 (40) |
| Spiliopoulos et al.48 | Coils, sten recubierto, plug vascular | 58 | 58 (100) | 0 (0) | 5 (8,6) |
| Lagana et al.42 | Coils, sten recubierto, NBCA, trombina | 29 | 26 (89,7) | 0 (0) | 8 (27,5) |
| Balderi et al.49 | Coils, sten recubierto, SRF, plug vascular | 31 | 31 (100) | 1 (3,2) | 8 (25,8) |
| Won et al.50 | Coils, NBCA | 14 | 14 (100) | 0 (0) | 2 (14,2) |
| Sachdev et al.41 | Coils, sten recubierto | 35 | 31 (89) | 0 (0) | 9 (31,0) |
| Etezadi et al.51 | Coils, sten, sten recubierto, gelfoam, trombina, partículas, plug plug vascular | 41 | 40 (98) | 0 (0) | 7 (17,0) |
| Nicholson et al.33 | Coils, sten recubierto | 19 | 17 (89,5) | 2 (10,5) | NP |
| Ferrero et al.40 | Coils, sten recubierto, SRF, NBCA, trombina | 8 | NP | 0 (0) | 4 (50,0) |
| Saeed et al.38 | Coils, plug vascular | 8 | 8 (100) | NP | 0 (0) |
| Cochennec et al.35 | Coils, sten recubierto, Onyx | 15 | 15 (100) | 0 (0) | 1 (6,6) |
| Chiesa et al.13 | Coils | 7 | 4 (57,1) | 0 (0) | 14,3 |
| Vallina-Victorero et al.52 | Coils, sten | 4 | 4 (100) | 0 (0) | 1 (25,0) |
| Gehlen et al.45 | Coils | 3 | 2 (67) | 0 (0) | 0 (0) |
| Kok et al.12 | Coils, trombina, NBCA, SRF | 19 | 19 (100) | 0 (0) | 3 (15,7) |
| Bratby et al.53 | Onyx | 3 | 3 (100) | 0 (0) | 0 (0) |
| Nuestra serie | Stent recubierto | 25 | 24 (96) | 0 (0) | 3 (12) |
Gelfoam: Pfizer, Puurs, Bélgica; NBCA: N-butil cianoacrilato; NP: no publicado; Onyx: Covidien, Irvine, CA, EE. UU.; SRF: sten multicapa con redireccionamiento del flujo; Ttos: tratamientos.
El porcentaje de complicaciones global del 12% detectado en nuestra serie se encuentra dentro del rango de las complicaciones de la técnica endovascular reportados en general en otras series (0-50%)9,29,38-41. En la literatura se reporta una tasa de endofuga-recanalización, incluyendo las distintas técnicas, del 5,4% según un metaanálisis recientemente publicado12 (con un rango que va desde el 0% hasta un 26% en caso de coiling con seguimiento a largo plazo)32,41,42. La necesidad de retratamiento varía entre un 0 y un 15%4,13,34,35. En nuestra experiencia tuvimos, durante el seguimiento, 2casos de endofuga que, debido a la ausencia de aumento de tamaño y de sintomatología, no precisaron tratamiento. De hecho, en ambos casos se objetivó resolución espontánea en el control radiológico con angio-TC a los 6 y 24 meses. En el seguimiento de estos pacientes tuvimos 4 casos de trombosis a los 1, 6 y 12 meses, sin evidencia de daño isquémico de órgano asociado. Kunzle et al. también reportan 2casos de trombosis asintomáticas en el seguimiento28. Ni en esta serie ni en la nuestra se reportan trombosis agudas. Las trombosis tardías parecen ser toleradas mejor gracias a una compensación hemodinámica por colateralidad, evitando así el daño isquémico del órgano afectado, al contrario de lo que ocurre en los casos de embolización con coils, en los que la oclusión aguda y voluntaria del vaso tratado puede provocar un daño isquémico relevante. En nuestra serie, en el caso de fallo técnico, se tuvo que terminar embolizando mediante coils en agudo la arteria esplénica, que ocasionó una isquemia complicada con un absceso esplénico. Igualmente, en nuestra serie, en 2casos la trombosis se asoció a migración del sten, una asintomática y otra con fistulización al estómago. En la literatura, la migración de sten en vasos esplácnicos suele ocurrir asociada a la colocación de EVAR, que son en todo momento migraciones intravasculares. En cambio, las migraciones extravasculares son eventos extremamente raros y parecen debidos a efectos citotóxicos por quimioterapia43 o estados inflamatorios crónicos locales, por ejemplo pancreatitis, como en nuestro caso. Ferrero et al. en una serie mixta (quirúrgica y endovascular) reportan un caso de migración de sten recubierto en un paciente con un aneurisma de tronco celiaco y bypass aortoaórtico previo; el caso fue solucionado con colocación de un segundo sten40.
En las series publicadas, la embolización mediante espirales de platino (coiling) es la técnica más utilizada12. Se han reportado diferentes complicaciones relacionadas con esta técnica —dado que no garantiza la permeabilidad distal a la zona embolizada del vaso— como la perforación del saco1, el síndrome postembolización (0-30% de los casos)9,29,35,44 y la isquemia mayor de órganos vascularizados por dichas arterias (50% o más del órgano) que, según la literatura, puede ocurrir en un porcentaje de casos entre el 0 y el 21%32,39,45. Desde un punto de vista teórico, que nuestra experiencia refrenda, la técnica endovascular que conseguiría disminuir la tasa de este tipo de complicaciones es la utilización de stents recubiertos, dado que permite preservar la permeabilidad del vaso tratado (asociando además un menor riesgo de perforación del saco aneurismático y de embolia distal)46 así como reducir el tiempo del procedimiento29,45. La reparación de aneurismas y pseudoaneurismas mediante sten está particularmente indicada en casos de aneurismas de cuello ancho (relación 2 a 1 entre el diámetro del aneurisma y el cuello), situados en vasos proximales a la aorta o con poca tortuosidad (dada la limitación del perfil de los stents actuales que requieren un calibre mínimo de 6 Fr), tanto de forma electiva como de urgencia. Nuestra predilección, en concordancia con la de la mayoría de los grupos, es la utilización de los stents expandibles con balón en casos en los que es más necesaria una elevada precisión al colocar el dispositivo (ramas cerca del saco no embolizables, aneurismas muy proximales a la aorta) y en zonas en las que no hay riesgo de compresión extrínseca; y los stents autoexpansibles en casos en los que resulta más útil una mayor flexibilidad del dispositivo debido a la tortuosidad de los vasos en cuestión. También es importante recordar que entre las varias marcas de stents hay diferencias de longitudes, lo cual puede condicionar la decisión a la hora de la elección del dispositivo.
La embolización preventiva de ramas colaterales en el origen del aneurisma es recomendable para evitar endofugas: la técnica con coils es la más utilizada. Kunzle et al.28 reportan un caso de infarto de órgano sobre 9 embolizaciones. En nuestra experiencia la embolización de ramas colaterales ha sido necesaria en 4 casos, sin evidencia de daños isquémicos relacionados. En otra serie de 10 pacientes, tratados únicamente con stenstents recubiertos y limitada a pacientes con aneurisma del tronco celiaco, los autores reportan una tasa de éxito del 100% sin complicaciones29.
El uso de sten multicapa con redireccionamiento del flujo podría ser una alternativa al uso de stenstents recubiertos, con la ventaja potencial de la preservación de las ramas colaterales. Todavía hay pocos datos en la literatura relativos a la utilización del sten multicapa y están limitados a casos electivos. Además, los costes de este dispositivo actualmente son más elevados que con otras técnicas. Una de las series más amplia es la de Ruffino et al. sobre 19 aneurismas tratados mediante el sten Cardiatis Multilayer Flow Modulator (Cardiatis, Isnes, Bélgica) que a los 6 meses presentaban exclusión del aneurisma en el 87,5% de los casos, con preservación de las colaterales en todos los casos. En 2casos se produjo una trombosis del sten47.
Nuestro trabajo es el primer estudio multicéntrico y es el más numeroso publicado en la literatura sobre el tratamiento endovascular de aneurismas viscerales con stents recubiertos. El estudio presenta algunas limitaciones: es retrospectivo, el número de los pacientes es insuficiente como para realizar un análisis estadístico significativo y no es posible realizar una estratificación adecuada (debido a la extrema variabilidad de las características del aneurisma, del vaso involucrado y del tipo de sten utilizado). Por último, no disponemos actualmente de guías de práctica clínica ni por el tratamiento ni por el seguimiento de esta entidad.
En nuestro estudio, el tratamiento endovascular de los aneurismas y pseudoaneurismas viscerales mediante stents recubiertos demuestra ser seguro y eficaz, tanto de forma electiva como en urgencia, con una alta tasa de éxito terapéutico y una baja tasa de complicaciones a largo plazo.
Autoría/colaboracionesDiseño del estudio: MC, FG, JMF, MR.
Adquisición y recogida de los datos: MC, FZ, GO, JM, FL, DB, AMT.
Análisis e interpretación de los resultados: MC, FZ, GO, JM, FL, DB, AMT, ALR, FG, JMF, MR.
Redacción del artículo: MC, FZ, ALR, FG.
Revisión crítica: MC, FZ, GO, JM, FL, DB, AMT, ALR, FG, JMF, MR.
Aprobación de la versión final: MC, FZ, GO, JM, FL, DB, AMT, ALR, FG, JMF, MR.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.