Los tumores primarios de vena cava inferior son tumores raros de origen mesenquimal que surgen de la musculatura lisa de la pared. Debido a su escasa prevalencia, existen pocos datos definitivos sobre su tratamiento y pronóstico. Su tratamiento se basa en principios oncológicos generales.
MétodosSe ha analizado una serie de 6 casos intervenidos desde 2010 a 2020, evaluando distintos parámetros relacionados con las características demográficas del tumor, del tratamiento recibido y de los resultados obtenidos en supervivencia y morbilidad. Además, se ha llevado a cabo una revisión bibliográfica de la evidencia disponible actualmente.
ResultadosEn todos los pacientes se llevó a cabo una resección quirúrgica óptima con R0 en 4/6 y R1 en 2/6. La mayor morbilidad sucedió en un paciente fallecido en periodo intraoperatorio. Se realizó cavorrafia en un paciente y cavoplastia en 5/6 utilizando injerto criopreservado en 3/6 y prótesis en 2/6. Al final del seguimiento de nuestra serie (con una media de seguimiento de 10,7 meses), el 50% de los pacientes continúan vivos. La media de supervivencia fue de 11,3±9,07 meses. De los 6 pacientes, 3 presentaron recidivas hematógenas con un intervalo libre de enfermedad de 9±2 meses.
ConclusiónEl diagnóstico y tratamiento del leiomiosarcoma de vena cava inferior continúa siendo un reto. Debido a su baja prevalencia, resultará difícil establecer un tratamiento totalmente estandarizado, y se recomienda su abordaje en centros especializados. Por otra parte, se deberían intentar aunar los casos intervenidos de cara a avanzar en el conocimiento del abordaje de esta enfermedad.
Primary tumors of the inferior vena cava are rare tumors of mesenchymal origin. They arise from the smooth muscles of the vena cava wall. Due to its low prevalence, there are few definitive data on its treatment and prognosis. Its treatment is based on general oncological principles.
MethodsA series of six cases operated from 2010 to 2020 were analyzed. Different parameters related to the demographic characteristics, the tumor, the treatment received, and the results obtained in survival and morbidity were analyzed. In addition, a bibliographical review of the currently available evidence was carried out.
ResultsOptimal surgical resection was accomplished in all patients with R0 in 4/6 and R1 in 2/6. The greatest morbidity occurred in a patient who died in the intraoperative period. Cavography was performed in one patient and cavoplasty in 5/6 using cryopreserved graft in 3/6 and prothesis in 2/6. The 50% were still alive at the end of the follow-up (with a mean follow-up of 10.7 months). The mean survival was 11.3±9.07 months. 3/6 patients presented hematogenous recurrences with a disease-free interval of 9±2 months.
ConclusionThe diagnosis and treatment of inferior vena cava leiomyosarcoma is still a challenge. Due to its low prevalence, it will be difficult to establish a totally standardized treatment and its approach is recommended in specialized centers. On the other hand, a multicentric study should be made to collect the most cases as possible in order to advance in the understanding of the approach to this disease.
Los tumores primarios de vena cava inferior son tumores raros de origen mesenquimal que surgen de la musculatura lisa de la pared de la misma, con crecimiento intra o extraluminal1,2. Su manejo se basa en consideraciones oncológicas generales debido a su escasa prevalencia por lo que existen pocos datos definitivos sobre su tratamiento y pronóstico.
El tratamiento principal y aceptado es la extirpación quirúrgica del mismo, lo cual, constituye un reto quirúrgico debido a su singular situación, órganos en vecindad y al manejo hemodinámico que requieren.
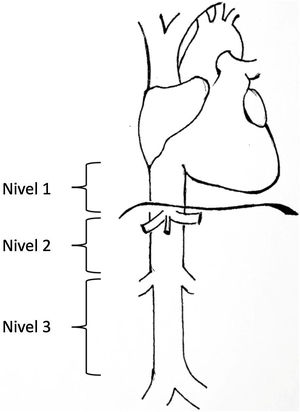
Los leiomiosarcomas de cava son descritos y clasificados en función de diversos aspectos como la edad del paciente, el tamaño, las características del tumor, el abordaje del tumor y su localización3. Una de las clasificaciones más utilizada es la propuesta por Kulaylat et al.4, que divide a estos tumores según su localización en 3 niveles distintos (fig. 1). Existen fundamentalmente, 3 abordajes quirúrgicos: resección y ligadura de cava, resección y sutura primaria o resección acompañada de reconstrucción con prótesis. El abordaje principal en la mayoría de las series es la resección asociando reconstrucción. Para la reconstrucción venosa existen diversas opciones en la literatura y ninguna ha demostrado superioridad sobre otra debido a los pocos casos descritos. Se pueden utilizar tanto materiales biológicos como injertos venosos del propio paciente (vena safena, vena renal izquierda, yugular, etc.), injertos procedentes de pericardio bovino o injertos vasculares preservado procedente de donante cadáver; como sintéticos (PTFE, Dacron®).
Niveles de afectación según la clasificación de Kulaylat et al.4.
El propósito de nuestro estudio es analizar la serie de casos intervenidos en nuestra unidad evaluando la morbimortalidad, las técnicas de reconstrucción y la supervivencia global y libre de enfermedad.
MétodosLos pacientes fueron analizados desde una base de datos retrospectiva, recogida entre los años 2010 y 2020. Los pacientes firmaron el consentimiento informado y el estudio descriptivo está aprobado por el comité de ética de nuestro centro.
La clasificación utilizada para los leiomiosarcomas atendiendo a la localización fue la descrita por Kulaylat et al.4 en la que la vena cava inferior es dividida en 3 segmentos. El nivel 1: desde la entrada de las venas suprahepática en la vena cava inferior a la entrada al ventrículo derecho; el nivel 2: desde la desembocadura de las venas renales a las venas suprahepáticas y el nivel 3: desde la confluencia de las venas ilíacas a la desembocadura de las venas renales (fig. 1).
La resecabilidad se clasificó en R0 (márgenes libres en la pieza de anatomía patológica); R1 (márgenes libres macroscópicamente, pero con sospecha de enfermedad microscópica) y R2 (a simple vista que los márgenes no se encuentran libres). La morbilidad postoperatoria se evaluó utilizando la escala de Dindo-Clavien5 que categoriza las complicaciones postoperatorias desde el nivel 1, pequeñas desviaciones en el período postoperatorio, hasta el nivel 5, que corresponde al fallecimiento del paciente en este período. Se consideró el corte para considerar morbilidad mayor en el nivel 3, por ser el punto de corte donde los pacientes requieren intervenciones radiológicas, endoscópicas o quirúrgicas; indicando de forma clara una mayor gravedad de la complicación subyacente. La comorbilidad de los pacientes al ser intervenidos fue evaluada mediante el Índice de comorbilidad de Charlson6.
La terapia adyuvante se dividió en quimioterapia, radioterapia o quimiorradioterapia. Los esquemas de quimioterapia más utilizados se basaron en adriamicina, ifosfamida o trabectedina. La neoadyuvancia, cuando fue aportada, consistió en radioterapia externa.
Se analizaron las variables cuantitativas mediante media y desviación estándar y las cualitativas en porcentajes. Se utilizó el programa IBM SPSS® v.18.0.
ResultadosDesde el año 2010 hasta el año 2020, 6 pacientes fueron intervenidos en nuestro centro diagnosticados de leiomiosarcoma de cava. Fueron excluidos de nuestro análisis los casos de leiomiosarcomas de otras localizaciones, así como aquellos pacientes con enfermedad metastásica no susceptibles de intervención quirúrgica. Ningún paciente presentó irresecabilidad intraoperatoria.
Los datos demográficos se muestran en la tabla 1. La media de edad fue de 63±14,6 años. De predominio en mujeres (83%). La clínica más frecuente al diagnóstico fueron molestias y dolor abdominal en un 66,6%. La localización más frecuente fue el nivel 2 (83,3%). El diámetro máximo fue de 10,38±5,16cm. Fue preciso resecar órganos adyacentes en 2/6 pacientes. En todos excepto un paciente se realizó biopsia preoperatoria.
La técnica más frecuente de reconstrucción fue la cavoplastia en un 83,3%, con utilización, de injerto vascular criopreservado3, prótesis de PTFE1 y prótesis de Dacron®1.
La tasa de resección R0 (márgenes quirúrgicos libres) fue del (66,67%), la tasa de R1 sospecha de enfermedad microscópica fue del 33,33%.
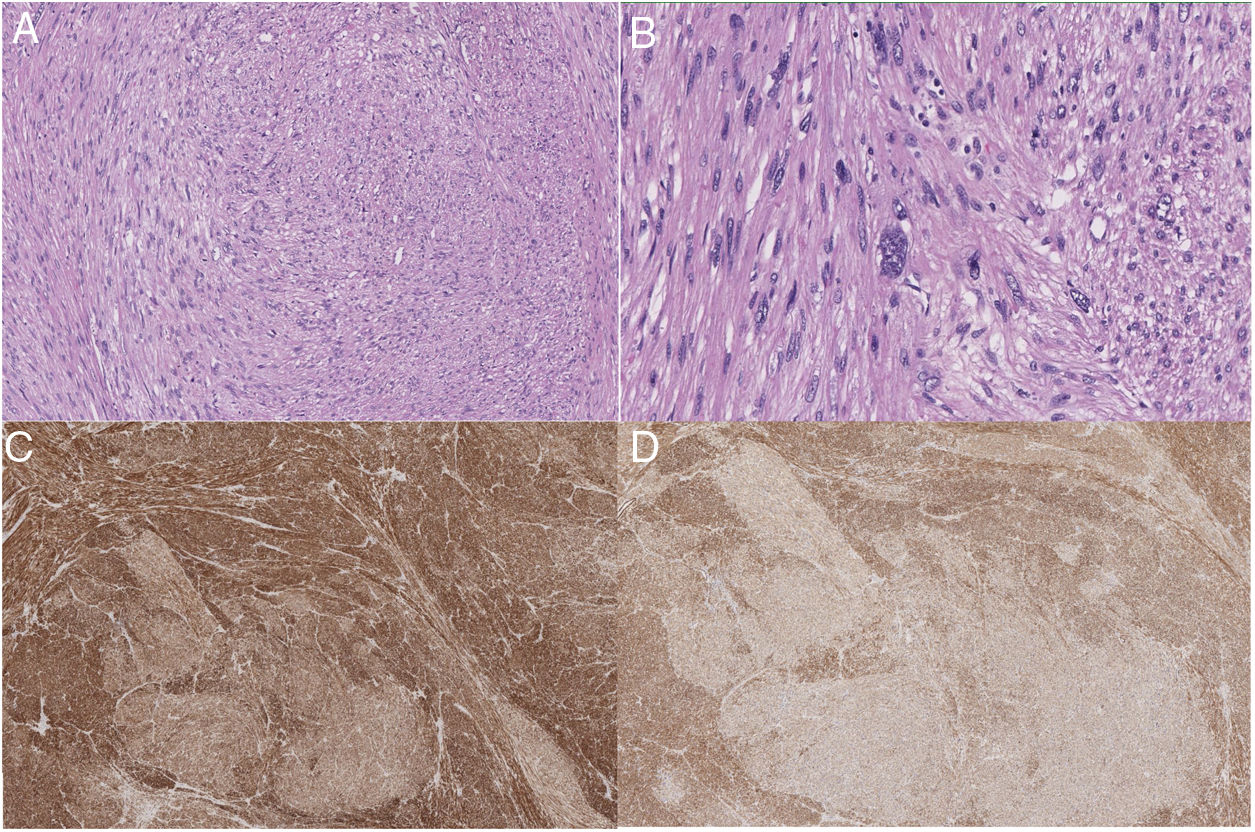
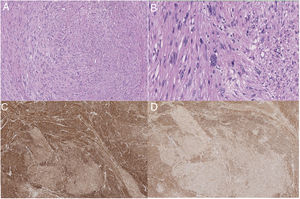
Anatomía patológicaLas piezas quirúrgicas se fijaron con solución de formaldehído al 10%, y se incluyeron en parafina obteniéndose cortes de 3μm que se tiñeron con H&E. El estudio inmunohistoquímico se realizó de forma automatizada con el método bond de detección con polímeros (Leica), empleando anticuerpos monoclonales o policlonales contra actina específica de músculo liso, desmina, caldesmón, CD-31, Ki-67, calponina y CD-34 (fig. 2).
MorbimortalidadSolo un paciente presentó morbilidad mayor falleciendo intraoperatoriamente debido a inestabilidad hemodinámica. Como morbilidad menor, un paciente presentó un ictus isquémico transitorio debido a un embolismo paradójico con un foramen oval permeable no conocido resuelto de forma conservadora, y un segundo paciente, presentó un leve hematoma retroperitoneal que no precisó manejo invasivo.
No hubo trombosis de los injertos tanto artificiales como biológicos en la serie presentada. La terapia anticoagulante-antiagregante más utilizada fue enoxaparina en dosis de tratamiento siendo sustituida al mes por terapia antiagregante predominantemente AAS 150mg/24h.
Terapia adyuvanteDe los 6 pacientes, solo uno recibió neoadyuvancia con radioterapia (paciente 5). Hubo 2 pacientes que recibieron adyuvancia. El paciente 2, que recibió adriamicina y trabectedina. El paciente 3 recibió adyuvancia con radioterapia y quimioterapia; los quimioterápicos utilizados en primera línea fueron ifosfamida y adriamicina, y tras la recidiva, trabectedina.
SupervivenciaAl final del seguimiento (con una media de seguimiento de 10,7 meses) el 50% de los pacientes continúan vivos. La supervivencia global es de 11,3±10,0 meses. De los 6 pacientes, 3 presentaron recidiva. EL ILE medio fue de 9,5±2,4 meses; los 2 restantes en el momento del estudio presentaban 3 y 27 meses de seguimiento, sin signos de recidiva.
DiscusiónLos tumores malignos de la pared de los grandes vasos son excepcionales. Aparecen con mayor frecuencia en mujeres7,8, en pacientes entre 50 y 60 años7,8. Estos datos se asemejan a los de nuestra serie, resumidos en las tablas 1 y 2.
Características demográficas y perioperatorias
| Variable | Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | Paciente 5 | Paciente 6 |
|---|---|---|---|---|---|---|
| Edad | 70 | 58 | 38 | 79 | 73 | 60 |
| Sexo | Mujer | Mujer | Mujer | Mujer | Mujer | Varón |
| Clínica al diagnóstico | Ferritina alta | Dolor abdominal | Tumoración flanco derecho | Dolor abdominal | Dolor abdominal | Dolor abdominal |
| Biopsia pre | Sí | Sí | No | Sí | Sí | Sí |
| Tamaño | 6×5×7,5cm | 12cm | 8×9,3×7,5cm | 20×14cm | 7,8×6,5×5,5cm | 5,7×5,5×5,4cm |
| Crecimiento predominante | Extraluminal | Extraluminal | Extraluminal | Extraluminal | Extraluminal | Extraluminal |
| Trombo | No | Sí | No | No | No | No |
| Segmentos de VCI incluidos | 1 | 1 | 1 | 1 | 1 | 2 |
| Localización (nivel) | 2 | 1 | 2 | 2 | 2 | 1+2 |
| Incisión | Subcostal bilateral | Rio Branco | Río Branco | Mercedes Benz | Mercedes Benz | LMSI |
| Resección y reparación VCI | Cavoplastia con PTFE | CavoplastiaconDacron® | Cavorrafia | Cavoplastiaconarteria pulmonar criopreservada | Cavoplastiacon arteria pulmonar criopreservada | Cavoplastia con arteria pulmonar criopreservada |
| Resección completa | R0 | R1 | R0 | R1 | R0 | R0 |
| Resección órganos adyacentes | No | No | Sí (vesícula biliar) | Sí Riñón y glándula suprarrenal derecha | No | Sí Riñón y glándula suprarrenal derecha |
| Tiempo postoperatorio hasta alta (días) | 4 | 21 | 6 | — | 8 | 8 |
| Dindo-Clavien≥3 a los 30 días | No | No | No | V | No | No |
| Índice de Charlson | 5 | 4 | 2 | 9 | 5 | 5 |
| Profilaxis antitrombótica | Doble antiagregación clopidogrel+AAS | Anticoagulación Enoxaparina 90mg/24h | Anticoagulación profiláctica 10 días tras alta. | — | Enoxaparina 80mg/24h/un mes. En tratamiento con AAS 100mg | Enoxaparina 40mg /12h/2 meses. Se encuentra con AAS que ya tomaba de antes |
| Supervivencia (meses) | 3 (vivo) | 14 (fallecido) | 17 (fallecido) | 0 (fallecido) | 27 | 7 |
| ILE (meses) | No (3) | Sí (11) | Sí (19) | — | No (27) | Sí (7) |
| Tipo de recidiva | — | Metástasis | Metástasis hepática | — | — | Local y metástasis (óseas y pulmonares) |
AAS: aspirina, ILE: intervalo libre de enfermedad; LMSI: laparotomía media supra e infraumbilical; PTFE: politetrafluoretileno; VCI: vena cava inferior.
Estudio anatomopatológico
| Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | Paciente 5 | Paciente 6 | |
|---|---|---|---|---|---|---|
| Características AP tumor | Desmina y actina de músculo liso positivas.Necrosis 10% | Quistificación.Extensa necrosis | Áreas extensas de desdiferenciación. Actina, desmina y caldesmón+ (en áreas desdiferenciadas), CD34+.Necrosis 20% | Desmina+, caldesmón+, AML+.Necrosis 40% | Expresión de desmina y caldesmón.Necrosis 30% | Moderadamente diferenciado, con moderado pleomorfismo y necrosis focal.AML, desmina y calponina+ |
| Grados de malignidad | G2 | No disponible | No disponible | G3 | G3 | G3 |
| Ki-67 | 20% | No disponible | 70% | 80% | 20% | 30% |
AML: actina ML; AP: anatomía patológica.
Los leiomiosarcomas de vena cava inferior se pueden clasificar según su localización siguiendo el esquema empleado por Kulaylat et al.4 como hemos descrito con anterioridad, algunos pueden ser clasificados como nivel 1,2; nivel 2,3 o incluso nivel 1,2,3. Son tumores denominados binivel o trinivel4. Existen otras clasificaciones como la de Stilidi et al.9 (que dividen la vena cava inferior en 6 niveles), o la de Kieffer et al.10, aunque no tan difundidas. Esta clasificación anatómica también resulta importante porque los síntomas que se presenten pueden variar en función del segmento en el que se localiza el tumor11.
El patrón de crecimiento puede ser clasificado como predominantemente extraluminal, predominantemente intraluminal o en reloj de arena, con un crecimiento importante tanto intraluminal como extraluminal4,7. En algunos casos el origen del tumor es muy evidente, y se identifica con facilidad con un pedículo que une la masa extraluminal a la pared de la vena. En otros, está firmemente adherido a la pared y requiere resección para una extirpación radical8. Clásicamente se ha considerado que presentan un crecimiento lento en la mayoría de los casos, pero se ha comprobado que puede ser rápido. Sus metástasis son tardías y se encuentran fundamentalmente en hígado y pulmones, aunque prácticamente ningún órgano está exento de ser afectado4. Resulta difícil determinar en una serie de 6 casos qué velocidad de crecimiento han presentado. No obstante, podemos contrastar nuestros datos con los presentes en la bibliografía. Como en ellos, lo más frecuente es la afectación del nivel 2 de Kulaylat et al.4; con un crecimiento predominantemente extravascular3.
La clínica resulta muy inespecífica y puede resultar un hallazgo casual, tras la realización de una prueba de imagen. Siendo el síntoma más frecuente molestias abdominales7,8; acorde con los datos de nuestro centro, donde 4 de los 6 pacientes comenzaron con dicha clínica. Existen otras posibles manifestaciones: síndrome de Budd-Chiari, TVP, síntomas respiratorios, edema de miembros inferiores, pérdida de peso, dolor de espalda, fiebre, etc.7. Para el diagnóstico, son necesarias pruebas de imagen, generalmente TC y RMN, que pueden ayudar a definir el origen y la extensión del tumor. En la TC, el tumor presenta baja densidad, con masa sólida o heterogénea; pudiendo presentar una zona de necrosis; resulta útil hallar la presencia de calcificación interna secundaria a esta necrosis, pero es un hallazgo infrecuente4,12,13. La RMN muestra información similar a la TC, pero ofrece mayor información acerca de la extensión del tumor y de los posibles trombos presentes4. Pese a la información que nos puedan aportar, de cara a confirmar el diagnóstico, la biopsia preoperatoria con aguja gruesa guiada por TC o ecografía es indicada con el fin de descartar otras enfermedades no susceptibles de cirugía. Straker et al.14. realizaron un estudio de cohortes retrospectivo en el que, usando los datos de 2.620 paciente con sarcomas retroperitoneales de la National Cancer Database, concluyeron que la biopsia preoperatoria no tiene efectos negativos para la supervivencia. Sin embargo, sí podría mejorar de forma indirecta los resultados de supervivencia, al facilitar la terapia neoadyuvante y aumentar el logro de resección completa del tumor. En todos los pacientes de nuestro centro salvo en uno se realizó biopsia preoperatoria. En nuestro protocolo prequirúrgico la biopsia preoperatoria siempre es realizada con el fin de planificar el tratamiento acorde a la histología, que en el caso de leiomiosarcomas de cava el tratamiento es la resección primaria, igualmente los pacientes son estudiados con valoración anestésica asociando angio-TC o angio-RMN, se establece protocolo con ONT para la adquisición de injertos criopreservados como primera elección. Así la selección de pacientes es fundamental para el buen pronóstico de los mismos, en nuestra serie el único paciente con muerte intraoperatoria constituyó una indicación límite, la cual fue consensuada con paciente y en comité multidisciplinar.
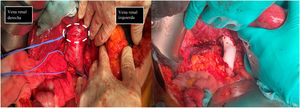
Pese a existir varias opciones terapéuticas, la resección quirúrgica con márgenes (fig. 3) puede alargar la supervivencia, y constituye actualmente la única posibilidad de cura11,15,16. A pesar de la resección tumoral extensa, las recurrencias suceden en un elevado número de pacientes, pero la mayoría corresponde a metástasis hematógenas y no a recidivas locorregionales16. Existen muchas posibilidades a la hora de llevar a cabo la intervención quirúrgica. Debido al pequeño número de casos, no ha sido posible determinar cuál es el mejor material a la hora de realizar la cavoplastia; ni el tamaño ideal16,17, para nosotros el uso de injertos criopreservados es de elección. El diámetro de la prótesis tiene importancia puesto que determina la velocidad del flujo y la adaptabilidad al vaso nativo. La utilización de una prótesis de un calibre algo inferior a la vena cava inferior permite mejorar la velocidad del flujo y la realización de la anastomosis sobre el anillo de la prótesis limita el fenómeno de compresión11,16. Entre los materiales sintéticos que se pueden utilizar como PTFE o Dacron®. En el momento actual, las prótesis de PTFE son las más aceptadas para el reemplazo de la vena cava inferior, por delante de los injertos biológicos10,11. En nuestra serie de casos, la arteria pulmonar criopreservada fue el material más frecuentemente utilizado al realizar la cavoplastia (60%) frente a Dacron® (20%) y PTFE (20%) (fig. 3). En futuras intervenciones sería interesante recoger calibre de la prótesis utilizada de cara a evaluar la influencia de éste en los resultados de la intervención. El tratamiento adyuvante o neoadyuvante con quimioterapia y radioterapia es controvertido15,16. En nuestro centro sólo un paciente recibió neoadyuvancia con radioterapia. La adyuvancia fue administrada en dos pacientes (adriamicina y trabectedina).
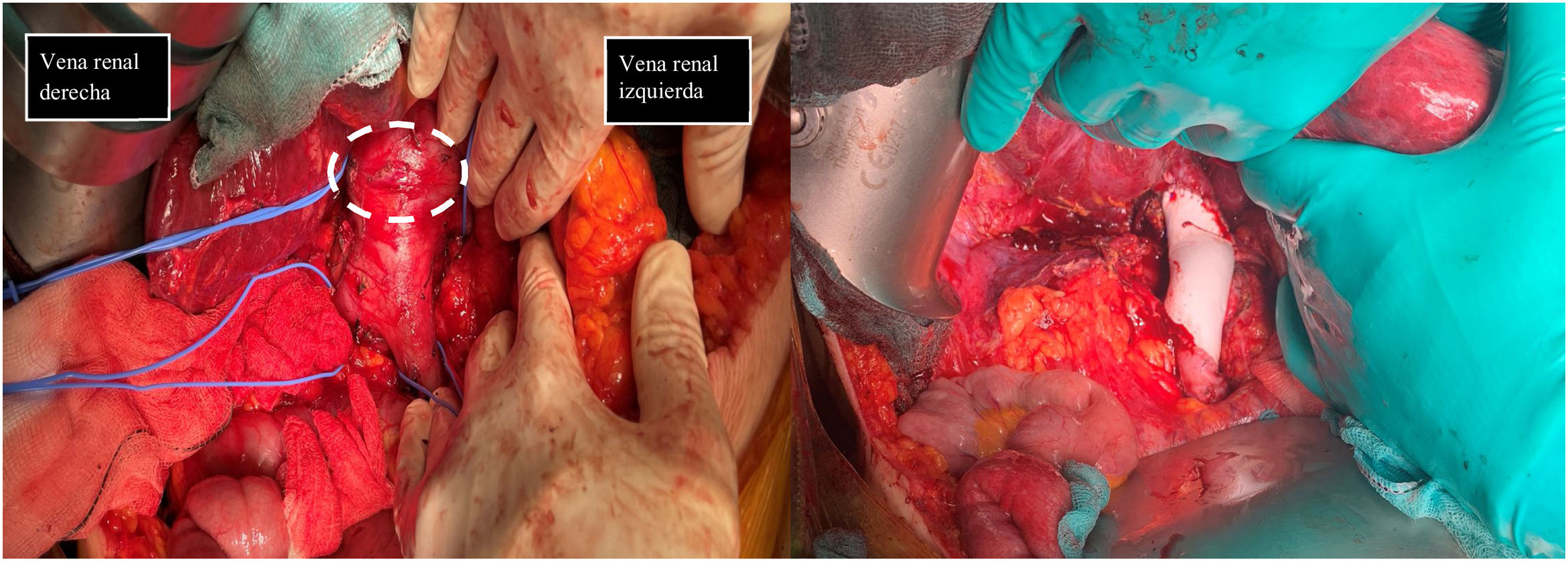
En la primera imagen muestra el momento de la identificación de estructuras previo a la extirpación de leiomiosarcoma. Se describe el control vascular en cava retrohepática, infrarenal y ambas venas renales previo a extirpación tumoral (tumor señalado con línea discontinua blanca). En la segunda imagen se evidencia la presencia de prótesis de PTFE en sustitución de VCI se han preservado ambas venas renales, reinsertando la izquierda.
Los sarcomas de los grandes vasos (aorta, arterias y venas pulmonares, venas cavas) se clasifican en luminales y murales18. Los primeros se originan de la íntima. Son neoplasias indiferenciadas más frecuentes en la aorta torácica o de las arterias pulmonares. Histológicamente pueden ser parecidos a los leiomiosarcomas, por inmunohistoquímica son positivos para marcadores como actina y marcadores vasculares como CD-31 negativos a desmina. Los sarcomas que se originan de las venas son con mayor frecuencia leiomiosarcomas18. Los leiomiosarcomas venosos son más comunes en la VCI. Histológicamente son idénticos a los leiomiosarcomas encontrados en otros sitios, y son positivos para la vimentina, la actina de músculo liso, la actina de músculo específico y la desmina 19 y negativos para marcadores vasculares como CD-31.
Al comprobar el tumor extraído, se comprueba la presencia de un patrón típico de células en forma de huso entrelazadas, con citoplasma eosinofílico y núcleos centrales. Las células tumorales muestran positividad para desmina, vimentina y actina de células musculares lisas, pero no para la proteína s-100, alfa inhibina o CD1174,20. Se puede clasificar en distintos estadios según los criterios FNCLCC: grados I, II y III. Sin embargo, este grado histológico no se correlaciona con un peor tiempo libre de enfermedad o una menor supervivencia3. Por el contrario en el tamaño del tumor sí se observa una asociación con disminución del tiempo libre de enfermedad y de la supervivencia7.
Tras la cirugía, algunos autores recomiendan anticoagulación de larga duración de cara a mejorar la permeabilidad de las prótesis; otros, sin embargo, han comunicado la presencia de buenos resultados sin necesidad de anticoagulantes orales11. Los pacientes de nuestra serie en los que se utilizó prótesis tuvieron diferentes pautas de anticoagulación, seguidas de antiagregación permanente de baja dosis. En el caso del paciente en el que se realizó una cavorrafía, la anticoagulación se limitó a los 10 días postoperatorios.
A los 5 años de ser intervenidos, el 55% permanecen con vida; sin embargo, solo una minoría de los pacientes vive más de 10 años. Esta supervivencia no es homogénea, en ella influyen multitud de factores; algunos de ellos ya mencionados7. Prácticamente todos los pacientes presentan recurrencia de la enfermedad siendo principalmente hematógena como en nuestra serie. La supervivencia libre de enfermedad a los 5 años en las series publicadas tan solo alcanza el 6%, lo cual es acorde a nuestra serie7.
ConclusiónLos leiomiosarcomas de cava constituyen una enfermedad poco común cuyo manejo diagnóstico-terapéutico no puede ser estandarizado. Constituyen un reto quirúrgico que debe de realizarse en unidades de referencia que incluyan a comités multidisciplinares especializados en el manejo de sarcomas. Hoy en día, la resección quirúrgica constituye el principal tratamiento obteniendo resultados aceptables en unidades de referencia. Estudios multicéntricos son necesarios con el fin de coleccionar la mayor experiencia posible en esta rara entidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.