Los tumores fibrosos solitarios (TFS) son neoplasias mesenquimales poco frecuentes que pueden presentarse en una amplia variedad de localizaciones anatómicas. Los TFS fueron descritos inicialmente en la pleura1, pero pueden encontrarse en sitios extratorácicos de la cavidad abdominal, cabeza y cuello o retroperitoneo2–4. La mayoría de los TFS son asintomáticos en un primer momento, pero las neoplasias abdominales pueden asociar dolor abdominal, síntomas urinarios o una masa palpable4. Su comportamiento maligno es inusual, pero posible5,6.
Presentamos el caso de una mujer de 83 años sometida a cirugía y radioterapia adyuvante, sin reportar datos de recidiva tras 36 meses de seguimiento.
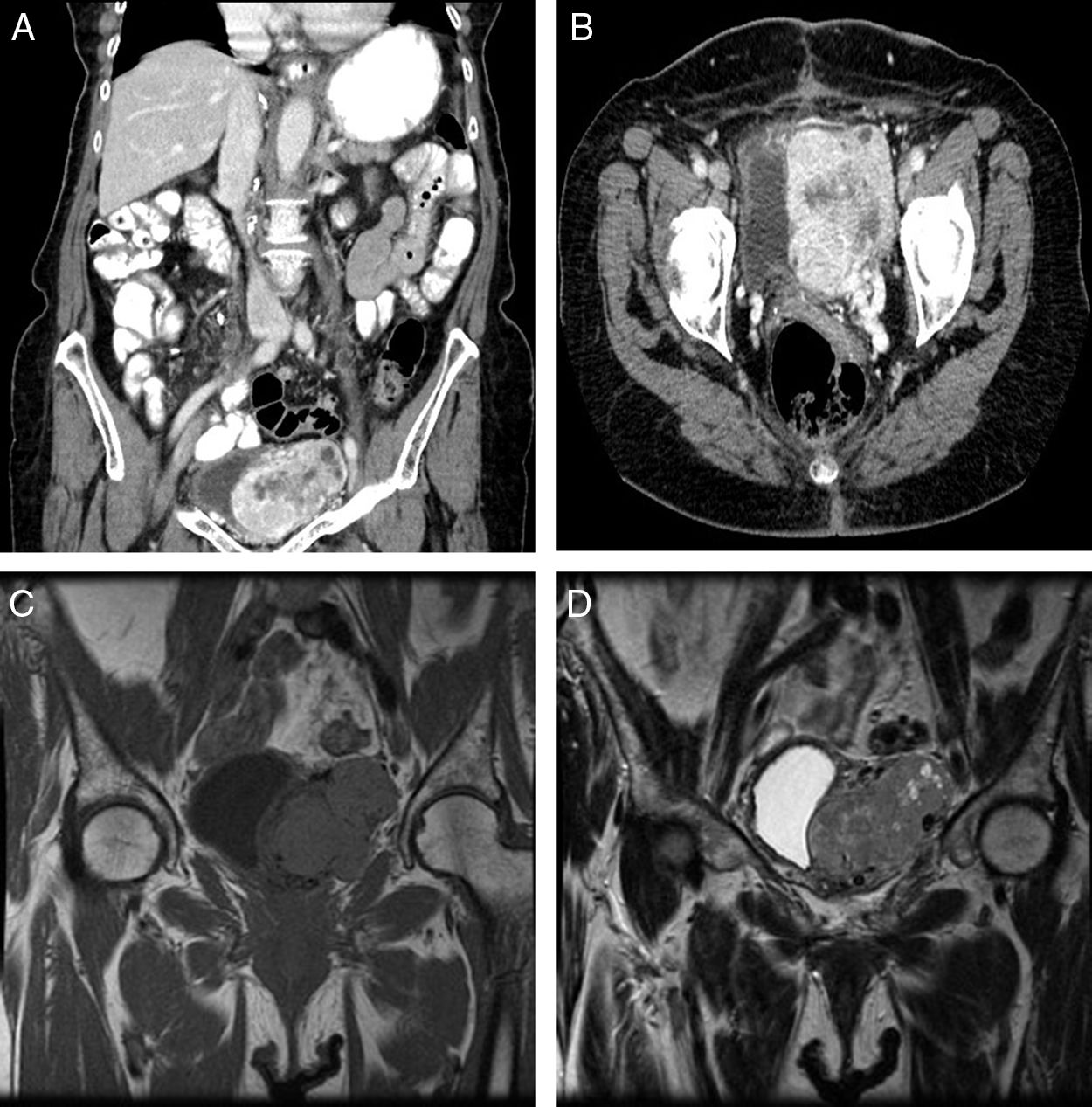
Una mujer de 83 años fue remitida a nuestro servicio por el hallazgo incidental de una masa pélvica en una ecografía abdominal ordenada por su médico de Atención Primaria. La paciente refirió molestias abdominales durante algunos meses, no estando presentes signos de hipoglucemia en el momento del diagnóstico. En la exploración física se objetivó una masa indolora y palpable en fosa iliaca izquierda. Las pruebas de laboratorio resultaron normales. La tomografía computarizada reveló una masa pélvica de 7,5×5,4×4,2cm en íntimo contacto con la pared izquierda de la vejiga, desplazando a este órgano lateralmente. Se apreció una masa bien definida, sólida y lobulada, con áreas internas necróticas y pequeños compuestos quísticos periféricos. Se identificaron estructuras vasculares múltiples y dilatadas ubicadas en el interior, conectadas a los vasos periféricos e irrigadas por vasos ilíacos internos (figs. 1A y B). La resonancia magnética (RM) con contraste (figs. 1C y D) mostró una masa sólida heterogénea con hiperintensidad leve en la imagen ponderada en T2 y la captación intensa de contraste.
A y B) En la tomografía computarizada se aprecia una masa pélvica de 7,5×5,4×4,2cm en íntimo contacto con la vejiga. Se observa una masa bien definida, sólida, y con áreas internas necróticas y pequeños compuestos quísticos periféricos. Se identifican estructuras vasculares múltiples y dilatadas ubicadas en el interior. C y D) En la resonancia magnética con contraste se observa una masa sólida heterogénea e hipervascularizada. La imagen revela una isointensidad en T1 (C) e hiperintensidad parcial en T2 (D), con una intensa captación de contraste.
El historial médico de la paciente no incluyó antecedentes relevantes, habiéndose practicado únicamente a los 30 años de edad una laparotomía infraumbilical con cistectomía parcial izquierda por un quiste ovárico benigno.
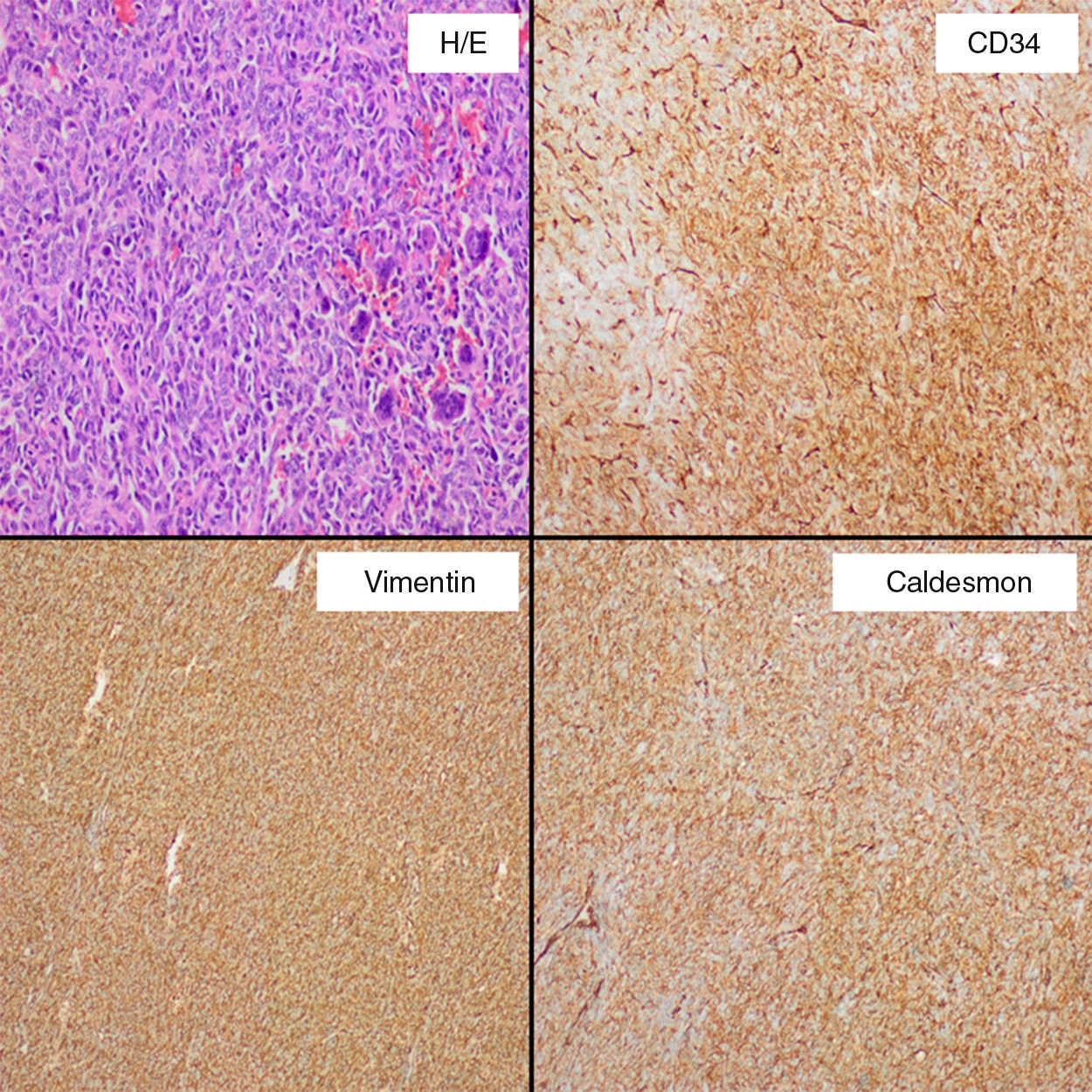
Se realizó una biopsia percutánea de la masa para orientar mejor el diagnóstico, cuyo resultado indicó la presencia de una neoplasia mesenquimal hipervascular con células fusiformes y atipias aisladas. Los marcadores de células CD34 y CD99 fueron positivos. Para reducir el tamaño del tumor, se embolizaron las arterias nutricias. Se realizó una laparotomía con una disección compleja debido a adherencias a la pared de la vejiga, el uréter izquierdo y la vena iliaca interna izquierda; logrando resecar la masa con seguridad, siendo las pérdidas hemáticas de 200cc. En el examen microscópico (fig. 2), se identificó infiltración de márgenes y una alta densidad celular con disposición en haces cortos y mezcla de áreas necróticas y estructuras vasculares dilatadas. La tasa de mitosis fue de 4/10 campos de gran aumento y el índice de proliferación Ki-67 en torno a 20%. La tinción inmunohistoquímica mostró positividad de las células para CD34, CD99, vimentina, caldesmón y Bcl-2, y negatividad para S-100, desmina, CD117 y queratina, lo cual fue concordante con el diagnóstico de un TFS maligno. No se detectaron complicaciones relevantes durante el curso postoperatorio. Posteriormente, la paciente fue tratada con radioterapia adyuvante (60Gy). A los 36 meses después de la cirugía, no se evidenciaron datos de recidiva.
Los TFS son neoplasmas mesenquimales poco comunes que representan menos del 2% de todos los tumores de partes blandas. Los TFS fueron descritos por primera vez en 1931 como mesotelioma pleural1, aunque se ha comprobado que pueden surgir en cualquier localización, incluyendo un amplio espectro histológico con características fibroblásticas o miofibroblásticas4. Estos tumores tienen características yuxtapuestas a las de otros tumores de partes blandas, clasificándose la mayoría de los hemangiopericitomas también como TFS3,4,6.
Por lo general, los TFS suelen ser asintomáticos y de gran tamaño, manifestándose como una masa de crecimiento lento, con leve dolor y pudiendo ser finalmente palpables. La hipoglucemia puede apreciarse en hasta el 5% de los pacientes, debido a una secreción autónoma del factor de crecimiento insulínico 2 (IGF-2), descrito como síndrome de Doege-Potter7. La distensión abdominal, la obstrucción intestinal o la uropatía obstructiva podrían acompañar a los tumores del abdomen o la pelvis4. La tomografía computarizada es la herramienta de elección para el diagnóstico inicial, ya que permite apreciar al TFS presente como una masa hipervascular que desplaza órganos adyacentes como la vejiga urinaria, el uréter o vasos pélvicos. Las áreas centrales hipodensas o hipointensas pueden representar necrosis o cambios quísticos. Los TFS se caracterizan por la yuxtaposición y proliferación de células fusiformes, incluyendo cantidad de vasos sanguíneos con una fina pared. La RM revela igualmente las características hipervasculares y los cambios intratumorales, la imagen ponderada en T1 generalmente muestra una apariencia isointensa al músculo adyacente y la T2 muestra hiperintensidad parcial o predominante (las áreas hipointensas implican componentes estromales), incluida la alta captación de contraste. Los hallazgos en el análisis inmunohistoquímico incluyen positividad para CD34, Bcl-2 y vimentina, con negatividad para queratina, actina y S1004–6.
Los TFS malignos suelen ser de gran tamaño, incluyendo gran hipercelularidad, atipia focal moderada o marcada, una tasa de mitosis igual o mayor a 4/10 campos de gran aumento, calcificaciones, numerosas áreas de necrosis y hemorragia y márgenes infiltrativos4–6. El diagnóstico diferencial del TFS maligno es amplio e incluye lesiones como el angiosarcoma, el leiomiosarcoma, el tumor desmoide, el mesotelioma y los tumores uterinos. La exéresis quirúrgica completa con márgenes negativos se ha establecido como el tratamiento de elección, mientras que la embolización preoperatoria puede reducir la hemorragia intraoperatoria.
En este caso, debido a la ubicación y tamaño del TFS, el íntimo contacto con la vejiga y los antecedentes de una laparotomía infraumbilical, se decidió realizar una laparotomía, aunque existen descripciones de abordajes mínimamente invasivos para tratar el TFS abdominal o pélvico, con gran seguridad8. Se han utilizado tanto la radioterapia neoadyuvante como la adyuvante con o sin quimioterapia concomitante, con tasas de éxito variables2,4,9.