El objetivo de este estudio observacional multicéntrico fue determinar la tasa de dehiscencia anastomótica en los hospitales que participan en el Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos y evaluar si había diferencias atribuibles al volumen quirúrgico entre los hospitales que participan en él.
MétodosLa variación interhospitalaria se cuantificó mediante un estudio multinivel realizado con una base de datos prospectiva de los pacientes operados por un adenocarcinoma de recto con una resección anterior en 84 hospitales, entre marzo de 2006 y diciembre de 2013. En los análisis se incluyeron: las variables demográficas, la clasificación de la American Society of Anaesthesiologists, la utilización de un estoma de derivación, la localización y el estadio del tumor, la administración de tratamiento neoadyuvante y el volumen quirúrgico anual del hospital.
ResultadosSe analizó a 7.231 pacientes operados consecutivamente. La tasa de dehiscencia anastomótica fue del 10,0%. Los porcentajes de dehiscencia de los hospitales, estratificados por el volumen quirúrgico annual, variaron entre el 9,9 y el 11,3%. En el análisis de regresión multinivel el sexo masculino, los tumores localizados por debajo de 12cm medidos desde el margen anal y los estadios T avanzados favorecieron la aparición de la dehiscencia, mientras que la presencia de un estoma de derivación la previno. El volumen quirúrgico anual del hospital no se asoció con la dehiscencia (OR: 0,852; [0,487-1,518]; p=0,577). Además, se observó una variación significativa de la tasa de dehiscencia entre los hospitales (MOR: 1,475; [1,321-1,681]; p<0,001).
ConclusiónLa dehiscencia anastomótica varía de forma estadísticamente significativa entre los hospitales incluidos en el proyecto, y esta diferencia no se puede atribuir al volumen quirúrgico anual.
This multicentre observational study aimed to determine the anastomotic leak rate in the hospitals included in the Rectal Cancer Project of the Spanish Society of Surgeons and examine whether hospital volume may contribute to any variation between hospitals.
MethodsHospital variation was quantified using a multilevel approach on prospective data derived from the multicentre database of all adenocarcinomas of the rectum operated by an anterior resection at 84 surgical departments from 2006 to 2013. The following variables were included in the analysis; demographics, American Society of Anaesthesiologists classification, use of defunctioning stoma, tumour location and stage, administration of neoadjuvant treatment, and annual volume of elective surgical procedures.
ResultsA total of 7231 consecutive patients were included. The rate of anastomotic leak was 10.0%. Stratified by annual surgical volume hospitals varied from 9.9 to 11.3%. In multilevel regression analysis, the risk of anastomotic leak increased in male patients, in patients with tumours located below 12cm from the anal verge, and advanced tumour stages. However, a defunctioning stoma seemed to prevent this complication. Hospital surgical volume was not associated with anastomotic leak (OR: 0.852, [0.487-1.518]; P=.577). Furthermore, there was a statistically significant variation in anastomotic leak between all departments (MOR: 1.475; [1.321-1.681]; P<0.001).
ConclusionAnastomotic leak varies significantly among hospitals included in the project and this difference cannot be attributed to the annual surgical volume.
El tratamiento estándar del cáncer de recto, cuando es posible, es la resección anterior baja con escisión total del mesorrecto1. Este procedimiento quirúrgico se asocia con una tasa de dehiscencia de la anastomosis que varía entre el 10 y el 15%2,3.
Se ha estudiado la contribución de múltiples factores en la aparición de esta complicación. Sin embargo, la investigación de la influencia del volumen quirúrgico de un hospital y de la subespecialización en la frecuencia de la dehiscencia anastomótica es limitada y controvertida4,5. Además, los resultados de los registros de Escandinavia6,7, en los que se inspira el Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos, también son controvertidos.
El objetivo de este estudio fue determinar la tasa de dehiscencia anastomótica en el Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos durante el periodo 2006-2013, y evaluar, mediante un estudio multinivel, la influencia del volumen quirúrgico del hospital en la dehiscencia de la anastomosis en los hospitales participantes.
MétodosEste estudio observacional multicéntrico se ha realizado con la base de datos prospectiva del Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos. Esta iniciativa docente iniciada en 2006 tuvo por objetivo introducir inicialmente la cirugía de escisión del mesorrecto y, posteriormente, la amputación abdominoperineal extendida a los grupos multidisciplinares de los hospitales del Sistema Nacional de Salud que lo solicitaron y que cumplían las condiciones requeridas: disponer de unidades de Coloproctología con los medios técnicos de diagnóstico imprescindibles, y que realizaran 12 o más resecciones de recto al año, incluyendo bajo este concepto las siguientes operaciones: resección anterior, amputación abdominoperineal, intervención de Hartmann y proctocolectomía.
Los datos recogidos prospectivamente en los hospitales por los cirujanos responsables del proyecto se enviaban a un registro centralizado. Este informaba anualmente a cada centro de los resultados de su actividad con relación al conjunto de los hospitales participantes. Una descripción más detallada del proyecto ha sido publicada previamente8,9.
Criterios de inclusión y exclusión de los pacientesSe incluyó a los pacientes intervenidos con una resección anterior realizada de forma electiva entre el 1 de marzo de 2006 y el 31 de diciembre de 2013 en 84 hospitales integrados en el proyecto.
Se excluyó a los pacientes operados de urgencia, a los pacientes que no tenían los resultados de alguna de las variables de interés y a aquellos en los que los resultados eran incongruentes.
Técnica quirúrgicaLa escisión total del mesorrecto fue el procedimiento estándar para tratar los tumores situados a 12cm o menos del margen anal. Los tumores situados por encima de 12cm fueron tratados con una escisión parcial del mesorrecto, incluyendo la fascia mesorrectal hasta 5cm por debajo del tumor, o una escisión total del mesorrecto a criterio del cirujano. La realización de una ileostomía de derivación también dependió de la preferencia del cirujano.
Variables de estudioLa variable de resultado del estudio fue la dehiscencia de la anastomosis. Las variables de confusión se dividieron en fijas y aleatorias. Las siguientes variables demográficas se consideraron como variables de confusión fijas: edad, categorizada en 3 grupos (<65, 65-80, >80 años), y género; el grado del riesgo quirúrgico (medido mediante el grado del riesgo anestésico ASA); la localización del tumor, que se categorizó en 3 grupos (0-6, 7-12, 13-15cm); la utilización de ileostomía de derivación; el estadio patológico tumoral; la utilización de tratamiento neoadyuvante y la casuística del hospital categorizada en 4 grupos según la mediana del número de pacientes tratados anualmente con una resección anterior: 11, 12-23, 24-35 y>36 pacientes. El centro hospitalario fue considerado como una variable de confusión aleatoria.
DefinicionesSe consideraron tumores de recto (CIE20) los situados en los últimos 15cm medidos desde el margen anal mediante rectoscopia rígida en la retirada o mediante resonancia magnética10.
El estadio tumoral patológico se clasificó con la quinta versión de la clasificación TNM (American Joint Committee on Cancer [AJCC] stages I–IV; 5th edition)11.
La dehiscencia de la anastomosis se definió como un evento de la anastomosis que requirió radiología intervencionista o una intervención quirúrgica en el postoperatorio. Los abscesos pélvicos sin evidencia radiológica de una dehiscencia y las fístulas recto- vaginales precoces también se consideraron dehiscencias de la anastomosis. Las dehiscencias subclínicas detectadas en el enema de contraste soluble antes del cierre del estoma no fueron consideradas como una dehiscencia de la anastomosis, al igual que hacen los registros de Escandinavia, a los que este proyecto imita y con los que compara sus resultados12,13.
Al estar anonimizado el nombre de los hospitales y los pacientes incluidos, no se consideró necesaria la aprobación por los comités de ética de los centros incluidos, aunque el proyecto sí había sido avalado por estos comités.
Análisis estadísticoLas variables categóricas fueron analizadas mediante los test χ2 y la comparación de las muestras no paramétricas se realizó mediante la prueba U de Mann-Whitney.
Para determinar la variación de la variable de resultado, dehiscencia de la anastomosis, entre los hospitales incluidos se construyeron 3 modelos: un modelo de efectos fijos que incluía las variables de confusión fijas, un modelo completo que incluía las variables de confusión fijas y la variable aleatoria hospital, y un modelo nulo que incluía exclusivamente la variable aleatoria hospital. En el primero se realizó una regresión logística y en los 2 últimos una regresión logística multinivel.
Para cada modelo se calculó el criterio de información de Akaike (AIC)14 y el test de la devianza. En los modelos multinivel se calcularon la varianza aleatoria (σ2) y sus intervalos de confianza, la mediana de la odds ratio (MOR)15 y la odds ratio (OR) entre el peor y el mejor, excluyendo el 5% de los centros extremos. La MOR cuantifica la variación entre hospitales en mediana, comparando pares de pacientes seleccionados al azar con los mismos valores de las variables confusoras16.
ResultadosDe los 7.231 pacientes operados electivamente con una resección anterior en el periodo de estudio, 727 (10,0%) presentaron una dehiscencia anastomótica.
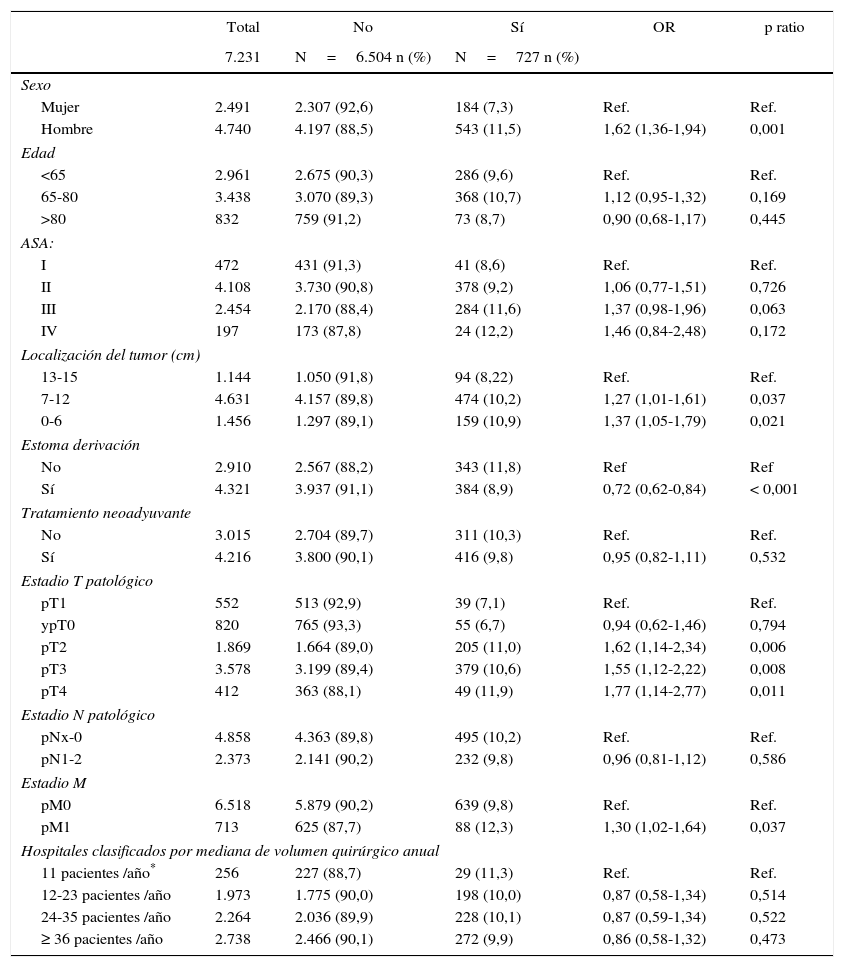
En la tabla 1 se describen las características de la población estudiada y el riesgo de dehiscencia expresado en OR para cada una de las variables estudiadas mediante un estudio univariante. En ella puede verse que los porcentajes de dehiscencia anastomótica de los hospitales agrupados por categorías según el volumen quirúrgico variaron entre 9,9 y 11,3%.
Descripción y resultados del análisis univariante de la muestra de población estudiada
| Total | No | Sí | OR | p ratio | |
|---|---|---|---|---|---|
| 7.231 | N=6.504 n (%) | N=727 n (%) | |||
| Sexo | |||||
| Mujer | 2.491 | 2.307 (92,6) | 184 (7,3) | Ref. | Ref. |
| Hombre | 4.740 | 4.197 (88,5) | 543 (11,5) | 1,62 (1,36-1,94) | 0,001 |
| Edad | |||||
| <65 | 2.961 | 2.675 (90,3) | 286 (9,6) | Ref. | Ref. |
| 65-80 | 3.438 | 3.070 (89,3) | 368 (10,7) | 1,12 (0,95-1,32) | 0,169 |
| >80 | 832 | 759 (91,2) | 73 (8,7) | 0,90 (0,68-1,17) | 0,445 |
| ASA: | |||||
| I | 472 | 431 (91,3) | 41 (8,6) | Ref. | Ref. |
| II | 4.108 | 3.730 (90,8) | 378 (9,2) | 1,06 (0,77-1,51) | 0,726 |
| III | 2.454 | 2.170 (88,4) | 284 (11,6) | 1,37 (0,98-1,96) | 0,063 |
| IV | 197 | 173 (87,8) | 24 (12,2) | 1,46 (0,84-2,48) | 0,172 |
| Localización del tumor (cm) | |||||
| 13-15 | 1.144 | 1.050 (91,8) | 94 (8,22) | Ref. | Ref. |
| 7-12 | 4.631 | 4.157 (89,8) | 474 (10,2) | 1,27 (1,01-1,61) | 0,037 |
| 0-6 | 1.456 | 1.297 (89,1) | 159 (10,9) | 1,37 (1,05-1,79) | 0,021 |
| Estoma derivación | |||||
| No | 2.910 | 2.567 (88,2) | 343 (11,8) | Ref | Ref |
| Sí | 4.321 | 3.937 (91,1) | 384 (8,9) | 0,72 (0,62-0,84) | < 0,001 |
| Tratamiento neoadyuvante | |||||
| No | 3.015 | 2.704 (89,7) | 311 (10,3) | Ref. | Ref. |
| Sí | 4.216 | 3.800 (90,1) | 416 (9,8) | 0,95 (0,82-1,11) | 0,532 |
| Estadio T patológico | |||||
| pT1 | 552 | 513 (92,9) | 39 (7,1) | Ref. | Ref. |
| ypT0 | 820 | 765 (93,3) | 55 (6,7) | 0,94 (0,62-1,46) | 0,794 |
| pT2 | 1.869 | 1.664 (89,0) | 205 (11,0) | 1,62 (1,14-2,34) | 0,006 |
| pT3 | 3.578 | 3.199 (89,4) | 379 (10,6) | 1,55 (1,12-2,22) | 0,008 |
| pT4 | 412 | 363 (88,1) | 49 (11,9) | 1,77 (1,14-2,77) | 0,011 |
| Estadio N patológico | |||||
| pNx-0 | 4.858 | 4.363 (89,8) | 495 (10,2) | Ref. | Ref. |
| pN1-2 | 2.373 | 2.141 (90,2) | 232 (9,8) | 0,96 (0,81-1,12) | 0,586 |
| Estadio M | |||||
| pM0 | 6.518 | 5.879 (90,2) | 639 (9,8) | Ref. | Ref. |
| pM1 | 713 | 625 (87,7) | 88 (12,3) | 1,30 (1,02-1,64) | 0,037 |
| Hospitales clasificados por mediana de volumen quirúrgico anual | |||||
| 11 pacientes /año* | 256 | 227 (88,7) | 29 (11,3) | Ref. | Ref. |
| 12-23 pacientes /año | 1.973 | 1.775 (90,0) | 198 (10,0) | 0,87 (0,58-1,34) | 0,514 |
| 24-35 pacientes /año | 2.264 | 2.036 (89,9) | 228 (10,1) | 0,87 (0,59-1,34) | 0,522 |
| ≥ 36 pacientes /año | 2.738 | 2.466 (90,1) | 272 (9,9) | 0,86 (0,58-1,32) | 0,473 |
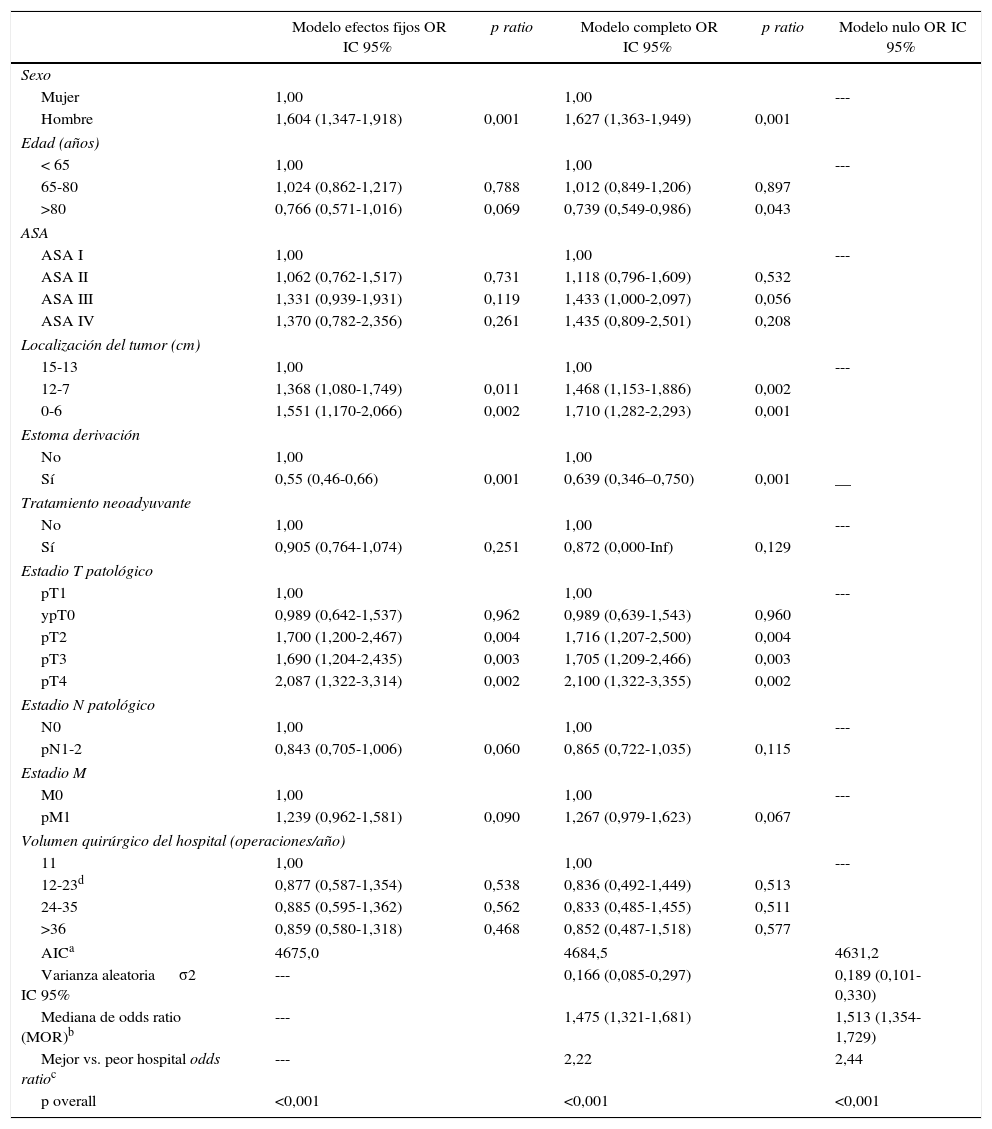
Los resultados de los modelos de efectos fijos, del modelo completo y del modelo nulo se detallan en la tabla 2. En ella se pueden ver las variables que influyeron significativamente en la dehiscencia anastomótica. El sexo masculino, la distancia del tumor al margen anal y los estadios T avanzados favorecieron su aparición; mientras que el estoma de derivación la previno. El volumen quirúrgico de los hospitales no influyó en las tasas de dehiscencia anastomótica. Además, los modelos completo y nulo pusieron de manifiesto que la dehiscencia de la anastomosis era significativamente diferente entre los hospitales estudiados.
Resultados del análisis de los 3 modelos
| Modelo efectos fijos OR IC 95% | p ratio | Modelo completo OR IC 95% | p ratio | Modelo nulo OR IC 95% | |
|---|---|---|---|---|---|
| Sexo | |||||
| Mujer | 1,00 | 1,00 | --- | ||
| Hombre | 1,604 (1,347-1,918) | 0,001 | 1,627 (1,363-1,949) | 0,001 | |
| Edad (años) | |||||
| < 65 | 1,00 | 1,00 | --- | ||
| 65-80 | 1,024 (0,862-1,217) | 0,788 | 1,012 (0,849-1,206) | 0,897 | |
| >80 | 0,766 (0,571-1,016) | 0,069 | 0,739 (0,549-0,986) | 0,043 | |
| ASA | |||||
| ASA I | 1,00 | 1,00 | --- | ||
| ASA II | 1,062 (0,762-1,517) | 0,731 | 1,118 (0,796-1,609) | 0,532 | |
| ASA III | 1,331 (0,939-1,931) | 0,119 | 1,433 (1,000-2,097) | 0,056 | |
| ASA IV | 1,370 (0,782-2,356) | 0,261 | 1,435 (0,809-2,501) | 0,208 | |
| Localización del tumor (cm) | |||||
| 15-13 | 1,00 | 1,00 | --- | ||
| 12-7 | 1,368 (1,080-1,749) | 0,011 | 1,468 (1,153-1,886) | 0,002 | |
| 0-6 | 1,551 (1,170-2,066) | 0,002 | 1,710 (1,282-2,293) | 0,001 | |
| Estoma derivación | |||||
| No | 1,00 | 1,00 | |||
| Sí | 0,55 (0,46-0,66) | 0,001 | 0,639 (0,346–0,750) | 0,001 | __ |
| Tratamiento neoadyuvante | |||||
| No | 1,00 | 1,00 | --- | ||
| Sí | 0,905 (0,764-1,074) | 0,251 | 0,872 (0,000-Inf) | 0,129 | |
| Estadio T patológico | |||||
| pT1 | 1,00 | 1,00 | --- | ||
| ypT0 | 0,989 (0,642-1,537) | 0,962 | 0,989 (0,639-1,543) | 0,960 | |
| pT2 | 1,700 (1,200-2,467) | 0,004 | 1,716 (1,207-2,500) | 0,004 | |
| pT3 | 1,690 (1,204-2,435) | 0,003 | 1,705 (1,209-2,466) | 0,003 | |
| pT4 | 2,087 (1,322-3,314) | 0,002 | 2,100 (1,322-3,355) | 0,002 | |
| Estadio N patológico | |||||
| N0 | 1,00 | 1,00 | --- | ||
| pN1-2 | 0,843 (0,705-1,006) | 0,060 | 0,865 (0,722-1,035) | 0,115 | |
| Estadio M | |||||
| M0 | 1,00 | 1,00 | --- | ||
| pM1 | 1,239 (0,962-1,581) | 0,090 | 1,267 (0,979-1,623) | 0,067 | |
| Volumen quirúrgico del hospital (operaciones/año) | |||||
| 11 | 1,00 | 1,00 | --- | ||
| 12-23d | 0,877 (0,587-1,354) | 0,538 | 0,836 (0,492-1,449) | 0,513 | |
| 24-35 | 0,885 (0,595-1,362) | 0,562 | 0,833 (0,485-1,455) | 0,511 | |
| >36 | 0,859 (0,580-1,318) | 0,468 | 0,852 (0,487-1,518) | 0,577 | |
| AICa | 4675,0 | 4684,5 | 4631,2 | ||
| Varianza aleatoria σ2 IC 95% | --- | 0,166 (0,085-0,297) | 0,189 (0,101-0,330) | ||
| Mediana de odds ratio (MOR)b | --- | 1,475 (1,321-1,681) | 1,513 (1,354-1,729) | ||
| Mejor vs. peor hospital odds ratioc | --- | 2,22 | 2,44 | ||
| p overall | <0,001 | <0,001 | <0,001 | ||
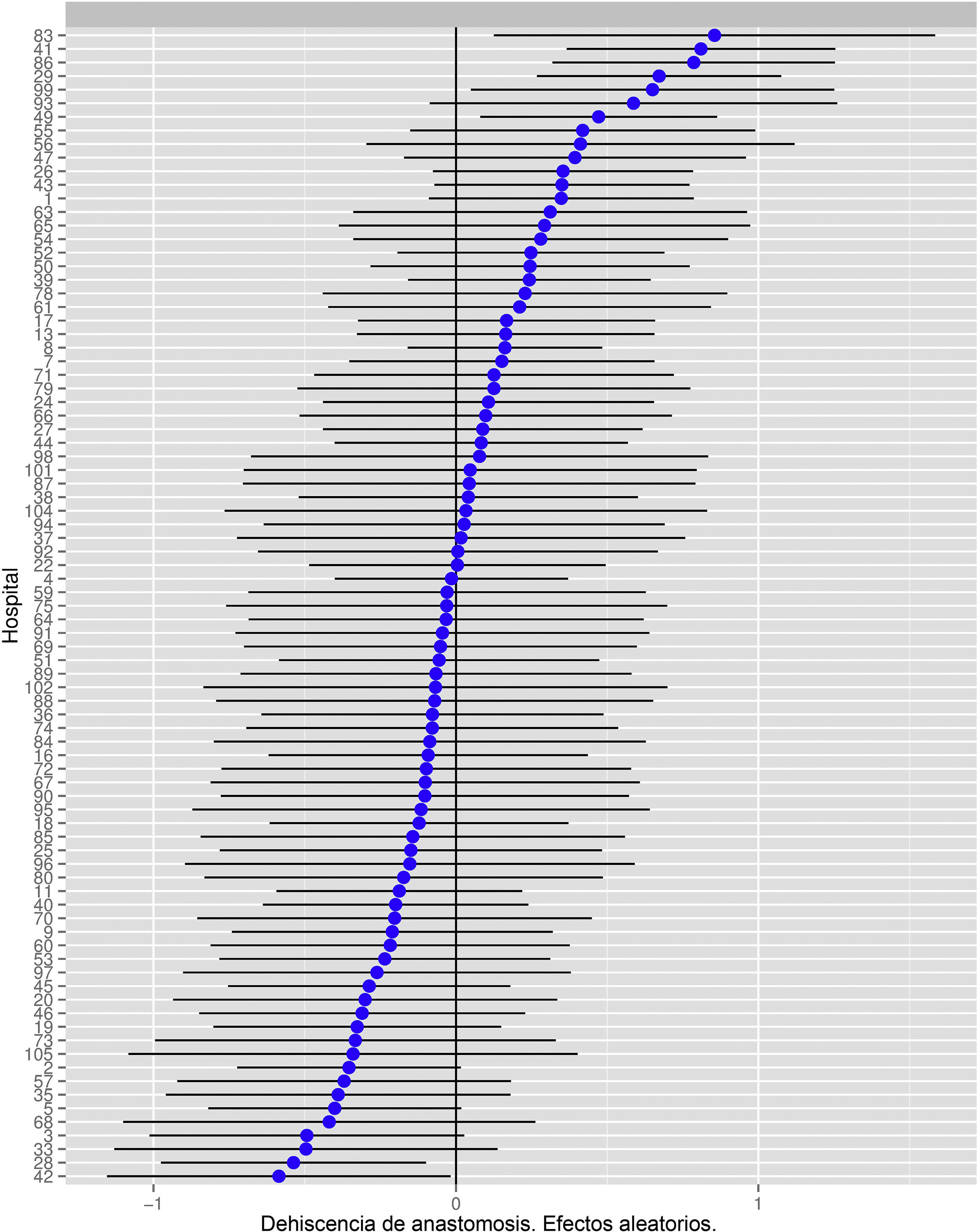
En la figura 1, se muestran las diferencias entre los hospitales.
Riesgo de dehiscencia de anastomosis en los hospitales, obtenido mediante una regresión logística multinivel, considerando la variable hospital como un efecto aleatorio para corregir por la no independencia de los datos. Los hospitales están representados en el eje vertical con el número de código que tienen en el proyecto. Se muestra el valor de la constante aleatoria para cada hospital. Cada hospital está ordenado de menor a mayor valor de la constante: los valores positivos de la constante son los que indican peores resultados.
Los resultados de este estudio indican que, en el Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos, la dehiscencia anastomótica no depende del volumen quirúrgico del hospital, y que su tasa varía entre los hospitales incluidos de forma estadísticamente significativa.
La mayor debilidad de este estudio tiene que ver con la naturaleza voluntaria de inclusión de los datos en el Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos, sobre todo cuando se compara con los registros de los países escandinavos17,18, en los que la inclusión de datos en el registro es obligatoria. Sin embargo, como ya se indicó con más detalle8,9, se han tomado diversas iniciativas para evitar sesgos voluntarios o involuntarios de inclusión y de información. Desgraciadamente, debido al carácter anónimo de los datos y a la carencia de otras fuentes para contrastar la información en nuestro país, no es posible asegurar con certeza la ausencia de tales datos. Por ello, en el peor de los escenarios, los datos de este estudio indican las tasas mínimas de dehiscencia de la anastomosis.
Otra debilidad del estudio es que la base de datos del proyecto no incluye distintas variables que puedan influir en la dehiscencia anastomótica, como por ejemplo obesidad, niveles de albúmina, etc. Sin embargo, el objetivo del proyecto es que los centros participantes conozcan los resultados inmediatos y alejados de su actividad en comparación con los del conjunto y, como el proyecto está implantado en 15 comunidades autónomas, es poco probable que haya diferencias atribuibles a factores socioeconómicos, tal como se ha demostrado en Dinamarca19.
La tasa de dehiscencia anastomótica observada en este estudio, 10%, se sitúa entre las de Noruega17 (7%), Suecia20 (8,7%) y Dinamarca18 (12,7%), según los últimos informes y estudios publicados por estos registros, y es muy superior a la indicada en el programa irlandés de centralización de esta enfermedad (4,3%)5.
De estos registros, en 3 se ha evaluado la influencia del volumen quirúrgico del hospital en la tasa de dehiscencia, con resultados contradictorios. En Irlanda5 y Noruega6, mediante estudios estadísticos univariantes, se observaron diferencias atribuibles al volumen, mientras que en Dinamarca7, empleando estadística multivariante, estas no se han observado, al igual que en el presente estudio en el que se ha empleado una estadística multinivel. Por tanto, la discrepancia entre los 4 estudios puede explicarse por la diferencia de metodología estadística y, obviamente, tanto la estadística multivariante, que permite ajustar los resultados por múltiples variables de la muestra, como la multinivel, son mucho más sólidas.
Una tendencia natural es utilizar los datos de los registros nacionales para establecer indicadores de resultado de la actividad tal como se ha hecho en Escandinavia, ya que estos permiten a los hospitales incidir en la corrección de la variabilidad. Desgraciadamente, aunque los departamentos que participan en el Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos tengan unas características similares a las de los hospitales de Escandinavia, y el volumen de la muestra de pacientes analizada en el presente estudio sea razonablemente grande, es imposible establecer a partir de él un indicador nacional de resultado. La razón, como han probado los registros voluntarios del National Bowel Cancer Project de Gran Bretaña21 y del cáncer de recto belga PROCARE22, es que cuando los hospitales no envían todos los datos, y con ello sesgan la información, o no participan en absoluto en el registro, las tasas de mortalidad operatoria son mayores en los pacientes no incluidos en el registro que en los incluidos en él, y con ello se subestima la mortalidad quirúrgica a nivel nacional y se impide conseguir estimaciones precisas de los indicadores de actividad.
En conclusión, los resultados de este estudio indican que, en el Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos, la tasa de dehiscencia anastomótica es similar a la de los registros de Escandinavia y, además, varía entre los hospitales incluidos de forma estadísticamente significativa, sin que esta diferencia pueda explicarse por el volumen quirúrgico.
FinanciaciónEste proyecto ha sido financiado con las siguientes ayudas de investigación: FIS número: PI11/ 00010 y Consejería de Sanidad, Gobierno de Navarra: 20/11.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Grupo colaborador del Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos (2006-2013).
Virgen de la Arrixaca (Juan Luján), Bellvitge (Doménico Fraccalvieri, Sebastiano Biondo), Complejo Hospitalario de Navarra (Miguel Á. Ciga), Clínico de Valencia (Alejandro Espí), Josep Trueta (Antonio Codina), Sagunto (María D. Ruiz), Vall d’Hebrón (Eloy Espin, F. Vallribera), La Fe (Eduardo García-Granero), Complejo Hospitalario Ourense (Alberto Parajo), Germans Trias i Pujol (Ignasi Camps, Marta Piñol), Lluís Alcanyis (Vicent Viciano), Complejo Asistencial Burgos (Evelio Alonso), Hospital del Mar (Miguel Pera), Meixoeiro (Nieves Cáceres), Complejo Asistencial Salamanca (Jacinto García), Gregorio Marañón (Marcos Rodríguez), Torrecárdenas (Ángel Reina), General de Valencia (Verónica Gumbau), Txagorritxu (José Errasti), Donostia (José A. Múgica), Reina Sofía (José Gómez), Juan Ramón Jiménez (Ricardo Rada, Mónica Orelogio), Arnau de Vilanova de Valencia (Natalia Uribe), General de Jerez (Juan de Dios Franco), Arnau de Vilanova de Lérida (José Enrique Sierra), Santa Creu i Sant Pau (Pilar Hernández), Clínico de Santiago de Compostela (Jesús Paredes), Universitario de Jaén (Gabriel Martínez), Clínico San Carlos (Mauricio García), Cabueñes (Guillermo Carreño), General de Albacete (Jesús Cifuentes), Miguel Servet (José Monzón), Xeral de Lugo (Olga Maseda), Universitario de Fuenlabrada (Daniel Huerga), Clínico y Provincial de Barcelona (Luis Flores), Joan XXIII (Fernando Gris), Virgen de las Nieves (Inmaculada Segura, Pablo Palma), Nuestra Señora de la Candelaria (José G. Díaz), Complejo Hospitalario de Badajoz (Jesús Salas), Clínico Universitario San Cecilio (Francisco Pérez, Benito Mirón), General Universitario de Alicante (Félix Lluis), Virgen Macarena (Luis Capitán, Javier Valdés), Xeral-Cies de Vigo (Nieves Cáceres), Infanta Sofía (Javier Martínez), Policlínica de Vigo (Alfredo Estévez), Virgen del Rocío de Sevilla (José Díaz, María V. Maestre), San Juan de Dios del Aljarafe (Antonio Amaya, Mónica Reig), Nuestra Señora de Sonsoles (Antonio Carmona), Universitario de Getafe (Francisco Javier Jiménez), H. Granollers (Didac Ribe), Universitario de La Paz (Isabel Prieto), Rafael Méndez (Ginés Sánchez, Sergio del Valle), General Universitario Reina Sofía (Pedro A. Parra), San Pedro de Alcántara (Francisco Romero), Torrevieja Salud (Alessandro Garcea), Santa María de Lérida (Xavier Rodamilans), Virgen del Puerto (José A. Pérez), Segovia (Guillermo Asís), Reus (Santiago Blanco), Instituto Valenciano de Oncología (Alfonso García, Rafael Estévan), Viladecans (Albert Sueiras), Cruces (Alberto Lamíquiz, José M.ª García), Ramón y Cajal (Javier Die), Manises (Amparo Solana), La Ribera Alzira (Francisco J. Blanco), Nuestra Señora del Rosell (Ana Lage), Mérida (José Domínguez), Universitario Fundación Alcorcón (Paula Dujovne), Henares Coslada (Natividad Palencia), Vinaroz (Raúl Adell), Onkologikoa de San Sebastián (Roberto Martínez), Consorci Sanitari Integral (Luis Ortiz de Zarate), Complejo Hospitalario Palencia (Ana M.ª Huidobro), Fundación Jiménez Díaz (Carlos Pastor), Torrejón (Jesús Á. Garijo), Puerto Real (M.ª del Coral de la Vega), Espíritu Santo (Manuel López).