Los avances en la formación de imágenes, la computación y la óptica han alentado la aplicación del enfoque quirúrgico mínimamente invasivo a una variedad de procedimientos neuroquirúrgicos. Las ventajas incluyen la localización exacta de las lesiones generalmente inaccesibles a la cirugía convencional, menos trauma al cerebro sano, a los vasos sanguíneos y a los nervios, más corto el tiempo de funcionamiento, la reducción de la pérdida de sangre, la recuperación temprana y el alta. Sin embargo, los procedimientos en la neurocirugía mínimamente invasiva (NMI) todavía tienen potenciales complicaciones intra y postoperatorias que pueden causar morbimortalidad.
ObjetivosEl objetivo de este estudio fue revisar y analizar la literatura publicada que describe las experiencias en el manejo anestésico de los procedimientos más comúnmente realizados en NMI.
Materiales y métodosLiteratura sobre neurocirugía y neuroanestesia (1990-2013). Revisión y descripción de la técnica anestésica / gestión y morbilidad perioperatoria / mortalidad notificada. Comparación de la experiencia de los diferentes autores en procedimientos de NMI.
ResultadosLa literatura sobre NMI se ha expandido, pero hay pocas referencias en relación con el manejo anestésico. Las metas anestésicas siguen siendo las mismas: la evaluación preoperatoria cuidadosa y la planificación y el meticuloso control de la hemodinámica cerebral para asegurar la presión de perfusión cerebral adecuada. El grado de cuidado postoperatorio depende de la práctica local, de los factores del paciente y de la imagen cerebral postoperatoria.
Advances in imaging, computing and optics have encouraged the application of minimally invasive surgical approach to a variety of neurosurgical procedures. The advantages include accurate localization of lesions usually inaccessible to conventional surgery, less trauma to healthy brain, blood vessels and nerves, shorter operating time, reduced blood loss, and early recovery and discharge. Nevertheless minimally invasive neurosurgical (MIN) procedures still have potential intra- and post-operative complications that can cause morbidity and mortality.
ObjectivesThe aim of this study was to review and analyze published literature describing experiences in the anesthetic management of the most commonly performed MIN procedures.
Materials and methodsNeurosurgical and neuroanesthesia literature (1990-2013) were reviewed and description of anesthetic technique/management and perioperative morbidity/mortality reported. We also compared the different authors’ experience with MIN procedures.
ResultsThe neurosurgical literature dealing with MIN has expanded, but there are few references in relation to anesthetic management. Anesthesia goals remain the same: careful pre-operative assessment and planning, and meticulous cerebral hemodynamic control to ensure adequate cerebral perfusion pressure. The degree of postoperative care depends on local practice, patient factors and postoperative brain imaging.
La literatura de neurocirugía relacionada con neurocirugía mínimamente invasiva (NMI) ha ido creciendo, pero existen pocas referencias sobre el manejo de la anestesia. Las metas en la anestesia siguen siendo las mismas: una cuidadosa evaluación preoperatoria, planeación y cuidadoso control hemodinámico para garantizar una adecuada presión de perfusión cerebral. Los pacientes deben monitorizarse cuidadosamente como si se sometieran a una craneotomía tradicional. Es importante seleccionar una técnica anestésica que permita un rápido despertar para una oportuna valoración neurológica1.
A continuación se presenta un resumen de las características de la anestesia y perioperatorias de los procedimientos de NMI realizados con más frecuencia, a partir de una revisión narrativa de literatura de neurocirugía y neuroanestesia entre 1990 y 2013.
Biopsia cerebral cerradaLa biopsia «cerrada» del cerebro incluye la biopsia cerebral percutánea con marco (guiada por tomografía con marco estereotáxico), sin marco (guiada por navegación o Stealth) y fijación del cráneo con tornillos en 3 puntos con el cranioestato de Mayfield, con o sin endoscopia.
Consideraciones sobre la anestesiaLa opción anestésica para la biopsia cerrada del cerebro depende de la técnica quirúrgica, de las características del paciente y de la posición. Se puede usar el Doppler Precordial para detectar embolismo aéreo venoso en la posición semisentada2. Los procedimientos de neuronavegación requieren un alto grado de precisión e inmovilidad del paciente. Esto se logra fácilmente con anestesia general, y por ende es la técnica preferida por encima de la anestesia local y la sedación3,4. Contrario a la práctica de rutina en neuroanestesia, donde se desea un cerebro relajado, el desplazamiento del cerebro por causa de un cerebro «relajado» puede conllevar la pérdida de confiabilidad del sistema de navegación. Mantener la normocarbia y evitar el manitol minimizarán el desplazamiento del cerebro. Si un paciente no se despierta después de un procedimiento, deberá realizarse una tomografía para descartar la presencia de edema cerebral, hematoma o pneumocéfalo.
Cuando se elige anestesia local y sedación monitorizada, se pueden aplicar bloqueos nerviosos regionales5. Puede ser necesaria la sedación, y se logra utilizando dexmedetomidina, propofol, y/o remifentanilo2. Un registro invasivo o no invasivo pero continuo de la presión arterial es útil para monitorizar picos inesperados de hipertensión que pudieran promover hemorragia.
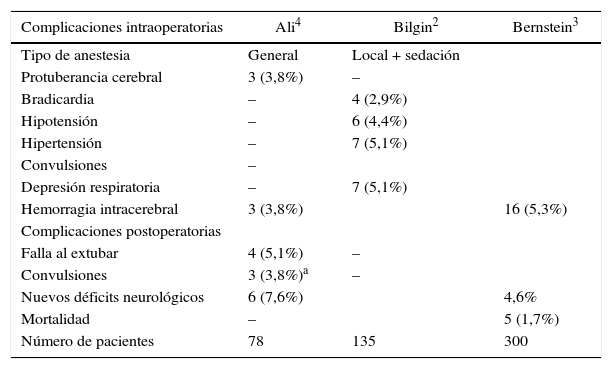
Ambiente perioperatorioLa tabla 1 señala las complicaciones perioperatorias asociadas a la biopsia cerebral cerrada. El resultado diagnóstico, las tasas de eventos y la mortalidad relacionada con la biopsia no difieren entre las distintas técnicas de biopsia cerrada4,6.
Complicaciones perioperatorias / mortalidad asociada a la biopsia cerebral cerrada
| Complicaciones intraoperatorias | Ali4 | Bilgin2 | Bernstein3 |
|---|---|---|---|
| Tipo de anestesia | General | Local + sedación | |
| Protuberancia cerebral | 3 (3,8%) | – | |
| Bradicardia | – | 4 (2,9%) | |
| Hipotensión | – | 6 (4,4%) | |
| Hipertensión | – | 7 (5,1%) | |
| Convulsiones | – | ||
| Depresión respiratoria | – | 7 (5,1%) | |
| Hemorragia intracerebral | 3 (3,8%) | 16 (5,3%) | |
| Complicaciones postoperatorias | |||
| Falla al extubar | 4 (5,1%) | – | |
| Convulsiones | 3 (3,8%)a | – | |
| Nuevos déficits neurológicos | 6 (7,6%) | 4,6% | |
| Mortalidad | – | 5 (1,7%) | |
| Número de pacientes | 78 | 135 | 300 |
El grado de atención postoperatoria varía de una institución a otra. En Purzner et al.7, de 244 pacientes que se sometieron a biopsia cerebral, 152 (62%) se seleccionaron como pacientes ambulatorios; 143 pacientes (94,1%) fueron dados de alta con éxito de la unidad de cirugía ambulatoria; el 4,6% no pudieron ser dados de alta y el 1,3% fueron dados de alta pero debieron ser hospitalizados de nuevo (tabla 2). Otros centros realizan un estudio de imágenes cerebrales antes de dar al paciente de alta de la unidad de cuidados postoperatorios. Idealmente, cada centro debe tener una rutina clínica que prepara y planifica a los pacientes para biopsia cerebral cerrada, dependiendo de la localización del tumor, de la presencia de edema, del desplazamiento de la línea media, de la presencia de eventos intraoperatorios inesperados y de los resultados y desenlaces históricos de la institución8.
Criterios de inclusión/exclusión para la intervención ambulatoria de biopsia cerebral
| Criterios de inclusión |
| 1. Disponibilidad de un cuidador para observación durante la noche |
| 2. Tumor supratentorial intraaxial |
| 3. El paciente está relativamente cerca del hospital |
| Criterios de exclusión |
| 1. Obesidad severa o comorbilidades importantes (cardiacas/respiratorias) |
| 2. Vía aérea difícil esperada |
| 3. Ya es un paciente hospitalizado |
| 4. Epilepsia no controlada o estado neurológico pobre |
| 5. Se espera una cirugía o procedimiento largo que termine después de la 1:00 pm |
| 6. Discapacidad neurosicológica |
| 7. Preferencia del paciente |
Luego de la cirugía, los pacientes se monitorizan en la unidad de cuidado postoperatorio durante 2horas y luego se transfieren a la unidad de cuidados ambulatorios durante un mínimo de 6horas. Cuatro horas después de la intervención se hace una tomografía simple del cerebro. Todos los pacientes son examinados por el cirujano jefe, quien determina si el paciente está listo para ser dado de alta: tomografía postoperatoria normal, buen control del dolor, hemostasia de la herida, estado neurológico estable y la disponibilidad de un adulto responsable que monitoree al paciente durante la noche.
Adaptado de Purzner et al.7.
La estimulación cerebral profunda (ECP) es el tratamiento quirúrgico de elección para trastornos de motricidad, especialmente la enfermedad de Parkinson, que son refractarios a tratamiento médico. La guía electrofisiológica intraoperatoria consiste en el registro con microelectrodos y macroestimulación en el paciente despierto, a fin de verificar que la estimulación del electrodo mejora los síntomas del paciente con un mínimo de efectos secundarios9. La ECP también se ha utilizado para tratar muchas otras condiciones neurológicas y psiquiátricas, incluyendo el dolor crónico, la epilepsia refractaria, el trastorno obsesivo-compulsivo y la depresión. Los sistemas estereotáxicos sin marco han mejorado la tolerancia de los pacientes a estos procedimientos.
Consideraciones sobre la anestesiaLos principales retos son los efectos de los agentes anestésicos sobre el registro de los microelectrodos en los núcleos y la necesidad de contar con un paciente despierto que colabore, durante las pruebas de macroestimulación intraoperatoria9.
La ECP se realiza bajo anestesia local y sedación monitorizada. La infusión de propofol puede brindar una sedación óptima cuando no se requiere la cooperación del paciente. Sin embargo, los pacientes con enfermedad de Parkinson son más sensibles a los sedantes y tienen mayor tendencia a desarrollar obstrucción de la vía aérea e hipoventilación, especialmente si se agrega remifentanilo. La dexmedetomidina pudiera ser el fármaco de elección, pues brinda sedación con un mínimo de depresión respiratoria10. Luego de colocados los electrodos, se pasan las derivaciones por un túnel y se inserta en generador de pulso en una bolsa subcutánea por debajo de la clavícula, generalmente bajo anestesia general.
La anestesia general pudiera ser la única opción para pacientes con distonía severa11. Algunos centros utilizan la guía con resonancia magnética intraoperatoria para insertar el dispositivo ECP, que entonces requiere anestesia general durante todo el procedimiento12,13.
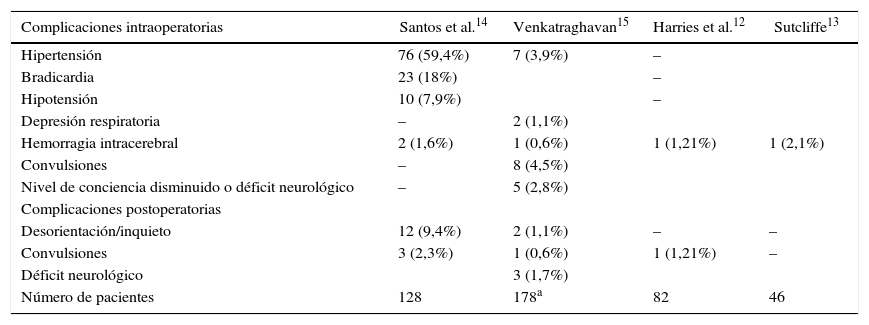
Ambiente perioperatorioEn la tabla 3 se enumeran las complicaciones perioperatorias asociadas al ECP para enfermedad de Parkinson. La levodopa puede inducir hipotensión ortostática. Por otra parte, la hipertensión durante el procedimiento se ha asociado a un mayor riesgo de hemorragia intracraneana16. Puede ser necesario monitorizar la presión intraarterial en pacientes hipertensos y durante procedimientos largos. Se ha descrito bradicardia durante la estimulación de la amígdala y el hipocampo. No son raros los problemas conductuales y cognitivos postoperatorios luego de la inserción del ECP. Pueden usarse antagonistas selectivos de la dopamina (clozapina, quetiapina) para tratar las alucinaciones postoperatorias. Deben evitarse los antagonistas no selectivos (olanzapina, haloperidol)17. La retirada de medicamentos que debe hacerse antes del implante del ECP puede aumentar los síntomas del paciente durante el período postoperatorio y puede ser necesaria la administración de medicamentos para el Parkinson a través de una sonda nasogástrica18. Los estudios han demostrado que suelen presentarse complicaciones dentro de las 6h siguientes a la cirugía, de manera que los pacientes pueden ser dados de alta al piso luego de un período de estricta observación. Algunos centros realizan un estudio de imágenes antes de dar de alta al paciente al piso de neurocirugía19.
Complicaciones perioperatorias relacionadas con la estimulación cerebral profunda para la enfermedad de Parkinson
| Complicaciones intraoperatorias | Santos et al.14 | Venkatraghavan15 | Harries et al.12 | Sutcliffe13 |
|---|---|---|---|---|
| Hipertensión | 76 (59,4%) | 7 (3,9%) | – | |
| Bradicardia | 23 (18%) | – | ||
| Hipotensión | 10 (7,9%) | – | ||
| Depresión respiratoria | – | 2 (1,1%) | ||
| Hemorragia intracerebral | 2 (1,6%) | 1 (0,6%) | 1 (1,21%) | 1 (2,1%) |
| Convulsiones | – | 8 (4,5%) | ||
| Nivel de conciencia disminuido o déficit neurológico | – | 5 (2,8%) | ||
| Complicaciones postoperatorias | ||||
| Desorientación/inquieto | 12 (9,4%) | 2 (1,1%) | – | – |
| Convulsiones | 3 (2,3%) | 1 (0,6%) | 1 (1,21%) | – |
| Déficit neurológico | 3 (1,7%) | |||
| Número de pacientes | 128 | 178a | 82 | 46 |
La ventriculostomía endoscópica del tercer ventrículo es el tratamiento de elección para la hidrocefalia no comunicante. También se ha utilizado la neuroendoscopia para tratar la hidrocefalia infecciosa y la hemorragia intraventricular. Otras intervenciones son la escisión endoscópica de quistes, biopsias de tumor, extirpación completa de tumores intra y paraventriculares como la neurocisticercosis, hematomas, y cauterización del plexo coroideo en el tratamiento de la hidrocefalia en los países en desarrollo20,21.
Consideraciones sobre la anestesiaLa posición del paciente para la neuroendoscopia suele ser supina con una ligera flexión del cuello, o con la cabeza levantada entre 45 a 90°. El cráneo se fija con un marco cefálico. A través de un orificio de trépano coronal, se introduce el endoscopio al sistema ventricular a través del asta frontal. El endoscopio tiene un canal para aspirar y un canal de trabajo a través del cual se pueden pasar diversos instrumentos. Las metas de la anestesia son asegurar la inmovilidad del paciente, prevenir, detectar y tratar aumentos marcados de la presión intracraneal (PIC) y planificar un rápido despertar para una oportuna valoración neurológica. Se evita el óxido nitroso para prevenir su difusión en el aire atrapado en los ventrículos y en el espacio subdural, luego de la descompresión de los ventrículos22. Margetis y Souweidane23 utilizaron corticoides endovenosos preoperatorios para reducir el posible riesgo de ventriculitis química subsiguiente a hidrocefalia, como consecuencia del derrame intraventricular de material coloide durante la resección endoscópica.
La solución caliente de Ringer lactato es el líquido más comúnmente utilizado para irrigar24-27. Salvador et al.28 encontraron que el uso de solución salina producía cambios significativos en la composición del LCR. Con el fin de evitar complicaciones intraoperatorias y postoperatorias a consecuencia del uso de líquidos de irrigación, debe tenerse cuidado en limitar la pérdida de LCR y utilizar la irrigación solo cuando sea necesario29.
El líquido suele infundirse bajo presión y se deja que salga pasivamente a través de un puerto abierto del endoscopio. La purga inadecuada del líquido de irrigación puede conllevar a un marcado aumento de la PIC.
Además de los monitores estándar, se recomienda el uso del monitor intraarterial22,25–27. Es esencial tener una medición continua de la perfusión cerebral26. Para evaluar la presión de perfusión cerebral (PPC) se puede medir la PIC indirectamente midiendo la presión dentro del endoscopio (PIN). La PIN se obtiene con un catéter lleno de líquido que está conectado a una válvula de paso conectada a la luz de irrigación del neuroendoscopio y adosada a un transductor de presión calibrado en cero en la base del cráneo30.
Se ha recomendado mantener la PPC intraoperatoria constante en 40mmHg26. Kalmar et al.26 encontraron que la aparición de hipertensión y taquicardia («reflejo atípico de Cushing») era el resultado de un aumento de la PIC. Además, el reflejo de Cushing se desarrolló casi en todos los casos cuando la presión de perfusión cerebral cayó por debajo de 15mmHg. Sin embargo, la presencia de bradicardia no siempre se asoció a una baja PPC.
La velocidad del flujo sanguíneo de la arteria cerebral media puede medirse con una sonda de Doppler transcraneal (DTC) de 2MHz, adosada a la ventana temporal. Puede presentarse una baja PPC de manera precipitada, por la purga inadecuada de la solución de irrigación24. Sin embargo, mantener una señal confiable de DTC durante toda la cirugía es técnicamente difícil y algunas veces inalcanzable.
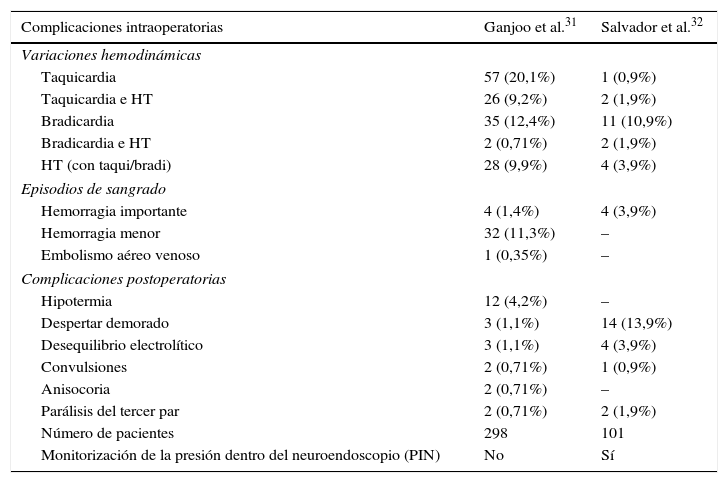
Ambiente perioperatorioLa tabla 4 reseña las complicaciones perioperatorias31,32. Las arritmias cardiacas son comunes y van desde bradicardia, taquicardia, contracciones ventriculares prematuras, taquicardia supraventricular hasta asístole. Afortunadamente suelen ser transitorias. Las complicaciones más graves son lesiones en las estructuras del cerebro, incluyendo la arteria basilar y la subsiguiente hemorragia.
Complicaciones perioperatorias asociadas a neuroendoscopia intraventricular
| Complicaciones intraoperatorias | Ganjoo et al.31 | Salvador et al.32 |
|---|---|---|
| Variaciones hemodinámicas | ||
| Taquicardia | 57 (20,1%) | 1 (0,9%) |
| Taquicardia e HT | 26 (9,2%) | 2 (1,9%) |
| Bradicardia | 35 (12,4%) | 11 (10,9%) |
| Bradicardia e HT | 2 (0,71%) | 2 (1,9%) |
| HT (con taqui/bradi) | 28 (9,9%) | 4 (3,9%) |
| Episodios de sangrado | ||
| Hemorragia importante | 4 (1,4%) | 4 (3,9%) |
| Hemorragia menor | 32 (11,3%) | – |
| Embolismo aéreo venoso | 1 (0,35%) | – |
| Complicaciones postoperatorias | ||
| Hipotermia | 12 (4,2%) | – |
| Despertar demorado | 3 (1,1%) | 14 (13,9%) |
| Desequilibrio electrolítico | 3 (1,1%) | 4 (3,9%) |
| Convulsiones | 2 (0,71%) | 1 (0,9%) |
| Anisocoria | 2 (0,71%) | – |
| Parálisis del tercer par | 2 (0,71%) | 2 (1,9%) |
| Número de pacientes | 298 | 101 |
| Monitorización de la presión dentro del neuroendoscopio (PIN) | No | Sí |
HT: hipertensión.
Fuente: autores.
La demora en el despertar es una grave preocupación para el anestesiólogo. Salvador et al.32 encontraron una marcada asociación entre un aumento de la PIC por encima de 30mmHg y un mayor número de complicaciones postoperatorias. Detectar y diagnosticar temprano la disfunción neurológica es imperativo para excluir causas tratables tales como la hemorragia intracraneal.
Los pacientes sometidos a ventriculostomía endoscópica del tercer ventrículo pueden manejarse como pacientes ambulatorios, siempre y cuando el procedimiento sea corto y sin complicaciones.
Cirugía endoscópica endonasal de la hipófisisLa cirugía endoscópica endonasal puede realizarse en caso de patologías tanto benignas como malignas de la base del cráneo. Las ventajas que ofrece esta técnica sobre la cirugía transcraneal convencional en parte tienen que ver con la mínima alteración del tejido normal, una mejor visualización de la diana y con el hecho de que se evita la retracción del cerebro y de los pares craneanos33. Este abordaje es actualmente la técnica preferida para resecar los tumores de la hipófisis. En un informe de Dehdashti et al.34, la resección endoscópica de un adenoma de hipófisis resultó ser tan segura y efectiva como el procedimiento «transesfenoidal tradicional». Se encontraron tasas de remisión comparables en tumores funcionales y una tasa muy baja de complicaciones.
Consideraciones de la anestesiaEs necesario evaluar cuidadosamente la disfunción hormonal peroperatoria. Los pacientes con acromegalia tienen mayor riesgo de enfermedad cardiovascular, incluyendo hipertensión, coronariopatía, miocardiopatía, insuficiencia cardiaca congestiva y arritmias debido al exceso de secreción de la hormona de crecimiento35,36. El manejo de la vía aérea y la intubación pueden resultar desafiantes37. Es más seguro utilizar las técnicas de intubación con el paciente despierto, si se sospecha una vía aérea difícil38,39. Más aún, hasta el 70% de los pacientes con acromegalia pueden presentar apnea del sueño, lo cual los coloca en mayor riesgo de compromiso perioperatorio de la vía aérea.
Las metas y el manejo de la anestesia son similares a los descritos para el abordaje clásico transesfenoidal. El remifentanilo en combinación con propofol o con un agente volátil brinda estabilidad hemodinámica y permite una recuperación mucho más rápida en comparación con los agentes volátiles solos40. En un estudio en 90 pacientes sometidos a cirugía transesfenoidal de hipófisis, estos se aleatorizaron para recibir propofol, isoflurano o sevoflurano de mantenimiento, titulando el nivel de anestésico hasta un puntaje en el índice biespectral entre 40 y 6041. El tiempo hasta el despertar de la anestesia y la extubación traqueal fueron comparables en los grupos de propofol y sevoflurano. Sin embargo, la función cognitiva postoperatoria, medida según el puntaje Aldrete modificado a los 5 y 10min, fue mejor en los pacientes que recibieron propofol.
Luego de la inducción anestésica, se inyecta el anestésico local que contiene epinefrina en la mucosa nasal, a fin de preparar las narinas para la cirugía endoscópica. La epinefrina puede producir hipertensión en los pacientes con enfermedad de Cushing o acromegalia, pudiendo requerir tratamiento con betabloqueantes o vasodilatadores como la nitroglicerina. Se ha descrito el bloqueo bilateral del nervio infraorbitario con anestésico local para evitar la respuesta hipertensiva asociada a la estimulación quirúrgica42. Puede ser necesario un catéter intratecal lumbar para prevenir o tratar filtraciones del LCR. Durante la endoscopia, los neurocirujanos suelen pedir hipotensión permisiva sistémica, además de revertir la posición de Trendelenburg a fin de mejorar la visión del campo quirúrgico. En este escenario, la saturación cerebral regional pudiera ser una herramienta útil para evaluar el mantenimiento de una perfusión cerebral adecuada43,44.
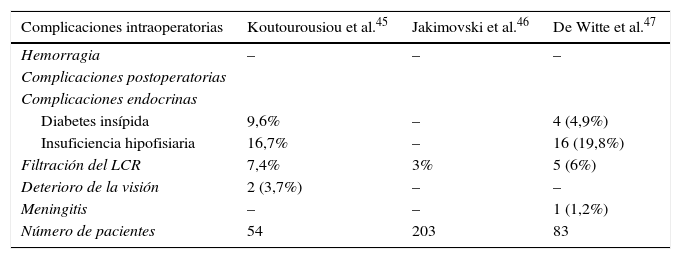
Ambiente perioperatorioEn la tabla 5 se presentan las complicaciones perioperatorias asociadas a cirugía endoscópica endonasal de la hipófisis. Las complicaciones son raras y generalmente se deben a lesiones de las estructuras vecinas. La identificación de la carótida interna con Doppler puede evitar las lesiones. Es posible que se presenten convulsiones postoperatorias, pero su incidencia es baja (1%)33.
Complicaciones perioperatorias asociadas a cirugía endoscópica endonasal de la hipófisis
| Complicaciones intraoperatorias | Koutourousiou et al.45 | Jakimovski et al.46 | De Witte et al.47 |
|---|---|---|---|
| Hemorragia | – | – | – |
| Complicaciones postoperatorias | |||
| Complicaciones endocrinas | |||
| Diabetes insípida | 9,6% | – | 4 (4,9%) |
| Insuficiencia hipofisiaria | 16,7% | – | 16 (19,8%) |
| Filtración del LCR | 7,4% | 3% | 5 (6%) |
| Deterioro de la visión | 2 (3,7%) | – | – |
| Meningitis | – | – | 1 (1,2%) |
| Número de pacientes | 54 | 203 | 83 |
Fuente: autores.
Los cuidados postoperatorios luego de cirugía de la hipófisis requieren un cuidadoso manejo de la vía aérea y una estricta monitorización neurológica y endocrina. Aproximadamente el 25% de los pacientes desarrollan diabetes insípida postoperatoria transitoria que dura de días a semanas y en el 0,5% de los casos es permanente. En el 9 al 25% de los casos se reporta el síndrome de secreción inadecuada de la hormona antidiurética (SIADH por sus siglas en inglés) y usualmente se manifiesta una semana después de la cirugía48. La filtración del LCR es la complicación postoperatoria más frecuente.
El abordaje endoscópico tiene menos morbilidad que una craneotomía y su uso está creciendo; por ejemplo, se ha reportado la cirugía endoscópica endonasal para reparación de un aneurisma de la arteria vertebral inferoposterior49.
Los pacientes sometidos a cirugía de la base del cráneo requieren una monitorización postoperatoria intensiva. Los pacientes de alto riesgo (mayores de 60años de edad, con comorbilidades severas, acromegalia clínicamente activa, enfermedad de Cushing, tumor voluminoso con riesgo de disfunción hipotalámica o complicaciones intraoperatorias o en el postoperatorio temprano) programados para cirugía de la hipófisis pueden requerir cuidados intensivos durante la noche50.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónNinguna.