La diálisis sostenida de baja eficiencia (sustained low efficiency dialysis [SLED]) como terapia primaria de reemplazo renal en la lesión renal aguda no está muy extendida, a pesar de sustanciales ventajas económicas. Nosotros evaluamos los costos y los resultados en un estudio retrospectivo de 5años en nuestra unidad de cuidados intensivos (UCI).
MétodosDesde 2006 hasta 2010 seleccionamos todos los pacientes con los códigos ICD-10 N17 y N18 que fueron tratados con SLED en nuestra UCI. Fueron excluidos los pacientes con una estancia de menos de 2días, una indicación extrarrenal para diálisis o la diálisis crónica. Las variables fueron: el número de SLED, la duración en la UCI y la estancia hospitalaria, la mortalidad hospitalaria y en la UCI, SAPSII, TISS28, la urea y la creatinina séricas, la proteínaC reactiva, la ventilación mecánica y los diagnósticos. El resultado a largo plazo se evaluó mediante el envío de un cuestionario a todos los pacientes dados de alta.
ResultadosEntre 2006 y 2010 se llevaron a cabo 3.247tratamientos de SLED en 421pacientes (media de SAPSII: 41 puntos sin GCS). La mortalidad en la UCI y el hospital de los pacientes tratados solo con SLED (n=392) fue del 34 y del 45%, respectivamente. El 71% de todos los pacientes que sobrevivieron tenían buena calidad de vida y el 12% de todos los pacientes dados de alta aún necesitaban diálisis. Los costos totales de SLED fueron de 526.819€, y el producto total, de 734.996€. Si se considera 3.247 «días de hemodiafiltración venovenosa continua [HDFVVC]» para las comparaciones de costos, se calcularon los costos en 729.991€ con el producto de 690.864€ para HDFVVC.
ConclusionesEn los pacientes críticamente enfermos con lesión renal aguda la SLED es una eficaz terapia de reemplazo renal con resultados a corto y largo plazo que son comparables a los datos de los resultados de HDFVVC. En base a nuestro análisis de costo-beneficios, SLED parece ser la terapia preferible de reemplazo renal.
Sustained low efficiency dialysis (SLED) as primary renal replacement ther- apy (RRT) in acute kidney injury (AKI) is not widely used, despite substantial economic advantages. We evaluated costs and outcome in a 5 year retrospective study on our ICU.
MethodsFrom 2006 to 2010 we selected all patients with the ICD-10 codes N17 and N18 who were treated with SLED on our ICU. Patients with a stay <2 days, an extra-renal indication for dialysis or chronic dialysis were excluded. Variables: number of SLEDs, duration of ICU and hospital stay, ICU and hospital mortality, SAPS II, TISS 28, blood urea and creatinine, C-reactive protein, mechanical ventilation, diagnoses. Long-term outcome was evaluated by sending all discharged patients a questionnaire.
ResultsBetween 2006 and 2010, 3247 SLED-treatments in 421 patients (mean SAPS II: 41 points without GCS) were performed. ICU and hospital mortality in the patients treated only with SLED (n = 392) was 34% and 45%, respectively. 71% of all surviving patients had good quality of life and 12% of all discharged patients still needed dialysis. Total costs for SLED were 526.819€ and total proceeds were 734.996€. Assuming also 3247 «CVVHDF-days» for cost comparisons we calculated costs of 729.991€ with proceeds of 690.864€ for CVVHDF.
ConclusionsIn critically ill patients with AKI SLED is an effective RRT, with short- and long-term outcome being comparable to outcome data with CVVHDF. Based on our cost–proceeds analysis SLED seems to be the preferable renal replacement therapy.
Con una incidencia superior al 35% en el paciente críticamente enfermo, la insuficiencia renal aguda (IRA) es la complicación orgánica más frecuente de la patología subyacente1,2. La IRA es un factor de riesgo independiente de mortalidad hospitalaria3,4 y pudiera ser un precursor de disfunción orgánica múltiple5.
Aproximadamente el 5-6% de todos los pacientes con IRA en la unidad de cuidados intensivos (UCI) necesitan terapia de reemplazo renal6,7. Aún se cree que la terapia de reemplazo renal continua (hemodiafiltración venovenosa continua [HDFVVC] o hemofiltración) ofrece mayor estabilidad hemodinámica en caso de disfunción orgánica múltiple y niveles séricos más fisiológicos de urea, creatinina y potasio en el tiempo. Por otra parte, las terapias de reemplazo renal (hemodiálisis, diálisis sostenida de baja eficiencia [sustained low efficiency dialysis, SLED]) necesitan una anticoagulación menos intensa y brindan al paciente mayores oportunidades para su movilización o para otras intervenciones.
En la actualidad no existen guías basadas en la evidencia con relación al momento oportuno, la modalidad y la terminación de la terapia de reemplazo renal. Dos estudios aleatorizados, controlados, que compararon la técnica de HDFVVC continua contra discontinua (SLED, hemodiálisis), no encontraron ventajas ni desventajas con ninguna de las 2técnicas, aun en el caso de pacientes sépticos en la UCI8,9. Más aún, modalidades de tratamiento más intensas no se tradujeron en un mejor resultado para el paciente, independientemente de que se usara como terapia de reemplazo una terapia discontinua (3 versus 6 veces por semana)9 o una continua (25ml/kg de peso vs. 40ml/kg de peso10, y 20ml/kg de peso vs. 35ml/kg de peso)9.
Sin embargo, una ventaja sorprendente de todos los tratamientos intermitentes es el hecho de que los costos por tratamiento son considerablemente menores en comparación con las terapias continuas11-13. Nosotros suministramos SLED como terapia de reemplazo renal estándar en nuestra unidad desde el cuatro trimestre de 2006. Luego de 5años de utilizar SLED, el presente estudio evalúa 3preguntas fundamentales:
- 1)
Los resultados (mortalidad en la UCI y hospitalaria) de nuestros pacientes tratados con SLED ¿son comparables a los datos publicados?
- 2)
¿Cómo es la sobrevida en el largo plazo, la calidad de vida y la adherencia a la diálisis?
- 3)
¿Cuál ha sido el índice costo-beneficio en el transcurso de los últimos 5años?
Desde 2006 hasta el 2010 seleccionamos a todos los pacientes con diagnósticos según la CIE-10, códigos N17 o N18, quienes fueron tratados con SLED o HDFVVC en nuestra UCI. Excluimos a todos los pacientes que estuvieron hospitalizados <2 días o con indicaciones extrarrenales para la diálisis o diálisis crónica preexistente.
MétodosLas siguientes variables se extrajeron de la tabla: número de tratamientos SLED, número de días de tratamiento HDFVVC, tiempo de permanencia en la UCI y en el hospital, mortalidad en la UCI y en el hospital, SAPSII y TISS28, urea y creatinina séricas, proteínaC reactiva, ventilación mecánica, diagnósticos. Todos los datos se ingresaron en MS Excel 2007®. Como parte de nuestra rutina de gestión de calidad, evaluamos los resultados de largo plazo, incluyendo la dependencia de diálisis persistente de todos los pacientes dados de alta. La encuesta se hizo enviando a todos los pacientes dados de alta un cuestionario con las siguientes preguntas (ver anexo 1):
- •
De acuerdo con la escala glasgow de resultados, ¿en qué condición fue dado de alta el paciente?14
- •
Si entre tanto el paciente ha fallecido, ¿cuánto tiempo después de haber salido del hospital ocurrió el fallecimiento? (La respuesta fue suministrada por los familiares más cercanos.)
- •
¿Ha sido necesario un tratamiento posterior dependiente de diálisis luego de ser dado de alta? (Varias opciones de respuesta en términos de los criterios RIFLE «LOSS» y «ESKD».)
- •
En un espacio libre para escribir los pacientes podían colocar algunas sugerencias y comentarios.
Dentro del sobre con el cuestionario se incluía además un sobre con estampilla para su reenvío. A los pacientes que respondieron el primer cuestionario se les volvía a enviar el mismo cuestionario después de 6meses. Todos los cuestionarios devueltos se ingresaron también en la base de datos MS Excel.
Circuito extracorpóreo, soluciones de hemofiltración y anticoagulantesLa terapia de reemplazo renal intermitente se administró en forma de SLED con el sistema Genius®, un sistema móvil de diálisis individualizada que se describe más adelante15. En el caso de pacientes que no están en riesgo de hemorragia se utilizó heparina no fraccionada; en todos los demás se logró la anticoagulación con citrato de sodio. Se administró una dosis de carga de 1.000U al sistema de tubos al inicio de la diálisis, seguido de una infusión continua de entre 400-800U/h. Se necesitaron varios bolos cuando se formaban coágulos en el circuito extracorpóreo. Se administró citrato de sodio con un nivel objetivo de Ca2+ entre 0,3 y 0,45mmol/l en el brazo venoso del circuito extracorpóreo. La media de tiempo de tratamiento de SLED fue de 10h (rango: 6-20h).
Independientemente del tratamiento administrado (Genius90® o HDFVVC), cada paquete siempre contenía un circuito extracorpóreo con mangueras y filtro, los ingredientes para preparar el fluido de dializado, una jeringa apropiada para la administración de los anticoagulantes y un frasco de cloruro de sodio al 0,9% (1l) para llenar el sistema de tuberías.
El precio de la tratamiento de reemplazo renal (TRR) dependía del número de aplicaciones por año. Los costos se calcularon por el número de paquetes que se habían utilizado el año anterior e incluía todos los desinfectantes para los dispositivos, el alquiler de equipos, los costos de mantenimiento y todos los servicios por Fresenius®.
La terapia de reemplazo renal continua se realizó como HDFVVC con el multiFiltrate®. Si se utilizaba tratamiento de reemplazo renal continuo (TRRC), el volumen de intercambio era de aproximadamente 25ml/kg/h. Se administró heparina no fraccionada o citrato de sodio, como se ha descrito anteriormente.
EstadísticasCon el fin de evaluar el impacto económico de nuestras terapias de reemplazo renal, se extrajeron las siguientes variables de nuestro departamento de suministro de materiales: número de juegos de SLED y HDFVVC (filtro, mangueras y jeringa para anticoagulación), drogas (heparina, citrato), soluciones de sustitución, además de bolsas para ultrafiltración. Estos datos también se ingresaron en MS Excel.
Todos los datos se presentan como media±DE, a menos que se especifique lo contrario. Los datos se presentan para cada año y para los 5años en total.
En todos los pacientes tratados únicamente con SLED se evaluó el resultado a corto y a largo plazo. Para estos pacientes se compararon SAPSII y TISS al momento de ser ingresados y se compararon con el resultado según se describe en el cuestionario. También se resumió la relación entre SAPSII y TISS y el resultado individual para cada uno de los años investigados.
Todas las cantidades de dinero presentadas incluyen el impuesto sobre el valor añadido del 16% para el 2006 y del 19% desde el año 2007. Los datos económicos se compararon como suma promedio por año de los costos y beneficios de un procedimiento, así como la suma total de costos y beneficios después de 5años.
ResultadosPacientesSe identificaron 510pacientes, de los cuales 83 se excluyeron de continuar con las investigaciones de acuerdo con nuestros criterios predefinidos. La mayoría de estos casos excluidos (n=46) ya eran dependientes de diálisis. Además, 30pacientes llevaban menos de 2días de hospitalizados. En 7pacientes la diálisis se realizó por condiciones extrarrenales: intoxicación por litio (n=4), hipercalcemia por hiperparatiroidismo (n=1), hiperpotasemia con arritmias malignas (n=1) y recalentamiento extracorpóreo luego de hipotermia accidental (n=1)16.
Por lo tanto, quedaron 427pacientes para nuestro análisis de costo-beneficio. Había 266pacientes médicos (62%) y 161pacientes quirúrgicos (38%). De los pacientes médicos, 211 sufrieron de una patología respiratoria o cardiovascular, 41 se trataron por una enfermedad nefrológica y en 14 se presentaron patologías de los órganos abdominales superiores. Entre los pacientes quirúrgicos, 124 pacientes se sometieron a cirugía abdominal, 8 pacientes a cirugía torácica y 2 pacientes a cirugía general; 21 pacientes ingresaron a trauma o a cirugía ortopédica, y en 6 pacientes se llevaron a cabo procedimientos ginecológicos. Con relación a la modalidad de la diálisis, 392pacientes fueron tratados únicamente con SLED, con 8 tratamientos en promedio (rango: 1-133). Seis pacientes recibieron HDFVVC, con un período de tratamiento medio de 3,4días. En 29casos se utilizaron las 2modalidades de tratamiento: SLED y HDFVVC.
En 347 (81%) pacientes se necesitó ventilación mecánica, y en 221pacientes (52%) se realizó una traqueotomía percutánea. El tiempo promedio de ventilación fue de 382h (±390).
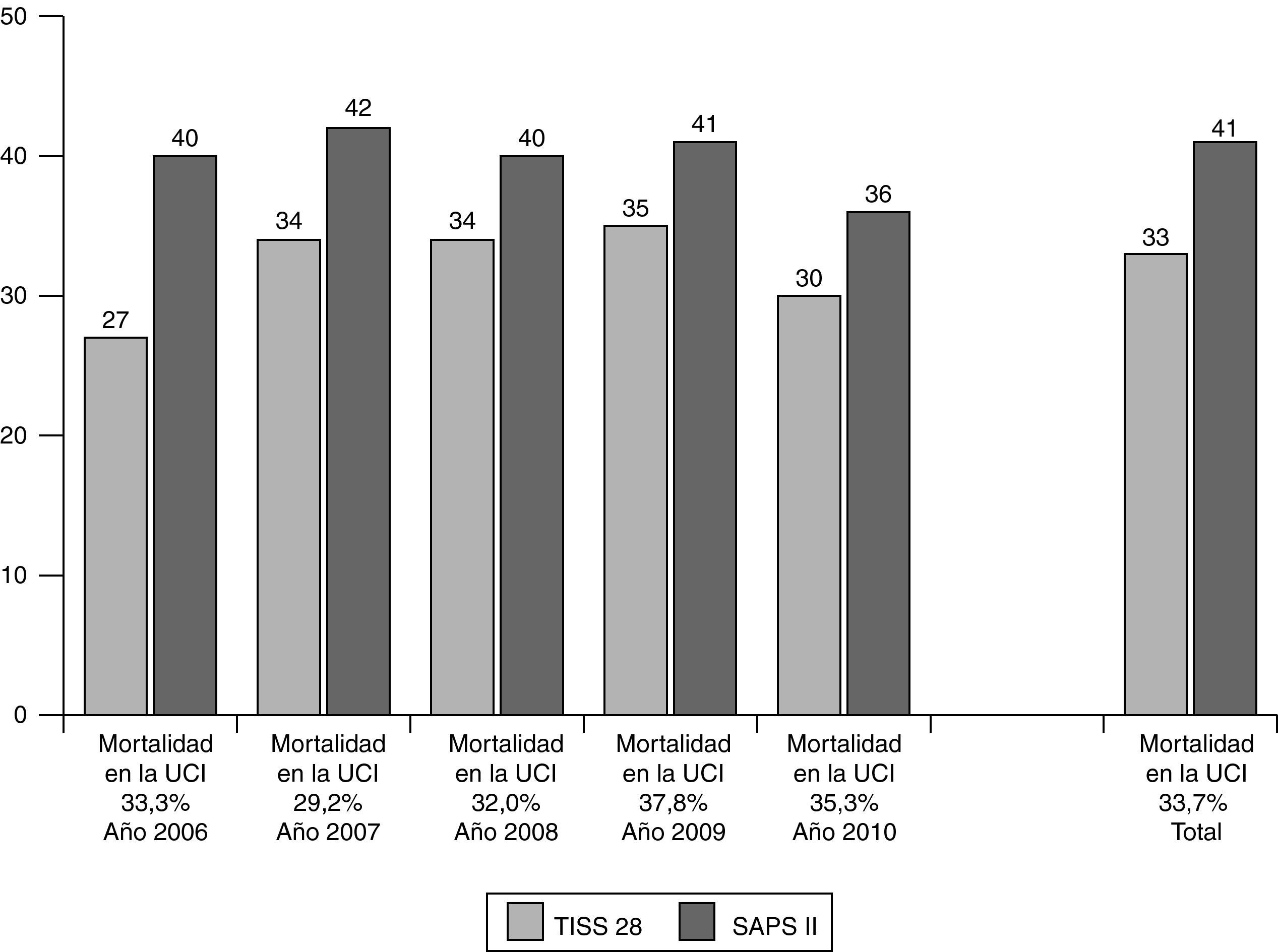
Para la evaluación del resultado a corto y a largo plazo, solo se consideraron los pacientes tratados únicamente con SLED (n=392). La puntuación media SAPSII fue de 41 puntos (±11), sin inclusión de la Escala Glasgow de Coma porque se administró analgosedación en la mayoría de la población de nuestro estudio. La media de TISS28 fue de 33 puntos (±11) (fig. 1). Ciento noventa y dos pacientes pudieron abandonar el hospital para regresar a su anterior situación de vida o a una institución de rehabilitación. Ciento treinta y dos pacientes murieron en nuestra UCI, y otros 44pacientes fallecieron en el pabellón periférico. Veinticuatro pacientes habían sido transferidos por razones médicas a otros hospitales (fig. 2). La media de permanencia en la UCI fue de 16días (±16); la media de permanencia en el hospital fue de 28días (±23).
En septiembre de 2011 y marzo de 2012 contactamos por correo a todos los 216 sobrevivientes de nuestro grupo de estudio. Cincuenta y dos cartas no pudieron ser entregadas porque la persona se había mudado sin dejar una dirección para correspondencia.
Los resultados se presentan en la figura 3. Hubo un total de 112 respuestas devueltas. Setenta y siete (69%) pacientes seguían vivos, 35 (31%) habían muerto durante ese tiempo, 28 pacientes (36%) se habían recuperado bien de su enfermedad (GOS1), otros 27 pacientes (35%) tenían algunas restricciones de salud pero preservando la autosuficiencia en las actividades cotidianas (GOS2). Veinte pacientes (26%) habían sido dados de alta con incapacidad severa y requerían asistencia personal (GOS3), 2 pacientes (3%) dependían las 24h de cuidado (GOS4), 88 pacientes habían sido dados de alta sin depender de diálisis, y 13 pacientes tenían necesidad persistente de tratamiento de diálisis (fig. 4)17.
Índice costo-beneficiosEl precio de un equipo para el circuito de SLED extracorpóreo era de 182.12€ en 2006. Después de 3años, el precio se redujo a 127.52€. Desde 2006 a 2010 los costos totales de los circuitos extracorpóreos fueron de 518.431€ por 3.247 tratamientos. El anticoagulante más comúnmente utilizado para SLED fue la heparina, con 2.941 aplicaciones. El precio de un vial de heparina sódica (25.000U) era de 2,24€. El consumo calculado de heparina fue de 10.000U por tratamiento, y el costo total fue de 2.635€. Se aplicó citrato de sodio 306 veces. El precio de una botella de infusión de citrato de sodio 1M (250ml) fue de 9,40€ y se aplicó mediante una bomba de infusión volumétrica. El consumo calculado de citrato fue de 500ml por tratamiento, y el costo total llegó a 5.753€. Por lo tanto, en el periodo 2006-2010 los costos globales del tratamiento SLED, incluyendo todos los factores de costo, totalizaron 526.819€.
Las beneficios del hospital correspondientes a un tratamiento con SLED fueron de 247,90€ en 2006 y a lo largo de los años bajaron a 221,02€ en el 2010. Los beneficios totales del hospital por concepto de SLED durante el período de evaluación fueron de 734.996€.
Para comparaciones directas de costos entre las terapias de reemplazo renal intermitente vs. continua también asumimos 3.247 «días HDFVVC». Desde 2006 a 2010 administramos 119HDFVVC días tratamiento y los costos totales —incluyendo circuitos extracorpóreos, bolsas de solución de hemofiltración y la terapia anticoagulante— totalizaron 26.754€. Por lo tanto, la media de costo para un día de tratamiento con HDFVVC fue de 224,82€. Basados en este valor, extrapolamos unos costos totales de 729.991€. La administración del hospital negoció anualmente los beneficios del hospital por un día de tratamiento HDFVVC, y alcanzaron un total de 212,77€ durante los 5días examinados. Basados en ese valor, extrapolamos unos beneficios totales de 690.864€. Por lo tanto, los costos de un tratamiento continuo son considerablemente más elevados, principalmente debido a la gran demanda de soluciones para hemofiltración (fig. 5).
DiscusiónEncontramos que en nuestros pacientes tratados exclusivamente con SLED, la mortalidad en la UCI y en el hospital (34 y 45%), así como la mortalidad a un año (55%), eran comparables a los datos publicados con HDFVVC8-10. El resultado a largo plazo demuestra que el 71% de todos los pacientes que sobrevivieron tienen buena calidad de vida (no requieren soporte práctico para sus actividades cotidianas). El 12% de todos los pacientes dados de alta dependieron de diálisis a largo plazo. El índice costo-beneficios de los últimos 5años demuestra un margen positivo total de 208.177€ cuando se utilizó SLED.
Resultados a corto plazoNuestra mortalidad en la UCI y en el hospital correspondiente a los 392 pacientes tratados únicamente con SLED fue del 33,7 y del 44,9%, respectivamente. Comparativamente, un estudio fundamental realizado en 2008 investigó la influencia de la intensidad de la terapia de reemplazo renal sobre la moralidad en la UCI9. En dicho estudio, dependiendo de la condición del paciente, se han comparado diferentes modalidades de TRR (incluyendo SLED), bien sea con un modo intensivo (tratamiento de reemplazo renal intermitente [TRRI] 6veces por semana y TRRC a razón de 35ml/kg de peso de efluente) o con un modo menos intensivo (TRRI 3veces a la semana y TRRC a razón de 20ml/kg de peso de efluente). El punto final primario de este estudio fue la mortalidad a los 60días. La mortalidad fue del 53,6 y del 51,5%, respectivamente, para modos de tratamiento intensivo y menos intensivo, y no hubo diferencia entre modalidades. Se obtuvieron resultados similares en un segundo estudio fundamental en 200910. Dos grupos de estudio recibieron diferentes niveles de intensidad de hemodiafiltración venosa continua. El punto final primario fue la mortalidad a los 90días, que ascendió al 44,7% para cada grupo. Por lo tanto, puesto que nuestra mortalidad en la UCI y en el hospital con tratamiento con SLED está dentro del mismo rango, pareciera que la modalidad de tratamiento de reemplazo renal juega un papel determinante en la mortalidad a corto plazo.
En nuestra base de datos, los niveles de proteínaC reactiva en los pacientes fallecidos (mediana 105mg/dl para el momento de la muerte) son notablemente más altos en comparación con los pacientes que sobrevivieron (mediana 35mg/dl para el momento en que fueron dados de alta) (p < 0,001). Esta observación sugiere marcadamente que en los pacientes fallecidos ha prevalecido una infección activa, lo cual pudiera ser la causa principal de la muerte en pacientes críticamente enfermos con disfunción de múltiples órganos18.
Dentro de este contexto, la IRA ha adquirido importancia, puesto que pudiera inducir cierta inmunosupresión, reforzando una infección persistente19.
Un punto crítico al evaluar el desenlace de pacientes con IRA es la pregunta de cuándo iniciar la terapia de reemplazo renal en el transcurso de la enfermedad. En un estudio retrospectivo de 1999 en 100 pacientes adultos de trauma que fueron tratados con TRRC por IRA, se demostró un beneficio en la sobrevida del inicio precoz de la TRR para el paciente críticamente enfermo. Los pacientes se dividieron en 2grupos: un grupo de «inicio precoz» y un grupo de «inicio tardío», según el nivel de BUN inferior o superior a 60mg/dl antes de iniciar el TRRC. La tasa de sobrevida fue significativamente superior en el grupo de inicio precoz que el grupo control (39% vs. 20%)20. Un estudio clínico prospectivo en pacientes quirúrgicos cardiacos produjo resultados similares: los autores aleatorizaron a 64 pacientes, bien sea a un tratamiento precoz (producción de orina <100ml/8h) o a un tratamiento de inicio tardío (nivel de urea ≥30mmol/l) de hemofiltración venovenosa continua. La mortalidad hospitalaria dentro de los grupos de inicio precoz y tardío fue del 22 vs. el 43%, respectivamente (p<0,05)21. Por lo tanto, ambos estudios sugirieron un beneficio para la sobrevida de pacientes tratados precozmente.
Además, la introducción de los criterios RIFLE, que clasifican la severidad de la insuficiencia renal según el aumento de la creatinina sérica, la disminución del índice de filtración glomerular o a reducción en la producción de orina, conlleva un diagnóstico más temprano de lesión renal aguda con el consiguiente inicio de tratamiento más temprano17. En la actualidad, un nivel diana de urea de 150mg/dl no produce ninguna diferencia en la mortalidad entre un tratamiento intensivo y uno menos intensivo9. La comparación anual de nuestros exámenes químicos de laboratorio en nuestros pacientes mostró una disminución en el nivel de urea para el momento de iniciar la diálisis (de 176mg/dl en 2006 a 131mg/dl en 2010), lo cual concuerda con los datos publicados20,21. Sin embargo, la mortalidad no disminuyó a lo largo de los años. Por lo tanto, los valores objetivo actuales de urea sérica pudieran no ser un marcador adecuado para iniciar y mantener la terapia de reemplazo renal.
Sobrevida a largo plazo, calidad de vida y recuperación renalEn nuestro estudio, 112 de 216pacientes dados de alta respondieron, 77continúan con vida, y de ellos 28 (36%) pertenecen a GOS1 con una buena recuperación. Cincuenta y cinco pacientes (71%) pertenecen a GOS1 y 2 y son autosuficientes en sus actividades cotidianas. Treinta y cinco pacientes murieron luego de ser dados de alta (GOS5). La sobrevida más larga luego de ser dado de alta fue de 58meses, y correspondió a un paciente masculino de 84años de edad que se clasificó en GOS2 sin dependencia de diálisis.
La calidad de vida puede caracterizarse por diferentes variables, pero desde el punto de vista de los pacientes y sus familiares un aspecto primordial es la autosuficiencia para desempeñar las actividades cotidianas. En 2002 se llevó a cabo un gran estudio retrospectivo: una encuesta a 301 pacientes con TRRC en IRA, luego de ser dados de alta del hospital22. La información posterior a salir del hospital estuvo disponible para 267pacientes. El 77% de los pacientes evaluaron su estado de salud actual como bueno a excelente, y el 57% eran autosuficientes, lo cual fue comparable con nuestros resultados.
En función de los datos disponibles en la actualidad, no existe diferencia en términos de la mortalidad hospitalaria entre hemodiálisis intermitente y TRRC8-10. Sin embargo, sí existe cierta variación en la sobrevida a largo plazo, de acuerdo con las distintas poblaciones de pacientes. La mortalidad a un año varía entre el 57 y el 64%23,24. Nuestra población de pacientes es comparable con los estudios publicados anteriormente (SAPSII 41 puntos±11) y la evaluación de nuestros cuestionarios muestra una tasa de mortalidad estimada a un año del 55%.
El resultado renal de largo plazo también se puede evaluar en términos de la tasa de enfermedad renal terminal. Puesto que la adherencia prolongada a diálisis implica un costo considerable para el sistema de salud, cualquier diferencia en la enfermedad renal terminal entre las distintas modalidades de diálisis sería importante. Solo unos pocos estudios se concentran en la función renal a largo plazo después de TRR en la UCI con resultados inconsistentes25,26. Un estudio prospectivo representativo de Suiza demuestra una tasa de enfermedad renal terminal del 10,1% a los 3años cuando se llevó a cabo terapia de reemplazo renal continua en pacientes críticamente enfermos27. El seguimiento de nuestros pacientes tratados con SLED reveló una tasa de enfermedad renal terminal del 12%, lo cual es comparable a los datos publicados con TRRC.
Índice costo-beneficiosEn nuestro análisis de los años 2006 a 2010, el precio de un tratamiento con SLED fue en promedio de 162,25€, y el reembolso, de acuerdo con el catálogo de precios por caso, fue en promedio de 226,36€, generando un margen de contribución positivo de 64,11€ por tratamiento. El costo diario calculado para un tratamiento con HDFVVC fue en promedio de 224,82€ y el reembolso promedio fue de 212,77€, generando un margen negativo de contribución de 12,05€ por día de tratamiento. Por lo tanto, en comparación con la HDFVVC, la SLED resulta en un margen importante de contribución positiva.
Un estudio multicéntrico del año 2010 describe la diferencia de costo entre TRRC y TRRI en 53 centros de 23 países11. En realidad, comparado con el TRRI, el TRRC resultó ser de 289,60$ (media) más costoso por día. Los investigadores del estudio también encontraron que los costos varían ampliamente de una región a otra.
La preparación de un dispositivo Genius90® para diálisis toma aproximadamente 20min, lo cual es mucho menos que para HDFVVC. Por lo tanto, existe una gran aceptación del uso de SLED entre el personal médico28, pues el dispositivo necesita una sesión de instrucción más corta y es fácil de manejar. En nuestro estudio los costos del personal no se tomaron en consideración, porque en Alemania la planificación de personal para la UCI no toma en cuenta ningún tipo de terapia de reemplazo renal.
Una ventaja adicional de un sistema de reemplazo renal intermitente como el SLED es la reducción considerable en el uso de anticoagulantes. Por ejemplo, el uso de heparina para una adecuada anticoagulación en un grupo de SLED fue de una quinta parte, comparado con un grupo de HDFVVC (media de 4.000IE/día vs. 21.100IE/día)29. Por lo tanto, las complicaciones hemorrágicas deben ser mucho menores utilizando SLED en comparación con TRRC, e incluso menores utilizando citrato de sodio30,31.
ResumenA fin de evaluar si el uso de SLED en IRA genera o no resultados comparables a los datos publicados con TRRC, analizamos retrospectivamente nuestros pacientes tratados desde el año 2006 hasta el 2010. Durante dicho período realizamos 3.247 tratamientos con SLED en 421pacientes. La mortalidad en la UCI y en el hospital de estos pacientes tratados exclusivamente con SLED (n=392) fue del 34 y del 45%, respectivamente. La mortalidad acumulada a 1 y 3años fue del 55 y del 60%, respectivamente. La evaluación de resultados a largo plazo reveló una buena calidad de vida en el 71% de los sobrevivientes. Trece pacientes eran dependientes de diálisis en forma permanente. Los costos y beneficios totales correspondientes al tratamiento SLED totalizaron 526.819 y 734.996€, respectivamente. Por lo tanto, en términos de resultados, la SLED es al menos comparable a la HDFVVC estándar. En términos de costo, la SLED pareciera ser el sistema preferido de terapia de reemplazo renal.
FinanciaciónNinguna
Conflicto de interesesT. Neuenfeldt no tiene conflicto de intereses. H.B. Hopf ha sido conferenciante en talleres patrocinados por Fresenius®.