La efectividad del haloperidol en la profilaxis para náuseas y vómito postoperatorios (NVPO) ha sido demostrada en estudios previos resumidos en 2004 por Buttner. Desde entonces ha surgido nueva evidencia, por lo cual nuestro objetivo es actualizar el estado presente del conocimiento en este tema. Se realizó una revisión sistemática y metaanálisis con el fin de aproximarnos a la efectividad y a la seguridad del uso de haloperidol en la profilaxis de NVPO.
MetodologíaLa búsqueda sistemática, la selección de artículos relevantes, la extracción de datos, el análisis crítico de los estudios primarios, las comparaciones y los análisis se realizaron con base en las recomendaciones de Cochrane Collaboration y a través del software RevMan5.
ResultadosDiez experimentos clínicos controlados, publicados entre 1962 y 2010, que incluyen 2.711 pacientes, cumplen los criterios de selección. Comparado con el droperidol (RR: 0,97; IC95%: 0,52-1,79) y con el ondansetrón (RR: 1,24; IC95%: 0,66-2,35), no se encontraron diferencias en la efectividad a las 24h. Se evidencia un efecto protector contra NVPO asociado al uso de haloperidol en diferentes dosis, vías de administración y momentos de administración al comparar frente a placebo. No hay reporte de aumento de efectos adversos de forma significativa.
DiscusiónLa efectividad de haloperidol como profilaxis de NVPO queda sustentada por esta revisión sistemática sin que se logren identificar diferencias estadísticamente significativas cuando se compara con el ondansetrón o el droperidol.
ConclusionesEl haloperidol es un medicamento efectivo y seguro para la profilaxis de NVPO.
The effectiveness of haloperidol for the prophylaxis of postoperative nausea and vomiting (PONV) has been proven in prior trials summarized by Buttner in 2004. New evidence has surfaced since then. Our objective is thus to update the current knowledge on the topic. A systematic review and a meta-analysis were performed, in order to determine the effectiveness and safety of the use of haloperidol as prophylaxis for PONV.
MethodologyThe systematic search, the selection of relevant articles, the extraction of data, the critical analysis of the primary studies, the comparisons and analyses were all based on the recommendations of the Cochrane Collaboration and using RevMan5 software.
ResultsTen controlled clinical trials published between 1962 and 2010, that included 2,711 patients, met the selection criteria. As compared against droperidol (RR: 0.97; 95%CI: 0.52-1.79) and against ondansetron (RR: 1.24; 95%CI: 0.66-2.35), no differences were found in terms of effectiveness after 24hours. A protective effect against PONV associated with the use of haloperidol at varying doses, routes of administration and timing of administration was observed as compared with placebo. No significant increases in adverse events have been reported.
DiscussionThis systematic review supports the effectiveness of haloperidol as prophylactic treatment of PONV. No statistically significant differences were found as compared against ondansetron or droperidol.
ConclusionsHaloperidol is an effective prophylactic drug for PONV.
La náuseas y el vómito postoperatorios (NVPO) son un problema frecuente, asociado a la administración de anestesia y sedación, que se relaciona con insatisfacción del paciente, retraso del alta hospitalaria y admisiones no planeadas1. Otras complicaciones descritas son: dehiscencia y hematoma de herida quirúrgica, desequilibrio hidroelectrolítico, broncoaspiración de contenido gástrico y rotura esofágica2,3.
Los factores de riesgo que se relacionan de forma independiente con NVPO son: género, no consumo de tabaco, cinetosis, antecedente de NVPO y administración de opiáceos en el perioperatorio4,5. La frecuencia de esta complicación varía dependiendo del tipo y duración de la cirugía, del tipo de anestesia, de los fármacos anestésicos y del tratamiento del dolor postoperatorio6.
El haloperidol es un antagonista de los receptores dopaminérgicos D2 utilizado en psiquiatría y en el manejo del delírium en el contexto médico-quirúrgico durante más de 40años7. Pertenece al grupo de las butirofenonas, potentes antieméticos, al igual que el droperidol, uno de los medicamentos más usados y coste-efectivos para el manejo de NVPO hasta la advertencia hecha por la Food and Drug Administration en 2003 acerca de su relación con el desarrollo de arritmias cardiacas8–10. Se ha renovado el interés por la efectividad, la seguridad y el uso de haloperidol para el manejo de NVPO por ser una alternativa asequible y de bajo coste con ventajas teóricas, como vida media prolongada, que le confieren un efecto protector tardío potencial11,12.
Un metaanálisis publicado por Buttner et al. en 20047 evalúa la efectividad del haloperidol en diferentes escenarios, incluido NVPO, encontrando adecuada efectividad sin relación entre la dosis administrada y la magnitud del efecto. Desde entonces se han conocido nuevas evidencias13,14 que evalúan la efectividad del haloperidol15–21, por lo que consideramos pertinente la realización de una nueva revisión sistemática para evaluar la efectividad y la seguridad del haloperidol en la profilaxis de NVPO.
ObjetivosPrincipal- •
Estimar la efectividad del haloperidol como profilaxis de NVPO en adultos sometidos a procedimientos quirúrgicos, diagnósticos o terapéuticos bajo anestesia general, regional o cuidado anestésico monitorizado.
- •
Estimar la frecuencia de efectos adversos asociados a la administración de haloperidol.
- •
Estimar la necesidad de antieméticos terapéuticos después de la administración profiláctica de haloperidol para NVPO.
- •
Evaluar si el riesgo de NVPO se modifica según la vía de administración del haloperidol.
- •
Evaluar si el riesgo de NVPO se modifica según el momento de administración del haloperidol.
- •
Evaluar si el riesgo de NVPO se modifica según la dosis de administración del haloperidol.
Revisión sistemática de la literatura y metaanálisis de experimentos clínicos.
Criterios de inclusión- •
Tipo de estudios. Experimentos clínicos aleatorizados, publicados y no publicados que evalúen la efectividad del haloperidol para la prevención de NVPO.
- •
Tipo de participantes. Pacientes adultos sometidos a procedimientos diagnósticos o terapéuticos bajo anestesia general, regional o sedación.
- •
Tipos de intervención. Haloperidol, en cualquier vía de administración y dosis, administrado en cualquier momento previo a la aparición de NVPO, comparado con placebo, otro fármaco o ningún tratamiento. El fármaco podía administrarse en el preoperatorio, durante la inducción de la anestesia, en el periodo intraoperatorio o postoperatorio (antes de que aparezcan náuseas y/o vómito).
- •
Tipo de desenlaces. Incidencia de náuseas, vómito, NVPO, necesidad de medicamentos de rescate, trastornos en el segmento Q-T y cualquier efecto adverso asociado con el haloperidol.
- •
Estudios que evalúen terapias combinadas en el grupo del haloperidol, sin especificar los efectos antieméticos por separado.
- •
Estudios con menos de 20 participantes.
Se realizó una búsqueda electrónica de la literatura en las bases de datos Medline, EMBASE, CINAHL y The Cochrane Controlled Trials Register. La búsqueda utilizó una combinación de palabras clave (descrita en términos de búsqueda) y un filtro recomendado en la sección Clinical Queries de Medline que tiene una sensibilidad del 93% y una especificidad del 97% para encontrar experimentos clínicos aleatorizados. La búsqueda no tuvo restricciones de idioma o año de publicación.
Términos de búsqueda- 1.
(MESH) AND haloperidol (MESH) or postoperative (ALL FIELDS) AND nausea (ALL FIELDS) AND vomiting (ALL FIELDS) AND Haloperidol (ALL FIELDS) MeSH-NAUSEA OR NAUSEA* OR INAPPETENCE
- 2.
MeSH-VOMITING OR VOMIT* OR EMESIS OR EMET*
- 3.
MeSH-POSTOPERATIVE NAUSEA AND VOMITING OR POSTOPERATIVE NAUSEA AND VOMITING
- 4.
Randomised Controlled Trials
- 5.
#1 OR #2 OR #3
- 6.
MeSH-POSTOPERATIVE OR POST-OPERATIVE
- 7.
MeSH-ANESTHESIA OR ANAESTHESIA OR ANESTHET* OR ANAESTHET*
- 8.
MeSH-HALOPERIDOL
Filtro: (randomized controlled trial [Publication Type] OR (randomized[Title/Abstract] AND controlled[Title/Abstract] AND trial[Title/Abstract]).
Se realizó búsqueda de literatura no publicada contactando a los autores más representativos y a la industria farmacéutica productora de haloperidol. Se realizó una búsqueda en las referencias de los artículos seleccionados, de las guías de práctica clínica de NVPO, de editoriales y de artículos de revisión relevantes.
La búsqueda fue realizada por 2 investigadores independientes y las discrepancias se resolvieron por consenso.
Selección de los estudiosSe revisaron los títulos de los artículos encontrados en la búsqueda para identificar los artículos relevantes. Después se realizó una selección por resumen y se intentó obtener el artículo, en texto completo, de los seleccionados. Se aplicaron los criterios de inclusión y exclusión por 2 autores independientes y las diferencias se resolvieron por consenso.
Extracción de datosLos artículos seleccionados fueron revisados por 2 investigadores independientes para extraer la información acerca de los participantes, las intervenciones y los desenlaces planteados. Las diferencias se resolvieron por consenso.
Evaluación de calidad de los estudios incluidosLa evaluación de la calidad de los estudios seleccionados se realizó utilizando el instrumento propuesto en GRADE Guidelines (Guyatt G.H.) y la lista de chequeo CONSORT 2010 Statement (Murphy J.F.) para evaluación de experimentos clínicos controlados. Esta evaluación fue realizada por 2 evaluadores independientes y las diferencias se resolvieron por consenso.
Análisis de datosInicialmente se realizó un análisis descriptivo de la información extraída y de la calidad de los estudios primarios. El análisis cuantitativo se hizo a través del software RevMan5 de la colaboración Cochrane.
Manejo de datos faltantesSe intentó contactar con los autores para obtener los datos faltantes de los estudios primarios. Si no era posible obtener los datos, estos no se incluían en el análisis. Los estudios seleccionados sin acceso a texto completo (Maggi y Dyberg) fueron incluidos; aunque no fue posible hacer el análisis de calidad planeado, los datos se obtuvieron de la revisión sistemática publicada en 2004 por Buttner. Se decidió incluir estos datos porque el tamaño de la muestra de las referencias en cuestión es representativo para el análisis. Se realizó un análisis de sensibilidad excluyendo estos artículos para medir su influencia en el estimativo global de efectividad.
Aproximación a la heterogeneidadClínicaSe realizó una exploración visual basándose en el análisis descriptivo de los artículos incluidos para estimar la variabilidad de los datos demográficos y los factores de riesgo para NVPO. Se ajustaron las variables clínicamente significativas por análisis de sensibilidad.
La medición del efecto en los estimativos metaanalíticos se hizo a través del modelo de efectos aleatorios. La estimación de heterogeneidad se realizó por la prueba I2.
Análisis de subgruposSe realizó análisis de subgrupos por tiempo de medición de desenlaces, tipo de antiemético de control, tiempo de administración de haloperidol y vía de administración de haloperidol.
Análisis de sensibilidadSe realizó un análisis de sensibilidad para evaluar el impacto de los datos incluidos provenientes de artículos no recuperados en texto completo y con base en la calidad metodológica de los estudios primarios.
ResultadosSe identificaron 395 artículos a través de nuestra estrategia de búsqueda. Se seleccionaron 38 artículos por título y resumen, 3 de los cuales se repetían en todas las bases de datos, 12 más se repetían en 2 de las bases de datos consultadas y 5 artículos estaban en una sola de las bases de datos. De los 20 artículos originales obtenidos, 7 fueron excluidos por terapia combinada en el grupo de haloperidol sin análisis diferencial, 2 fueron excluidos por uso de haloperidol terapéutico —no profiláctico— y otro artículo fue excluido por no considerar el escenario de NVPO. Al final del proceso de selección se obtuvieron 10 artículos, los cuales se intentaron recuperar en texto completo a través de la biblioteca de la Pontificia Universidad Javeriana.
En los casos donde no fue posible obtener el texto completo se intentó contactar con los autores. Sin embargo, no fue posible obtener el texto completo de los artículos de Dyberg 1962 y Maggi 1964; la frecuencia de desenlaces se obtuvo de la revisión sistemática publicada por Buttner en 2004. No se realizó el análisis de calidad de estos experimentos, pero con todo se incluyeron en el análisis dado que su tamaño de muestra es representativo.
Durante la búsqueda manual no se identificaron estudios adicionales. Como resultado de la comunicación establecida con Jansen, la industria farmacéutica productora de haloperidol, y con el autor Koung-Shing Chu, del Departamento de Anestesiología del Kaohsiung Medical University Hospital de Kaohsiung (Taiwán), no se encontraron estudios adicionales no publicados.
Características de los estudios incluidosSe analizaron 10 estudios publicados desde 1962 hasta 2010, con 2.711 participantes. La edad de los participantes oscila entre 15 y 75 años. Uno de los estudios se realizó en población llevada a colecistectomía laparoscópica (Chu), 2 estudios en cirugía laparoscópica ginecológica (Aouad y Wang), otro artículo en cirugía ginecológica abierta (Chu) y el resto incluía población quirúrgica mixta. Las dosis de haloperidol utilizadas variaban entre 0,25 y 5mg.
El momento de administración de la profilaxis de NVPO fue después de la inducción anestésica en 4 estudios y en el intraoperatorio en otros 4 estudios. Dos estudios no especificaban el momento de administración y no fue posible obtener esta información al intentar contactar con los autores.
Los medicamentos utilizados como control fueron ondansetrón, droperidol, dexametasona y placebo.
Los desenlaces incluidos en los estudios fueron incidencia de náuseas, vómito y NVPO, evaluados a las 2, a las 4, a las 6 y a las 24horas. Así mismo, la necesidad de antieméticos de rescate y la prolongación del intervalo QT.
Calidad de los estudios incluidosNo logramos obtener datos acerca de la calidad de los experimentos publicados por Dyberg en 1962 y Maggi 1964. Los datos acerca de los desenlaces fueron tomados del metaanálisis publicado por Buttner en 2004 y de los anexos a esta revisión publicados en internet22–25.
Todos los estudios incluidos son experimentos clínicos aleatorizados. Seis de los estudios incluidos reportan pérdidas al seguimiento, pero ninguna de estas pérdidas tuvo repercusión en la validez de los resultados. Dos de los estudios no tienen pérdidas al seguimiento y otros 2 estudios no reportan datos relacionados. Solo 3 estudios utilizan análisis por intención de tratar; el resto no reportan datos relacionados26–29.
Ocho de los estudios incluidos reportan cegamiento de los participantes, 8 estudios cegamiento de los médicos tratantes, y 6, de los evaluadores. Seis de los estudios especifican el desarrollo y el cegamiento de la aleatorización26–34.
La calidad de los experimentos y la cantidad de información reportada en los artículos mejoró en función del año de publicación, probablemente por la creación de listas de chequeo que facilitan a los investigadores la organización y la articulación de los reportes de los experimentos. Para esta revisión sistemática los artículos incluidos son de mediana y alta calidad. Ocho de los 10 artículos cumplen con 5 o más de los 7 ítems evaluados por la escala de Guyatt. Los 2 artículos restantes (Tornetta y Maggi) no cumplen con los criterios de calidad evaluados. La evaluación de calidad propuesta por CONSORT aplicada a nuestro metaanálisis resalta que 5 artículos cumplen con al menos 11 de los ítems, un artículo cumple 9 de los ítems y en 2 artículos (Dyberg y Maggi) no hay datos disponibles para aplicar la evaluación de calidad.
Dada la heterogeneidad clínica explicada por la diversidad en las intervenciones control, decidimos realizar un análisis de subgrupo por tipo de control.
Haloperidol contra placeboSeis de los estudios incluidos comparan haloperidol contra placebo como profilaxis de NVPO. En general los reportes favorecen el uso de haloperidol, pero no fue posible realizar la síntesis cuantitativa por la gran heterogeneidad clínica explicada por la variedad de dosis usadas. Por lo tanto, decidimos hacer el análisis por dosis.
Haloperidol 0,25mgSolamente Tornetta (1972) evaluó el efecto profiláctico de haloperidol 0,25mg por vía intramuscular 45min antes de la inducción anestésica (fig. 1).
No hay diferencia estadísticamente significativa en la incidencia de NVPO en las primeras 6h del postoperatorio, único momento evaluado. Sin embargo, Buttner reporta que no hay diferencia significativa para NVPO a las 24h (RR: 0,57; IC95%: 0,18 a 1,28 para náuseas y RR: 0,85; IC95%: 0,4 a 1,79 para vómito).
Haloperidol 0,5mgSolamente Tornetta utilizó haloperidol 0,5mg por vía intramuscular 45min antes de la cirugía (fig. 2).
El grupo control tiene mayor número de participantes. Este estudio se realizó en 2 fases: la fase inicial incluyó 4 grupos determinados por dosis de 0,5, 1 y 2mg, comparados con placebo, y la segunda fase evaluó dosis de 0,25 y de 4mg comparados con placebo.
Existe diferencia significativa en la prevención de NVPO a las 6h. Según Buttner, el análisis diferencial de incidencia de náuseas y vómito a las 24h muestra fue RR: 0,48; IC95%: 0,24 a 0,96 para náuseas y RR 0,28; IC95%: 0,08 a 0,63 para vómito. No hay reducción diferencial en la incidencia de náuseas o vómito.
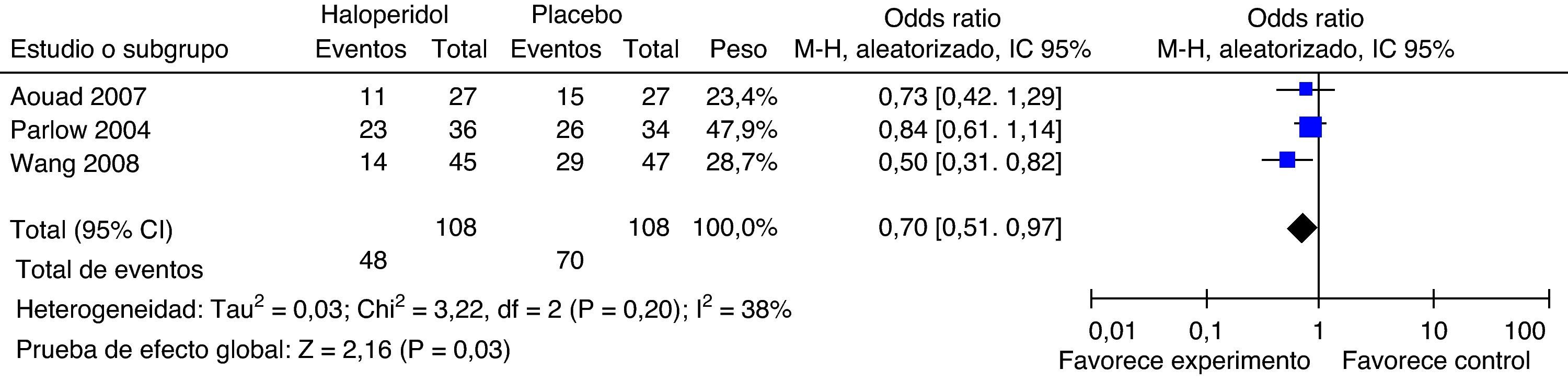
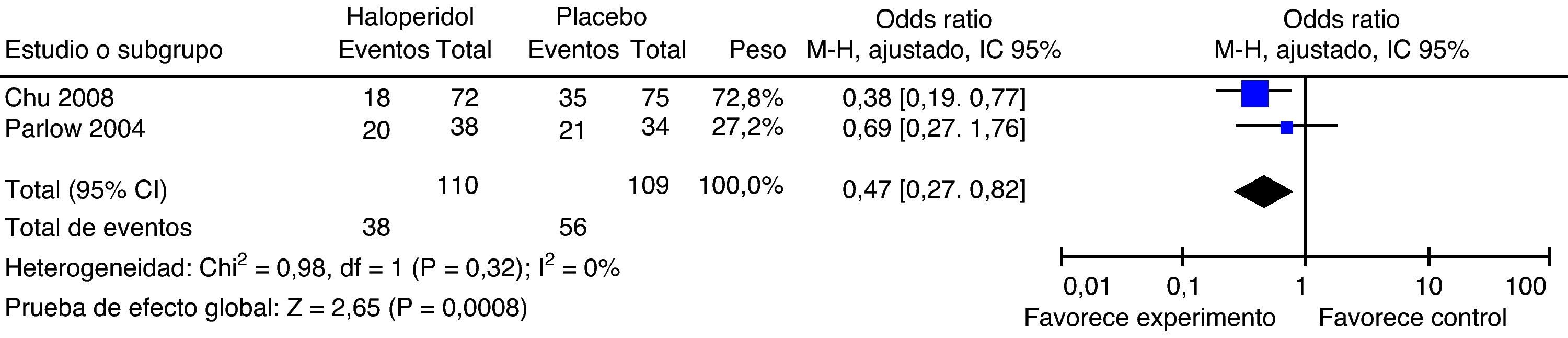
Haloperidol 1mg (fig. 3)Aouad estudió participantes sometidos a cirugía laparoscópica; Parlow, a cirugía urológica y de miembros inferiores bajo anestesia regional con morfina intratecal, y Wang, a laparoscopia ginecológica. El efecto total muestra beneficio con la administración de haloperidol 1mg en la prevención de náuseas y vómito a las 24h. Existe moderada heterogeneidad, probablemente explicada por el estudio de Parlow (anestesia asociada a morfina intratecal), con riesgo basal de NVPO diferente a los otros estudios incluidos en la comparación. Sin embargo, no conocemos la diferencia de riesgo de NVPO entre diferentes tipos de cirugía y técnicas anestésicas.
La vía de administración de haloperidol en los estudios de Aouad y Wang es intravenosa y en el estudio de Parlow es intramuscular, lo que podría significar heterogeneidad. Excluimos de este análisis el estudio de Tornetta porque solo evalúa el desenlace a 6h.
En conclusión, existe una reducción del riesgo de NVPO del 30% con haloperidol comparado contra placebo (IC95%: 0,3 a 49; p=0,03).
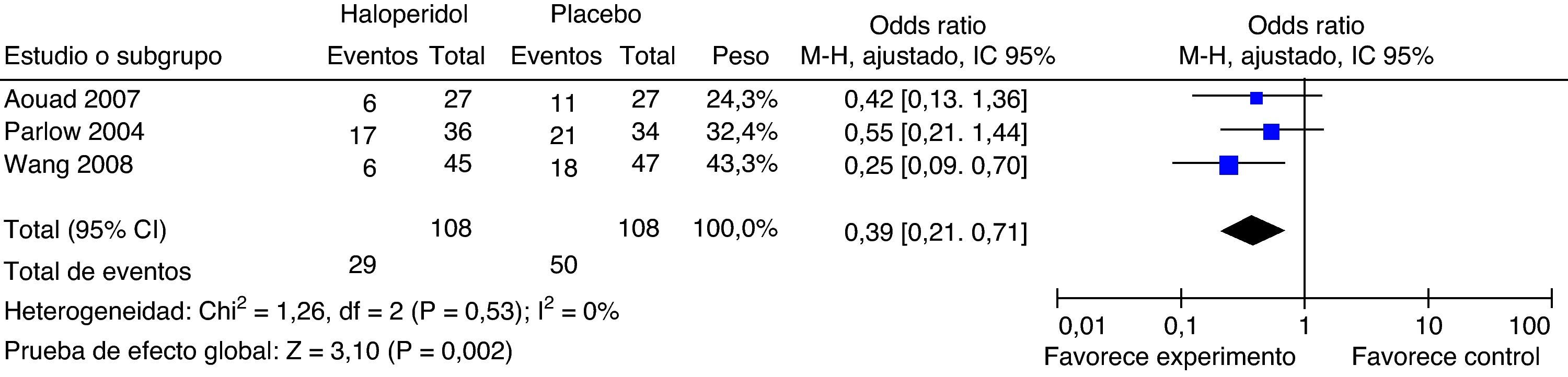
Necesidad de antieméticos de rescateEn el estudio de Aouad los pacientes recibieron inicialmente prometacina 12,5mg y ondansetrón 4mg intravenoso si los síntomas persistían. En el estudio de Parlow, difenhidrinato 50mg intravenoso y, si persistían los síntomas, procloperazina 10mg y ondansetrón 4mg intravenoso. En el estudio de Wang no se especifican los antieméticos de rescate (fig. 4).
El haloperidol disminuye en un 60% la necesidad de antieméticos de rescate. El mayor efecto se evidencia en el estudio de Wang, que tiene mayor peso en el análisis por su mayor tamaño de muestra. La incertidumbre en los otros 2 estudios se debe al pequeño tamaño de muestra, pero el estimativo puntual está a favor de haloperidol. No hay heterogeneidad entre los estudios incluidos en este análisis.
Intervalo QTLos estudios de Aouad y Wang miden el intervalo Q-T y no encuentran aumento en la medición después de administrar haloperidol. Wang lo hace 10min después de la administración del medicamento y Aouad al final de la cirugía.
SedaciónLos estudios de Aouad y Wang midieron sedación hasta 2h posterior a la cirugía, con la escala de clasificación numérica de 0 a 10, y no hubo diferencias entre las puntuaciones de sedación de los grupos.
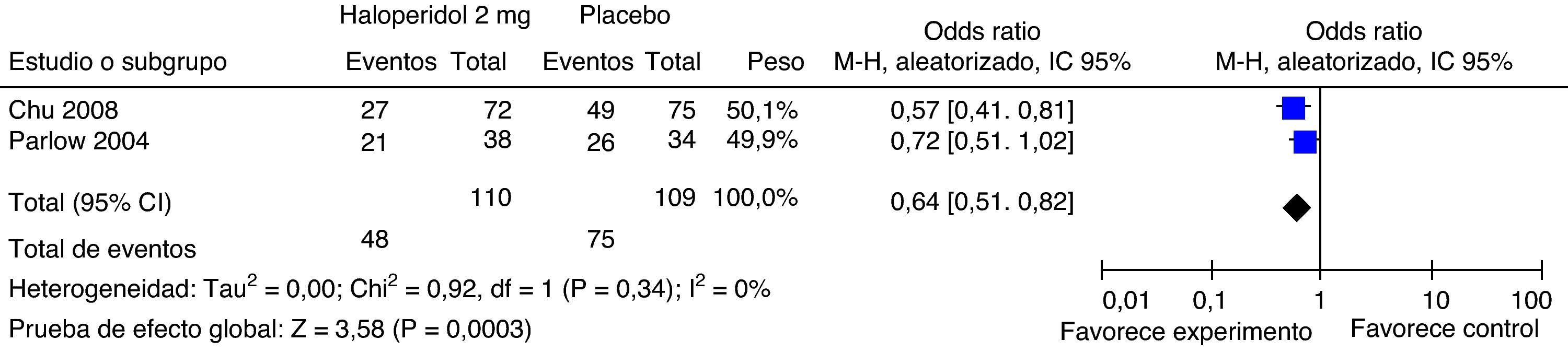
Haloperidol 2mg (fig. 5)En este análisis se incluyen 2 estudios que comparan la efectividad de haloperidol 2mg contra placebo como profilaxis de NVPO a las 24h. El estimativo global favorece al grupo haloperidol, con significación estadística, reducción de la incidencia de NVPO del 34% a las 24h con IC95%: 18-49. El efecto es igual para náuseas (0,71; IC95%: 0,51 a 0,99) y el vómito (0,61; IC95%: 0,41 a 0,89).
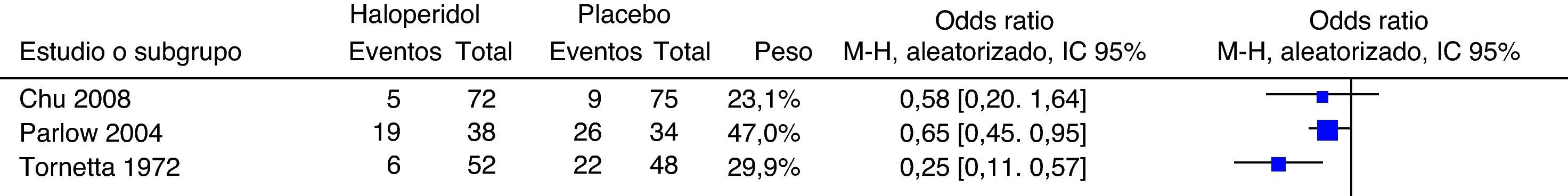
Haloperidol 2mg contra placebo en las primeras 12h (fig. 6)En este análisis incluimos los desenlaces medidos a las 2h por Chu, a las 12h por Parlow y a las 6h por Tornetta. Dada la heterogeneidad, no fue posible realizar síntesis metaanalítica. Sin embargo, en 2 de los estudios se evidencia el efecto protector del haloperidol a las 6 y 12h. No hay diferencia estadísticamente significativa en la incidencia de NVPO en las primeras 2h.
Necesidad de antieméticos de rescate (fig. 7)Chu utilizó ondansetrón 4mg como medicación de rescate y Parlow difenhidrinato 50mg intravenoso, y si persistían los síntomas, procloperazina 10mg y ondansetrón 4mg intravenoso. Se evidencia reducción en la necesidad de medicamentos de rescate en los pacientes que recibieron haloperidol comparado con placebo en un 53% (IC95%: 18 a 73).
Intervalo QTChu mide el intervalo QTc antes y 10min después de la administración de haloperidol. No se reportaron cambios de longitud del intervalo después de la administración de medicamentos.
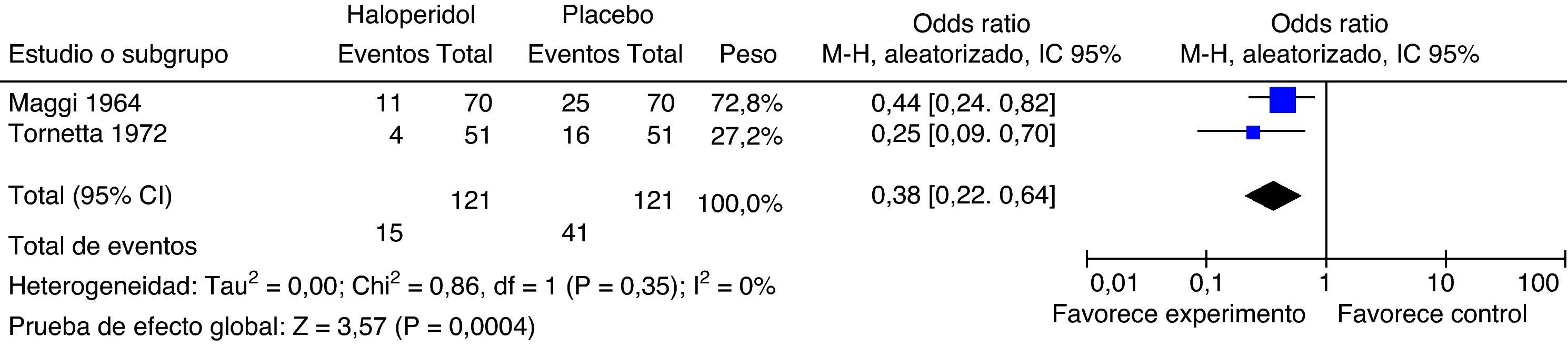
Haloperidol 4mgLos estudios que comparan haloperidol 4mg contra placebo son Tornetta (1972) y Maggi (1964). Los datos son tomados del metaanálisis de Buttner (2004) (fig. 8).
Maggi aleatorizó 140 pacientes a recibir haloperidol 4mg o placebo al finalizar la cirugía. Tornetta administró 4mg de haloperidol por vía intramuscular antes de la inducción anestésica. Se observa reducción del 38% en la incidencia de náuseas y vómito postoperatorio IC95%: 36 a 78). A pesar de la diferencia de las vías de administración, se mantiene el efecto.
Haloperidol 5mgDyberg evaluó la efectividad de haloperidol 5mg intravenoso, administrado durante la cirugía, como profilaxis de NVPO en población quirúrgica mixta. El seguimiento se realizó durante 24h. Los datos son tomados de la revisión sistemática de Buttner y muestra reducción del riesgo de náuseas del 63% (IC95%: 54 a 70; p<0,00001) y reducción del 70% (IC95%: 59 a 78; p<0,00001).
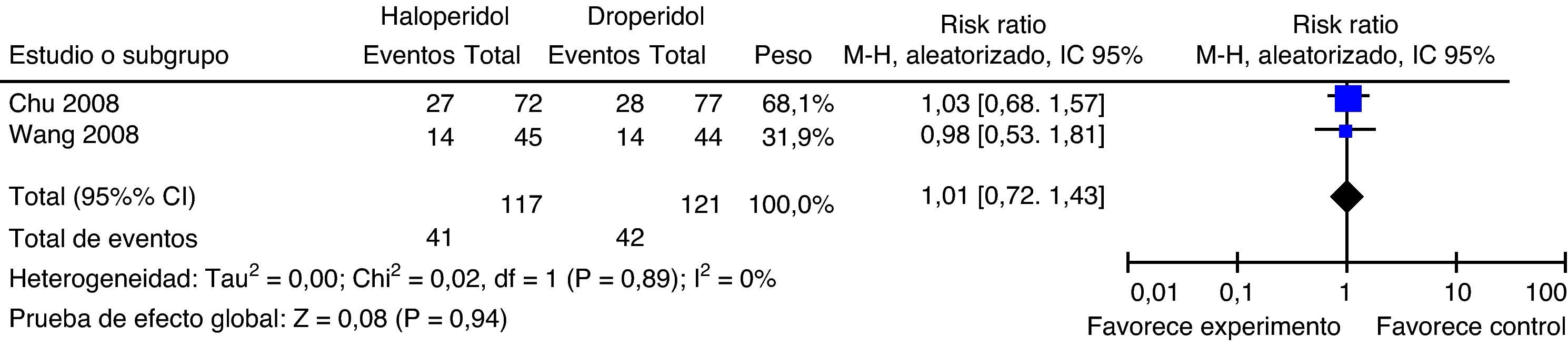
Haloperidol contra droperidolChu y Wang comparan la efectividad de haloperidol y droperidol para profilaxis de NVPO. Chu incluyó mujeres mayores de 18 años sometidas a histerectomía vaginal asistida por laparoscopia, y compara haloperidol 2mg contra droperidol 1,25mg intravenosos, 15min después de la inducción anestésica. Wang aleatorizó mujeres adultas sometidas a laparoscopia ginecológica, a haloperidol 1mg o droperidol 0,625mg intravenosos, 15min antes de la inducción anestésica.
Incidencia de náuseas y vómito postoperatorios a las 24h (fig. 9)No hay diferencia en la incidencia de NVPO a las 4h (RR: 0,97; IC95%: 0,52 a 1,79; p=0,91), ni entre las 4 y 24h (RR: 0,99; IC95%: 0,64 a 1,53; p=0,96).
Necesidad de medicamentos de rescateEn ambos estudios se administró ondansetrón 4mg intravenosos, como medicación de rescate, a los pacientes que reportaban náuseas intolerables y vómito (fig. 10).
No hay diferencia estadísticamente significativa en la necesidad de medicamentos de rescate entre grupos, en ambos estudios. La medición de este desenlace se realizó a las 4h en el estudio de Wong y a las 24h en el estudio de Chu.
Intervalo QTcNo se reportó ningún caso de prolongación del intervalo QTc, ni cambios en la longitud del intervalo antes y después de la administración de los antieméticos.
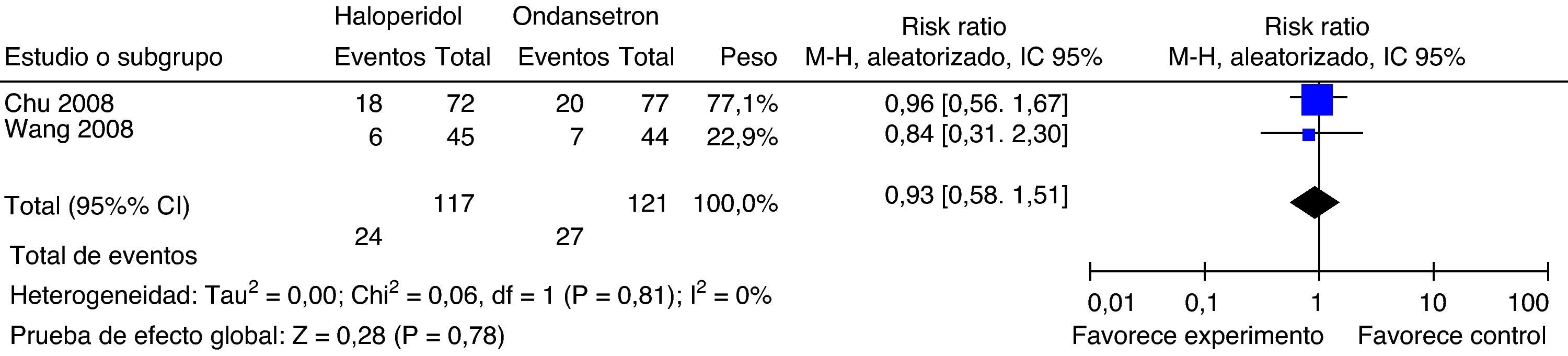
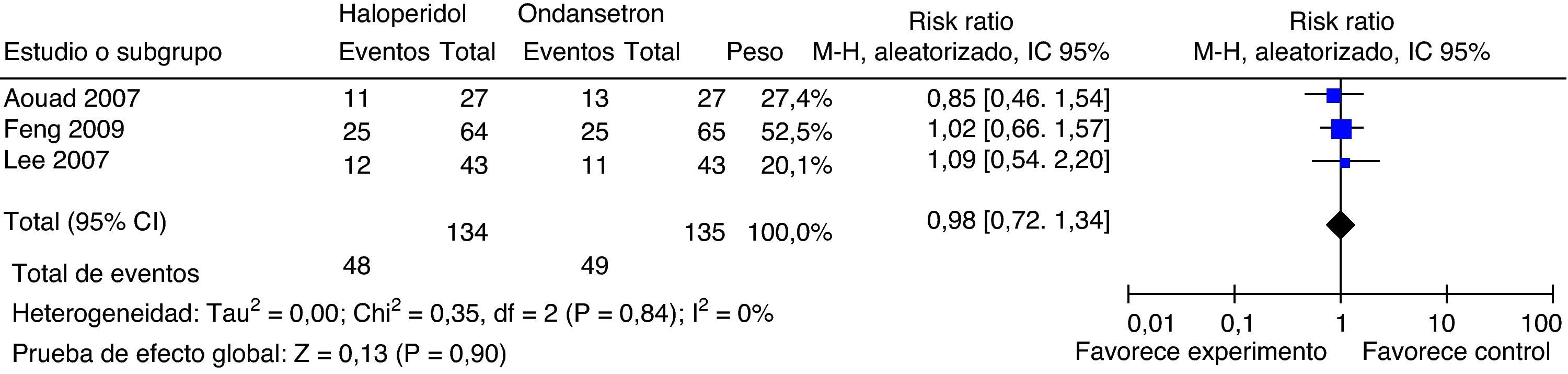
Haloperidol contra ondansetrónIncidencia de náuseas y vómito postoperatorios a las 24hTres estudios compararon la efectividad del haloperidol y del ondansetrón en la profilaxis de NVPO. Aouad aleatorizó mujeres adultas sometidas a cirugía ginecológica a recibir haloperidol 1mg u ondansetrón 4mg por vía intravenosa, 10min después de la inducción anestésica. Feng aleatorizó hombres y mujeres sometidos a colecistectomía laparoscópica a recibir haloperidol 2mg, 30min antes de terminar la cirugía u ondansetrón 4mg después de la inducción anestésica. Lee aleatorizó población quirúrgica mixta, bajo anestesia general, a recibir haloperidol 2mg u ondansetrón 4mg por vía intravenosa 30min antes de terminar la cirugía (fig. 11).
No existe diferencia estadísticamente significativa en la incidencia de NVPO a las 24h, ni en la incidencia de náuseas (RR: 0,86; IC95%; 0,57 a 1,29; p=0,46) o en la incidencia de vómito (RR: 1,24; IC95%: 0,66-2,35; p=0,5) a las 24h.
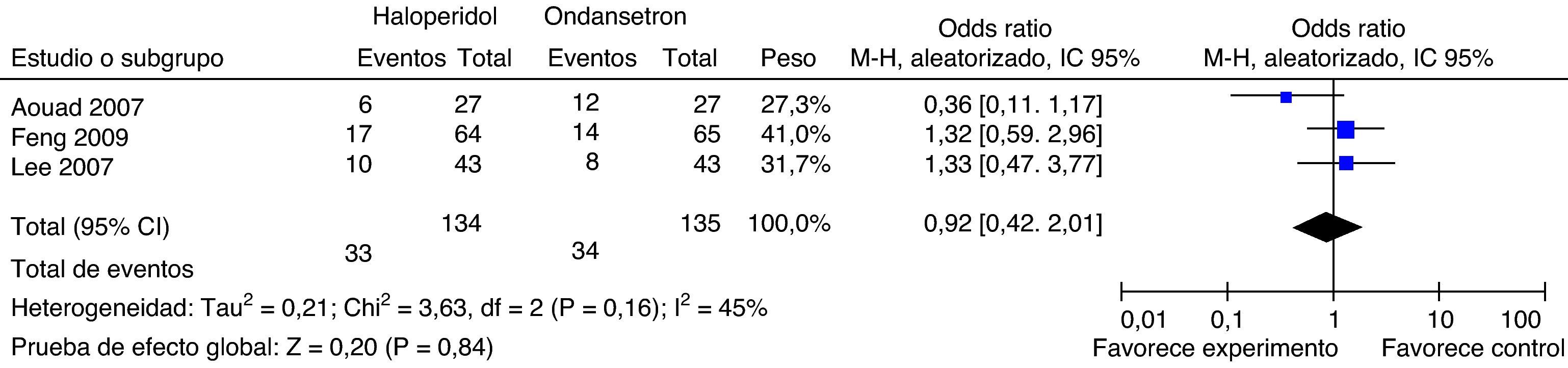
Medicamentos de rescateLos participantes recibieron como medicación de rescate prometacina 12,5mg intravenosa en el estudio de Aouad, si presentaban una puntuación mayor de 2/10 en la escala de clasificación de náuseas por más de 10min. Si los síntomas persistían por más de 10min se administraba una dosis adicional de ondansetrón 4mg. En el estudio de Lee administraron como rescate 25mg intravenosos de metoclopramida si presentaban un episodio de náuseas moderadas a severas o vómito severo. En el estudio de Feng administraron como rescate 10mg intramusculares de metoclopramida si presentaban puntuaciones de náuseas mayores de 5/10, si vomitaban o si el paciente lo solicitaba (fig. 12).
No existe diferencia en la necesidad de medicamentos de rescate a las 24h.
Intervalo QTAouad y Lee no encontraron ningún participante con intervalo QTc mayor a 470msg o disritmia cardiaca. No se encontraron cambios en la longitud del intervalo QTc antes y después de la administración de los antieméticos.
ExtrapiramidalismoNingún participante en estos 3 estudios presentó efectos extrapiramidales.
Tiempo de administración de haloperidolYang, en 2008, tenía como objetivo medir el efecto del tiempo de administración del haloperidol en la efectividad como profilaxis antiemética. En este estudio participaron 94 pacientes de entre 20 y 65 años, programados para cirugía ginecológica, de tiroides, de seno o plástica. Un grupo recibió haloperidol 2mg intravenoso al inicio de la cirugía y placebo 2ml al final de la cirugía. El otro grupo recibió 2ml de placebo intravenoso al inicio de la cirugía y 2mg de haloperidol intravenoso al final de la cirugía. No se encontraron diferencias estadísticamente significativas en la incidencia de náuseas, vómito, NVPO, ni necesidad de antieméticos de rescate a las 2h y entre las 2 y las 24h. Tampoco hay diferencia en las puntuaciones de sedación a las 2h.
DiscusiónSe identificaron 10 experimentos clínicos controlados que incluían 2.711 pacientes aleatorizados a haloperidol o terapia control. Se realizaron esfuerzos por identificar estudios no publicados y no se excluyeron artículos por año de publicación, idioma en que se reportó o estrategia de búsqueda usada. La búsqueda manual de referencias, el contacto con la industria farmacéutica y autores reconocidos en el tema no arrojó artículos no identificados en la estrategia de búsqueda electrónica.
La efectividad del haloperidol como profilaxis de NVPO queda sustentada por esta revisión sistemática, sin que se logren identificar diferencias estadísticamente significativas cuando se compara con ondansetrón o droperidol.
No logramos, a la luz de la evidencia disponible, aproximarnos al efecto diferencial del haloperidol con base en la duración, el tipo de cirugía y el tipo de anestesia. Existe heterogeneidad clínica por los diferentes riesgos basales de los participantes en los estudios (género, antecedente de tabaquismo, antecedente de NVPO o cinetosis, uso de opiáceos en el perioperatorio), por las diferentes dosis administradas, por los momentos de administración, por las vías de administración, por el tipo de cirugía, por la duración del procedimiento y por el tipo de anestesia. Sin embargo, esta población quirúrgica, diversa en características importantes para el desenlace, puede aumentar la generalizabilidad de los resultados uniformemente consistentes a favor del haloperidol35–37.
No se incluyeron estudios primarios en los que el haloperidol se combinara con otro mecanismo de acción (profilaxis combinada) en el mismo grupo, sin que se evaluara el efecto de forma diferencial para el mismo grupo. Sin embargo, en pacientes de riesgo moderado-alto de NVPO, la combinación de 2 o más mecanismos de acción puede mejorar los desenlaces en el postoperatorio. No se pueden extrapolar estos resultados a pacientes que requieran profilaxis combinada, un grupo de personas que probablemente se beneficiarían aún más del uso profiláctico del haloperidol.
La disponibilidad y el coste de los antagonistas serotoninérgicos, como el ondansetrón, han mejorado en los últimos años para diferentes países (alternativas genéricas de menos de 1dólar o equivalente), por lo que estudios económicos formales deberían realizarse para evaluar el coste-efectividad de estas 2 alternativas (haloperidol y ondansetrón) en nuestro país38–40.
ConclusiónEs contundente el efecto benéfico del haloperidol para la prevención de NVPO en las primeras 24h del postoperatorio. A pesar de las diferentes dosis administradas y diversos momentos y vías de administración usadas en los estudios incluidos, los resultados son consistentes a favor de su efectividad. La dosis mínima efectiva es de 0,5mg, y la efectividad es incremental en función de la dosis. Este incremento se aprecia mejor al aumentar la dosis de 2 a 4mg, aunque se requieren estudios adicionales para aproximarse a la seguridad de estas dosis. Sin embargo, dosis de 1 a 2mg son una alternativa segura y efectiva para la profilaxis de NVPO. La dosis de haloperidol empleada para profilaxis de NVPO es menor que la empleada en el tratamiento de enfermedades psiquiátricas, contexto en el cual es ampliamente usado de forma crónica. Es por esto que dosis menores y únicas no deberían asociarse a complicaciones serias, como arritmias, que aumentan los riesgos y los costes en la unidad de cuidados postanestésicos, durante la estancia hospitalaria postoperatoria o en el contexto ambulatorio.
Adicionalmente, al compararlo con otros antieméticos disponibles, como la dexametasona y el ondansetrón, el haloperidol se constituye en una alternativa efectiva y segura en la profilaxis de NVPO. Su bajo costo y su vida media prolongada podrían hacerlo más atractivo en el contexto perioperatorio. Se requieren estudios de coste-efectividad en nuestro medio para tener conclusiones definitivas al respecto.
FinanciaciónLos gastos fueron asumidos por el Departamento de Anestesiología, Facultad de Medicina, Pontificia Universidad Javeriana, y por recursos propios de los autores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses. Todos los autores desempeñan labores asistenciales y académicas no asociadas a la producción o venta de medicamentos.