Se presenta el caso de una paciente con hemorragia posparto (HPP) secundaria a atonía uterina, tratada con misoprostol 1.000μg por vía sublingual, y el curso de su evolución, en la que la hiperpirexia como efecto secundario por la vía de administración elegida, y la presentación clínica, generan dificultad diagnóstica e intervenciones especiales dentro del proceso de manejo. Se realiza una revisión de la literatura acerca del misoprostol, sus perfiles farmacocinéticos y sus efectos secundarios. Se concluye que el misoprostol, administrado por vía sublingual, procura la concentración máxima más alta y se asocia con la incidencia más alta de efectos secundarios en comparación con otras vías.
This is a patient with post-partum hemorrhage (PPH), secondary to uterine atony managed with sub-lingual misoprostol 1000μg. Hyperpyrexia resulting from the route of administration of the drug and the clinical presentation of the condition, give rise to diagnostic difficulties and special interventions during the management process. A literature review on misoprostol, its pharmacological profile and side effects concluded that sub-lingual misoprostol results in a maximum concentration and is associated with the highest incidence of side effects as compared to other routes of administration.
En 2003 la Federación Internacional de Ginecología y Obstetricia (FIGO) calificó la hemorragia posparto (HPP) como entidad de máxima prioridad mundial e indicó la implementación de estrategias para su prevención, diagnóstico temprano y tratamiento oportuno1.
Para el año 2005, estadísticas de la Organización Mundial de la Salud (OMS) informaron razones de mortalidad materna asociadas a complicaciones del embarazo, del parto y del puerperio de hasta 450 por 100.000 nacidos vivos en países en vía de desarrollo, y de 9 por 100.000 nacidos vivos en países desarrollados1. Estadísticas nacionales muestran que en Colombia, para el año 2006, la hemorragia obstétrica fue la segunda causa de muerte materna, precedida por trastornos hipertensivos propios del embarazo2.
La FIGO y la OMS recomiendan el alumbramiento activo en todas las mujeres. En el manejo de la atonía uterina, la primera opción terapéutica es la administración de uterotónicos (oxitocina) junto con la reposición de volumen (cristaloides o hemoderivados); las prostaglandinas son la segunda línea de tratamiento. Si no hay respuesta, el manejo continúa con intervenciones quirúrgicas: técnica de B-Lynch, ligadura de arterias uterinas e histerectomía3,4.El mantenimiento de los mecanismos del control de la temperatura diferencia los procesos fisiopatológicos en la fiebre y la hipertermia; en la fiebre y en la hiperpirexia (>41°C) estos mecanismos se conservan, por elevación del punto de ajuste de temperatura a nivel hipotalámico, mientras en la hipertermia se pierden: en esta el punto de ajuste hipotalámico está en niveles normotérmicos, y entonces la producción de calor excede la pérdida de este5.
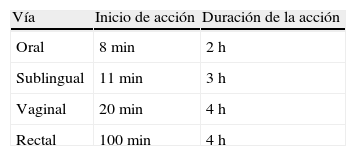
El misoprostol es un análogo sintético de la prostaglandina E1, con efecto uterotónico y de maduración cervical. Seguro, estable a temperatura ambiente, con pocos efectos secundarios, accesible y económico, sin embargo su uso sin supervisión puede generar complicaciones y teratogenicidad. Sus aplicaciones clínicas incluyen: aborto médico, maduración cervical, inducción del parto y hemorragia posparto. Puede ser administrado por vía oral, vaginal, sublingual o rectal. Su perfil farmacocinético, según la vía de administración, se muestra en la tabla 16.
En Ecuador, un estudio que evaluó 163 mujeres a quienes se administró misoprostol sublingual para el manejo de la HPP mostró efectos secundarios asociados a la vía de administración, evidenciando temperaturas corporales de más de 40°C, sin conseguir explicar el mecanismo fisiopatológico de esta asociación; estudios similares, en otro tipo de poblaciones, no han arrojado resultados de comportamiento similares a los descritos5.
Materiales y métodosSe realizó una búsqueda bibliográfica en las bases de datos electrónicas de: MEDLINE/PubMed, Lilacs, Scielo, Ovid, Elsevier, y Cochrane, con los términos «hiperpirexia por misoprostol», «misoprostol, vía sublingual», «HPP». Se buscaron artículos de revisión, series de casos y reportes de casos publicados entre 2000 y 2010.
Reporte de casoPaciente de 30 años, G3P1C0A1V1, con gestación de 40 semanas, admitida al servicio de urgencias en trabajo de parto. Antecedentes de migraña, controles prenatales normales, sin otras comorbilidades ni factores de riesgo establecidos. En la consulta inicial, con signos vitales: FC 80lpm, FR 16rpm, PA 110/70mmHg, en trabajo de parto fase latente, hospitalizada para atención de parto, progresa sin complicaciones. Se atiende parto eutócico vaginal, presentando en el periodo postalumbramiento inmediato un episodio de sangrado genital de origen endouterino profuso, de aproximadamente 800cc. Se activa código rojo, iniciando manejo activo con uterotónicos (oxitocina), reanimación volumétrica con cristaloides y 1.000μg de misoprostol por vía sublingual, con buen control del sangrado y estabilización hemodinámica. Tras una hora del manejo descrito la paciente presenta episodio febril (41°C), hipotensión (PA 70/40mmHg) y taquicardia (FC 200lpm), glucometría 120mg/dl, electrocardiograma: taquicardia supraventricular, y posterior alteración del sensorio (desorientación). Se considera como primera opción el diagnóstico «reactivación de sangrado posparto». Es llevada a revisión del canal del parto sin evidenciar pérdidas activas; continúa el manejo con hidratación intravenosa y medios físicos (medida antipirética), sin respuesta, con persistencia de temperatura de 40°C. Se considera probable una «sepsis de origen ginecológico», iniciando cubrimiento antibiótico empírico (clindamicina y gentamicina). Súbitamente la paciente presenta un episodio descrito como movimientos tónicos con pérdida del estado de conciencia y se decide intubación orotraqueal para la protección de la vía aérea; se conceptúan como diagnósticos adicionales: «reacción secundaria a misoprostol» vs. «embolia de líquido amniótico», por evidente compromiso sistémico. Se interconsulta con la unidad de cuidados intensivos, adonde es trasladada. Paraclínicos: hemograma, función renal, pruebas de coagulación y perfil hepático normales; gases arteriales con acidemia metabólica; ecocardiograma: sin alteraciones; electrólitos: normales; tomografía cerebral simple: sin anormalidades.
Evoluciona hacia la estabilidad hemodinámica, con recuperación progresiva del estado de conciencia, sin requerimiento de soporte inotrópico ni vasopresor, con adecuada tolerancia al destete progresivo de parámetros de ventilación hasta conseguir respiración espontánea y normalización de patrón ácido-base. A las 24h del proceso inicial se consigue extubación, con evolución de puerperio mediato normal, manteniendo estabilidad hemodinámica y con ausencia de signos de respuesta inflamatoria sistémica. Se descartan los diagnósticos iniciales y se establece el diagnóstico de «reacción idiosincrática a misoprostol sublingual». Egresa al tercer día sin complicaciones.
DiscusiónEl misoprostol es un fármaco seguro. Su dosis tóxica se desconoce, pero se sabe que las dosis letales en animales son hasta 1.000 veces mayores que las dosis consideradas terapéuticas en seres humanos. Sin embargo, es importante comprender las propiedades farmacocinéticas de las diferentes vías de administración para elegir el mejor régimen según la aplicación clínica deseada6.
No se han encontrado efectos adversos clínicamente significativos con misoprostol. La diarrea es la principal reacción adversa reportada, usualmente leve y autolimitada; también pueden darse náuseas y vómito, que se resuelven en 2 a 6h. El reconocimiento de la hiperpirexia asociada a su administración es vital, pues un retraso diagnóstico implica mayor mortalidad.
El misoprostol administrado por vía sublingual procura la concentración máxima más alta, y por ende se asocia con una mayor incidencia de efectos secundarios, haciendo caso a la relación propuesta por la cinética de absorción, entre estos 2 elementos. El misoprostol por vía sublingual tiene el tiempo más corto desde su administración hasta alcanzar el punto de concentración máxima, lo que lo hace útil cuando se precisa un inicio rápido de su acción clínica, como en la HPP. No es esta la única vía de administración que ofrece ventajas, pues por ejemplo la vía vaginal ofrece alta biodisponibilidad y un nivel plasmático sostenido, lo que la hace de elección cuando se requiere un tiempo mayor en la manifestación de sus efectos clínicos6.
Estudios de misoprostol para la prevención de HPP han reportado: escalofríos en el 32 al 57% de los casos, hiperpirexia (41°C) tras la administración de 600μg e hiperpirexia con delirio y/o ingreso en cuidados intensivos después de la administración de 800μg por vía oral.
Las elevaciones de temperatura asociadas al uso de misoprostol son compatibles con cambios en los puntos de ajuste hipotalámico. Las prostaglandinas E2 (PGE2) se han involucrado en el mecanismo fisiopatológico de la fiebre endógena y son reconocidas como mediador principal de la inducción de fiebre por su interacción con el receptor de prostaglandina E3 (EP3). No hay evidencia de que la prostaglandina E1 actúe de forma diferente a la PGE2. Se establece entonces que la fiebre por misoprostol imita el patrón de termorregulación endógeno de la PGE2, cambiando el ajuste hipotalámico en su punta superior y estimulando la elevación de la temperatura. Sin embargo, se requieren estudios farmacológicos para validar esta hipótesis5.
En el embarazo, el aumento de la tasa de fiebre puerperal tras la administración de misoprostol puede ser consecuencia de la disminución del umbral de las prostaglandinas, que induce elevación de la temperatura. Pero estudios pre-clínicos sugieren que, por el contrario, el embarazo suprime la fiebre por aumento en la producción endógena de antipiréticos y disminución de la producción endógena de pirógenos5.
A pesar de la incierta relación entre prostaglandinas, embarazo y fiebre, se sabe que las prostaglandinas endógenas desempeñan un papel importante en los procesos fisiopatológicos involucrados en el trabajo de parto, la ruptura de membranas, la maduración cervical, la contractibilidad del miometrio, el alumbramiento y la involución uterina.
Otros efectos asociados al uso de misoprostol son: ruptura uterina, infección (incidencia baja: 0,92%), y en el embarazo temprano, defectos congénitos. Sin embargo, los estudios de mutagénesis con misoprostol han sido negativos y no se ha demostrado efecto embriotóxico, fetotóxico ni teratogénico6.
ConclusionesLas prostaglandinas son la segunda línea de tratamiento farmacológico en la HPP. El misoprostol, análogo sintético de la prostaglandina E1, puede ser administrado por vía oral, vaginal, sublingual o rectal. Es seguro y bien tolerado. No se han encontrado efectos adversos clínicamente significativos. En estudios de misoprostol para la prevención de HPP se reporta: hiperpirexia (41°C) tras la administración de 600μg, e hiperpirexia con delirio y/o ingreso en cuidados intensivos posterior a la administración de 800μg por vía oral. La administración sublingual proporciona la concentración máxima más alta y se asocia con la incidencia más alta de efectos secundarios en comparación con otras vías.
FinanciaciónRecursos propios de los autores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.