Introducción
La diálisis peritoneal (DP) ha demostrado ser una alternativa eficaz en la depuración de toxinas urémicas y en el mantenimiento de un equilibrio hidrosalino adecuado. Su prevalencia es muy dispar, con una media del 11 % de todos los pacientes dializados del mundo. En España es de alrededor del 10 %, con gran variación entre las diferentes autonomías.
Definición de diálisis adecuada
Cantidad y calidad de diálisis necesaria para que el paciente se encuentre bien, sin sintomatología urémica, con la mejor corrección posible de las alteraciones metabólicas y sistémicas relacionadas con la uremia, consiguiendo una larga supervivencia del paciente y de la técnica con la menor morbilidad, además de permitir una buena calidad de vida1-4.
Definición de estándares de calidad y cantidad de diálisis
Existe la necesidad de unos estándares de calidad y cantidad, útiles para la actuación clínica, basados en la evidencia científica y en la opinión de expertos, con la finalidad de profundizar en aspectos concretos de la actuación clínica diaria mediante un riguroso proceso de revisión sistemática de forma regular que refleje los nuevos avances y tecnologías adaptados a la realidad sanitaria y social del país y de cada comunidad autónoma a partir de las guías ya publicadas por entidades internacionales5-8.
Consenso 1. Selección del paciente
Consenso 1.0
La mayoría de los pacientes con enfermedad renal crónica tributarios de tratamiento sustitutivo renal pueden ser candidatos de DP.
Consenso 1.1. Derecho a la información
El paciente tiene derecho a ser informado de las diferentes opciones terapéuticas.
La consulta prediálisis es una buena opción para informar al paciente y ayudarle a elegir la modalidad dialítica más apropiada para él. La participación del paciente en la elección del tratamiento es una forma de concienciarlo y hacerle responsable del tratamiento que debe seguir.
La preferencia de realizar un tratamiento domiciliario, autonomía para trabajar o estudiar, menor dependencia de servicios sanitarios y el alejamiento de los centros de diálisis es bien aceptada por la mayoría de pacientes no dependientes (evidencia)10-12.
Consenso 1.2. Indicaciones
Indicaciones sociales: niños, elección del paciente, actividad laboral o equivalente, distancia a centros de diálisis, mantenimiento del entorno sociofamiliar.
Indicaciones médicas: niños, dificultad de acceso vascular, enfermedades infecciosas de alto riesgo de contagio, intolerancia a la hemodiálisis, contraindicación de anticoagulación.
Consenso 1.3. Contraindicaciones
Contraindicaciones sociales: incapacidad psíquica o física en ausencia de cuidador, enfermo no cumplidor o domicilio inadecuado.
Contraindicaciones médicas: alteraciones abdominales graves, enfermedad respiratoria grave, obesidad mórbida (evidencia)13.
Consenso 2. Catéteres
Consenso 2.1. Tipo de catéteres
No hay evidencia a favor de un tipo u otro de catéter (evidencia).
Consenso 2.2. Técnicas de implantación
Adecuándose a las características especiales del paciente (índice de masa corporal [IMC], tratamiento anticoagulante, cirugía previa, tolerancia...), se puede utilizar:
Punción mediante trocar.
Peritoneoscopia.
Laparoscopia.
Cirugía.
No hay superioridad de un método sobre otro (evidencia A).
Hay que disponer de un equipo experto en la implantación y los cuidados del catéter para poder analizar los resultados (opinión).
Consenso 2.3. Profilaxis
Se recomienda la utilización de vancomicina, 1 g, o cefazolina, 1 g (evidencia)14.
Consenso 3. Adecuación
Consenso 3.1. Requiere la evaluación de la dosis de diálisis (evidencia)
Comprende la dosis de diálisis referida a los índices de aclaración de solutos y toxinas urémicas mediante la clínica y datos bioquímicos calculando la cinética de la urea (Kt/V) y el aclaramiento semanal de creatinina, control del volumen y presión arterial, normalización de electrolitos y del equilibrio ácido-base, control de la anemia, osteodistrofia, nutrición, y prevención y tratamiento de la comorbilidad:
Clínica.
Datos bioquímicos.
Función renal residual (FRR)15.
Kt/V semanal15-22.
Aclaramiento de creatinina semanal15-22,28.
Parámetros nutricionales22-23.
Ultrafiltración27-28 (evidencia)
Consenso 3.2. Recomendaciones generales
Es aconsejable el aprovechamiento del peritoneo las 24 h adaptando al paciente la máxima dosis tolerada.
Sin síntomas urémicos, con funcionalidad plena permitiendo una buena calidad de vida.
Buen control clínico de la presión arterial, estado de hidratación, equilibrio de sodio, acidosis, nutrición, anemia y osteodistrofia.
Consenso 3.3. Dosis de diálisis (evidencia)22-28
a)Diálisis óptima:
Kt/V > 2 (renal + peritoneal).
Aclaramiento de creatinina > 60 l/semana (peritoneal + renal).
Ultrafiltración > 1,5 l/día.
b)Diálisis mínima:
Kt/V ≥ 1,7 (anúricos).
Aclaramiento de creatinina 45-50 l/semana.
Ultrafiltración 1 l/día.
Existen múltiples estudios que demuestran una correlación entre Kt/V y morbimortalidad (Teehan, Lameire, Selgas, Maiorca, CANUSA, Bhaskaran, etc.), y nutrición (Blake, Churchill, Bagman)14-24.
Consenso 3.4. Función renal residual (evidencia)22-30
La preservación de la FRR es muy importante para mantener al paciente con buen estado clínico; al inicio del tratamiento dialítico contribuye en un 30-50 % del aclaramiento total de agua y solutos.
a)Ventajas de mantener función renal residual25,29-30:
Factor de supervivencia y de menor hospitalización.
Contribuye al bienestar del paciente.
Contribuye al Kt/V, al aclaramiento de creatinina y a la depuración de moléculas medianas.
Equilibrio de líquidos y sodio.
Permite una ingesta de líquido y dieta menos restrictiva, mejor nutrición.
Mayor conservación de la función endocrina.
Prevención de infecciones del tracto urinario.
Asociada a un menor rechazo y necrosis tubular aguda en el postrasplante.
Menor empleo de líquidos hipertónicos que a la larga dañan a la función peritoneal.
Supervivencia de la técnica.
b)Para la preservación de la función renal residual25-26,29-31 se recomienda:
No utilizar fármacos nefrotóxicos.
Diuréticos del asa que aumentan la diuresis.
Limitar las soluciones hipertónicas.
Los inhibidores de la enzima de conversión protegen al riñón y frenan la caída de la FRR.
Consenso 3.5. Ultrafiltración (evidencia)27,28
1 l/día.
1,5 l/día en pacientes anúricos.
Consenso 3.6. Equilibrio de sodio
Relacionado con el balance de líquidos.
Un litro de ultrafiltrado supone un equilibrio negativo de 130 mmol de Na+, por lo que una ultrafiltración diaria de 1.500 ml consigue una extracción de sodio de 200 mmol que compensan la ingesta diaria de sodio de la dieta sin una restricción excesiva.
Se recomienda un equilibrio negativo mínimo de unos 130 mmol de sodio (evidencia).
Consenso 4. Modalidad de diálisis peritoneal31-35
Elección de la modalidad de diálisis peritoneal:
Participación del paciente en la elección según sus circunstancias sociolaborales y las indicaciones médicas.
La prescripción deberá adaptarse posteriormente al transporte peritoneal y a las necesidades de ultrafiltración de cada paciente.
Modalidades de diálisis peritoneal:
a)Diálisis peritoneal continua ambulatoria (DPCA)
b)Diálisis peritoneal automatizada (DPA):
DP cíclica continua (DPCC).
DPCC ampliada.
DP marea.
DP nocturna (DPN).
DP intermitente (DPI).
Consenso 4.1. Prescripción y modalidades de diálisis28-33
La prescripción debe ser:
Individualizada.
Adecuando el volumen de solución de diálisis a la superficie corporal.
Tipo de transporte peritoneal.
Grado de FRR (diálisis incremental).
Variables:
Tipo de diálisis: DPCA/DPA.
Día húmedo/seco.
Número de intercambios.
Volumen.
Tiempo de permanencia.
Tipo de solución: lactato, lactato/bicarbonato, bicarbonato, AA, icodextrina, glucosa.
Concentración de glucosa.
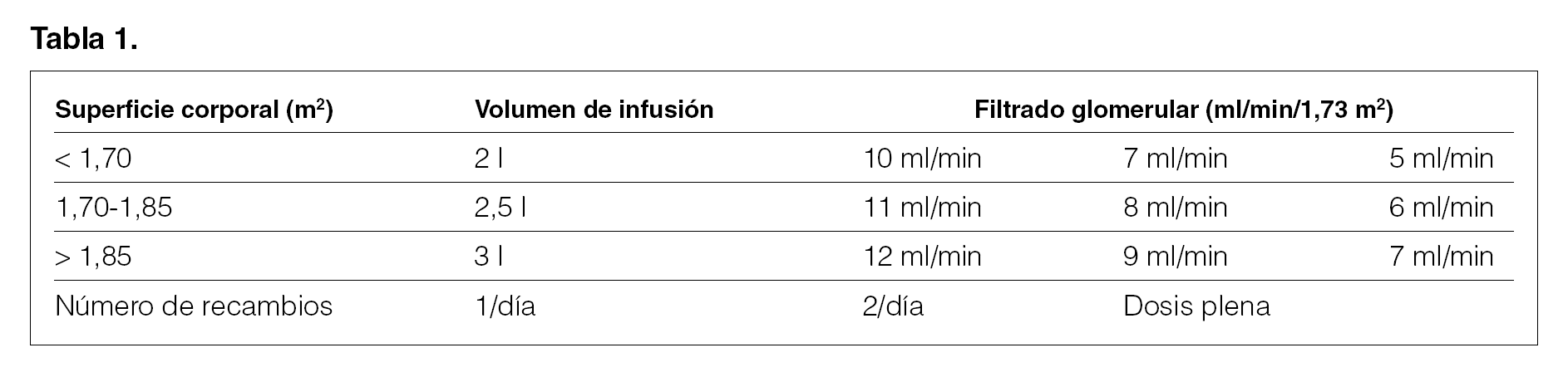
Consenso 4.1.1. Prescripción de diálisis según superficie corporal (evidencia)
Superficie corporal (m2) < 1,70: volumen de infusión, 2 l.
Superficie corporal (m2) 1,70-1,85: volumen de infusión, 2,5 l.
Superficie corporal (m2) > 1,85: volumen de infusión, 3 l.
Prescripción de diálisis según superficie corporal y filtrado glomerular (tabla 1)
Consenso 4.1.2. Prescripción de diálisis según transporte peritoneal (evidencia)
Se establece mediante evaluación del transporte peritoneal. El método usualmente aconsejado es el test de equilibrio peritoneal (TEP), que consiste en:
Infusión de 2 l con concentración de glucosa al 2,3 %.
Según sea la ratio D/P a las 4 h de solutos (urea, creatinina) y glucosa (ultrafiltración), el tipo de transporte se clasifica en:
a)Lento o bajo: 0,34-0,49.
b)Medio-lento: 0,50-0,64.
c)Medio-rápido: 0,65-0,81.
d)Rápido o alto: 0,82-1,03.
Se aconseja la DPA en (evidencia)31-34:
Transporte alto.
Ultrafiltración subóptima.
Aclaramientos insuficientes con DPCA.
Se aconseja la DPCA en:
Transportadores bajos o medio-bajos con buena ultrafiltración en permanencias largas.
Consenso 5. Soluciones y sistemas de DP35,37 (evidencia)
Consenso 5.1. Sistemas de diálisis peritoneal10,13
Para DPCA, el sistema de elección es sin duda el de desconexión con doble bolsa35,36.
Materiales biocompatibles.
Cumplimiento con las normas europeas.
Consenso 5.2. Soluciones (evidencia)37-45
Aspectos de aplicación clínica
Múltiples estudios han puesto en evidencia que las soluciones de diálisis tradicionales no son biocompatibles a causa del bajo pH, concentraciones de glucosa y lactato, hiperosmolaridad y la producción de productos de degradación de la glucosa (PDG) que conducen a la pérdida de función de la membrana peritoneal. Todo ello ha llevado a la búsqueda de nuevas soluciones que eviten la toxicidad y lesiones sobre la membrana peritoneal, así como la producción de PDG.
Se han sugerido soluciones que contienen:
a)Electrolitos:
Sodio, 132-134 mmol/l.
Calcio, 1,75 mmol/l, 1,25 mmol/l.
Cloro, 95-103 mmol/l.
Magnesio, 0,25-0,75 mmol/l.
b)Agentes osmóticos:
Glucosa monohidrato, 1,5 %, 1,3 %, 4,25 %.
Glucosa anhidra, 1,36 %, 2,27 %, 3,86 %.
Glucosa con reducción de PDG.
Aminoácidos, 1,1 %.
Icodextrina, 7,5 %.
c)Tampón
Lactato, 35-40 mmol/l, pH 5,5.
Lactato doble cámara.
Bicarbonato, 34 mmol/l, 39 mmol/l.
Lactato/bicarbonato, 25/15 mmol/l.
Bicarbonato/glicina, 30/10 mmol/l.
Se consideran motivo de consenso:
Utilización de soluciones con la menor concentración de glucosa.
Conceder prioridad a las soluciones de glucosa con reducción de plásticos.
Conceder prioridad a las soluciones de glucosa con reducción de PDG.
Conceder prioridad a las soluciones con bicarbonato o bicarbonato/lactato.
Recomendar la utilización de solución con AA en la desnutrición moderada-grave.
Recomendar la utilización de solución con icodextrina al 7,5 % en las permanencias largas y en pacientes diabéticos.
Consenso 6. Nutrición (evidencia A)9,15,19,22-23
Objetivo: corrección de los diferentes factores catabólicos presentes en los tratados con DP.
Correlación directa entre:
Dosis de diálisis y la ingesta proteica diaria.
FRR y carga calórica.
Nutrición con inflamación.
Desnutrición con morbimortalidad y hospitalización.
Para su asunción es preciso valorar el estado nutricional mediante:
a)Parámetros clínicos:
Valoración subjetiva global o análisis antropométrico.
Peso corporal, índice de masa corporal, pliegues (tricipital, subescapular, abdominal), circunferencia del brazo, índice cintura-cadera.
Composición corporal: bioimpedancia eléctrica, absorciometría de rayos X de energía dual (DEXA).
Encuesta dietética.
Ingesta proteica diaria (PCR), tasa de catabolismo proteico (nPNA).
b)Parámetros bioquímicos:
Proteínas viscerales: albúmina, prealbúmina, transferrina.
Colesterol, BUN, PCR, producción diaria de creatinina, bicarbonato.
Dosis de diálisis.
Consenso 6.1. Requerimientos nutricionales
a)Ingesta calórica, 35 kcal/kg/día:
Hidratos de carbono, 50-60 % del total calórico.
Lípidos, 30 %.
Proteínas, 10-15 %.
b)Ingesta proteica diaria (IDPI), 1,2-1,5 g/kg/día ajustada a la edad y al ejercicio físico; aumentar a 1,8 g/kg/día si hay inflamación aguda o caquexia.
Estas pautas deberían permitir alcanzar:
nPNA > 1-1,2 g/kg/día.
Valores de albúmina > 35 mg/dl, prealbúmina > 30 mg/dl y bicarbonato > 25 meq/l.
Consenso 7. Complicaciones asociadas a la técnica de DP5,36
Consenso 7.1. Relacionadas con el catéter
Orificio (evidencia)5,14,36,45
a)Profilaxis:
Evaluación sistemática periódica: aspecto normal, equívoco, infección aguda.
Búsqueda de portadores nasales de Staphylococcus aureus.
b)Diagnóstico:
Clínico: dolor, eritema, exudado, granuloma.
Microbiológico: tinción de Gram, cultivo, antibiograma.
c)Tratamiento:
Portadores nasales de S. aureus: mupirocina, salino hipertónico.
Tratamiento de la infección aguda.
Eritema: tratamiento tópico: mupirocina 2 % o CPx, dependiendo del material del catéter.
Exudado: según antibiograma del germen, en tratamiento sistémico.
Túnel (evidencia)
a)Diagnóstico:
Clínico: dolor, eritema, exudado, palpación dolorosa y/o fluctuación.
Microbiológico: tinción de Gram, cultivo, antibiograma.
Ecográfico: visualización de absceso.
b)Tratamiento:
Exudado. Según antibiograma del germen, sistémico 2-4 semanas; > 4 semanas, se debe añadir fluconazol, 50 mg/día, oral.
Absceso. Tratamiento quirúrgico: escisión quirúrgica del túnel y rasurado del cuff.
Si no hay mejoría o aparece peritonitis, retirada del catéter.
Consenso 7.2. Peritonitis (evidencia)36.46
Complicación con incidencia significativa que contribuye frecuentemente al fracaso de la técnica. Presenta morbilidad específica y mortalidad no despreciable, así como afectación en la calidad de vida; su coste económico es considerable.
Diagnóstico
Clínico: turbidez del líquido drenado, dolor abdominal, fiebre, alteraciones intestinales.
Laboratorio: recuento celular > 100 leucocitos, > 50 % polimorfonucleares.
Microbiológico: tinción de Gram, cultivo, antibiograma, frotis de orificio de salida.
En líquido peritoneal con permanencia superior a 2 h en el abdomen, cultivo en medio sólido y en medio estándar de hemocultivo poscentrifugación.
Tratamiento
Medidas generales: lavados si dolor intenso, heparina sódica 1.000 U/l, analgesia intraperitoneal y/o intravenosa.
Tratamiento antibiótico:
Grampositivos: vancomicina o cefalosporina.
Gramnegativos: cefalosporinas de tercera generación o aminoglucósido.
Tratamiento empírico (antes de conocer la tinción de Gram): intraperitoneal-intravenoso-intramuscular:
Primera opción: vancomicina + aminoglucósido.
Segunda opción: vancomicina + ceftazidima.
Tercera opción: cefalosporinas de primera generación + ceftazidima.
Cuarta opción: cefalosporinas de primera generación + aminoglucósido.
Recomendaciones ISPD Guidelines. Consideraciones:
Se recomienda el ajuste de dosis por peso y FRR.
Debe estar durante un mínimo de 6 h en dosis de inicio si es intraperitoneal.
En DPA, pasar a DPCA o administrar antibioterapia en intercambio más largo.
Duración del tratamiento: mínimo 2 semanas; en casos más graves, 3 semanas.
Una alternativa en gramnegativos al aminoglucósido son las quinolonas (levofloxacina o pefloxacina).
a)Tratamiento según la tinción de Gram:
Grampositivos: vancomicina o cefalosporina.
Gramnegativos: ceftazidima + aminoglucósido o ciprofloxacino.
b)Tratamiento según cultivo y antibiograma y pauta empírica de inicio:
S. aureus: continuar con cefalosporina de primera generación o vancomicina y suspender el resto.
MARSA: vancomicina; si hay resistencia a la vancomicina: rifampicina o considerar oxazolidonona (Linezolid®).
Staphylococcus epidermidis: continuar cefalosporina de primera generación o vancomicina y suspender el resto.
Pseudomonas: continuar ceftazidima + aminoglucósido o ciprofloxacino.
c)Peritonitis polimicrobianas:
Si múltiples organismos grampositivos: puede responder a los antibióticos.
Si múltiples organismos entéricos, particularmente anaerobios: cirugía, metronidazol + ampicilina + ceftazidima o aminoglucósido.
Peritonitis fúngicas: retirar inmediatamente el catéter e instaurar tratamiento prolongado con antifúngicos (flucitosina/fluconazol).
Peritonitis por micobacterias: difícil diagnóstico, inicio con rifampicina, isoniazida, pirazinamida y ofloxacino.
Consenso 7.3. Hemoperitoneo36
a)Diagnóstico:
Clínico: líquido peritoneal hemático.
Laboratorio: líquido peritoneal, hemograma, control de vitamina K.
Radiografía de abdomen/ecografía.
b)Tratamiento:
Según la gravedad y la presunción diagnóstica:
Leve (hematocrito en líquido de diálisis < 2 % sin repercusión en hemograma):
Intercambios a temperatura ambiente o fríos.
Heparina sódica 1.000 U/l (10 mg).
Grave (hematocrito en líquido de diálisis > 2 % con repercusión en hemograma):
Diagnóstico etiológico.
Tratamiento de la causa.
Consenso 7.4. Fallo de flujo
Puede consistir en fallo de drenaje o de entrada.
a)Drenaje:
Causas extrínsecas: estreñimiento, mala posición, atrapamiento por omento/asas, adherencias, oclusión por órganos adyacentes.
Causas intrínsecas: coágulos de sangre o fibrina.
b)Infusión: acodamiento del catéter, coágulos intraluminales.
Diagnóstico: radiografía de abdomen/ecografía.
Tratamiento conservador: laxantes, solución de Bohm, maniobras push-and-suck.
Fibrinolíticos: urocinasa, 5.000 U en 10 ml intracatéter; activador del plasminógeno tisular (TPA), 1-2 mg/ml durante 1 h.
Medidas invasivas: laparotomía, laparoscopia, reemplazo del catéter.
Consenso 7.5. Fuga
a)Diagnóstico:
Clínico: salida periorificial del líquido, disminución de volumen, edema de pared/genital.
Imagen: ecografía de pared abdominal, gammagrafía peritoneal, tomografía computarizada (TC) con contraste.
b)Tratamiento:
Fuga externa: antibióticos (vancomicina 1-2 g intraperitoneal; cefazolina 2 g intraperitoneal).
Disminuir volumen.
Posición supina.
Paso a DPN.
Cierre de diálisis durante 2 semanas si es postimplantación.
Cirugía si la fuga es importante.
Consenso 7.6. Hernias
a)Diagnóstico:
Clínico: disminución de volumen, edema de pared/genital, tumoración (inguinal, umbilical, epigástrica, pericatéter).
Imagen: ecografía de pared abdominal, gammagrafía peritoneal, TC con contraste.
b)Tratamiento:
Evitar estreñimiento.
Disminuir volumen.
Paso a diálisis nocturna con cicladora.
Cirugía: cierre de diálisis durante 2 semanas, DPI o DPN con volumen bajo durante 4 semanas.
Consenso 7.7. Fibrina
Respuesta de la membrana peritoneal a lesión química o bacteriana.
a)Diagnóstico:
Laboratorio: células, tinción de Gram y cultivo.
b)Tratamiento:
Descartar peritonitis bacteriana.
Heparina sódica al 1 %, 1.000 U/2 l.
Urocinasa, infusión 10.000 U en 1-2 h.
Se recomienda una duración de hasta 3 días después de la desaparición de la fibrina.
Consenso 7.8. Líquido turbio
a)Causas: hemoperitoneo, fibrina, tiempo prolongado, células malignas, vancomicina, soluciones de DP con icodextrina, eosinófilos > 10 %.
b)Diagnóstico:
Laboratorio: células, tinción de Gram y cultivo, células malignas, marcadores tumorales en suero, cuantificación de triglicéridos y quilomicrones en líquido peritoneal, proteinuria 24 h.
Imagen: ecografía, TC abdominal, eco-Doppler de venas renales.
Si hay quiloperitoneo (concentración de triglicéridos > 110 mg/dl en el dializado); etiología: enfermedades malignas (50 % linfoma), paraproteína, cirrosis, pancreatitis, síndrome nefrótico, microtraumas AG del Ca+2.
Consenso 7.9. Hidrotórax
a)Diagnóstico:
Clínico: disnea, disminución de volumen drenado, dolor torácico, tos; asintomático en el 2 %.
Laboratorio: líquido pleural por toracocentesis, glucosa DP > plasma, proteínas DP < plasma, lactatodeshidrogenasa DP < plasma, recuento celular y cultivo, isómeros L y D de lactato (lendógeno L y D en líquido peritoneal), albúmina.
Imagen: radiografía de tórax, gammagrafía peritoneal.
b)Tratamiento:
Drenaje de la cavidad peritoneal.
Descanso peritoneal 2-4 semanas.
Toracocentesis.
Pleurodesis química: talco, oxitetraciclina, cola de fibrina-aprotonina, sangre autóloga.
Cirugía.
Aumentar los valores de albúmina.
Consenso 7.10. Perforación intestinal
a)Diagnóstico:
Clínico: disminución del volumen drenado, abdomen agudo, diarrea tras la infusión, líquido fecaloideo o sanguinolento.
Laboratorio: aumento de amilasa en el líquido peritoneal, peritonitis por gramnegativos o polimicrobiana.
Imagen: radiografía de abdomen, TC.
b)Tratamiento:
Cese de la DP.
Retirada del catéter.
Antibioterapia parenteral.
Cirugía: reparación de la pared intestinal.
Consenso 8. Hospitalización (opinión)47
a)Razón:
La tasa de hospitalización es un buen parámetro de calidad.
La tasa de hospitalización es un buen parámetro de evolución de los pacientes.
La hospitalización depende de muchos factores epidemiológicos y clínicos.
Es necesario cuantificar el número y los días de ingresos.
Es útil diferenciar las causas relacionadas con la diálisis y las no relacionadas.
b)Objetivos del consenso:
Recoger el número de ingresos y días de estancia.
Registro de diagnósticos.
Registro y análisis de reingresos.
Consenso 9. Calidad de vida (evidencia)48
a)El tratamiento pretende lograr:
Máxima adaptación biológica, psicológica y social.
Mínimos efectos adversos en estas áreas.
Máxima maduración psicológica y social.
Óptima función familiar y mínimo estrés relacionado con el tratamiento.
Mínima dependencia del paciente al cuidador.
Máxima satisfacción profesional.
b)Evaluación:
General: estado global de salud, energía/fatiga, dolor, sufrimiento.
Física: signos y síntomas de enfermedad, gravedad de la enfermedad, motilidad.
Mental: bienestar, autonomía, función cognitiva, ansiedad/depresión.
Social: participación social, logros-disponibilidad, sexualidad.
c)Instrumentos de valoración:
Test genérico: índice de Karnofsky.
Test específico de enfermedad: Kidney disease quality of life-short form (KDQOL-SF).
Consenso 10. Supervivencia de la técnica (opinión)50-52
a)Limitaciones:
Clínicas: fallo de ultrafiltración, aclaramientos inadecuados.
Técnicas: peritonitis recurrentes, malfuncionamiento de catéter, infección crónica del orificio, fugas irreparables.
Psicosociales: cansancio, excesiva ocupación, falta de apoyo, trastornos psicológicos.
b)Visión actual. El objetivo consiste en lograr:
Mayor supervivencia de la técnica.
Menos peritonitis.
Menos infecciones.
Mejoría de aclaramientos con DPA.
Mejoría del fallo de ultrafiltración con DPA.
Consenso 11. Mortalidad (evidencia)53
a)Implica diagnóstico y control de:
La morbilidad de los pacientes dializados.
Factores de riesgo.
Factores de riesgo de mortalidad ya manifestados al inicio del TSR.
b)Implicará (opinión) revisión bibliográfica con supervivencia variable en DP frente a hemodiálisis y mejoría de técnicas dialíticas:
Edad.
Diabetes mellitus.
Enfermedad cardiovascular, hipertensión arterial, disfunción sistólica ventricular con fracción de eyección baja, enfermedad coronaria...
Índice de masa corporal.
Tiempo en TSR.
Subdiálisis.
Mejoría del control de la morbilidad y la comorbilidad.
Malnutrición.
Anemia.
Estado inflamatorio.
Hiperparatiroidismo.
FRR.