La linfadenectomía en la cirugía del carcinoma papilar de tiroides se aconseja cuando hay evidencia de metástasis ganglionar cervical (terapéutica) o en pacientes de alto riesgo (profiláctica), como en los tumores T3 y T4 de la clasificación TNM. La técnica de la biopsia selectiva del ganglio centinela puede mejorar el diagnóstico prequirúrgico de las metástasis ganglionares.
ObjetivoAnalizar el resultado de la biopsia selectiva del ganglio centinela en un grupo de pacientes con carcinoma papilar de tiroides T sin evidencia de afectación ganglionar antes de la cirugía.
Pacientes y métodoEstudio retrospectivo, unicéntrico en el que se incluyeron los pacientes intervenidos entre los años 2011-2013 que fueran clínicamente N0. La identificación del ganglio centinela se realizó mediante técnica isotópica. En todos los casos, se practicó linfadenectomía del compartimento afecto si el ganglio centinela era positivo, y del compartimento central en caso de ganglio centinela negativo.
ResultadosSe incluyeron 43 pacientes, 34 mujeres, con una edad media de 52,3 (±17) años. De los 170 ganglios centinela resecados, 46 (27%) fueron positivos para metástasis, que correspondían a 24 (55,8%) pacientes. En las linfadenectomías se resecaron 612 ganglios. De ellos, 96 (15,6%) fueron positivos para metástasis. Doce de los treinta (40%) pacientes cT1N0 y cT2N0 pasaron a pN1 tras la biopsia selectiva del ganglio centinela, mientras que 12 de los 13 (92%) pacientes cT3N0 y cT4N0, acabaron siendo pN1.
ConclusionesLa biopsia selectiva del ganglio centinela recalifica más del 50% de pacientes de cN0 a pN1. Se confirma la necesidad de vaciamiento ganglionar en los tumores T3 y T4, pero pone al descubierto la presencia de metástasis linfáticas en el 40% de los T1-T2.
Lymphadenectomy is recommended during surgery for papillary thyroid carcinoma when there is evidence of cervical lymph node metastasis (therapeutic) or in high-risk patients (prophylactic) such as those with T3 and T4 tumors of the TNM classification. Selective sentinel lymph node biopsy may improve preoperative diagnosis of nodal metastases.
ObjectiveTo analyze the results of selective sentinel lymph node biopsy in a group of patients with papillary thyroid carcinoma and no evidence of nodal involvement before surgery.
Patients and methodA retrospective, single-center study in patients with papillary thyroid carcinoma and no clinical evidence of lymph node involvement who underwent surgery between 2011 and 2013. The sentinel node was identified by scintigraphy. When the sentinel node was positive, the affected compartment was removed, and when sentinel node was negative, central lymph node dissection was performed.
ResultsForty-three patients, 34 females, with a mean age of 52.3 (±17) years, were enrolled. Forty-six (27%) of the 170 SNs resected from 24 (55.8%) patients were positive for metastasis. In addition, 94 (15.6%) out of the 612 lymph nodes removed in the lymphadenectomies were positive for metastases. Twelve of the 30 (40%) low risk patients (cT1N0 and cT2N0) changed their stage to pN1, whereas 12 of 13 (92%) high risk patients (cT3N0 and cT4N0) changed to pN1 stage.
ConclusionsSelective sentinel lymph node biopsy changes the stage of more than 50% of patients from cN0 to pN1. This confirms the need for lymph node resection in T3 and T4 tumors, but reveals the presence of lymph node metastases in 40% of T1-T2 tumors.
El carcinoma papilar de tiroides (CPT) es el tumor endocrino más frecuente1. Su forma de diseminación más habitual es la linfática, por lo que es común la presencia de metástasis en los ganglios linfáticos regionales, especialmente del compartimento central2. En el momento actual, se debate si la linfadenectomía profiláctica del compartimento central debe acompañar la tiroidectomía de manera rutinaria (vaciamiento ganglionar profiláctico [VGP]), o si debe efectuarse tan solo cuando se demuestra la presencia de metástasis ganglionares (MG) previamente o durante la intervención (vaciamiento ganglionar terapéutico [VGT])3–5. Como argumentos a favor del VGP se encuentran la dificultad para diagnosticar las MG antes de la cirugía, el hecho de evitar una segunda intervención para realizar la linfadenectomía y la relación existente entre la MG y el riesgo de recidivas de la enfermedad. Por el contrario, los detractores apuntan que el VGP alarga el tiempo quirúrgico, aumenta la morbilidad de la cirugía de tiroides, especialmente en relación con el hipoparatiroidismo definitivo y no modifica la supervivencia5. Las recomendaciones actuales proponen realizar el vaciamiento ganglionar en todos los casos en que se constate la presencia de MG antes o durante el acto quirúrgico, y también en aquellas situaciones con un elevado riesgo de diseminación linfática, aunque esta no haya sido demostrada. Así, la guía de la American Thyroid Association6 en su recomendación 36, aconseja realizar el VGP en los tumores T3 y T4 de la clasificación TNM de la American Joint Committee on Cancer7.
Dado que uno de los factores clave es poder planificar la intervención conociendo el estatus ganglionar del paciente, se han establecido diferentes estrategias con el fin de mejorar el diagnóstico de las MG antes o durante la intervención quirúrgica. Una de ellas es la biopsia selectiva del ganglio centinela (BSGC)8,9. La detección del ganglio centinela (GC) se puede realizar mediante un radiotrazador, un colorante vital, la combinación de ambos o incluso con la utilización de partículas magnéticas. En todos los casos se detecta la primera estación de drenaje linfático del tumor. Una vez identificada, se extirpa durante el acto quirúrgico y se analiza histológicamente en el mismo momento, obteniéndose un dictamen provisional sobre la presencia o no de MG en el transcurso de la cirugía (estudio intraoperatorio). En caso de demostrarse MG se procede a la linfadenectomía del compartimento que corresponda.
El objetivo del presente trabajo fue analizar los resultados de la BSGC en un grupo de pacientes con CPT en los que no había evidencia de afectación ganglionar (cN0) antes de la intervención quirúrgica y que fueron sometidos a vaciamiento ganglionar.
Pacientes y métodoPacientesSe revisaron de forma retrospectiva todos los pacientes diagnosticados de CPT entre los años 2011- 2013 y que cumplieran los siguientes criterios: 1) no hubiera evidencia de afectación ganglionar previa a la cirugía (cN0, según clasificación TNM). Para ello, se requería que todos los casos dispusieran de una ecografía tiroidea prequirúrgica. 2) Se les practicara la técnica de BSGC. 3) La técnica de BSGC fuera efectiva, es decir, localizara al menos un GC, y 4) se les realizara un vaciamiento ganglionar del compartimento central. En los casos en que la BSGC fue positiva, se procedía al vaciamiento del compartimento afecto, en caso que fuera negativa y como procedimiento de validación de la técnica, se practicaba vaciamiento del compartimento central homolateral al tumor. Todos los pacientes incluidos firmaron el consentimiento informado para la realización de las técnicas aplicadas.
Técnica biopsia selectiva ganglio centinelaEl día previo a la intervención quirúrgica se procedía a la inyección intratumoral ecodirigida de 0,1–0,2mL de 99mTc-nanocoloide (Nanocoll ®). El tamaño de la partícula era de 50 y 80nm y la actividad del trazador de 148 MBq. A las 2-4 h se practicaba SPECT/TC (General Electric, Infinia Hawkeye 4) y se marcaba en la piel la proyección de los GC detectados por la prueba de imagen. Al día siguiente, se realizaba la tiroidectomía total y a continuación se localizaban los GC mediante una sonda detectora de rayos gamma (Europrobe; Eurorad, Eckbolsheim, Francia). Posteriormente, se resecaban y se remitían al laboratorio de anatomía patológica. A continuación, se practicaba la linfadenectomía del compartimento central homolateral al tumor, y la del compartimento lateral en los casos con GC positivo en el estudio anatomopatológico. El análisis intraoperatorio de los GC se realizaba mediante impronta citológica y secciones en congelación, obteniéndose un resultado provisional. El diagnóstico definitivo de los GC se obtenía de forma diferida, con el análisis de los mismos en secciones histológicas a diferentes niveles de profundidad y teñidas mediante hematoxilina y eosina (HyE). Adicionalmente, en los GC sin aparente metástasis se practicó estudio inmunohistoquímico para citoqueratinas con el fin de descartar la presencia de depósitos metastásicos de pequeño tamaño que no hubieran sido evidenciados al examen óptico inicial de las secciones teñidas mediante HyE. El análisis de las linfadenectomías se realizó mediante el estudio histológico de una sección central de cada ganglio teñida con HyE.
Análisis estadísticoLas variables cuantitativas se expresaron como mediana (rango intercuartil, RIC) y las categóricas como frecuencias y proporciones. La comparación de medianas se realizó mediante la prueba de U de Mann-Whitney. La relación entre variables cuantitativas se exploró mediante estudio de correlación de Pearson (r) y el coeficiente de determinación (R2). Se consideró con significación estadística un valor p inferior o igual a 0,05.
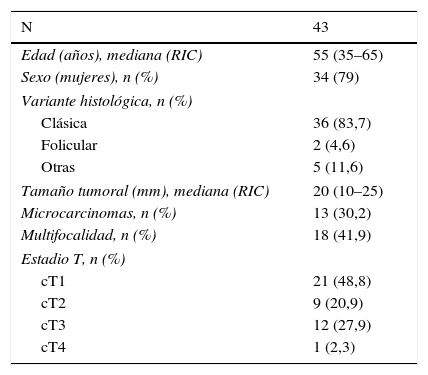
ResultadosDe la serie total de 60 casos de validación de la técnica BSGC llevada a cabo en nuestro centro, un total de 43 cumplían con los criterios establecidos para este estudio. Las características principales clínico-histológicas se resumen en la tabla 1.
Características clínico-patológicas de los pacientes
| N | 43 |
|---|---|
| Edad (años), mediana (RIC) | 55 (35–65) |
| Sexo (mujeres), n (%) | 34 (79) |
| Variante histológica, n (%) | |
| Clásica | 36 (83,7) |
| Folicular | 2 (4,6) |
| Otras | 5 (11,6) |
| Tamaño tumoral (mm), mediana (RIC) | 20 (10–25) |
| Microcarcinomas, n (%) | 13 (30,2) |
| Multifocalidad, n (%) | 18 (41,9) |
| Estadio T, n (%) | |
| cT1 | 21 (48,8) |
| cT2 | 9 (20,9) |
| cT3 | 12 (27,9) |
| cT4 | 1 (2,3) |
Se resecaron 170 GC, 139 de los cuales correspondían al compartimento central (CC), y 31 al compartimento lateral (CL). La mediana de GC por paciente fue de 4 (2-5,4) (mínimo 1, máximo 9). Fueron positivos para metástasis 46 (27%), 40 del CC y 6 del CL que correspondían a 24 (55,8%) pacientes, con una mediana de ganglios positivos de 1,5 (1-3). No se observaron diferencias significativas en la mediana de ganglios centinela resecados entre los que acabaron siendo vaciamientos negativos, 3 (2-5), y los que fueron positivos, 4 (2-5); p=0,74.
En total, se realizaron 43 vaciamientos del CC y 7 del CL. Veintiuno de los centrales (48,8%) y 5 (71,4%) de los laterales fueron positivos, en cuatro pacientes hubo afectación de ambos y un paciente solo tuvo afectación del CL. Como resultado de los vaciamientos se resecaron 612 ganglios, con una mediana de 14 (8-18) ganglios por paciente. De ellos 96 (15,6%) fueron positivos para metástasis con una mediana de 3 (1,5-5,5) ganglios positivos por vaciamiento. No hubo diferencias en el número de ganglios por vaciamiento entre los que resultaron negativos, 12 (7,2-18) y los que fueron positivos, 14,54 (11,5-17,5); p=0,42. Hubo una correlación entre el número de GC y el número de ganglios resecados por vaciamiento (R2=0,46, p=0,002); en cambio no se encontró correlación entre el número de GC y el número de ganglios totales positivos (R2= 0,17; p=0,26), ni entre el número de GC positivos y en número de ganglios resecados (R2=0,23; p=0,13). Finalmente, hubo correlación entre el número de GC positivos y el número de ganglios resecados positivos (R2= 0,64, p <0,001).
La morbilidad registrada fue de 2 pacientes (4,6%) con parálisis recurrencial unilateral temporal, 4 pacientes (9,3%) con hipoparatiroidismo transitorio y un quilocérvix autolimitado. No hubo ninguna complicación asociada específicamente a la BSGC.
Todos los pacientes eran cN0, doce de los treinta (40%) cT1 y cT2 fueron pN1 tras la BSGC, mientras que 12 de los 13 (92%) cT3 y cT4 acabaron siendo pN1. Hubo dos casos en los cuales el estudio intraoperatorio del GC no detectó metástasis pero su análisis diferido, así como los vaciamientos fueron positivos en el estudio anatomopatológico final, lo que dio una tasa de falsos negativos del 8,3%. Contrariamente, no hubo ningún falso positivo (estudio intraoperatorio positivo no confirmado en el análisis histológico definitivo). Finalmente, en 4 pacientes (16,6%) el único ganglio positivo fue el centinela, siendo el resto de vaciamiento negativo.
DiscusiónEl uso de la BSGC en el CPT es motivo de debate10,11. La diversidad de los protocolos y de las características de los pacientes, los distintos marcadores empleados en la identificación del GC (colorante, radioisótopo, nanopartículas de carbón o una combinación de ellos)12,13, así como las limitaciones de la técnica intraoperatoria para detectar las metástasis14,15 hacen que los resultados sean muy variables entre las distintas series publicadas. La técnica isotópica es la que ofrece los porcentajes de localización del GC más elevados12,16.
El presente estudio analizó la efectividad de la técnica de la BSGC para la estadificación intraoperatoria de la afectación ganglionar cervical en el CPT. La finalidad de la técnica es delimitar aquellos pacientes que serían tributarios de linfadenectomía (en todos los casos sería terapéutica dado que se habría demostrado la afectación ganglionar). Para ello se seleccionaron tan solo los casos en los que previamente al acto quirúrgico no hubiera ninguna evidencia de MG. Además, como proceso de validación inicial de la técnica se procedía al vaciamiento ganglionar del compartimento cervical central en todos los casos, independientemente del resultado de la BSGC, por lo que se disponía del resultado histológico definitivo del estatus ganglionar del CC. Aunque el número de pacientes es limitado, se trataba de un grupo homogéneo de casos con una estadificación cN0 y, por tanto, se convertían en el prototipo de pacientes en los cuales existe la disyuntiva de realizar o no el VGP. El análisis intraoperatorio del GC demostró MG en 24 de los 43 pacientes (55,8%). Ello supone que la aplicación de la técnica hizo cambiar la estadificación (de cN0 a pN1) en más de la mitad de los casos. En un estudio parecido con 99 pacientes, Pelizzo et al.9 detectaron un 49% y Chow et al.17 hallaron metástasis linfáticas ocultas en 10 de 15 pacientes (67%). Otros autores han publicado porcentajes menores15,18,19. Así, por ejemplo, en una reducida serie de 23 pacientes Cabrera et al.18 detectaron un porcentaje del 30,4% de casos que pasaban de cN0 a pN1, similar al de Larrad el al.8 y Ji et al.15 que encontraban este viraje en 24 de 114 pacientes (28,6%), pero encontraban otros 7 casos de positividad en la histología definitiva del GC (6%). En una serie más reciente y con más de 340 pacientes analizados, Carcoforo et al.20 detectaban MG en el 27% de los casos. En el metaanálisis de Balasubramanian y Harrison10, se constataban grandes diferencias entre los estudios incluidos, con una media del 43% de GC positivos en pacientes clínicamente N0. Uno de los argumentos del VGP es la baja sensibilidad de las pruebas de imagen en el estudio de extensión de la enfermedad. La ecografía cervical, si bien muestra un alto rendimiento en el estudio del nódulo tiroideo e incluso en las adenopatías laterocervicales, se muestra mucho menos eficaz en el diagnóstico de los ganglios del CC (el más afectado en el CPT)21.
Según la guía de la British Thyroid Association22, la linfadenectomía profiláctica del compartimento central debería individualizarse en todos los pacientes de alto riesgo (definidos como aquellos con alguno de los siguientes criterios: variante histológica de mayor agresividad, pacientes de más de 45 años, tumor multifocal, mayor de 4cm o con extensión extratiroidea), y la reciente guía de la American Thyroid Association6 cataloga este tipo de pacientes como los T3 y T4 de la clasificación TNM. En nuestra serie, 30 de los 43 casos correspondían al grupo cT1 y cT2. De ellos, 12 (40%) pasaron a pN1. Por el contrario, 12 de los 13 casos cT3 y cT4 también estaban afectados. Estos datos confirman la elevada incidencia de MG en los estadios de mayor riesgo, reforzando la indicación de VGP en pacientes con tumores avanzados. No obstante, la presencia de afectación adenopática (40%) en los pacientes de bajo riesgo, plantea la duda de si debería realizarse en este grupo. En un trabajo de Maniakas et al.23 utilizando BSGC con técnica de localización con tinción, encuentran afectación metastásica en tan solo el 11% de los T1–T2 y en el 58% de los T3-T4.
Existen importantes limitaciones en el trabajo. El escaso número de pacientes y el carácter retrospectivo del estudio aconsejan ser cautos con los resultados. Se han incluido los pacientes con GC localizado, que en nuestra experiencia alcanza el 95% de los casos14. Aunque no disponíamos del resultado histológico definitivo, se procedía a realizar la linfadenectomía del compartimento afectado en casos de GC positivo durante el estudio intraoperatorio, o del compartimento central cuando el GC era negativo. Por ello, no se puede determinar la afectación real de los dos compartimentos en su conjunto, dado que no se resecaron ambos en todos los pacientes.
Desde que se propusiera por primera vez el uso de la BSGC en el CPT por Kelemen et al.24 hace casi 20 años, su utilización ha sido motivo de intenso debate. Así, las características específicas del tumor y el elevado porcentaje de falsos negativos hacen que no se haya convertido en una técnica de uso rutinario como sí ocurre en otros tumores25–27. A pesar de ello, concluimos que la utilización de la BSGC consigue una estadificación más precisa de la afectación ganglionar de los pacientes con CPT. La presencia de MG es frecuente incluso en pacientes de bajo riesgo. No obstante, se desconoce la repercusión de este hallazgo en el pronóstico a largo plazo.
FinanciaciónEn parte financiado por la Beca de Investigación en Evaluación de Tecnologías Sanitarias y Servicios de Salud (PI09/90440) 2010-2012, investigador principal: Óscar González.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.