Conocer el perfil sociodemográfico y clínico en una muestra representativa de personas con diabetes mellitus tipo 1 (DM1) en España, e identificar los factores asociados con el control glucémico.
Material y métodosEstudio observacional, transversal en adultos y niños con DM1 tratados en las consultas de 75 hospitales públicos españoles, distribuidos geográficamente para ser representativos de la población española. Dentro de cada centro, los pacientes fueron incluidos de forma consecutiva según acudían a consulta. Se les entrevistó y se revisaron sus historias clínicas. Se realizó un análisis estadístico descriptivo y se analizaron los factores asociados con la hemoglobina glicada (HbA1c) utilizando un análisis de regresión lineal multivariante.
ResultadosSe incluyeron 647 pacientes: 55,3% mujeres, edad 36,6±14,4 años, 97,2% caucásicos, índice de masa corporal (IMC) 24,7±4,4kg/m2 (12,1%≥30kg/m2) y el 74,0% tenía estudios secundarios/universitarios. El 20,2% eran fumadores activos. El tiempo medio desde el diagnóstico de DM1 fue de 17,9±12,0 años. Un 48,7% presentaban comorbilidades, un 19,3% retinopatía y un 16,4% hipotiroidismo. Respecto al tratamiento para la DM1, el 76,5% usaban insulinoterapia basal-bolo y el 20,7% infusión subcutánea continua de insulina (ISCI); el 51,0% de los pacientes utilizaban una ratio insulina/hidratos de carbono (ICR), realizaban 4,6±1,6 autoanálisis de glucemia capilar (AAGC) diaria y el 24,8% utilizaba monitorización continua de glucosa (MCG). El valor medio de la HbA1c fue del 7,6±1,1% (30% inferior al 7%). El control metabólico fue mejor (menor HbA1c) a mayor número de AAGC diarios (B=−0,053; p=0,009), mayor nivel de estudios (B=0,461; p<0,001), mayor número de hipoglucemias (B=−0,253; p=0,018) y la realización de recuento de hidratos de carbono (B=−0,190; p=0,048), y peor a mayor duración de la enfermedad (B=0,010; p=0,010), mayor dosis total de insulina (B=0,010; p<0,0001), peor adherencia a la dieta (B=0,650; p<0,0001) y con antecedentes familiares de DM (B=−0,233; p=0,007).
ConclusionesEl manejo de los pacientes con DM1 en España, así como el tratamiento que reciben, es similar al observado en otros países occidentales. El control glucémico está asociado al nivel de estudios, la duración de la enfermedad y las características del tratamiento y autocuidado.
To determine the sociodemographic and clinical profile of a representative sample of people with type 1 diabetes mellitus (DM1) in Spain and identify factors associated with glycemic control.
Material and methodsA cross-sectional observational study was carried out in adults and children with DM1 treated in 75 Spanish public hospitals, geographically distributed in order to be representative of the Spanish population. Within each center, the patients were included on a consecutive basis as they visited the clinic. They were interviewed, and their clinical histories were reviewed. A descriptive statistical analysis was made, and factors associated with HbA1c were analyzed using multivariate linear regression analysis.
ResultsA total of 647 patients were included: 55.3% females, aged 36.6±14.4 years, 97.2% Caucasians, BMI 24.7±4.4kg/m2 (12.1% ≥30kg/m2), and 74.0% had secondary / university education. A total of 20.2% were active smokers. The mean time from the diagnosis of DM1 was 17.9±12.0 years. A total of 48.7% presented comorbidities: 19.3% retinopathy and 16.4% hypothyroidism. As regards treatment for DM1, 76.5% received basal-bolus insulin therapy and 20.7% continuous subcutaneous insulin infusion (CSII); 51.0% of the patients used an insulin/carbohydrate ratio (ICR), with 4.6±1.6 self-monitored capillary blood glucose (SMCBG) measurements a day, and 24.8% used continuous glucose monitoring (CGM). The mean HbA1c value was 7.6±1.1% (30% below 7%). Metabolic control improved (lower HbA1c) with more daily SMCBG (B=−0.053; p=0.009), a higher educational level (B=0.461; P<0.001), greater number of hypoglycemia episodes (B=−0.253; P=0.018) and carbohydrate counting (B=−0.190; P=0.048), and worsened the longer the duration of the disease (B=0.010; P=0.010), higher total dose of insulin (B=0.010; P<0.0001), poorer adherence to diet (B=0.650; P<0.0001) and a family history of DM (B=−0.233; P=0.007).
ConclusionsThe management of patients with DM1 in Spain, as well as the treatment they receive, is similar to that seen in other Western countries. Blood glucose control is associated with educational level, disease duration, and the characteristics of treatment and self-care.
La diabetes mellitus tipo 1 (DM1) se caracteriza por una deficiencia absoluta o casi absoluta de insulina, por lo que los pacientes precisan a diario de un aporte externo de insulina. Europa presenta una de las mayores tasas de incidencia de DM1 en niños, con una estimación de 21.600 nuevos casos al año1. Los estudios de incidencia y prevalencia que proporcionen datos actualizados en España son escasos, sin embargo, se puede estimar que la incidencia está entorno a los 11-15 casos por cada 100.000 habitantes menores de 15 años2–4 y la prevalencia estaría entre el 0,08 y el 0,2%5.
La DM1 se asocia con un riesgo sustancialmente mayor de muerte prematura en comparación con la población general6. Entre las personas con diabetes menores de 30 años, el exceso de mortalidad se explica en gran medida por las complicaciones agudas de la diabetes, incluyendo cetoacidosis diabética e hipoglucemia7–9. La enfermedad cardiovascular es, sin embargo, la principal causa de muerte7–10.
Los objetivos del manejo de la DM1 fueron inicialmente establecidos en 1993 por el Diabetes Control and Complications Trial (DCCT)11. Es importante mantener unos niveles de glucosa en sangre en un rango cercano al normal para prevenir complicaciones microvasculares y macrovasculares a largo plazo12,13. Sin embargo, este estudio de referencia mostró que los episodios recurrentes de hipoglucemia constituyen una limitación fundamental para conseguir objetivos intensivos de control, por lo que un porcentaje relativamente bajo de las personas con DM1 alcanzan los niveles recomendados de hemoglobina glicada (HbA1c)14. Adicionalmente, otros factores podrían influir en el control glucémico continuado: la edad, la motivación, el cumplimiento, la información sobre la diabetes o las habilidades de manejo de la enfermedad15.
Se acepta como objetivo de control glucémico general una HbA1c<7%16. La estrategia actual para obtener el control glucémico y mantener la HbA1c en estos niveles es imitar la secreción fisiológica de insulina, ya sea con terapia de infusión subcutánea continua de insulina (ISCI) o de múltiples dosis de insulina (MDI).
Diferentes estudios realizados en España han permitido definir variables relacionadas con el control metabólico en pacientes con la DM1: el de Gómez-Peralta et al. permitió identificar aspectos como una baja adherencia a la dieta, la frecuencia de autoanálisis de glucemia capilar (AAGC) y la actividad física, como variables relacionadas con el control metabólico17, mientras que Amor et al. describieron que la prevalencia de complicaciones cardiovasculares disminuía en los pacientes con DM1 tras un programa específico de seguimiento18. El objetivo del estudio es describir el manejo y la situación clínica de la población con DM1 en España, así como los posibles factores relacionados con el control metabólico de la enfermedad.
Material y métodosTipo de diseñoEstudio observacional, multicéntrico, transversal con recogida de datos retrospectiva y no intervencionista, sobre una muestra representativa a nivel nacional de adultos y niños con DM1 tratados en las consultas de especialistas en endocrinología miembros de la SED, de 75 hospitales públicos de España, en condiciones de práctica clínica habitual (Material Suplementario Tablas S1-S2). El estudio fue clasificado por la Agencia Española del Medicamento (AEMPS) y aprobado por el Comité Ético de Investigación Clínica (CEIC) de los centros participantes.
Población de estudioEl tamaño de la muestra debía permitir describir el perfil sociodemográfico y clínico de los pacientes con DM1. Dado que se basó en una descripción de la población del estudio, se calculó el tamaño de la muestra mínima necesaria para estimar variables dicotómicas que se presentaran con una probabilidad de 0,50 (valor que requiere el tamaño de muestra máximo). Asumiendo un tamaño de la población total española de 46.454.535 habitantes (según datos del INE a 01/07/2016), con una prevalencia de DM1 del 0,1%, se estimó una población de 46.455 pacientes con DM1. Para estimar variables dicotómicas con una p de 0,5, una precisión de 0,04 y un nivel de significación de 0,05, se requería una muestra mínima a incluir de 594 pacientes adultos con DM1. En el Material Suplementario Tabla S3 se describe la distribución aproximada de centros participantes por comunidades autónomas (CC. AA.) y estimación de pacientes a incluir en cada una de ellas para mantener la distribución geográfica de la población española.
Participaron un total de 75 centros clínicos seleccionados, teniendo en cuenta la representatividad a nivel de comunidad autónoma proporcionando así una representación de pacientes pediátricos y adultos con DM1, y cubrir la muestra mínima requerida. Cada centro debía incluir de manera consecutiva, un número determinado de pacientes adultos con DM1, y los centros pediátricos un mínimo de 4 pacientes, para mantener la representatividad geográfica.
Los pacientes debían cumplir con los siguientes criterios: pacientes diagnosticados de DM1, con historia clínica en el centro, con un mínimo de 2 valores de HbA1c disponibles en la visita de estudio y que otorgaran su consentimiento informado por escrito en el caso de los pacientes adultos y el de los padres/tutores en el caso de los participantes menores de edad. Se excluyeron pacientes con diagnóstico de diabetes tipo 2 (DM2) y con historia de trasplante de páncreas y/o de células de islote.
Variables de estudioLa información para las variables descritas a continuación se obtuvo a través de las historias clínicas o directamente de los pacientes durante la visita de estudio.
Proceden de la historia clínicaEdad, género, talla, peso, circunferencia de la cintura, presión arterial, frecuencia cardíaca, antecedentes familiares, edad en el diagnóstico del familiar, diabetes tipo 1, diabetes tipo 2, enfermedad cardiovascular precoz, insuficiencia suprarrenal, hipotiroidismo, hipertiroidismo, fecha de diagnóstico de la DM1, educación diabetológica (recibida sí/no), fuente (equipo multidisciplinar, endocrino, dietista, enfermería, atención primaria), contenido (información DM1, dieta, ejercicio), autocontrol glucémico (realización/interpretación), cuidado/higiene, autoajuste dosis de insulina y material utilizado (sesiones presenciales, folletos, Internet, asociaciones, medios de comunicación), presencia de hipertensión (fecha de diagnóstico y tratamiento farmacológico) e hiperlipidemia (fecha de diagnóstico y necesidad de tratamiento farmacológico), comorbilidades y complicaciones asociadas a la DM1 (complicaciones micro y macroangiopáticas, otras enfermedades autoinmunes), perfil lipídico (colesterol total, triglicéridos, HDL y LDL), vacunación, hospitalizaciones en los últimos 12 meses (número de ingresos, motivo) y consultas relacionadas con la DM1, frecuencia de los controles analíticos y valores y factores de riesgo cardiovascular.
Variables aportadas por encuesta/valoración clínica al pacienteRaza (caucásica/blanca, negra, asiática/oriental), nivel de estudios (sin estudios, estudios primarios, estudios secundarios, estudios universitarios o similares), adecuación/frecuencia del AAGC (rango de glucosa objetivo prepandial y posprandial; realización de controles de glucemia y frecuencia diaria), sensor de glucosa continuo (frecuencia de uso diario o por temporadas), datos del último control glucémico (2 últimos perfiles glucémicos realizados en los últimos 15 días), plan de alimentación recomendado (sí/no, calorías/día, tomas/día y uso de recuento de hidratos de carbono), adherencia subjetiva a la dieta (muy buena, buena, regular, mala, muy mala), episodios de hipoglucemia en el mes previo a la visita de estudio y tipo (sintomáticas/asintomáticas), consumo de tabaco y alcohol, tratamiento en el momento de la visita (tratamiento con insulina y concomitante). Se registraron: tipo y número de inyecciones de insulina, insulina basal y rápida, método de administración (bolo basal, premezclas, bomba de infusión continua), número de unidades de insulina basal (mañana, tarde, noche), utilización de ajuste por ratio insulina/ración de hidratos de carbono, dosis correctoras y factor de sensibilidad calculado. Para analizar el efecto de la educación diabetológica y la adherencia al tratamiento insulínico considerado internacionalmente óptimo, se agruparon estas 3 características (uso de ratio insulina/hidratos de carbono, recuento de hidratos de carbonoy cálculo de factor de sensibilidad) de forma conjunta como «Uso de tratamiento avanzado con insulina».
Toda esta información fue incluida por los investigadores mediante un cuaderno de recogida de datos (CRD) electrónico diseñado expresamente para este estudio.
Gestión de análisis de datosLos datos se resumen mediante medias±DE o porcentajes. Para el análisis del control metabólico se utilizó la media de los 2 últimos valores de HbA1c. Se describieron separadamente los siguientes rangos de edad: 0-13, 14-17, 18-25 y 26-49 años. Se analizó la relación entre el nivel de HbA1c y la presencia de hipoglucemias con las variables: recuento de hidratos de carbono, uso de ratio insulina/hidratos de carbono y cálculo de factor de sensibilidad. Cuando se cumplían estas 3 condiciones al mismo tiempo también se analizaron conjuntamente para cada uno de los pacientes incluidos defiendo la variable como como «Uso de tratamiento avanzado con insulina».
Los análisis comparativos se realizaron mediante las pruebas U de Mann-Whitney o Friedman en variables continuas, y la prueba de Chi-cuadrado en variables categóricas. Se realizó un modelo de regresión multivariante incluyendo los factores que previamente en el análisis univariante obtuvieron un valor de p<0,1 y se aplicó un método de selección por pasos (stepwise) para la obtención del modelo final.
En todas las pruebas estadísticas realizadas con las variables de resultado se utilizó un nivel de significación estadística de 0,05. Para el análisis de los datos se utilizó el paquete estadístico SAS® versión 9.4 para Windows®.
ResultadosDescripción de la población de estudioSe incluyeron de forma consecutiva un total de 650 pacientes: 3 de los pacientes no presentaron el criterio de tener un mínimo 2 valores de HbA1c previos a la visita, siendo finalmente elegibles 647 pacientes con DM1.
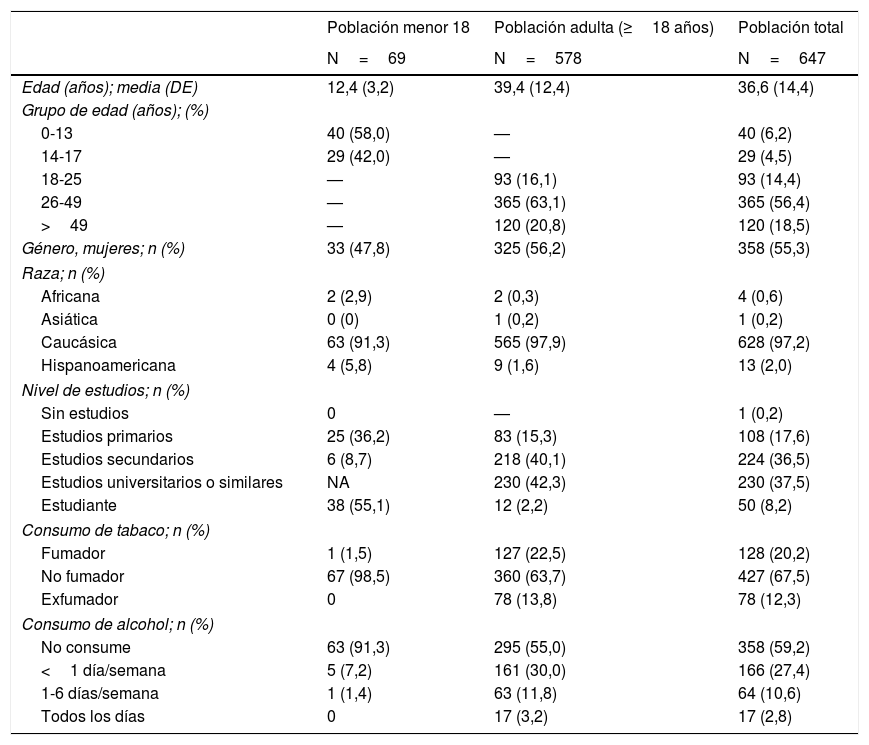
Datos demográficos, personales e historial familiarEn la tabla 1 se resumen los datos demográficos de la muestra: 69 pacientes <18 años (media de edad: 12,4±3,2 años) y 578 pacientes ≥18 años (39,4±12,4 años). El 55,3% de los pacientes eran mujeres y el 97,2% caucásicos. El 42,3% de la población adulta había completado estudios universitarios o similares. El 20,2% de la población total era fumadora. El 33,4% presentaba historia familiar de DM2, un 26,1% de DM1 y el 17,2% de hipotiroidismo (tabla 2).
Variables demográficas de la población de estudio
| Población menor 18 | Población adulta (≥18 años) | Población total | |
|---|---|---|---|
| N=69 | N=578 | N=647 | |
| Edad (años); media (DE) | 12,4 (3,2) | 39,4 (12,4) | 36,6 (14,4) |
| Grupo de edad (años); (%) | |||
| 0-13 | 40 (58,0) | — | 40 (6,2) |
| 14-17 | 29 (42,0) | — | 29 (4,5) |
| 18-25 | — | 93 (16,1) | 93 (14,4) |
| 26-49 | — | 365 (63,1) | 365 (56,4) |
| >49 | — | 120 (20,8) | 120 (18,5) |
| Género, mujeres; n (%) | 33 (47,8) | 325 (56,2) | 358 (55,3) |
| Raza; n (%) | |||
| Africana | 2 (2,9) | 2 (0,3) | 4 (0,6) |
| Asiática | 0 (0) | 1 (0,2) | 1 (0,2) |
| Caucásica | 63 (91,3) | 565 (97,9) | 628 (97,2) |
| Hispanoamericana | 4 (5,8) | 9 (1,6) | 13 (2,0) |
| Nivel de estudios; n (%) | |||
| Sin estudios | 0 | — | 1 (0,2) |
| Estudios primarios | 25 (36,2) | 83 (15,3) | 108 (17,6) |
| Estudios secundarios | 6 (8,7) | 218 (40,1) | 224 (36,5) |
| Estudios universitarios o similares | NA | 230 (42,3) | 230 (37,5) |
| Estudiante | 38 (55,1) | 12 (2,2) | 50 (8,2) |
| Consumo de tabaco; n (%) | |||
| Fumador | 1 (1,5) | 127 (22,5) | 128 (20,2) |
| No fumador | 67 (98,5) | 360 (63,7) | 427 (67,5) |
| Exfumador | 0 | 78 (13,8) | 78 (12,3) |
| Consumo de alcohol; n (%) | |||
| No consume | 63 (91,3) | 295 (55,0) | 358 (59,2) |
| <1 día/semana | 5 (7,2) | 161 (30,0) | 166 (27,4) |
| 1-6 días/semana | 1 (1,4) | 63 (11,8) | 64 (10,6) |
| Todos los días | 0 | 17 (3,2) | 17 (2,8) |
DE: desviación estándar; NA: no aplica.
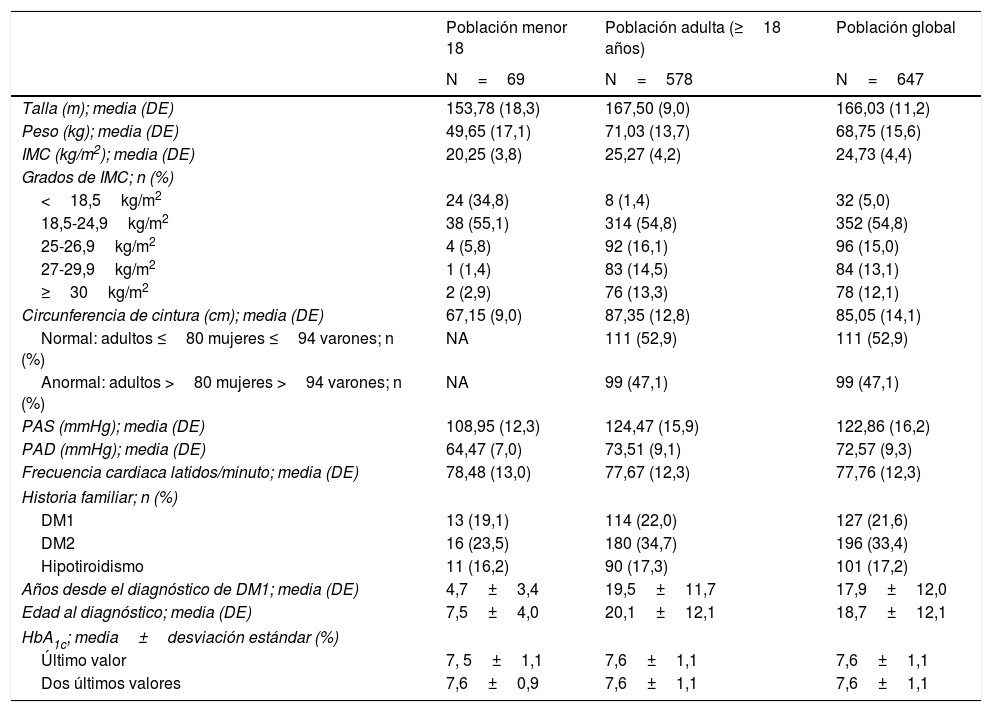
Características clínicas y de la DM1 de la población de estudio
| Población menor 18 | Población adulta (≥18 años) | Población global | |
|---|---|---|---|
| N=69 | N=578 | N=647 | |
| Talla (m); media (DE) | 153,78 (18,3) | 167,50 (9,0) | 166,03 (11,2) |
| Peso (kg); media (DE) | 49,65 (17,1) | 71,03 (13,7) | 68,75 (15,6) |
| IMC (kg/m2); media (DE) | 20,25 (3,8) | 25,27 (4,2) | 24,73 (4,4) |
| Grados de IMC; n (%) | |||
| <18,5kg/m2 | 24 (34,8) | 8 (1,4) | 32 (5,0) |
| 18,5-24,9kg/m2 | 38 (55,1) | 314 (54,8) | 352 (54,8) |
| 25-26,9kg/m2 | 4 (5,8) | 92 (16,1) | 96 (15,0) |
| 27-29,9kg/m2 | 1 (1,4) | 83 (14,5) | 84 (13,1) |
| ≥30kg/m2 | 2 (2,9) | 76 (13,3) | 78 (12,1) |
| Circunferencia de cintura (cm); media (DE) | 67,15 (9,0) | 87,35 (12,8) | 85,05 (14,1) |
| Normal: adultos ≤80 mujeres ≤94 varones; n (%) | NA | 111 (52,9) | 111 (52,9) |
| Anormal: adultos >80 mujeres >94 varones; n (%) | NA | 99 (47,1) | 99 (47,1) |
| PAS (mmHg); media (DE) | 108,95 (12,3) | 124,47 (15,9) | 122,86 (16,2) |
| PAD (mmHg); media (DE) | 64,47 (7,0) | 73,51 (9,1) | 72,57 (9,3) |
| Frecuencia cardiaca latidos/minuto; media (DE) | 78,48 (13,0) | 77,67 (12,3) | 77,76 (12,3) |
| Historia familiar; n (%) | |||
| DM1 | 13 (19,1) | 114 (22,0) | 127 (21,6) |
| DM2 | 16 (23,5) | 180 (34,7) | 196 (33,4) |
| Hipotiroidismo | 11 (16,2) | 90 (17,3) | 101 (17,2) |
| Años desde el diagnóstico de DM1; media (DE) | 4,7±3,4 | 19,5±11,7 | 17,9±12,0 |
| Edad al diagnóstico; media (DE) | 7,5±4,0 | 20,1±12,1 | 18,7±12,1 |
| HbA1c; media±desviación estándar (%) | |||
| Último valor | 7, 5±1,1 | 7,6±1,1 | 7,6±1,1 |
| Dos últimos valores | 7,6±0,9 | 7,6±1,1 | 7,6±1,1 |
DE: desviación estándar; DM1: diabetes mellitus tipo 1; DM2: diabetes mellitus tipo 2; HbA1c: hemoglobina glicosilada A1c; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Un 43,9% de adultos (>18 años) presentó sobrepeso u obesidad (IMC>25kg/m2).
Características de la diabetes mellitus y comorbilidadesLa edad media (DE) al diagnóstico fue de 18,7±12,1 años y el tiempo medio desde el diagnóstico de la DM1 de 17,9±12,0 años (4,7±3,5 en <18 años y de 19,5±11,7 en adultos). Más de la mitad de la población adulta (52,9%) presentaba alguna comorbilidad y/o complicación asociada a la DM1, siendo la retinopatía la más frecuente (21,6%), seguida por el hipotiroidismo (18,2%) y la dislipemia (14,2%). En la población <18 años, la comorbilidad más frecuente fue la celiaquía, presente en un 7,2%. El 49,2% de la muestra recibía un tratamiento concomitante en el momento de la visita del estudio (Material suplementario tabla S4 y datos de laboratorio y perfil glucémico capilar, tablas S5 y S6).
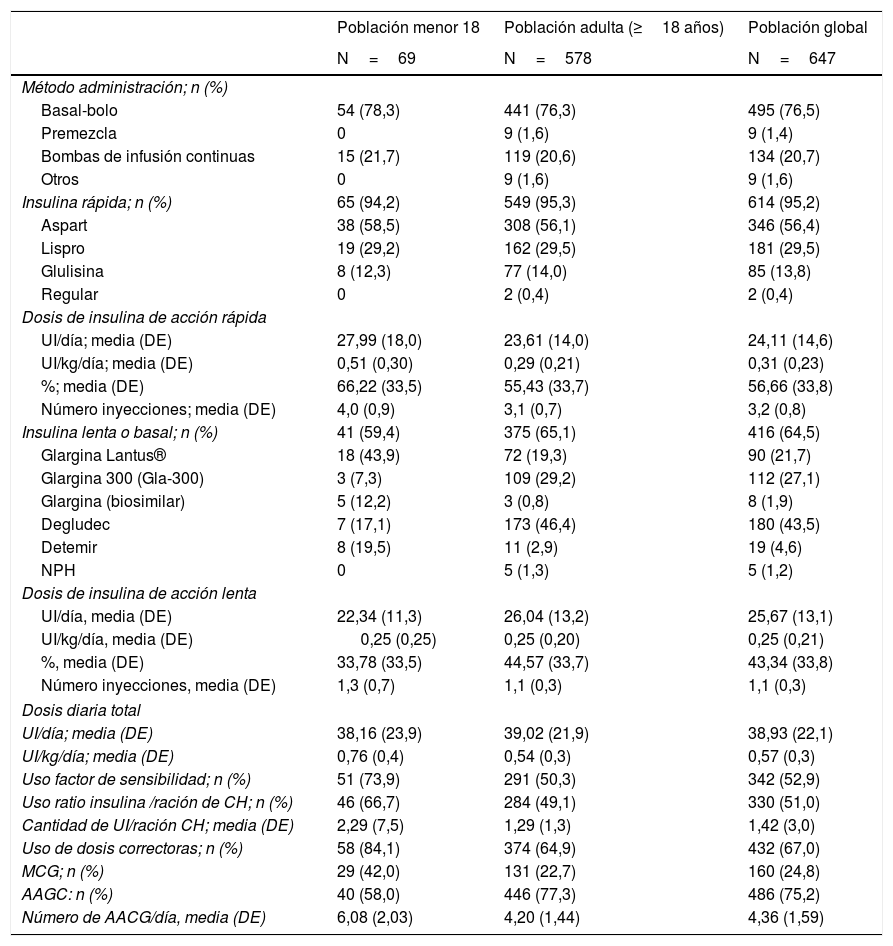
Tratamiento insulínicoEl método de administración de insulina más frecuente en la población global fue bolo-basal (76,5%) seguido de ISCI (20,7%) y premezclas (1,4%). Esta distribución también se mantuvo al hacer la diferenciación entre pacientes adultos y menores de 18 años (tabla 3).
Tratamientos con insulina
| Población menor 18 | Población adulta (≥18 años) | Población global | |
|---|---|---|---|
| N=69 | N=578 | N=647 | |
| Método administración; n (%) | |||
| Basal-bolo | 54 (78,3) | 441 (76,3) | 495 (76,5) |
| Premezcla | 0 | 9 (1,6) | 9 (1,4) |
| Bombas de infusión continuas | 15 (21,7) | 119 (20,6) | 134 (20,7) |
| Otros | 0 | 9 (1,6) | 9 (1,6) |
| Insulina rápida; n (%) | 65 (94,2) | 549 (95,3) | 614 (95,2) |
| Aspart | 38 (58,5) | 308 (56,1) | 346 (56,4) |
| Lispro | 19 (29,2) | 162 (29,5) | 181 (29,5) |
| Glulisina | 8 (12,3) | 77 (14,0) | 85 (13,8) |
| Regular | 0 | 2 (0,4) | 2 (0,4) |
| Dosis de insulina de acción rápida | |||
| UI/día; media (DE) | 27,99 (18,0) | 23,61 (14,0) | 24,11 (14,6) |
| UI/kg/día; media (DE) | 0,51 (0,30) | 0,29 (0,21) | 0,31 (0,23) |
| %; media (DE) | 66,22 (33,5) | 55,43 (33,7) | 56,66 (33,8) |
| Número inyecciones; media (DE) | 4,0 (0,9) | 3,1 (0,7) | 3,2 (0,8) |
| Insulina lenta o basal; n (%) | 41 (59,4) | 375 (65,1) | 416 (64,5) |
| Glargina Lantus® | 18 (43,9) | 72 (19,3) | 90 (21,7) |
| Glargina 300 (Gla-300) | 3 (7,3) | 109 (29,2) | 112 (27,1) |
| Glargina (biosimilar) | 5 (12,2) | 3 (0,8) | 8 (1,9) |
| Degludec | 7 (17,1) | 173 (46,4) | 180 (43,5) |
| Detemir | 8 (19,5) | 11 (2,9) | 19 (4,6) |
| NPH | 0 | 5 (1,3) | 5 (1,2) |
| Dosis de insulina de acción lenta | |||
| UI/día, media (DE) | 22,34 (11,3) | 26,04 (13,2) | 25,67 (13,1) |
| UI/kg/día, media (DE) | 0,25 (0,25) | 0,25 (0,20) | 0,25 (0,21) |
| %, media (DE) | 33,78 (33,5) | 44,57 (33,7) | 43,34 (33,8) |
| Número inyecciones, media (DE) | 1,3 (0,7) | 1,1 (0,3) | 1,1 (0,3) |
| Dosis diaria total | |||
| UI/día; media (DE) | 38,16 (23,9) | 39,02 (21,9) | 38,93 (22,1) |
| UI/kg/día; media (DE) | 0,76 (0,4) | 0,54 (0,3) | 0,57 (0,3) |
| Uso factor de sensibilidad; n (%) | 51 (73,9) | 291 (50,3) | 342 (52,9) |
| Uso ratio insulina /ración de CH; n (%) | 46 (66,7) | 284 (49,1) | 330 (51,0) |
| Cantidad de UI/ración CH; media (DE) | 2,29 (7,5) | 1,29 (1,3) | 1,42 (3,0) |
| Uso de dosis correctoras; n (%) | 58 (84,1) | 374 (64,9) | 432 (67,0) |
| MCG; n (%) | 29 (42,0) | 131 (22,7) | 160 (24,8) |
| AAGC: n (%) | 40 (58,0) | 446 (77,3) | 486 (75,2) |
| Número de AACG/día, media (DE) | 6,08 (2,03) | 4,20 (1,44) | 4,36 (1,59) |
AAGC: autoanálisis de glucemia capilar; CH: hidratos de carbono; DE: desviación estándar; ISCI: infusión subcutánea continua de insulina; MCG: monitorización continua de glucosa; NPH: insulina de acción intermedia; UI: unidades de insulina.
El 95,2% de los pacientes que usaban bolo-basal recibían tratamiento con insulina rápida con una dosis media de 24,1±14,6U/día, y una media de 3,2±0,8 inyecciones. Aspart (56,4%) y lispro (29,5%) fueron las insulinas rápidas más frecuentemente administradas. La dosis media de insulina prolongada en el tratamiento con bolo-basal fue de 25,7±13,10U/día, y una media de 1,1±0,3 inyecciones. Degludec (43,5%) seguido de glargina U300 (21,7%) fueron las insulinas prolongadas más administradas. Los pacientes menores de 18 años usaban una mayor proporción de insulina rápida vs. prolongada (66,2%) que la población adulta (55,3%).
El 67,0% de la población global usaba dosis correctoras de insulina (media: 1UI por cada 54mg/dl de glucemia en exceso). Un 51% de los pacientes de la población utilizaba una ratio insulina/ración para ajuste: la dosis media (DE) de UI/ración hidratos de carbono fue de 1,4±3,0.
Monitorización de glucemiaEl 75,2% de los pacientes realizaba AAGC diario (con una frecuencia media±DE de 4,36±1,59 controles/día) y un 98,8% controles regulares de HbA1c.
Un 24,8% de los pacientes usaba algún tipo de monitorización continua de glucosa (MCG), siendo un 40,3% de los tratados mediante ISCI y un 20,5% de los que usaban bolo-basal (Material suplementario figura S1).
Manejo nutricionalUn 81,5% de los pacientes había recibido un plan de alimentación recomendado por su equipo médico y en un 67,2% se consideró buena/muy buena la adherencia a la dieta.
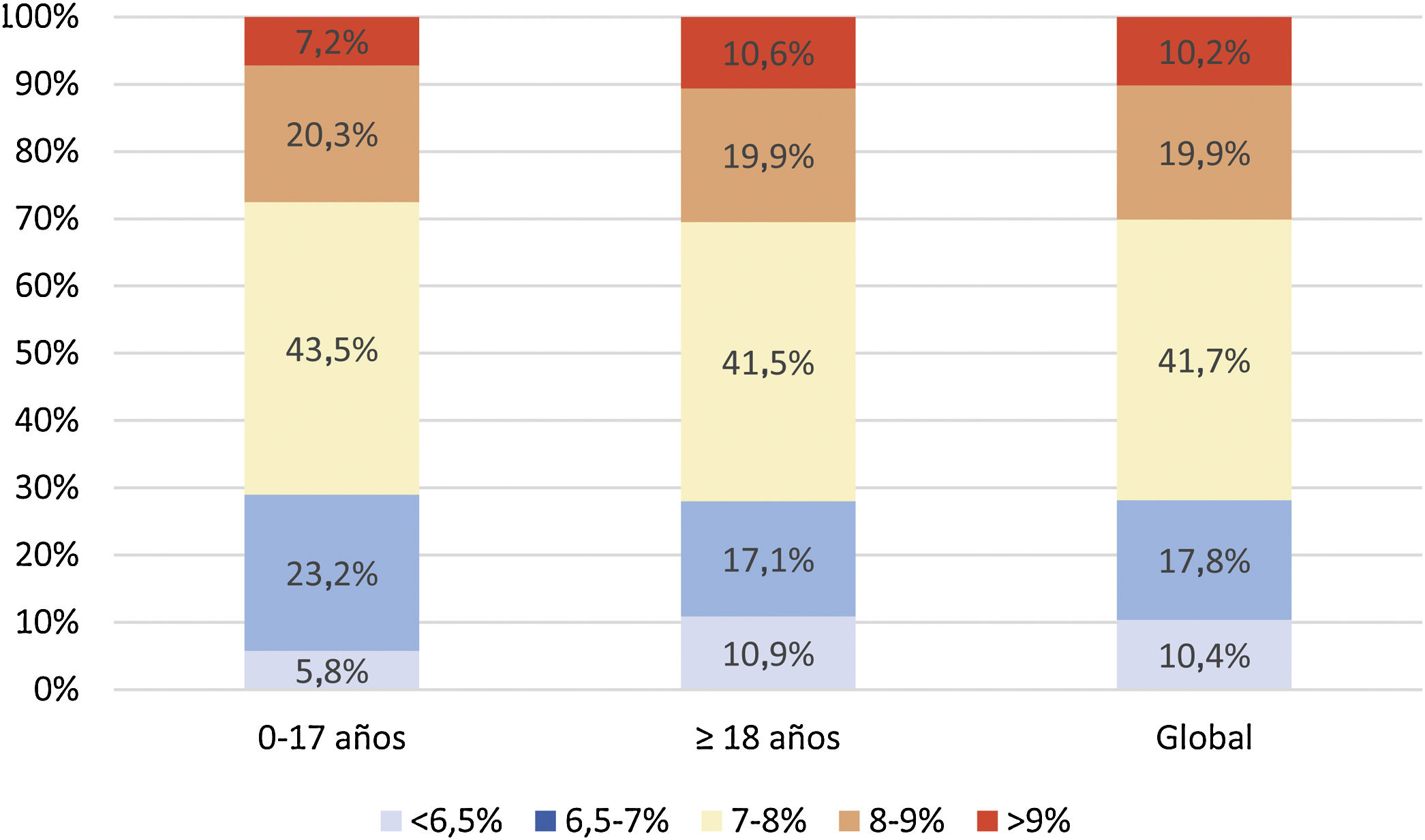
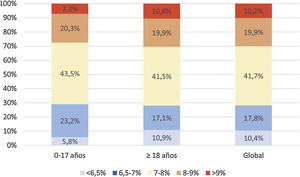
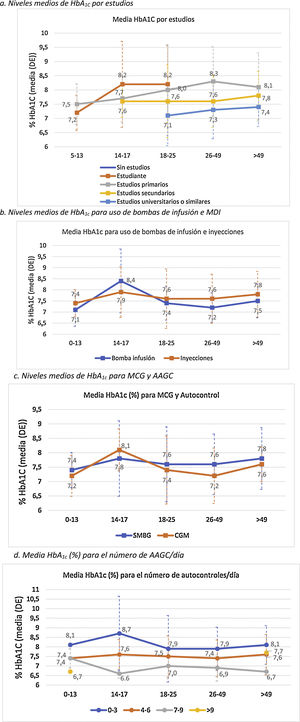
Análisis del control metabólicoHemoglobina glicadaLa media de las 2 últimas determinaciones de HbA1c de la población de estudio fue de 7,6±1,1% (7,6±25 0,9% en población <18 años y de 7,6±1,1% en adultos). De la muestra total incluida en el estudio, un 29,7% presentaron valores de HbA1c<7%. La figura 1 describe la distribución de la población por rangos de HbA1c y edad.
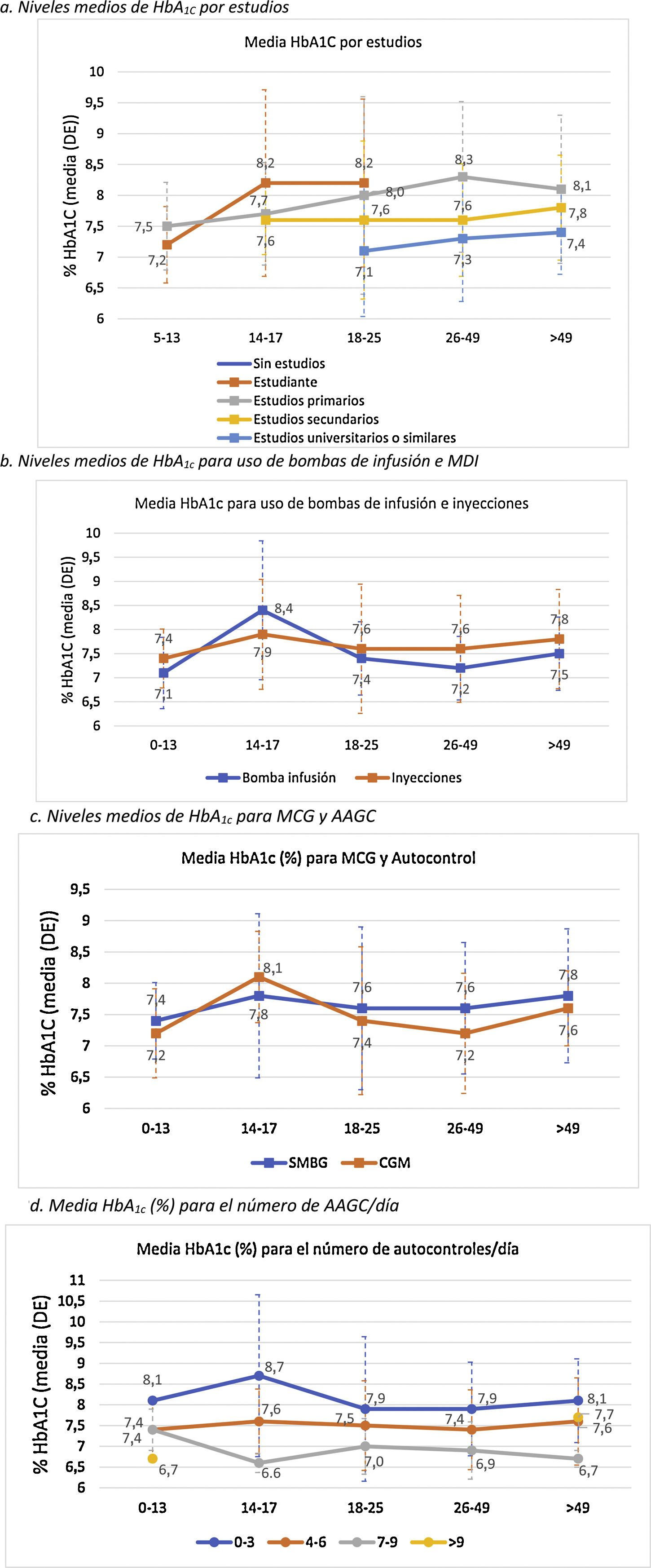
El control metabólico se relacionó con mayor nivel de estudios (p<0,0001) (fig. 2A).
En general, los pacientes que utilizaban ISCI mostraron un mejor control glucémico, exceptuando el grupo de edad de 14-17 años, donde la media de HbA1c en el grupo de bolo-basal fue menor (7,9 vs. 8,4%) (fig. 2B). Además, en este grupo se observa un incremento general de los valores medios de HbA1c en comparación con el resto rangos de edad. La diferencia de HbA1c por uso de ISCI solo alcanzó significación estadística en población adulta (7,3±0,7 vs. 7,7±1,1%; p<0,005).
Los niveles de HbA1c fueron significativamente más bajos en los pacientes adultos que usaban MCG que en los que utilizaban AAGC: 7,5 vs. 7,6% en menores 18 años (p=0,995) y 7,3 vs. 7,6% en adultos (p=0,002). Por grupos de edad, los pacientes de 14-17 años presentan unos valores medios de HbA1c más elevados, independientemente del uso de MCG (8,1%) o AAGC (7,8%), respecto a los otros grupos. Por el contrario, el grupo de pacientes entre 26 y 49 años es el que presentó mayores diferencias en los valores de HbA1c (p<0,001) en función de si usaban MCG (7,2%) o AAGC (7,6%) (fig. 2C).
Se observó que, a mayor número de AAGC realizados, el nivel de HbA1c era menor: 8,0% con 0-3 controles/día, 7,5% con 4-6 controles/día; 7,1% con 7-9 controles/día (p<0,0001). La significación estadística se mantuvo en el análisis de la población adulta por separado (p<0,0001) (fig. 2D).
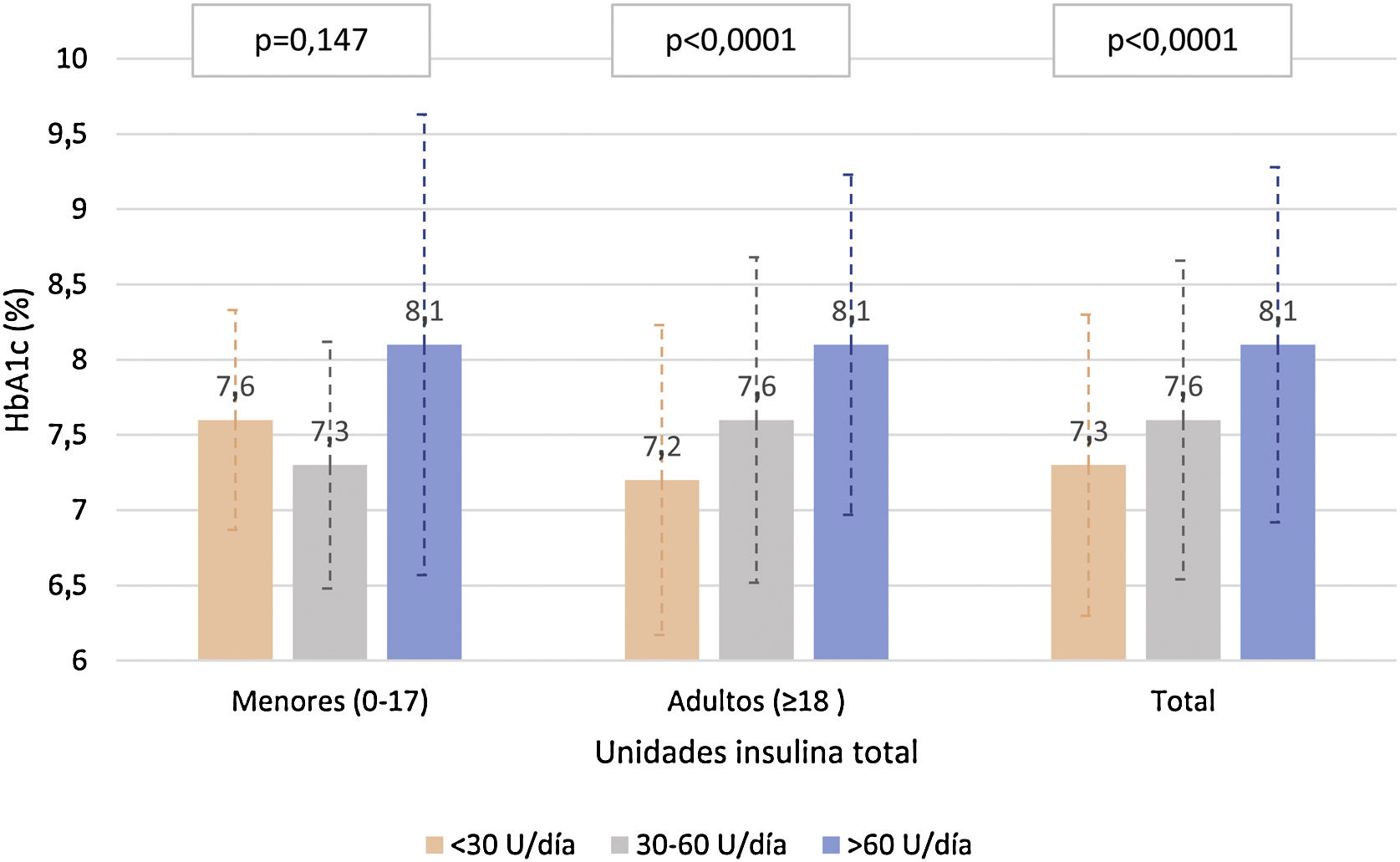
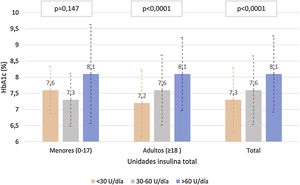
La figura 3 describe los niveles de HbA1c en la población adulta y <18 años, según la dosis total de insulina. En la población adulta, se observaron diferencias estadísticamente significativas (p<0,0001) en el control de HbA1c según la cantidad de insulina utilizada (tanto por unidades de insulina/día y unidades de insulina/kg/día), con medias de HbA1c de 7,3, 7,7 y 8,1 para <30, 30-60 y >60U/d, y de 7,3, 7,4 y 7,9 para 0-0,2, 0,2-0,6 y >0,6U/kg/día, respectivamente. En cambio no se observó una correlación entre la proporción de insulina rápida/lenta con los valores de HbA1c (r de Pearson=−0,041 y p=0,341 en adultos y r de Pearson=−0,050 y p=0,326 en menores de 18 años).
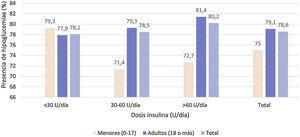
Episodios de hipoglucemiaUn 78,3% de la población de estudio refería episodios de hipoglucemia en el mes previo a la visita de estudio, principalmente sintomáticos (84,6%). Por población de estudio, un 78,6% de los menores de 18 años y un 81,1% en adultos con HbA1c<7% presentaron episodios de hipoglucemia.
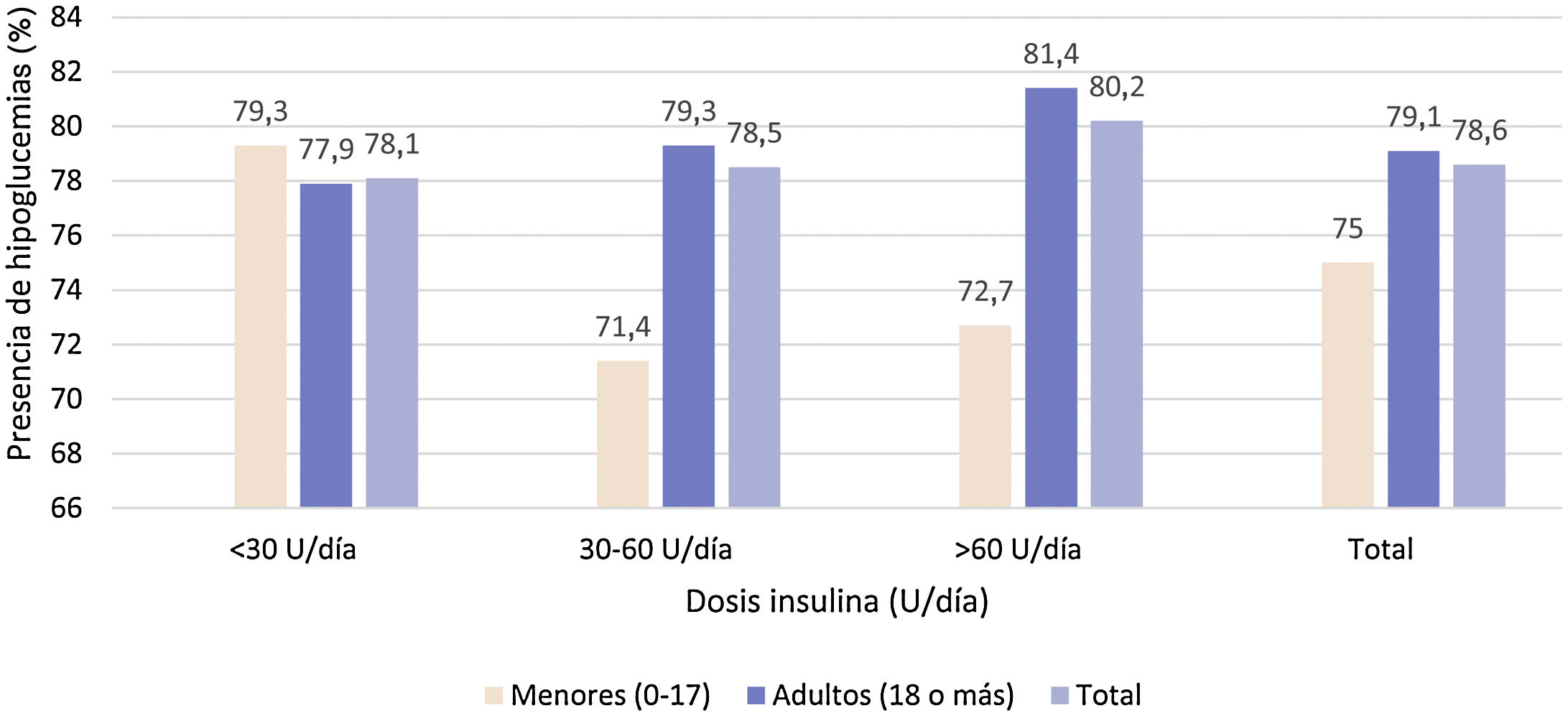
No se observó relación estadísticamente significativa (p=0,921) entre los puntos de corte de las dosis de insulina con la presencia de hipoglucemias (fig. 4).
Tampoco se observó relación estadísticamente significativa en ninguna de las 2 poblaciones de estudio entre la presencia de hipoglucemias y el uso de ISCI o bolo-basal (p=0,544 en menores 18 años y p=0,168 en adultos), con el uso de MCG o AAGC (p=0,809 en menores 18 años y p=0,125 en adultos).
Asociación de factores de educación diabetológica con niveles de hemoglobina glicada y presencia de hipoglucemiaSe observaron niveles de HbA1c significativamente menores en la población adulta que usa recuento de hidratos de carbono en relación con la población adulta que no lo usa (7,3±1,0 vs. 7,7±1,1%; p=0,0037).
No se observó relación entre el uso recuento de hidratos de carbono (p=0,467 en menores 18 años y p=0,302 en adultos) con la presencia de hipoglucemias.
Se observó una relación estadísticamente significativa entre el uso de una ratio insulina/ración para ajuste y niveles de HbA1c más bajos tanto en la población menor de 18 años (7,4±0,8 vs. 8,0±1,1%; p=0,014), como en los mayores de 18 (7,4±0,9 vs. 7,8±1,2%; p<0,0001), y al analizar la población total (p<0,0001). Sin embargo, se observó una mayor presencia de hipoglucemias en la población adulta en aquellos que usan una ratio insulina/ración para ajuste, (83,5%) vs. los que no usan ajuste (74,6%) (p=0,009).
Se observó un nivel de HbA1c menor en los pacientes que calculaban factor de sensibilidad (7,4±1,0 vs. 7,6±1,2; p=0,0273, en la población total). La presencia de hipoglucemias en los que calculaban factor de sensibilidad fue mayor: 83,6 vs. 74,1% en población adulta (p=0,005), y 82,2 vs. 74,0% en la población total (p=0,012).
Agrupando estas 3 características (recuento de hidratos de carbono, uso de ratio insulina/hidratos de carbono y cálculo del factor de sensibilidad) de forma conjunta como «Uso de tratamiento avanzado con insulina», se observó una relación estadísticamente significativa con los niveles de HbA1c en la población total: el «tratamiento con insulina avanzado» se asociaba con unos niveles de HbA1c inferiores (7,4±1,0 vs. 7,6±1,1%; p=0,041). Sin embargo, se observa una relación entre el uso de tratamiento con insulina avanzado y un porcentaje mayor de hipoglucemias en la población adulta (89,3%) vs. el no uso de tratamiento con insulina avanzado (77,8%) (p=0,045).
Análisis de regresión lineal múltiple de variables relacionadas con el control metabólicoEl modelo de regresión lineal múltiple en adultos incluyó las siguientes variables: edad, nivel de estudios, IMC, tiempo al diagnóstico, antecedentes familiares, HTA, hiperlipidemia, adherencia a la dieta, número de autocontroles realizados, episodios de hipoglucemia, bomba de infusión, MCG, ratio de insulina, dosis de insulina, plan de recuento de hidratos de carbono, uso de factor de sensibilidad y uso de tratamiento con insulina avanzado.
La HbA1c fue menor a número de AAGC diarios (B=−0,053; p=0,009), mayor nivel de estudios (estudios universitarios vs. estudios primarios B=0,461; p<0,001), mayor presencia de episodios de hipoglucemia en los últimos 12 meses (B=−0,253; p=0,018) y la realización de recuento de hidratos de carbono (B=−0,190; p=0,048).
El control metabólico fue peor (mayor HbA1c) a mayor número de años transcurridos desde el diagnóstico de DM1 (B=0,010; p=0,010), mayor dosis total de insulina (B=0,010; p<0,0001), con una mala adherencia a la dieta (B=0.650; p<0,0001) y con la presencia de antecedentes familiares de DM (B=−0,233; p=0,007).
DiscusiónSon pocos los estudios descriptivos realizados en población española con DM1 en práctica clínica y los resultados obtenidos en el estudio SED1 nos han proporcionado información descriptiva del control metabólico y manejo de la enfermedad.
Los datos de control glucémico global (HbA1c) en la población con DM1 española son similares a los descritos en otras poblaciones europeas19 o americanas20. Nuestros resultados señalan que valores menores de HbA1c se asocian con la presencia de hipoglucemias. Lo cual no debería interpretarse como que las personas con DM1 pueden sentirse libres de este riesgo manteniendo niveles de HbA1c por encima de los objetivos recomendados.
Sin embargo, no se observó relación estadística entre el uso de ISCI o MCG con la presencia de hipoglucemias. Incluso, lamentablemente, los resultados de este estudio indican que medidas propias de un tratamiento insulínico avanzado (basado en conceptos de educación terapéutica y motivación personal como el uso de ratio insulina/ración para ajuste, o el cálculo del factor de sensibilidad) presentaron un porcentaje mayor de hipoglucemias. Por supuesto, no puede extraerse una causalidad en esta relación.
Probablemente, un incremento de la sensibilidad en dicha población para reconocer estos eventos, autodeclarados en nuestro estudio, pueden explicar parcialmente el resultado. También podría explicarse por el hecho de que se iniciara el tratamiento con ISCI o MCG en personas con una alta presencia de hipoglucemias. En cualquier caso, estos datos sitúan a la hipoglucemia como un problema no resuelto de la vida diaria de la persona con DM1. Las nuevas insulinas y sistemas de administración y, fundamentalmente, sistemas de prevención automática de la misma son una esperanza en el futuro21.
Los datos previamente publicados indicaban un uso de ISCI en España entorno al 5% de pacientes con DM1, con una gran diferencia en comparación con otros países de nuestro entorno20. El porcentaje de pacientes tratados con ISCI en países que dedican un porcentaje similar del presupuesto al gasto en medicamentos y dispositivos sanitarios supera ampliamente esta cifra: Italia (12%), y Francia, Alemania y Holanda (20%)22. Sin embargo, en nuestro estudio el 20,7% de los pacientes utilizaban ISCI. El porcentaje de usuarios de MCG también se acerca a los recientemente publicados en EE. UU., pese a que la obtención de los datos de este estudio es previa a la financiación generalizada de los mismos por los sistemas públicos de salud. Este incremento puede confirmar que compartimos la tendencia de incremento en el uso de tecnologías aplicadas a la diabetes observada en otros países20. Sin embargo, no podemos descartar un sesgo en nuestro estudio, al participar centros de grandes ciudades, con servicios y tecnologías más avanzadas y, por tanto, pudiendo no reflejar el porcentaje real de su uso en el total de pacientes con DM1.
El uso de ISCI se asoció con cifras de HbA1c más bajas (entre el 0,3 y el 0,6%) cuando se compara con usuarios de bolo-basal. De forma similar, en este estudio también se han observado niveles más bajos de HbA1c en MCG respecto a AAGC, tanto en pacientes pediátricos como adultos. Sin embargo, estos datos deben analizarse con cautela, porque no puede inferirse una relación causal para esta diferencia obtenida con un diseño observacional. En el caso de la MCG sí parece existir un beneficio en reducción de HbA1c de forma consistente en los estudios publicados23. Sin embargo, en el análisis por grupos de edad, los pacientes en edades más habituales de la adolescencia (14-17 años) presentaron unos valores medios de HbA1c más elevados, independientemente de estar utilizando MCG o ISCI. Este hecho podría confirmar que factores individuales, más allá del sistema de administración y monitorización de insulina condicionan ampliamente el control glucémico. El estudio de Foster et al. muestra el mismo pico de HbA1c entorno a este difícil grupo20.
Algunos de esos factores individuales que pueden condicionar el control glucémico, son señalados en nuestro estudio. Varios son independientes del manejo de la DM1, como el nivel de estudios, pero otros son indicadores indirectos del grado de educación terapéutica recibida. Los indicadores en nuestro estudio de un tratamiento avanzado con insulina, como el recuento de hidratos de carbono, una buena adherencia a la dieta o el número de AAGC realizados, tal y como describe Miller et al. en su estudio, mostraron mejor control de HbA1c24.
La prevalencia de sobrepeso-obesidad en la población española adulta es elevada (53%)25, como también lo es en la población con DM1 (43,9% en nuestro estudio) y requiere un abordaje específico. La ganancia de peso con el tratamiento intensivo con insulina es un hecho observado desde hace décadas y el hiperinsulinismo generado por este tratamiento puede ser una posible causa26. Las recientemente propuestas como terapias adyuvantes al tratamiento exclusivamente insulínico en DM1, dirigidas a reducir el peso corporal y las dosis de insulina, podrían ser beneficiosas en este sentido27.
La principal limitación de este estudio está relacionada con su propio diseño, transversal y retrospectivo, y la forma de recogida de los datos. La calidad de la información está limitada por la información disponible en las historias clínicas. A pesar de ello, el diseño del estudio permitió obtener datos con suficiente precisión como para definir las características y el manejo de los pacientes con DM1 que acuden a consultas de endocrinología en España. Otro potencial sesgo sería el de selección: con el objetivo de disminuirlo se incluyeron los pacientes que acudían a la consulta de endocrinología de forma consecutiva. Si bien en general suelen acudir a la consulta los pacientes con mayor morbilidad, en el caso de pacientes con diabetes estos suelen realizar visitas para el control de su enfermedad de forma regular, independientemente de si experimentan o no un empeoramiento de esta. Por ello se considera que los pacientes incluidos son representativos de la población española que sufre DM1.
Destacar que en el proceso del cálculo del tamaño muestral se estimó también el número de centros y de pacientes que debían incluirse por cada CC. AA., de manera que al asegurar la representación proporcional en base a población española los resultados pueden ser extrapolados a la totalidad de dicha población. Este no es el caso de la muestra pediátrica, que no es representativa de la población pediátrica española con DM1. Se consideró oportuno incluir una muestra de pacientes DM1 menor a 18 años, que aun siendo estadísticamente insuficiente por sí misma, se calculó para que si fuese proporcional a la prevalencia de DM1 (en niños es más incidente pero mucho menos prevalente que en adultos, donde se van acumulando los casos de todas las edades de inicio). En todo caso, para conocer datos específicos y representativos para edad pediátrica debería realizarse un estudio específico.
ConclusiónLas características clínicas y el tratamiento de los pacientes con DM1 en España es similar a la de otros países occidentales. Menos de una tercera parte de los pacientes tiene valores HbA1c en objetivo. Si bien el porcentaje de uso de tecnologías en el tratamiento (ISCI y MCG) es superior a lo publicado previamente, y podría confirmar la tendencia observada en otros países, sigue siendo inferior a estos. Una mayor adherencia a las recomendaciones de la educación terapéutica en diabetes sobre el autocontrol y el uso de herramientas específicas para la optimización de la insulinoterapia se asocia a un mejor control glucémico.
FinanciaciónSanofi (código DIREGL08156) ha prestado apoyo logístico a la investigación, asesoramiento estadístico, así como a la redacción médica mediante una subvención sin restricciones a la Sociedad Española de Diabetes. La idea y diseño, obtención, análisis e interpretación de datos se realizó gracias al esfuerzo incondicional de todos los investigadores participantes, miembros de la SED.
Conflicto de interesesFernando Gómez-Peralta ha participado en Paneles de Expertos para Abbott Diabetes, Novartis, Astra Zeneca, Sanofi y Novo Nordisk; ha participado como investigador principal en Ensayos Clínicos financiados por Sanofi, Novo Nordisk, Boehringer Ingelheim Pharmaceuticals, y Lilly; y ha participado como ponente para Abbott Diabetes, Novartis, Sanofi, Novo Nordisk, Boehringer Ingelheim Pharmaceuticals, AstraZeneca Pharmaceuticals LP, Bristol-Myers Squibb Co., y Lilly.
Edelmiro Luis Menéndez Torre ha paticipado como investigador en Ensayos Clínicos financiados por Sanofi y Novo Nordisk, ha participado como ponente para Abbott Diabetes, Sanofi, Novo Nordisk, AstraZeneca, Menarini y Lilly; y ha recibido financiación para la educación e investigación de Sanofi, Roche y Medtronic
Santiago Conde Barreiro ha participado como asesor para Sanofi, ha participado como ponente para Lilly y Roche, ha recibido financiación para participar en cursos congresos desde Abbott Diabetes, Ascensia, Sanofi, Lilly y Novo Nordisk.
Ignacio Conget ha recibido financiación como asesor y ponente para Medtronic, Bayer, Ascendía, GlaxoSmithKline, Eli Lilly, Novo Nordisk, Sanofi-Aventis, Novartis y MSD
Anna Novials declara que no tiene ningún conflicto de intereses.
Francisco Tinahones Madueño
Florentino Carral San Laureano
Martín López de la Torre
Alberto Moreno Carazo
Javier Acha Pérez
Edelmiro Menéndez Torre
Lluís Masmiquel Comas
Ignacio Llorente Gómez
Juan Angel Hernández Bayo
Cristina Abreu
Daniel de Luis y Gonzalo Díaz Soto
Antonio López-Guzmán
Benito Blanco Samper
Ignacio Conget Donlo
Manuel Pérez Maraver
Ismael Capel Flores
Wifredo Ricart Engel
Francisco Javier Ampudia Blasco
Antonio Hernández Mijares
Carlos Sánchez Juan
Antonio Picó Alfonos
José Ramón Domínguez Escribano
Pablo Abellán Galiana
Paolo Rossetti
Francisco M. Morales-Pérez
Fidel Enciso Izquierdo
Alfonso Soto González
Diego Bellido Guerrero
José Manuel García López
Víctor M. Andía Melero
José Alfonso Arranz Martín
Miguel Brito Sanfiel
Alfonso Calle Pascual
Manuel Ángel Gargallo Fernández
Antonio M.Hernández Martínez
Lluis Forga Llenas
Juan Pedro López-Siguero
Alfonso María Lechuga Sancho
Roque Cardona Hernández
Francisco Javier Arroyo Diez
Ignacio Diez López
Isabel Serrano Olmedo
Orosia Bandrés Nivela
Francisca Payeras Mas
Coral Montalbán Carrasco
Estefania Santos Mazo
Luz Mª López Jiménez
Visitacion Alvarez de Frutos
Ana Chico Ballesteros
Belen Dalama Gómez
Berta Soldevila Madorell
Marta Hernández García
Ana Megia Colet
Elisenda Climent Biescas
Carmiña Fajardo Montañana
Mª Teresa Pedro Font
Reyes Luna Cano
Sharona Azriel Mira
Marta Botella Serrano
Noemí González Pérez de Villar
Fátima Illán Gómez
Virginia Bellido Castañeda y Pedro González
Clara Rosario Fuentes Gómez
Amelia Oleaga Alday
Mª Ángeles Martínez de Salinas Santamaría
Ana Lucía Gómez-Gila
Marta Ferrer Lozano
Isolina Riaño Galán
María Caimari Jaume
María Clemente León
Gemma Carreras González
Paloma Cabanas Rodríguez
Mª Belén Roldán Martín
Purificación Ros Pérez
Itxaso Rica Echevarría